中药对P-糖蛋白的影响及机制的研究进展
梁晓玲,冯立影,孙德春,刘高峰*
1.哈尔滨医科大学附属第二医院药学部,哈尔滨 150086;2.黑龙江省农垦总局总医院药剂科,哈尔滨 150088
·综述·
中药对P-糖蛋白的影响及机制的研究进展
梁晓玲1,冯立影1,孙德春2,刘高峰1*
1.哈尔滨医科大学附属第二医院药学部,哈尔滨 150086;2.黑龙江省农垦总局总医院药剂科,哈尔滨 150088
[摘要]P-糖蛋白是广泛分布于人体正常组织中的转运蛋白,能将内源性、外源性物质及其代谢物排出细胞。其广泛分布及对药物的逆向转运功能,使其在药物的吸收、分布、代谢和排泄方面都具有重要意义。P-糖蛋白可识别和转运在结构、化学性质和药理学特性等方面均不同的化合物,对P-糖蛋白的抑制或诱导可产生P-糖蛋白介导的药物相互作用,导致底物药物的不良反应增加或治疗不足。抑制P-糖蛋白可减少药物外排,以提高抗肿瘤药物的治疗效果,或增加药物在脑组织中的积累量,提高中枢神经系统疾病的治疗效果。关于中药对P-糖蛋白影响的报道日渐增多,本文根据已有的国内外研究,归纳了各种中药及其成分对P-糖蛋白的影响及作用机制,以系统了解并指导该领域的研究,并为临床合理用药提供参考。
[关键词]中药;P-糖蛋白;作用;机制
0引言
P-糖蛋白(P-glycoprotein,P-gp)广泛分布于人体正常组织中,其对药物有逆向转运功能,在药物的吸收、分布、代谢和排泄方面都具有重要意义[1]。很多治疗窗窄的药物是P-gp的底物,对P-gp的抑制或诱导可产生药物相互作用,导致药品不良反应增加或治疗不足。在肿瘤细胞中,P-gp是介导多药耐药的主要原因,影响化疗效果;在脑组织中,P-gp是影响药物通过血脑屏障进入脑组织中的主要原因[2]。已有报道,很多中药对P-gp有抑制或诱导作用,对与其联用药物产生影响[3]。本文旨在根据已有的国内外研究报道,系统整理和归纳各种中药及其成分对P-gp的影响及相关机制,以系统了解并指导该领域的研究,并为临床合理用药提供参考。
1P-gp
2抑制P-gp的中药及其成分
有些中药及其成分可抑制P-gp的功能和表达,详见表1。

表1 抑制P-gp功能和表达的中药及其成分
2.1百部及其成分百部提取物能显著增加KB-V-1高表达P-gp耐药细胞内长春花碱、紫杉醇和秋水仙素的积累量,呈剂量依赖性。百部提取物抑制P-gp的功能可能是干扰底物结合位点,使P-gp与底物不能结合[8]。百部叶碱可增加3[H]-长春花碱、钙黄绿素和罗丹明123(R123)细胞积累量和滞留量,且呈浓度依赖性。在KB-V1细胞中,百部叶碱抑制P-gp功能但不影响P-gp表达[9]。
2.2人参及其成分人参具有增强免疫、认知功能,对多种疾病有预防效果。其主要有效成分为人参皂苷和人参多糖。用非索非那定做底物研究人参对健康志愿者P-gp的影响时发现,与人参软胶囊同服,不改变非索非那定的药代动力学参数,因此认为人参可能不影响P-gp的功能,也可能是通过影响非索非那定多种转运体(P-gp和/或有机阴离子转运肽)平衡作用的结果[10]。红参中人参皂苷可抑制P-gp的功能。原人参萜三醇人参皂苷(Protopanaxatriol ginsenosides,PTG)可逆转AML-2/D100耐药细胞对柔红霉素的耐药性。而其他人参皂苷、原人参萜二醇人参皂苷、人参皂苷Rb1、Rb2、Rc、Rg1和Re等成分无增敏作用。PTG与P-gp azidopine位点相互作用,抑制P-gp而增加细胞内抗肿瘤药物的积聚[11]。红参中20(S)-人参皂苷Rg3显著逆转药物多药耐药性,半数抑制浓度为82 μM,且只有浓度达到254 μM,才会对KB耐药细胞产生细胞毒性。而人参中其他成分Rg2、Rg3、Rh1、Rh2和Rh3,只有在高浓度下才抑制P-gp[12]。宋娟等[13]研究人参皂苷Rg1对Caco-2细胞P-gp功能和表达的影响,结果表明,高浓度(20 mg/L)的人参皂苷Rg1抑制P-gp的外排转运功能,使细胞内R123的浓度增加了3.5倍,但长期使用不影响P-gp的活性。
2.3紫雏菊提取物紫雏菊具有抗细菌、抗病毒、刺激免疫应答、增强免疫系统功能等作用,用于预防和治疗上呼吸道感染如普通感冒、流感,以及免疫调节等。体外试验表明,紫雏菊可抑制P-gp的活性。在Caco-2细胞中,紫雏菊提取物抑制地高辛的转运,且呈剂量依赖性降低地高辛的外排[14]。然而体内结果却显示,紫雏菊提取物对P-gp无影响,健康志愿者服用14 d的紫雏菊提取物后,血清中地高辛的AUC0-24、t1/2和Cmax与对照组相比差异无统计学意义[15]。
2.4刺五加刺五加提取物非竞争性抑制P-gp。当联合给予刺五加提取物与地高辛时,增加地高辛在Caco-2细胞中Papp,A-B侧转运,显著提高R123的最大摄取速率和细胞内的积累量,降低R123Papp,B-A侧的外排量[16]。
2.5迷迭香迷迭香提取物抑制人乳腺腺癌细胞(MCF-7)中阿霉素和长春花碱的外排,但对野生型细胞无影响。迷迭香提取物阻断长春花碱类似物Azidopine结合位点,抑制P-gp活性[17]。
2.6五味子有效成分五味子属木兰科植物,其主要药用成分为木脂素类,具有保肝、抗缺氧、抗疲劳、抗衰老、抗肿瘤等作用。木质素类物质对P-gp有抑制作用。去氧五味子素、当归酰戈米辛、戈米辛A、巴豆酰基戈米辛H、戈米辛C浓度依赖性抑制R123细胞外排量,其中去氧五味子素抑制作用最强。在Caco-2细胞中,50 μM去氧五味子素显著增加地高辛的Papp,A-B转运,Papp,B-A侧转运显著降低[18]。五味子甲素增加阿霉素细胞积累量,下调P-gp的转录和表达水平,逆转KBv2000、MCF-7/Dox、人肝癌细胞株(Bel7402)细胞对长春新碱的耐药性[19]。五味子乙素显著抑制P-gp的表达和功能,逆转K562/Adr、KBv200、MCF-7/Adr细胞对紫杉醇、阿霉素、长春新碱的耐药性[20]。
2.7大黄有效成分大黄素属于羟基蒽醌类衍生物,是大黄有效成分之一,具有抗炎、抗菌、抗肿瘤和肾脏保护等作用。大黄素是P-gp强抑制剂,抑制Caco-2细胞P-gp的功能[21],通过阻止AP-1 DNA结合位点降低促分裂原活化蛋白激酶的表达,下调P-gp的表达[22]。
2.8防己有效成分防己中的多种生物碱对P-gp有抑制作用。粉防己碱和防己诺林碱显著增加阿霉素对Caco-2和CEM/ADR5000细胞的细胞毒性,增加R123细胞积累量,降低细胞外排量。粉防己碱和防己诺林碱显著降低P-gp的表达量,呈浓度依赖性[23]。粉防己碱可显著抑制阿霉素诱导的NF-κB mRNA和蛋白质的表达,减弱NF-κB DNA的结合活性[24]。
2.9其他中药及有效成分
2.9.1黄芪有效成分黄芪甲苷Ⅱ、黄芪甲苷Ⅳ是黄芪皂苷的主要活性成分,有抑制P-gp的功能,显著增加Bel-7402/FU细胞对5-氟尿嘧啶的细胞毒性,增加细胞内R123积累量。蛋白质印记法和RT-PCR法研究表明,黄芪皂苷Ⅱ通过抑制细胞外磷酸化途径,调节激酶1/2、p38和c-Jun N-端激酶,抑制P-gp表达和功能[25-26]。黄芪多糖本身无抗癌活性,但能增加化疗药物环磷酰胺、阿霉素、5-氟尿嘧啶、顺铂、依托泊苷、长春新碱对小鼠肝癌22耐药细胞(H22/ADM)的细胞毒性,且呈剂量依赖性增加。与空白组相比,黄芪多糖降低细胞对R123外排作用,增加其在细胞内滞留,呈剂量和时间依赖性下调P-gp mRNA的表达[27]。
2.9.2黄芩有效成分千层质素A是黄芩的黄酮类活性成分,能增加R123积累量,与5-氟尿嘧啶同时使用,显著增加细胞凋亡数量。千层质素A通过抑制NF-κB信号通路下调P-gp表达,逆转Bel7402/5-FU细胞对药物的多药耐药[28]。
2.9.3金鸡纳树有效成分金鸡纳为茜草科金鸡纳属植物,其树皮和叶中的生物碱有抗疟疾、抗心律失常等作用。体内外研究表明,金鸡纳提取的生物碱抑制P-gp活性。奎宁显著增加K562/ADM细胞中阿霉素的积累量,逆转K562/ADM细胞多药耐药性。当患者静脉持续滴注奎宁时,可增加耐药细胞中阿霉素摄取量[29]。弱金鸡纳碱强抑制P-gp,且呈剂量依赖性增加耐阿霉素Leukaemia细胞中阿霉素的量,减少R123外排量[30]。
2.9.4半枝莲有效成分半枝莲活性成分脱镁叶绿酸A常作为光敏感剂,与光联合使用作为光动力疗癌法。脱镁叶绿酸A通过抑制c-Jun氨基端激酶的活性而下调P-gp基因活性和表达,抑制多药耐药蛋白的产生[31]。
2.9.5姜黄有效成分姜黄素是姜黄中提取的一种植物多酚,是姜黄发挥药理作用最重要的活性成分。蛋白印迹法和RT-PCR均显示姜黄素与KB-V1细胞同时孵育72 h以上能显著降低P-gp的表达,且呈浓度依赖性。姜黄素浓度依赖性地增加R123的细胞积累量,抑制其外排泄,增加细胞对长春花碱的敏感性[32]。另有研究表明,姜黄素是通过抑制磷脂酰肌醇-3羧基激酶/丝氨酸/苏氨酸激酶(PI3K/Akt)信号通路降低NF-κB转录途径而抑制P-gp[33]。
2.9.6断肠草有效成分新狼毒素B是双二氢黄酮类化合物,是断肠草中主要抑菌活性成分之一。新狼毒素B抑制P-gp表达,呈浓度依赖性抑制P-gp功能,增加MDCK-hMDR1肿瘤细胞中R123的积累量。新狼毒素B呈竞争性和非竞争性混合抑制机制,通过提高细胞表面分子Fas及其受体Fas-L和肿瘤坏死因子(TNF-α)表达水平,逆转P-gp介导的多药耐药[34]。
有报道,芫花提取物及重楼、大白栓菌、石菖蒲、金钱松、娑罗子、灵芝和白芷的有效成分均可抑制P-gp的表达和功能[35-42]。
3诱导P-gp作用的中药及其成分
圣约翰草又称贯叶连翘,用于治疗精神、躯体不适、抑郁、情绪焦虑和失眠等。试验表明,圣约翰草与药物可发生P-gp介导的药物相互作用。Bill首次在健康志愿者身上研究圣约翰草对P-gp的影响,结果圣约翰草显著降低地高辛的药时曲线下面积(AUC0-24)和最大血药浓度(Cmax),表现出对P-gp的诱导作用[15]。另有研究表明,短期内使用圣约翰草提取物表现为轻度抑制P-gp功能,但随使用时间的延长,圣约翰草对P-gp的影响主要表现为诱导作用[43]。金丝桃素和贯叶金丝桃素是圣约翰草叶和花蕾醇提取物的主要成分。贯叶金丝桃素是介导圣约翰草提取物中药物相互作用的主要物质,且是孕烷X受体(PXR)的强兴奋剂[44]。圣约翰草影响P-gp的机制:贯叶金丝桃素可调节SXR/PXR受体活性,阻止内源性和外源性有害物质的进入,而圣约翰草中的金丝桃素和黄酮类物质不影响SXR/PXR受体的活性[45]。
4对P-gp有复杂影响的中药及其成分
有些中药及其成分对P-gp的作用表现比较复杂,可能因为其既是P-gp的底物,又是抑制剂或诱导剂,或同一中药有些成分是抑制作用,有些则为诱导作用。
4.1作为P-gp底物和抑制剂的中药及其成分详见表2。
4.1.1银杏叶及其成分银杏叶提取物(Ginkgo Biloba extract,GBE)具有扩张血管、调血脂、拮抗血小板活化因子、保护缺血损伤、抗炎及抗肿瘤等多种药理作用,是目前临床使用最广泛的中药提取物之一。GBE成分复杂,银杏黄酮类(山奈酚、槲皮素等)和银杏萜内酯类化合物是主要有效成分。研究表明,GBE及其成分可抑制P-gp活性,发生药物相互作用时需引起重视。当健康志愿者服用GBE体内药物浓度达稳态时,口服单剂量雷特格韦,与对照组相比,雷特格韦的AUC0-∞增加了21%,Cmax增加了44%。雷特格雷是P-gp的底物,其生物利用度和Cmax的增加是由于GBE抑制了P-gp的活性[46]。底物转运与P-gp ATP酶并不存在必然的偶联,但当与底物结合后,P-gp ATP酶的活性可以提高3~4倍,有时甚至是20倍[47]。
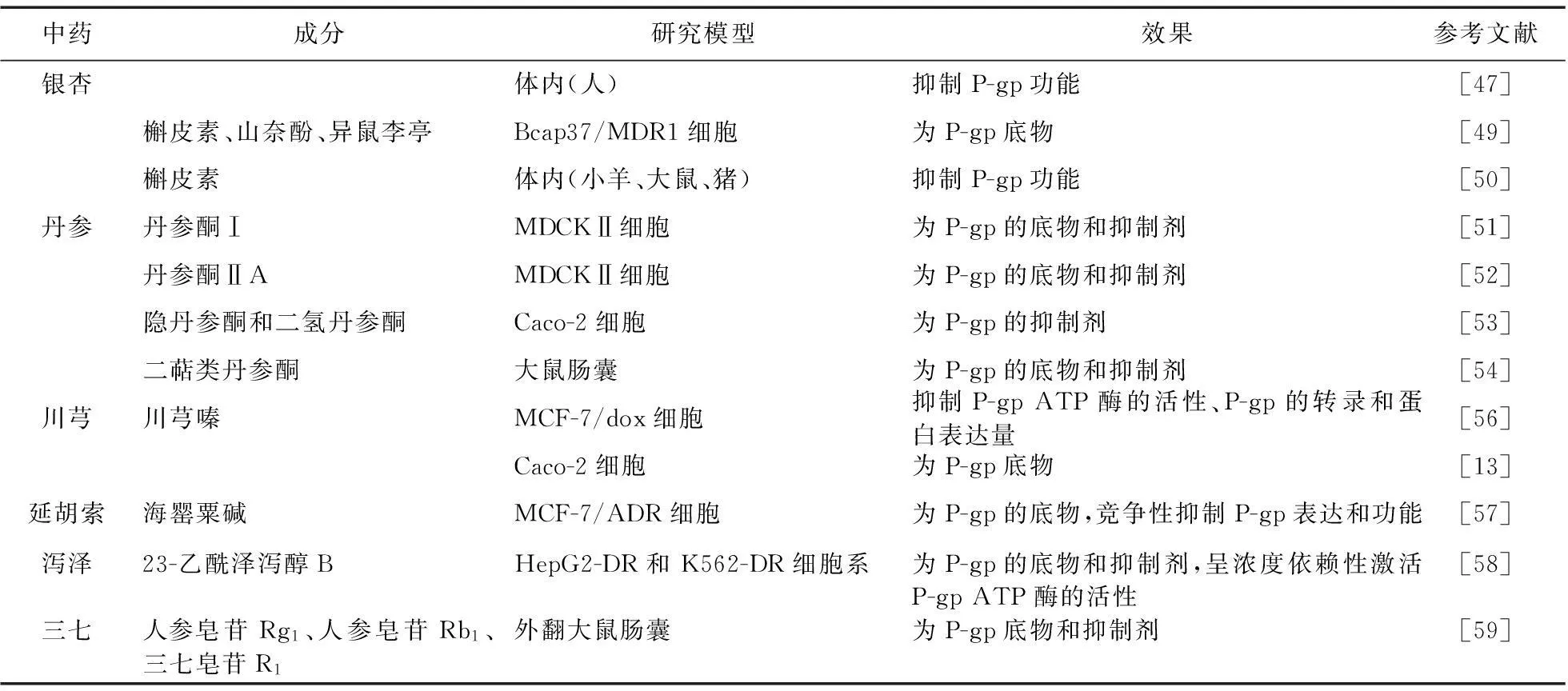
表2 为P-gp的底物或抑制剂的中药及其成分
Wang等[48]研究显示,GBE中的槲皮素和山奈酚可抑制P-gp ATP酶的活性,异鼠李亭可激活P-gp ATP酶活性,证明槲皮素、山柰酚、异鼠李亭均是P-gp的底物。槲皮素和莫西菌素共同给药可增加莫西菌素在小羊体内的生物利用度,槲皮素可增加大鼠体内紫杉醇的口服生物利用度,增加猪体内地高辛的口服生物利用度等,这些研究都说明了槲皮素是P-gp的抑制剂[49]。
4.1.2丹参有效成分丹参主要成分有脂溶性丹参酮类化合物和水溶性酚酸类化合物,用于治疗心绞痛、心肌梗死、卒中等。丹参酮Ⅰ和丹参酮ⅡA是P-gp底物和抑制剂。在MDCKⅡ细胞中丹参酮Ⅰ和丹参酮ⅡAPapp,B-A侧转运显著高于Papp,A-B侧,激活P-gp ATP酶活性,抑制Caco-2细胞中P-gp介导地高辛转运[50-51]。隐丹参酮和二氢丹参酮是P-gp的底物和抑制剂。隐丹参酮和二氢丹参酮浓度依赖性地减少地高辛细胞外排量,通过下调P-gp蛋白表达水平,抑制P-gp ATP酶活性降低P-gp功能[52]。二萜类丹参酮显著降低P-gp介导的隐丹参酮外排[53]。P-gp是影响丹参素进入脑内的重要因素,但具体机制不详[54]。
4.1.3川芎有效成分川芎嗪是伞形科蒿本属植物川芎根茎中的生物碱之一,主要用于心脑血管等疾病的治疗。川芎嗪可抑制P-gp的表达。非细胞毒性剂量(300 mg/L)的TMP能显著降低MCF-7/dox对长春新碱、阿霉素、紫杉醇的外排量,抑制MCF-7/dox中P-gp ATP酶的活性、P-gp的转录和蛋白表达量[55]。川芎嗪还是P-gp的底物,可与其他底物竞争性与P-gp结合,进而减少P-gp对细胞内底物药物的外排[13]。
4.1.4延胡索有效成分海罂粟碱是延胡索的生物碱成分,是P-gp的底物和竞争性抑制剂。海罂粟碱也可抑制ABC转运基因的表达,有效逆转MCF-7/ADR细胞对阿霉素和米托蒽醌的耐药性[56]。
4.1.5泽泻有效成分泽泻主要成分23-乙酰泽泻醇B,是P-gp的底物和抑制剂,呈浓度依赖性激活P-gp ATP酶的活性,呈剂量依赖性增加阿霉素的积累量和降低R123在耐药细胞的外排量,逆转药物的多药耐药性[57]。
4.1.6三七有效成分三七有效成分人参皂苷Rg1、人参皂苷Rb1和三七皂苷R1具有明显的P-gp底物特性及抑制P-gp底物外排作用[58]。
4.2为P-gp抑制剂、诱导剂和底物的中药详见表3。
4.2.1甘草提取物及成分甘草具有益气复脉、缓急止痛、润肺止咳、泻火解毒及调和诸药等药理作用。甘草水提取液活化PXR,促进体内毒物代谢与排泄,起到解毒的效果。甘草成分复杂,对P-gp作用亦不尽相同。甘草是P-gp的轻度抑制剂,大鼠10 g/kg 2次/d甘草提取液灌胃处理,1周后显著增加R123吸收方向的转运,分泌方向有增加趋势[59]。甘草总皂苷和甘草酸增强Caco-2细胞P-gp表达与功能,呈现出诱导P-gp的功能[60]。

表3 为P-gp的底物、抑制剂或诱导剂的中药及其成分
4.2.2穿心莲有效成分穿心莲内酯(Andrographolide,AP)是爵床科植物穿心莲主要活性成分,具有抗炎抗菌、抗病毒、抗肿瘤、免疫调节、治疗心脑血管疾病等作用。研究表明,AP是P-gp底物,由于代谢快,导致其口服生物利用度低。在肠灌流模型中,给予P-gp抑制剂维拉帕米可显著增加穿心莲内酯穿透率[61]。14-去氧-11,12-二去氢穿心莲内酯增加细胞膜上P-gp mRNA和蛋白质表达,对P-gp有诱导作用[62]。脱水穿心莲内酯(DAG)对P-gp有抑制作用,增加地高辛在MDR1-MDCKⅡ细胞Papp,A-B转运,降低Papp,B-A侧转运。DAG呈浓度依赖性激活P-gp ATP酶活性,竞争结合底物转运位点是其抑制P-gp的机制[21]。
4.2.3枸杞有效成分枸杞多糖抑制P-gp的功能,增加细胞内R123积累量,但经流式细胞术与免疫荧光抗体检测,发现P-gp的表达量增加,对P-gp的表达又呈现出诱导效应[63]。
5不影响P-gp活性的中药及其成分
根据目前的研究结果,有些中药或其成分对P-gp没有影响。
5.1水飞蓟水飞蓟为菊科水飞蓟属植物,具有保护肝脏和抗氧化作用。有研究表明,水飞蓟提取物不影响P-gp的活性。健康志愿者服用14 d水飞蓟制剂,地高辛的AUC0-24、Cmax、CL/F、清除半衰期与对照组比较差异无统计学意义(P=0.06)[64]。
5.2灯盏细辛有效成分黄岑素是灯盏细辛主要有效成分,对P-gp的影响微弱,与P-gp的底物之间不会发生药物相互作用[65]。
6小结
已有的研究结果显示,很多中药及其成分对P-gp均有影响,有的表现为抑制作用,有的表现为诱导作用,还有一些中药及其成分对P-gp的作用比较复杂,既是底物,也表现出抑制或诱导作用。
P-gp被抑制或诱导可影响药物的生物利用度、胆汁和肾脏的清除、脑内药物的摄取等,因此当中药是P-gp的抑制剂或诱导剂时,与P-gp的底物药物联合应用,可产生P-gp介导的药物相互作用,使药物在体内蓄积产生不良反应或治疗不足导致治疗失败,特别是治疗窗窄的药物,如强心药地高辛、免疫抑制剂环孢素、化疗药物甲氨蝶呤、抗癫疒间药苯妥英等。有报道,30例肾脏移植患者服用环孢素期间联合使用了对P-gp有诱导作用的圣约翰草,使环孢素的血药浓度降低了47%,环孢素的使用剂量约增加了46%,当停止合用圣约翰草后,环孢素的血药浓度增加了187%,环孢素的使用剂量必须降为未联合使用圣约翰草前的剂量[66]。因此,对P-gp有调控作用的中药与P-gp的底物药物联合应用时,应关注可能会产生P-gp介导的药物相互作用,以避免药物不良反应发生或治疗不足导致的治疗失败。
另一方面,中药对P-gp的影响还可以用于增加药物的疗效,如对P-gp有抑制作用的中药或有效成分与某些化疗药物合用时,可减少肿瘤细胞对化疗药物外排,增加化疗药物在肿瘤细胞中积累量,对于降低肿瘤细胞耐药性,提高化疗药物的治疗效果有重要临床意义。另外,正常情况下血脑屏障对阻止内外源性物质进出中枢起关卡作用,P-gp是血脑屏障中最重要和表达最高的一种转运蛋白,在药物转运过程中发挥外排泵作用,可降低脑内药物浓度和减轻细胞毒作用[7]。但当机体发生中枢神经系统疾病如脑部肿瘤、癫疒间、脑部创伤、感染等时,可利用抑制脑血屏障上的P-gp使药物进入脑组织的量增加,从而增强治疗效果。
目前,中药对P-gp的作用机制尚未完全清楚,而且,中药对P-gp的作用机制可能是单一或两种以上机制共同影响。已知影响P-gp的机制可概括为:①竞争性、非竞争性或别构阻断底物结合位点;②调节孕烷受体PXR的活性;③影响细胞膜的流动性;④抑制或诱导P-gp ATP水解酶的活性;⑤影响细胞内ATP水平;⑥上调或下调P-gp基因的表达等[67-68]。如何更好地了解P-gp对药物吸收、代谢及排泄的影响机制,尚需不断研究和探索。
还需注意的是:①有的中药对P-gp的作用效果并不是单一方向的,如圣约翰草提取物短暂使用对P-gp有轻度抑制作用,但随使用时间延长,可显著诱导P-gp表达。②中药的影响可能是多种转运体和酶共同作用的结果,以银杏叶制剂为例,Yang等[69]研究表明,银杏叶提取物抑制外翻的大鼠空肠和回肠P-gp的功能,对大鼠同时给予环孢素和GBE,其体内环孢素的AUC反而降低,说明GBE对肝药酶的诱导作用大于对肠道P-gp的抑制作用。③中药成分复杂,同一中药不同化学成分对P-gp的影响可能不同,如人参、甘草,但总的影响可能是这些成分综合作用的结果。④不同物种对同一药物的处置过程可能不同。人、猴、犬、大鼠和小鼠的多药耐药细胞系对P-gp底物转运速率是不同的[70]。因此,对同一药物,由于所选取的试验对象、探针药物、剂量、试验方法不同,可能会出现不同结果,这就需要在试验中更全面地考虑问题,已确保研究结果的准确性和可靠性。
参考文献:
[1]Leslie EM,Deeley RG,Cole SP.Multidrug resistance proteins:role of P-glycoprotein,MRP1,MRP2,and BCRP (ABCG2) in tissue defense[J].Toxicol Appl Pharmacol,2005,204(3):216-237.
[2]左明新,刘晓东.血脑屏障上的P-糖蛋白与药物转运功能[J].中国现代应用药学,1999,16(2):1-3.
[3]Lin JH,Yamazaki M.Role of P-glycoprotein in pharmacokinetics clinical implications[J].Clin Pharmacokinet,2003,42(1):59-98.
[4]潘树矿,陈伟.多药耐药糖蛋白P-糖蛋白研究进展[J].淮海医药,2010,28(6):564-565.
[5]Schinkel AH,Wagenaar E,Van Deemter L,et al.Absence of the mdr1a P-glycoprotein in mice affects tissue distribution and pharmacokinetics of dexamethasone,digoxin,and cyclosporin A[J].J Clin Invest,1995,96(4):1698-1705.
[6]Ford JM,Hait WN.Pharmacologic circumvention of multidrug resistance[J].Cytotechnology,1994,12:171-212.
[7]戴立波,何海梅,方平飞,等.中枢抑制药物与P-糖蛋白相互作用的研究进展[J].中国临床药理学杂志,2011,27(10):801-805.
[8]Limtrakul P,Siwanon S,Yodkeeree S,et al.Effect of Stemona curtisii root extract on P-glycoprotein and MRP-1 function in multidrug-resistant cancer cells[J].Phytomedicine,2007,14(6):381-389.
[9]Chanmahasathien W,Ohnuma S,Ambudkar SV,et al.Biochemical mechanism of modulation of human P-glycoprotein by Stemofoline[J].Planta Med,2011,77(18):1990-1995.
[10]Malati CY,Robertson SM,Hunt JD,et al.Influence of panax ginsengon cytochrome P450(CYP)3A and P-glycoprotein(P-gp) activity in healthy subjects[J].J Clin Pharmacol,2012,52(6):932-939.
[11]Choi CH,Kang G,Min YD.Reversal of P-glycoprotein-mediate multidrug resistance by Protopanaxatriol ginsenosides from Korean red ginseng[J].Planta Med,2003,69:235-240.
[12]Park JD,Kim DS,Kwon HY,et al.Effects of ginseng saponin on modulation of muitidrug resistance[J].Arch Pharm Res,1996,19(3):213-218.
[13]宋娟,刘晓磊,何娟,等.川芎嗪和人参皂苷Rg1对Caco-2细胞P-糖蛋白功能和表达的影响[J].中国药学杂志,2008,43(13):987-991.
[14]Hansen TS,Nilsen OG.Echinacea purpurea and P-glycoprotein drug transport in caco-2 cells[J].Phytother Res,2009,23(1):86-91.
[15]Gurley BJ,Swain A,Williams DK,et al.Gauging the clinical significance of P-glycoprotein-mediated herb-drug interactions:comparative effects of St.John′s wort,echinacea,clarithromycin,and rifampin on digoxin pharmacokinetics[J].Mol Nutr Food Res,2008,52(7):772-779.
[16]Takahashi T,Kaku T,Watanabe K,et al.Effects of Acanthopanax senticosus HARMS extract on drug transport in human intestinal cell line Caco-2[J].J Nat Med,2010,64(1):55-62.
[17]Plouzek CA,Ciolino HP,Clarke R,et al.Inhibition of P-glycoprotein activity and reversal of multidrug resistance in vitro by rosemary extract[J].Eur J Cancer,1999,35(10):1541-1545.
[18]Yoo HH,Lee M,Lee MW,et al.Effects of Schisandra lignans on P-glycoprotein-mediated drug efflux in human intestinal caco-2 cells[J].Planta Med,2007,73(5):444-450.
[19]Huang M,Jin J,Sun H,et al.Reversal of P-glycoprotein-mediated multidrug resistance of cancer cells by five Schizandrins isolated from the Chinese herb fructus schizandrae[J].Cancer Chemoth Pharm,2008,62(6):1015-1026.
[20]Pan Q,Wang T,Lu QH,et al.Schisandrin B-a novel inhibitor of P-glycoprotein[J].Biochem Bioph Res Co,2005,335(2):406-411.
[21]Li X,Hu JP,Wang BL,et al.Inhibitory effects of herbal constituents on P-glycoprotein in vitro and in vivo:herb-drug interactions mediated via P-gp[J].Toxicol Appl Pharm,2014,275(2):163-175.
[22]Choi RJ,Ngoc TM,Bae K,et al.Anti-inflammatory properties of anthraquinones and their relationship with the regulation of P-glycoprotein function and expression[J].Eur J Pharm Sci,2013,48(1-2):272-281.
[23]Sun YF,Wink M.Tetrandrine and fangchinoline,bisbenzylisoquinoline alkaloids from stephania tetrandra can reverse multidrug resistance by inhibiting P-glycoprotein activity in multidrug resistant human cancer cells[J].Phytomedicine,2014,21(8-9):1110-1119.
[24]Shen H,Xu W,Chen Q,et al.Tetrandrine prevents acquired drug resistance of K562 cells through inhibition of mdr1 gene transcription[J].J Cancer Res Clin Oncol,2010,136(5):659-665.
[25]Huang C,Xu D,Xia Q,et al.Reversal of P-glycoprotein-mediated multidrug resistance of human hepatic cancer cells by astragaloside II[J].J Pharm Pharmacol,2012,64(12):1741-1750.
[26]Wang PP,Xu DJ,Huang C,et al.Astragaloside IV reduces the expression level of P-glycoprotein in multidrug-resistant human hepatic cancer cell lines[J].Mol Med Rep,2014,9(6):2131-2137.
[27]Tian QE,Li HD,Yan M,et al.Effects of astragalus polysaccharides on P-glycoprotein efflux pump function and protein expression in H22 hepatoma cells in vitro[J].BMC Complem Altern M,2012,12(94):1472-1482.
[28]Yang HY,Zhao L,Yang Z,et al.Oroxylin A reverses multi-drug resistance of human hepatoma BEL7402/5-FU cells via downregulation of P-glycoprotein expression by inhibiting NF-κB signaling pathway[J].Mol Carcinogen,2012,51(2):185-195.
[29]Solary E,Velay I,Chauffert B,et al.Sufficient levels of quinine in the serum circumvent the multidrug resistance of the human leukemic cell line K562/ADM[J].Cancer,1991,68(8):1714-1719
[30]Furusawa S,Nakano S,Wu J,et al.Apoptosis induced by doxorubicin and cinchonine in P388 multidrug-resistant cells[J].J Pharm Pharmacol,2001,53(7):1029-1039.
[31]Tang PM,Zhang D,Xuan NB,et al.Photodynamic therapy inhibits P-glycoprotein mediated multidrug resistance via JNK activation in human hepatocellular carcinoma using the photosensitizer pheophorbide A[J].Mol Cancer,2009,8(56):1476-1488.
[32]Anuchapreeda S,Leechanachai P,Smith MM,et al.Modulation of P-glycoprotein expression and function by Curcumin in multidrug-resistant human KB cells[J].Biochem Pharmacol,2002,64(4):573-582.
[33]Choi BH,Kim CG,Lim Y,et al.Curcumin down-regulates the multidrug-resistance mdr1b gene by inhibiting the PI3K/Akt/NF-kB pathway[J].Cancer Lett,2008,259(1):111-118.
[34]Pan L,Hu H,Wang X,et al.Inhibitory effects of Neochamaejasmin B on P-glycoprotein in MDCK-hMDR1 cells and molecular docking of NCB binding in P-glycoprotein[J].Molecules,2015,20(2):2931-2948.
[35]黄蓓蓓,李国峰,任非,等.甘草与芫花对P-糖蛋白底物罗丹明123经空肠黏膜透过性的影响[J].中国中药杂志,2008,33(21):2521-2525.
[36]Nguyen VT,Darbour N,Bayet C,et al.Selective modulation of P-glycoprotein activity by steroidal saponines from Paris polyphylla[J].Fitoterapia,2008,80(1):39-42.
[37]Zhang Q,Wang J,He H,et al.Trametenolic acid B reverses multidrug resistance in breast cancer cells through regulating the expression level of P-glycoprotein[J].Phytother Res,2014,28(7):1037-1044.
[38]Meng X,Liao S,Wang X,et al.Reversing P-glycoprotein-mediated multidrug resistance in vitro by α-asarone and β-asarone,bioactive cis-transisomers from Acorus tatarinowii[J].Biotechnol Lett,2014,36(4):685-691.
[39]Yu F,Li K,Chen S,et al.Pseudolaric Acid B circumvents multidrug resistance phenotype in human gastric cancer SGC7901/ADR cells by downregulating Cox-2 and P-gp expression[J].Cell Biochem Biophys,2015,71(1):119-126
[40]刘丽娟,胡东莉,李汇娟,等.七叶皂苷对P-糖蛋白功能的影响[J].现代生物医学进展,2010,10(7):1208-1212.
[41]吴芬,成日华,李焕德.灵芝多糖肽对Caco-2细胞上P-糖蛋白功能、表达的影响[J].中南药学,2012,10(5):334-338.
[42]梁新丽,招丽君,廖正根,等.Caco-2细胞模型研究白芷提取物对P-糖蛋白功能的影响[J].中国医院药学杂志,2012,32(22):1781-1785.
[43]Perloff MD,Von Moltke LL,Störmer E.Saint John′s wort:An in vitro analysis of P-glycoprotein induction due to extended exposure[J].Br J Pharmacol,2001,134(8):1601-1608.
[44]Borrelli F,Izzo AA.Herb-drug interactions with St John′s Wort(Hypericum perforatum):an update on clinical observations[J].AAPS J,2009,11(4):710-727.
[45]Mannel M.Drug Interactions with St John′s Wort mechanisms and clinical implications[J].Drug Saf,2004,27(11):773-797.
[46]Blonk M,Colbers A,Poirters A,et al.Effect of Ginkgo biloba on the pharmacokinetics of raltegravir in healthy volunteers[J].Antimicrob Agents Ch,2012,56(10):5070-5075.
[47]Al-shawi MK,Polar MK,Omote H,et al.Transition state analysis of the coupling of drug transport to ATP hydrolysis by P-glycoprotein[J].J Biol Chem,2003,278(52):52629-52640.
[48]Wang Y,Cao J,Zeng S.Involvement of P-glycoprotein in regulating cellular levels of Ginkgo flavonols:quercetin,kaempferol,and isorhamnetin[J].J Pharm Pharmacol,2005,57(6):751-758.
[49]唐景玲.银杏叶提取物自乳化给药体系的制备及银杏叶提取物—药物相互作用的研究[D].沈阳:沈阳药科大学,2006.
[50]Li XX,Zhou ZW,Zhou SF.Role of P-glycoprotein in the transport of tanshinone I,one active triterpenoid from Salvia miltiorrhiza[J].Drug Metab Lett,2008,2(3):223-230.
[51]Yu XY,Lin SG,Zhou ZW,et al.Role of P-Glycoprotein in the intestinal absorption of tanshinone IIA,a major active ingredient in the root of Salvia miltiorrhiza bunge[J].Curr Drug Metab,2007,8(4):325-340.
[52]Hu T,To KK,Wang L,et al.Reversal of P-glycoprotein(P-gp) mediated multidrug resistance in colon cancer cells by cryptotanshinone and dihydrotanshinone of Salvia miltiorrhiza[J].Phytomedicine,2014,21(11):1264-1272.
[53]Dai H,Li X,Li X,et al.Coexisted components of Salvia miltiorrhiza enhance intestinal absorption of cryptotanshinone via inhibition of the intestinal P-gp[J].Phytomedicine,2012,19(14):1256-1262.
[54]Yu PF,Wang WY,Eerdun G,et al.The Role of P-glycoprotein in transport of danshensu across the blood-brain barrier[J].Evid Based Complement Alternat Med,2011,2011:713523.
[55]Zhang Y,Liu X,Zuo T,et al.Tetramethylpyrazine reverses multidrug resistance in breast cancer cells through regulating the expression and function of P-glycoprotein[J].Med Oncol,2012,29(2):534-538.
[56]Lei Y,Tan J,Wink M,et al.An isoquinoline alkaloid from the Chinese herbal plant Corydalis yanhusuo W.T.Wang inhibits P-glycoprotein and multidrug resistance-associate protein 1[J].Food Chem,2013,136(3-4):1117-1121.
[57]Wang C,Zhang JX,Shen XL,et al.Reversal of P-glycoprotein-mediated multidrug resistance by Alisol B 23-acetate[J].Biochem Pharmacol,2004,68(5):843-855.
[58]萨础拉,吕航,姜艳艳,等.三七皂苷在大鼠外翻肠囊中的吸收及与P-糖蛋白相互作用研究[J].北京中医药大学学报,2011,34(12):836-842.
[59]姚红卫,傅晓幼,解庆东,等.甘草提取液对肠粘膜P-糖蛋白的作用[J].南方医科大学学报,2009,29(8):1571-1573.
[60]彭燕,谭晓斌,贾晓斌.甘草总皂苷及甘草酸对Caco-2细胞P-gp功能和表达的影响[J].中成药,2013,35(9):1846-1851.
[61]Ye L,Wang T,Tang L,et al.Poor oral bioavailability of a promising anticancer agent andrographolide is due to extensive metabolism and efflux by P-glycoprotein[J].J Pharm Sci,2011,100(11):5007-5017.
[62]Chen HW,Huang CS,Liu PF,et al.Andrographis paniculata extract and Andrographolide modulate the hepatic drug metabolism system and plasma tolbutamide concentrations in rats[J].Evid-based Compl Alt,2013,2013:982689.
[63]成日华,吴芬,李焕德.枸杞多糖对Caco-2细胞P-糖蛋白作用的影响[J].中南药学,2012,10(7):500-504.
[64]Gurley BJ,Barone GW,Williams DK,et al.Effect of Milk Thistle(Silybum Marianum) and Black Cohosh(Cimicifuga Racemosa) supplementation on digoxin pharmacokinetics in humans[J].Drug Metab Dispos,2006,34(1):69-74.
[65]Han YL,Li D,Yang QJ,et al.In vitro inhibitory effects of Scutellarin on six human/rat cytochrome P450 enzymes and P-glycoprotein[J].Molecules,2014,19(5):5748-5760.
[66]Breidenbach TH,Kliem V,Burg M,et al.Profound drop in cyclosporin A whole blood trough levels caused by St John′s wort(Hypericum perforatum)[J].Transplantation,2000,69:2229-2230.
[67]Amin ML.P-glycoprotein inhibition for optimal drug delivery[J].Drug Target Insights,2013,7:27-34.
[68]杨慧莹,赵丽,郭青龙.P-糖蛋白抑制剂的研究进展[J].实用老年医学,2011,25(2):165-169.
[69]Yang CY,Chao PDL,Tsai SY,et al.Marked decrease of cyclosporin bioavailability caused by coadministration of ginkgo and onion in rats[J].Food Chem Toxicology,2006,44(9):1572-1578.
[70]Katoh M,Suzuyama N,Takeuchi T,et al.Kinetic analyses for species differences in P-glycoprotein-mediated drug transport[J].J Pharm Sci-US,2006,95(12):2673-2683.
Study progress of effects of traditional Chinese medicine on P-glycoprotein and the mechanismLIANG Xiao-ling1,FENG Li-ying1,SUN De-chun2,LIU Gao-feng1*(1.Department of Pharmacy,The Second Affiliated Hospital of Harbin Medical University,Key Laboratory of University in Heilongjiang Province,Harbin 150086,China;2.Department of Pharmacy,The General Hospital of Agriculture Bureau of Heilongjiang Province,Harbin 150088,China)
[Abstract]P-glycoprotein is a kind of transporting protein which widely expresses throughout the body,acts as a protective barrier that exports numerous endogenous,exogenous compounds and metabolites out of cells. Its extensive distribution and reverse transportation function have great significance on absorption,distribution,metabolism and excretion of drugs. P-glycoprotein could recognize and transport compounds of different structures,chemical properties and pharmacology characteristics. Inhibition or induction on P-glycoprotein may result in P-glycoprotein mediated drug-drug interaction,leading to adverse reactions increased or insufficient treatment of concomitant drugs. The inhibition on P-glycoprotein could also be used to enhance therapeutic effects of chemotherapy drugs by reducing their efflux from cancer cells,or improve therapeutic effects of drugs for central nervous system diseases by increasing the amount of drugs in brain tissues. More and more studies about effects of traditional Chinese medicines on P-glycoprotein have been reported,the influence and the mechanisms of traditional Chinese medicines and their ingredients on P-glycoprotein are summarized in this study,to provide references for related researches and clinical drug use.
Key words:Traditional Chinese medicine;P-glycoprotein;Effects;Mechanism
DOI:10.14053/j.cnki.ppcr.201601026
*通信作者
基金项目:国家自然科学基金项目(81173659)
收稿日期:2015-08-04

