人脐血干细胞经外周静脉移植治疗失代偿期肝硬化的临床研究
张岁,佟立新,闫宝勇,李全海,贾蓓,柳立平,马文波,张君
人脐血干细胞经外周静脉移植治疗失代偿期肝硬化的临床研究
张岁,佟立新,闫宝勇△,李全海,贾蓓,柳立平,马文波,张君
摘要:目的探讨人脐血干细胞经外周静脉移植治疗不同程度肝硬化患者的疗效及安全性。方法失代偿期肝硬化患者65例,分为干细胞组34例,其中Child-Pugh A级13例、B级14例、C级7例,在常规保肝治疗的基础上给予脐血干细胞移植治疗;对照组31例,其中Child-Pugh A级11例、B级13例、C级7例,给予常规保肝治疗。于治疗后2、4、12及24周观察不同程度肝硬化患者肝功能和凝血功能变化,并观察临床症状改善以及不良反应发生情况。结果(1)临床症状改善情况:Child-Pugh A、B级患者干细胞组临床症状较对照组明显改善。Child-Pugh C级患者2组临床症状改善程度差异无统计学意义。(2)肝功能和凝血功能改善情况:Child-Pugh A、B级患者干细胞组白蛋白(ALB)、凝血酶原活动度(PTA)治疗后2、4、12、24周均较治疗前升高,且干细胞组于12、24周均较对照组升高;干细胞组胆碱酯酶(CHE)治疗后4、12、24周均较治疗前升高,但与对照组比较差异无统计学意义;2组丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)比较差异均无统计学意义。干细胞组Child-Pugh C级患者治疗后ALT、AST、TBIL、ALB、CHE、PTA与治疗前及对照组比较差异均无统计学意义。(3)所有患者均未发生严重不良反应及并发症。结论经外周静脉移植脐血干细胞治疗失代偿期肝硬化患者安全有效,Child-Pugh A、B级患者的疗效优于Child-Pugh C级患者。
关键词:脐血干细胞移植;肝硬化;治疗;观察
1 资料与方法
1.1一般资料选择2012年9月—2015年6月于我院中西医结合肝病诊疗中心住院的失代偿期肝硬化患者65例,采用随机数字表法分为干细胞组和对照组。干细胞组34例,其中男20例,女14例,年龄34~74岁,平均(55.62±9.56)岁;乙型肝炎肝硬化30例、丙型肝炎肝硬化2例、原发性胆汁性肝硬化1例、酒精性肝硬化1例。Child-Pugh分级:A 级13例、B级14例、C级7例。对照组31例,其中男18例,女13例,年龄33~71岁,平均(55.10±9.21)岁;乙型肝炎肝硬化28例、丙型肝炎肝硬化1例、原发性胆汁性肝硬化1例、酒精性肝硬化1例。Child-Pugh分级:A级11例、B级13例、C级7例。诊断符合2000年《病毒性肝炎防治方案》中肝硬化的临床诊断标准。排除标准:重型肝炎急性期、已确诊有肝癌、严重的心肺脑疾病以及衰竭状态、高度过敏体质、有精神疾病者。所有患者均给予保肝降酶等综合内科治疗,干细胞组在此基础上给予脐血干细胞治疗。本研究得到医院伦理委员会许可,并征得患者及家属的知情同意,签署知情同意书。2组患者的年龄(t=0.223)、性别(χ2=0.004)、Child-Pugh分级(χ2=0.065)、肝硬化病因(P=1.000)差异均无统计学意义。
1.2脐血采集选择健康产妇,排除乙型肝炎、丙型肝炎、艾滋病、梅毒及其他传染性疾病,无病理妊娠者。胎儿娩出并断脐后,用装有ACD-B保存液的一次性采血袋以封闭式采血法采血,每袋采脐血约60~140mL备用。
1.3脐血干细胞的分离采用细胞处理试剂盒[宁夏中联达生物有限公司(外周血、骨髓、脐带血有核细胞分离液)宁(银)食药监测(准)字2011第1400021号]分离脐血干细胞。经流式细胞仪检测,结果显示:表达干细胞标志CD34、CD45,说明脐血干细胞分离培养成功。细胞活性检测大于95%,细胞内毒素检测阴性。单次移植提取的脐血干细胞总数为(0.7~2)×108/L,平均1.0×108/L,以0.9%氯化钠注射液稀释至100mL。
1.4移植途径与方法患者取仰卧位,采用外周静脉途径建立静脉留置针,使用输血器输注脐血干细胞。输注脐血干细胞前20min给予苯海拉明注射液20mg肌内注射,0.9%氯化钠溶液建立静脉通路,再给予脐血干细胞静脉滴注。滴注时注意控制滴速,100mL悬液滴注30min。
1.5术后随访2组患者治疗前和治疗后2、4、12、24周检查肝功能:丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素(to⁃tal bilirubin,TBIL)、白蛋白(albumin,ALB)、胆碱酯酶(cholin⁃esterase,CHE)。凝血功能:凝血酶原活动度(prothrombin ac⁃tivity,PTA),观察临床症状的改善情况、术后不良反应以及肝细胞癌的发生率、病死率。
1.6统计学方法所有数据采用SPSS 13.0软件进行统计分析。计量数据用均数±标准差(±s)表示,2组治疗前后各指标比较采用重复测量数据的方差分析,组内多重比较采用LSD-t法。2组间比较采用成组t检验;计数资料组间比较采用χ2检验或Fisher精确概率法,P < 0.05为差异有统计学意义。
2 结果
2.1临床症状的改善情况治疗4周后,干细胞组Child-Pugh A、B级患者临床症状改善率均高于对照组(P<0.01或P<0.05),见表1。2组Child-Pugh C级患者临床症状改善率差异无统计学意义(P>0.05),见表2。

Tab.1 Changes of clinical symptoms in patients with Child-Pugh A and Child-Pugh B表1 Child-Pugh A、B级患者临床症状的改善情况(例)
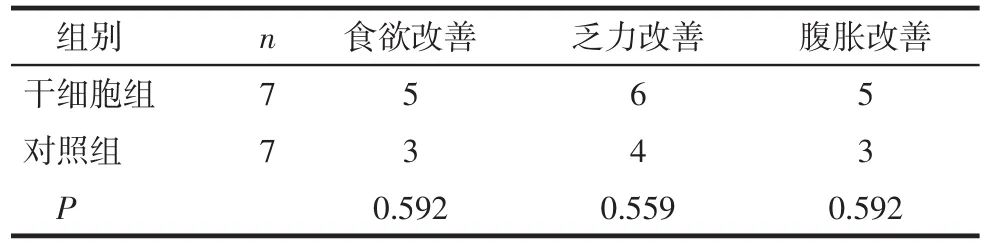
Tab.2 Changes of clinical symptoms in patients with Child-Pugh C表2 Child-Pugh C级患者临床症状的改善情况(例)
2.22组Child-Pugh A、B级患者血液生物学指标的比较干细胞组ALB、PTA治疗后2、4、12、24周较治疗前升高(P < 0.05),且在12、24周较对照组升高(P < 0.05)。对照组ALB、PTA治疗前后差异无统计学意义。干细胞组CHE治疗后4、12、24周较治疗前升高(P < 0.05),对照组CHE治疗前后差异无统计学意义,且2组间CHE比较差异无统计学意义。2组间各时点ALT、AST、TBIL差异无统计学意义;2组TBIL治疗后12周较治疗前降低(P < 0.05),见表3。
2.32组Child-Pugh C级患者血液生物学指标的比较2组ALT、AST、TBIL、ALB、CHE、PTA治疗后与治疗前比较差异无统计学意义,组间比较差异也无统计学意义,见表4。
2.4不良反应的发生情况2组患者随访6个月均未发现严重不良反应及并发症,无肝癌发生,无死亡患者。
Tab.3 Changes of blood biological indicators in patients with Child-Pugh A and Child-Pugh B表3 Child-Pugh A、B级患者各项血液生物学指标的变化 (±s)

Tab.3 Changes of blood biological indicators in patients with Child-Pugh A and Child-Pugh B表3 Child-Pugh A、B级患者各项血液生物学指标的变化 (±s)
*P<0.05;**P<0.01;ALT:F组间=0.427,F时间=2.241,F交互=0.285,均P>0.05;AST:F组间=2.042,F时间=1.874,F交互=0.753,均P>0.05;TBIL:F组间=0.378,F交互=0.326,均P>0.05;F时间=3.272,P=0.013;ALB:F组间=1.333,F时间=2.138,均P>0.05;F交互=3.912,P=0.004;CHE:F组间=0.105,F时间=1.256,均P>0.05;F交互=2.994,P=0.028;PTA:F组间=3.608,P=0.063;F时间=5.326,P=0.001;F交互=3.442,P=0.015;a与同组0周比较,P<0.05
组别干细胞组对照组t n ALT(U/L)F 27 24 0周35.76±23.60 39.00±25.17 0.475 2周36.13±21.78 37.88±21.58 0.288 4周33.99±18.44 38.59±16.31 0.939 12周32.41±16.64 37.46±23.75 0.886 24周30.65±13.56 31.34±16.76 0.163 1.536 1.078组别干细胞组对照组t n AST(U/L)F 27 24 0周38.39±22.91 50.39±36.40 1.425 2周39.99±22.27 43.90±31.87 0.542 4周36.50±16.99 43.20±25.25 1.114 12周33.59±14.62 44.40±24.31 1.949 24周33.49±15.15 42.44±29.63 1.381 2.537 0.867组别干细胞组对照组t n TBIL(μmol/L)F 27 24 0周32.19±21.19 31.05±14.09 0.223 2周31.00±19.39 27.21±12.48 0.819 4周31.04±18.24 28.33±14.68 0.580 12周28.64±17.82a25.19±14.71a0.748 24周29.52±15.96 27.55±9.59 0.524 1.606 1.800组别干细胞组对照组t n ALB(g/L)F 27 24 0周37.15±6.86 37.17±7.77 0.011 2周38.34±6.21a36.78±6.82 0.856 4周39.26±6.44a37.99±6.97 0.675 12周39.93±5.72a36.39±6.27 2.108*24周39.77±6.11a36.30±6.02 2.039*5.36**1.330组别干细胞组对照组t n CHE(U/L)F 27 24 0周4 122.59±1 649.85 4 438.67±2 222.06 0.581 2周4 217.37±1 500.40 4 107.04±1 786.47 0.240 4周4 339.93±1 574.49a4 262.75±2 199.04 0.145 12周4 639.26±1 521.58a4 188.71±2 023.58 0.905 24周4 622.33±1 681.30a4 180.29±1 565.41 0.968 4.214*0.757组别干细胞组对照组t n PTA(%)F 27 24 0周69.15±18.11 67.38±20.51 0.328 2周75.69±18.39a65.33±20.05 1.925 4周75.38±16.67a65.93±17.28 1.979 12周80.00±18.95a68.88±18.19 2.133*24周80.31±21.56a67.83±15.33 2.469*9.122**0.701
Tab.4 Changes of blood biological indicators in patients with Child-Pugh C表4 Child-Pugh C级患者各项血液生物学指标的变化 (n=7,±s)

Tab.4 Changes of blood biological indicators in patients with Child-Pugh C表4 Child-Pugh C级患者各项血液生物学指标的变化 (n=7,±s)
ALT:F组间=2.931,F时间=0.571,F交互=0.556,均P>0.05;AST:F组间=0.391,F交互=0.497,均P>0.05;F时间=3.565,P=0.013;TBIL:F组间=1.268,F时间=0.150,F交互=0.860,均P>0.05;ALB:F组间=0.009,F时间=1.902,F交互=1.205,均P>0.05;CHE:F组间=1.004,F时间=0.407,F交互=0.561,均P>0.05;PTA:F组间=1.993,F时间=0.440,F交互=0.862,均P>0.05
组别干细胞组对照组t ALT(U/L)F 0周28.69±4.64 25.37±9.28 0.845 2周33.17±6.69 26.07±10.75 1.484 4周32.76±3.83 24.77±9.23 2.115 12周31.46±2.84 25.27±9.53 1.645 24周30.76±6.46 25.91±8.79 1.175 1.085 0.085组别干细胞组对照组t AST(U/L)F 0周37.01±8.78 35.99±7.10 0.241 2周37.94±12.15 33.89±7.19 0.760 4周42.01±14.09 40.37±10.36 0.248 12周42.87±11.94 37.31±8.38 1.008 24周37.41±8.37 34.94±6.99 0.600 1.892 2.231组别干细胞组对照组t TBIL(μmol/L)F 0周53.07±6.17 48.99±12.04 0.799 2周55.89±16.34 44.89±11.51 1.451 4周51.64±6.93 47.27±14.56 0.717 12周49.91±13.01 47.94±17.45 0.240 24周54.57±9.68 44.61±13.74 1.568 0.826 0.318组别干细胞组对照组t ALB(g/L)F 0周28.33±2.01 27.59±3.66 0.375 2周29.30±2.64 30.06±8.31 0.424 4周28.63±3.78 29.00±5.24 0.418 12周27.43±2.84 27.49±4.40 0.474 24周27.89±2.43 28.44±5.47 0.550 0.943 1.126组别干细胞组对照组t CHE(U/L)F 0周1 835.29±168.10 2 051.29±342.24 1.517 2周1 860.00±160.92 2 165.86±557.13 1.405 4周1 798.43±252.51 2 000.00±584.32 0.774 12周1 976.57±295.50 1 999.14±520.96 0.090 24周1 857.43±416.89 2 041.43±559.77 0.697 0.378 0.664组别干细胞组对照组t PTA(%)F 0周38.86±5.21 44.43±10.92 1.218 2周35.43±3.31 46.71±14.21 2.047 4周38.86±7.10 43.57±13.99 0.795 12周36.86±6.04 41.14±11.16 0.894 24周38.00±5.03 43.43±12.71 1.050 0.909 0.565
3 讨论
3.1脐血干细胞移植治疗肝硬化的研发前沿和临床意义脐血干细胞是近年来发现的一类具有多向分化潜能的原始细胞。脐血干细胞来源广泛,易于采集,其较骨髓干细胞及外周血干细胞更为原始,有更强的分化和增殖能力,且免疫原性弱,临床应用无需配型[3],适用于细胞治疗。动物研究中,Shi等[4]用绿色荧光蛋白标记的人脐血干细胞通过直接肝内注射治疗CCl4诱导的急性肝损伤大鼠,结果发现脐血干细胞移植能够显著改善急性肝损伤大鼠的生存率,其潜在机制可能为脐血干细胞可以分化为肝样细胞并定向移位到肝脏的损伤部位发挥作用。临床研究显示脐血干细胞移植可以改善失代偿期肝硬化患者的肝功能及临床症状,安全性好[5-6]。但脐血干细胞移植对于不同程度肝硬化患者的疗效是否一致,仍需进一步探讨。本研究采用脐血干细胞移植治疗失代偿期肝硬化患者,设立对照组,对不同程度肝硬化患者的临床疗效进行了分析,为其应用提供了进一步临床指导。
3.2脐血干细胞移植治疗不同程度肝硬化的疗效分析Child-PughA、B级患者干细胞组ALB和PTA治疗后较治疗前和对照组均升高,提示脐血干细胞移植可以改善肝脏合成ALB和凝血因子的功能,其可能机制为干细胞通过静脉回输后优先到达受损伤或炎症组织[7],干细胞到达损伤的肝脏后:(1)可以抑制肝细胞的凋亡,还可以合成多种生长因子和细胞因子,通过旁分泌的作用促进肝细胞的再生[8],增强肝脏的合成功能。(2)在肝脏微环境中可以分化为肝细胞[9-10]或与肝细胞融合,从而促进肝脏的修复再生,使肝脏合成功能增强。本研究显示Child-PughA、B级患者2组ALT、AST、TBIL差异均无统计学意义,而ALT、AST、TBIL为肝脏炎症损伤的指标,提示脐血干细胞无明显改善肝脏炎症损伤的作用。Child-Pugh C级患者2组ALT、AST、TBIL、ALB、CHE、PTA差异均无统计学意义,提示脐血干细胞对Child-Pugh C级患者的临床疗效不佳。分析其原因可能为:肝功能Child-Pugh C级时肝脏出现明显肝窦变窄、血流受阻、肝内阻力增加,影响门静脉血流动力学,造成肝细胞缺氧和养料供给障碍,且门脉压力增高,加重肝细胞的营养障碍,植入的干细胞因没有合适的微环境,影响其增殖分化发挥作用。但由于Child-Pugh C级患者例数少,可能对疗效观察有一定的影响,需加大样本量进一步观察。此外,本研究显示Child-Pugh A、B级患者的临床症状较Child-PughC级患者明显改善。
综上所述,经外周静脉回输脐血干细胞治疗失代偿期肝硬化患者,能改善患者的肝功能、凝血功能和临床症状,安全可靠,并且肝硬化的程度越轻,疗效越好。但由于该项目开展时间尚短,病例数量少,随访时间较短,仍需扩大样本长期随访观察。
参考文献
[1] AminmA, Sabry D, Rashed LA, et al.Short-term evaluation of au⁃tologous transplantation of bonemarrow- dericedmesenchymal stem cells in patients with cirrhosis: Egyptian study[J].Clin Trans⁃plant, 2013, 27(4):607-612.doi: 10.1111/ctr.12179.
[2] Zhang Z, Linh, Shim , et al.Human umbilical cordmesenchymal stem cells improve liver function and ascites in decompensated liv⁃er cirrhosis patients[J].J Gastroenterolhepatol, 2012, 27(suppl2): 112-120.doi: 10.1111/j.1440-1746.2011.07024.x.
[3] Kakinuma S, Tanaka Y, Chinzei R, et al.Human umbilical cord blood as a source of transplantablehepatic progenitor cells[J].Stem Cells, 2003, 21(2):217-227.
[4] Shi LL, Liu FP, Wang DW.Transplantation ofhuman umbilical cord bloodmesenchymal stem cells improves survival rates in a ratmodel of acutehepatic necrosis [J].Am Jmed Sci, 2011, 342(3): 212-217.doi: 10.1097/MAJ.0b013e3182112b90.
[5] Yang YL, Wang SP, Wang LH, et al.Clinical study ofhuman umbil⁃ical cord blood stem cells transplantation in the treatment of Not posthepatitic cirrhosis[J].Tianjinmed J, 2013,41(1):67-68.[杨彦林,王树平,王丽华,等.脐带血干细胞移植治疗非肝炎后肝硬化的临床研究[J].天津医药,2013,41(1):67- 68].doi:10.3969/j.issn.0253-9896.2013.01.022.
[6] Wang KJ, Zhao SM, Wang F, et al.Effect of liver volume and liverhemodynamics ofhuman umbilical cord blood stem cell transplanta⁃tion on decompensated cirrhosis[J].Chin J Diffic and Compl Cas, 2014, 13(11): 1126-1133.[王可敬,赵山明,王方,等.脐血干细胞移植对失代偿期肝硬化肝功能及血流动力学的影响[J].疑难病杂志,2014,13(11):1126-1133].doi: 10.3969/j.issn.1671-6450.2014.11.008.
[7] Francois S, Bensidhoumm,mouiseddinem, et al.Local irradiation not only induceshoming ofhumanmesenchymal stem cells at ex⁃posed sites but promotes their widespread engraftment tomultiple organs: a study of their quantitative distribution after irradiation damage[J].Stem Cells, 2006, 24(4): 1020-1029.
[8] Liu WH, Song FQ, Ren LN, et al.Themultiple functional roles ofmesenchymal stem cells in participating in treating liver diseases [J].J Cellmolmed, 2015, 19(3): 511- 520.doi: 10.1111/jc⁃mm.12482.
[9] Li T, Zhu J,ma K, et al.Autologous bonemarrow-derivedmesen⁃chymal stem cell transplantation promotes liver regeneration after portal vein embolization in cirrhotic rats[J].J Surg Res, 2013, 184 (2):1161-1173.doi: 10.1016/j.jss.2013.04.054.
[10] Zheng G, Liu Y, Jing Q, et al.Differentiation ofhuman umbilical cord-derivedmesenchymal stem cells intohepatocytes in vitro[J].Biomedmater Eng, 2015,25(1 suppl): 145-159.doi: 10.3233/BME-141249.
(2015-01-27收稿2015-08-18修回)
(本文编辑李鹏)
Clinical study ofhuman umbilical cord blood stem cell transplantation via peripheral vein in the treatment of decompensated cirrhosis
ZHANG Sui, TONG Lixin, YAN Baoyong△, LI Quanhai, JIA Bei, LIU Liping,mA Wenbo, ZHANG Jun
Liver Disease Diagnoses and Treatment Center of Chinese Westernmedicine, the Firsthospital ofhebeimedical University, Shijiazhuang 050031, China
△Corresponding Author E-mail:yanbaoyong111@163.com
Abstract:ObjectiveTo investigate the effect and safety ofhuman umbilical cord blood stem cell transplantation via peripheral vein in the treatment of different degrees of liver cirrhosis.Methods Sixty-five patients with liver cirrhosis were selected, and divided into stem cell group (n=34) and control group (n=31).Stem cell group included patients with different degrees of cirrhosis: 13 with Child-Pugh A, 14 with Child-Pugh B and 7 with Child-Pugh C respectively, patients in stem cell group were given intravenous infusion ofhuman umbilical cord blood stem cells via peripheral vein on the basis of rou⁃tine treatment.The changes of liver function and coagulation function were observed before transplantation, 2, 4, 12 and 24 weeks after transplantation.In addition, clinical symptoms and side effects in patients were observed after the stem cell treat⁃ment.Results (1) Clinical symptoms were improved obviously in patients with Child-Pugh A and B in stem cell group com⁃pared with those in control group.There were no significant differences in clinical symptoms in patients with Child-Pugh C between stem cell group and control group.(2) Liver of albumin (ALB), prothrombin activity (PTA) were significantly in⁃creased in patients with Child-Pugh A and B in stem cell group at 2, 4,12 and 24 weeks after treatment than those before treatment.Levels of ALB and PTA were increased in stem cell group at 12 and 24 weeks after treatment than those of control group.The level of cholinesterase (CHE) was increased in stem cell group at 4, 12 and 24 weeks after treatment than thosebook=84,ebook=89before treatment.There was no significant differences in level of CHE between stem cells group and control group.There was no significant differences in levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and total bilirubin (TBIL) between stem cell group and control group.There were no significant differences in ALT, AST, TBIL, ALB, CHE and PTA in patients with Child-Pugh C between stem cell group and control group.(3) There were no severe complications and adverse reactions in patients after treatment.Conclusionhuman umbilical cord blood stem cell transplantation via periph⁃eral vein is safe and effective for the treatment of liver cirrhosis.The curative effect ismuch remarkable in patients with Child-Pugh A and B than that in patients with Child-Pugh C.
Key words:cord blood stem cell transplantation;liver cirrhosis;therapy;observation肝移植是治疗失代偿期肝硬化的理想选择,但因为肝来源缺乏、价格昂贵及移植后免疫排斥反应等限制了其临床应用。干细胞移植技术的发展为肝硬化的治疗提供了一个新思路。干细胞是一类具有自我更新、高度增殖和多向分化潜能的细胞群体,在体内外均有极强的向肝细胞分化的能力。研究表明,干细胞移植可以改善肝硬化患者的肝功能及临床症状[1-2],但对于不同程度肝硬化患者的疗效是否一致,尚缺乏临床对照研究。本研究通过分离脐血干细胞,并经外周静脉移植治疗不同程度失代偿期肝硬化患者,旨在对其临床疗效及安全性进行评价。
通讯作者△E-mail:yanbaoyong111@163.com
作者简介:张岁(1982),女,硕士,主要从事肝病研究
基金项目:河北省科技计划项目(12276102D)
中图分类号:R575.2,R457
文献标志码:A
DOI:10.11958/58304
作者单位:河北医科大学第一医院中西医结合肝病诊疗中心(邮编050031)

