STAT-3抑制剂WP1066增强顺铂对口腔鳞状细胞癌侵袭能力抑制作用的体外研究
孔令平,刘爱芹,周旋,任玉,黄媛媛,刘速,张仑△
STAT-3抑制剂WP1066增强顺铂对口腔鳞状细胞癌侵袭能力抑制作用的体外研究
孔令平1,刘爱芹1,周旋1,任玉2,黄媛媛1,刘速1,张仑1△
摘要:目的探讨信号转导及转录激活因子3(STAT-3)调控miR-21增强化疗药物顺铂抑制人口腔鳞状细胞癌侵袭能力的作用。方法实验共分3组:二甲基亚砜组(DMSO组)、顺铂组(DDP组)、小分子抑制剂+顺铂组(WP1066+DDP组)。实时定量PCR检测miR-21表达水平;Western blot检测STAT-3及p-STAT-3、基质金属蛋白酶组织抑制因子3(TIMP-3)、基质金属蛋白酶2/9(MMP-2/9)的表达;用Matrigel基质生长实验和Transwell体外侵袭实验检测肿瘤细胞生长形成球形克隆、侵袭能力;荧光素酶报告基因实验检测miR-21的表达水平。结果WP1066+DDP处理组的STAT3/pSTAT-3表达水平比DDP组低;WP1066+DDP组miR-21表达比前两组低;通过Transwell小室聚碳酸酯膜的细胞数WP1066+DDP组少于DDP组;WP1066+DDP组细胞生长形成球的能力明显较DDP组减弱;TIMP-3蛋白表达较前两组升高;MMP-2/9表达水平较前两组明显下调。荧光素酶实验证明WP1066+ DDP组的荧光素酶活性明显低于DDP组和DMSO组。结论通过抑制舌癌细胞中STAT-3活性,下调miR-21表达,可以增强化疗药物抑制口腔鳞状细胞癌的侵袭能力,为使WP1066联合DDP化疗成为靶向治疗人口腔鳞状细胞癌提供了实验依据。
关键词:癌,鳞状细胞;口腔肿瘤;肿瘤侵润;STAT3转录因子;顺铂;miR-21
鳞状细胞癌是口腔颌面部肿瘤中最常见的病理类型。进展期口腔鳞状细胞癌常呈浸润性生长,并伴有颈部淋巴结转移或远处转移,影响患者预后。STAT-3在口腔鳞癌中异常激活并影响肿瘤的转移及放化疗的敏感性等生物学行为[1]。Loffler等[2]在多发性骨髓瘤中发现STAT-3能够通过促进miR-21的转录影响肿瘤的生长。本课题组进而研究证明WP1066抑制STAT-3的表达可以降低人舌鳞状细胞癌的侵袭能力[3]。研究认为STAT-3极有可能成为肿瘤治疗的新靶点[4-5]。顺铂(DDP)是治疗人舌鳞状细胞癌的一线药物,但舌鳞癌对其产生耐药严重影响治疗效果,因此,逆转化疗耐药、提高舌鳞癌对其敏感性及寻找更有效的治疗靶点和药物越来越受到关注。本文拟通过使用STAT-3小分子抑制剂WP1066拮抗STAT-3信号通路活性,探讨WP1066联合DDP治疗口腔鳞癌的分子机制。
1 材料与方法
1.1材料及试剂RPMI1640培养基、MEM/EBSS培养基、胎牛血清及0.25%胰蛋白酶购自美国Hyclone公司;鳞状细胞癌细胞株Tscca购自中国医学科学院基础医学研究所,Tca8113P160购自中国典型培养物保藏中心。Western blot相关试剂购自上海索莱宝生物科技有限公司;PVDF膜购于瑞士罗氏公司;辣根过氧化物酶二抗购自北京天根生化科技有限公司;Western发光试剂购自美国Pierce公司。STAT-3 (CST,美国)、pSTAT-3(SAB,美国)、基质金属蛋白酶组织抑制因子-3(TIMP-3)购自美国Santa Cruz公司,基质金属蛋白酶2/9(MMP-2/9)及3-磷酸甘油酸(GAPDH)购自北京中杉金桥生物技术有限公司。WP1066购自德国Calbiochem公司;DDP、DMSO溶剂购自美国Sigma公司;Trizol试剂购自美国Invitrogen公司;RNA逆转录试剂盒购自日本Takara公司;Matrigel基质胶购自美国BD公司;pmiR-21荧光素酶报告载体购自美国Signosis公司。
1.2方法
1.2.1细胞培养和实验分组用含10%胎牛血清的MEM/EBSS完全培养基培养人口腔鳞状细胞癌细胞株Tscca,含10%胎牛血清的RPMI-1640完全培养基培养人口腔鳞状细胞癌细胞株Tca8113P160,并均置于37℃、5%CO2细胞培养箱内培养。实验分为3组。二甲基亚砜(DMSO)组:(1)将14 μL的DMSO加入4mL的Tca8113P160细胞培养基内。(2)将12.4 μL的DMSO加入4mL的Tscca细胞培养基内。顺铂(DDP)组:(1)以DDP终浓度为0.9mg/L(半数抑制浓度,IC50)的培养基处理Tca8113P160。(2)以DDP终浓度为1.0mg/L(IC50)的培养基处理Tscca。WP1066和顺铂共处理组(WP1066+DDP组):(1)以DDP终浓度为0.9mg/L且WP1066终浓度为3.5 μmol/L(IC50)的培养基处理Tca8113P160。(2)以DDP终浓度为1.0mg/L且WP1066终浓度为3.1 μmol/L(IC50)的培养基处理Tscca。
1.2.2舌癌细胞相关蛋白表达的检测采用Western blot法。常规培养对数生长期舌癌细胞Tscca、Tca8113P160,经3种实验分组处理细胞24h后,加入RIPA裂解液冰上裂解30min,离心,取上清液,使用Nanodrop紫外分光光度计(Gene,美国)测定总蛋白浓度和纯度,其余上清液与等体积2×上样缓冲液混匀、煮沸,分装并置于-80℃冰箱中保存。制胶上样,80 V电泳40min,150 V电泳1h,4℃转膜1.5h。实验采用GAPDH作为内对照。GAPDH一抗(1∶2 000稀释),STAT-3、pSTAT-3、MMP-2/9、TIMP-3一抗(1∶1 000稀释)4℃摇床孵育过夜,PBST洗涤3次,每次5min,加入辣根过氧化物酶标记的二抗(1∶2 000稀释)室温孵育1h,PBST洗去二抗,将化学发光底物滴加于聚偏二氟乙烯(PVDF)膜,凝胶成像系统采集图像。
1.2.3舌癌细胞miR-21表达水平检测采用实时定量PCR法。常规培养细胞,用3种实验处理组分别处理细胞24h后,弃培养基,加1mL Trizol试剂混匀,吹下置于1.5mL离心管中;加入0.2mL氯仿,混匀,4℃、12 000 r/min离心15min,取上清液加入0.4mL异丙醇混匀,静置10min,12 000 r/min离心20min,弃尽上清液,75%乙醇1mL洗涤3遍;7 500 r/min离心5min,弃尽上清液;加入DEPC水完全溶解,紫外分光光度计测其浓度及完整性。按试剂盒配成20 μL反转录体系,制成cDNA保存于-80℃;按试剂盒配成20 μL扩增体系。Opticon 3软件计算ΔCt值,使用(2-ΔΔCt)表示miR-21相对表达量。
1.2.4舌癌细胞侵袭能力的检测分别处理3组细胞,用无血清培养基制备成单细胞悬液;在Transwell板上室的聚碳酸酯膜上加入稀释后的Matrigel(3.9 g/L)70µL,在Transwell下室中加入完全培养基600µL,将单细胞悬液向上室孔中加入1×104个/孔,置于细胞培养箱中培养24h。待培养时间结束后,弃去上室液体,使用苏木精染色,PBS清洗,DP-70荧光相差倒置显微镜(×100)采集图像,选取3个视野,计算穿过膜的细胞数。
1.2.5舌癌细胞球形克隆形成能力的检测采用Matrigel基质生长实验检测法。分别处理3组细胞,Matrigel基质胶置于4℃过夜溶解,24孔板每孔中预铺100µLmatrigel基质胶,置于37℃培养箱30min;常规消化细胞并调节细胞密度至2×107个/L,按2∶1体积比将Matrigel与细胞悬液混合,置于37℃培养箱30min;加入完全培养基;每隔2 d更换完全培养基并加入WP1066、DDP,培养至2周,采集图像。
1.2.6荧光素酶活性检测将细胞接种于96孔板,待细胞贴壁后,按3种实验组的方法处理细胞,将0.2 μg pmiR-21荧光素酶报告载体(将miR-21启动子区域调控序列插入到荧光素酶表达序列前方的报告基因质粒)与2mL Lipofecta⁃min3000混匀,加入细胞,常规培养48h,弃去培养基,使用细胞裂解缓冲液充分裂解细胞20min,加入底物70 μL/孔,反应后,使用ELX800酶标仪测定荧光素酶活性。
1.3统计学方法用SPSS 18.0统计软件包处理实验数据,采用单因素方差分析对不同处理组的蛋白相对表达量、miR-21表达水平、克隆形成球直径、穿过聚碳酸酯膜的细胞数目及荧光素酶实验荧光强度进行统计学分析,以双侧P<0.05为差异有统计学意义。
2 结果
2.1WP1066+DDP组对舌癌细胞STAT-3/pSTAT-3蛋白表达的影响WP1066+DDP处理后,Tscca、Tca8113P160舌癌细胞株STAT-3下调,pSTAT-3蛋白相对表达量较DMSO组和DDP组显著下调,提示WP1066+DDP能够有效下调pSTAT-3蛋白的表达,见图1。

A:Tscca舌癌细胞;B:Tca8113P160舌癌细胞1:DMSO组;2:DDP组;3:WP1066+DDP组Fig.1 The expression of STAT3/pSTAT3 upon WP1066 treatment in tongue squamous carcinoma cells图1 WP1066处理后舌癌细胞系中STAT3/pSTAT3蛋白表达
2.2WP1066+DDP组处理后miR-21的表达变化DMSO组和DDP组舌癌细胞株miR-21表达水平差异无统计学意义。WP1066+DDP共同处理后,舌癌细胞株miR-21表达水平较DDP组显著下降(Tscca:F=259.750;Tca8113P160:F=301.302,均P < 0.01),见图2。
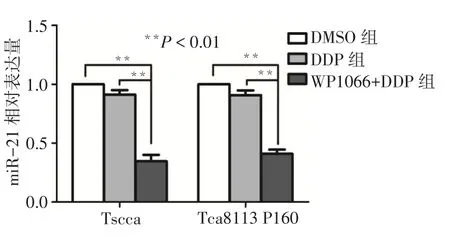
Fig.2 The relative expression ofmiR-21 wasmeasured by RT-PCR图2 实时定量PCR法检测WP1066+DDP处理后miR-21的表达水平
2.3WP1066+DDP对舌癌细胞迁移能力的影响结果以穿过聚碳酸酯膜的Tscca、Tca8113P160舌癌细胞株的细胞数目表明细胞的侵袭和迁移能力。结果显示,WP1066 + DDP组舌癌细胞Tscca和Tca8113P160均少于DMSO组和DDP组(F分别为181.691和216.766),见图3、4。
2.4WP1066对舌癌细胞生长形成球形克隆能力的影响结果经过15 d观察,DDP组较DMSO组舌癌细胞克隆形成能力略有下降,DMSO组细胞生长状态良好,WP1066+DDP处理后的细胞生长能力明显下降,绝大多数不能贴壁生长。且WP1066+DDP组[Tscca:(58.67±9.50)μm;Tca8113P160:(111.33± 17.04)μm]克隆形成球的平均直径明显小于DDP组[Tscca:(121.06±19.08)μm;Tca8113P160:(216.05± 19.52)μm]和DMSO组[Tscca:(204.03±24.76)μm;Tca8113P160:(315.33±21.50)μm],(Tscca:F=44.826;Tca8113P160:F=82.615,均P < 0.01)。见图5。
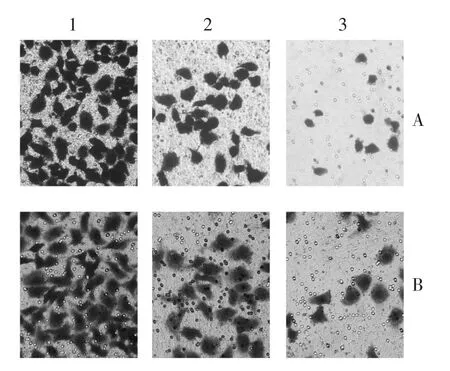
A:Tscca舌癌细胞;B:Tca8113P160舌癌细胞1:DMSO组;2:DDP组;3:WP1066+DDP组Fig.3 WP1066+DDP significantly inhibited cellmigration and invasion as shown by transwell assays图3 舌癌细胞经WP1066+DDP处理后侵袭和迁移能力下降(×100)

Fig.4 The number of cells thatmigrated through transwellmatrigel in two tongue squamous cell carcinoma cell lines图4 Transwell检测舌癌细胞穿膜细胞数目

A:Tscca舌癌细胞;B:Tca8113P160舌癌细胞1:DMSO组;2:DDP组;3:WP1066+DDP组Fig.5 WP1066 + DDP treatment inhibited cell growth onmartrigelmatrix effectively(×100)图5 2组舌癌细胞系经WP1066+DDP处理后Matrigel基质生长实验克隆形成结果(×100)
2.5不同处理后舌癌细胞肿瘤侵袭相关蛋白的表达变化WP1066+DDP共同处理后,TIMP-3蛋白相对表达量较DMSO组和DDP组显著上调,而MMP-2、MMP-9蛋白相对表达量显著下降,提示WP1066+ DDP共同处理后,Tscca、Tca8113P160舌癌细胞株细胞降解细胞外基质(ECM)能力下降,见图6。

A:Tscca舌癌细胞;B:Tca8113P160舌癌细胞1:DMSO组;2:DDP组;3:WP1066+DDP组Fig.6 Expression of invasion related proteins after WP1066+DDP treatment图6 WP1066+DDP处理后2细胞系肿瘤侵袭相关蛋白表达水平
2.6WP1066+DDP处理后荧光素酶活性荧光素酶实验证实WP1066+DDP处理并转染pmiR-21荧光素酶报告载体组荧光素酶活性较DMSO组和DDP组明显降低(Tscca:F= 425.893;Tca8113P160:F=687.809,均P < 0.01),见图7。

Fig.7 Luciferase activity in tongue squamous cell carcinoma after transfected withmiR-21 and treated with WP1066+DDP图7 转染miR-21后2组舌癌细胞荧光素酶活性
3 讨论
3.1STAT3在肿瘤中的作用STAT3是一种致癌性的转录因子,与癌细胞的增殖、侵袭及炎症反应有着密切的关系。当激活其上游信号通路时,STAT3发生磷酸化并形成二聚体或者与其他STAT家族成员形成异二聚体。被激活的STAT3复合物转移至细胞核内使cyclin D1、Bcl-xL、c-myc及血管内皮生长因子(VEGF)等下游靶基因发生转录[6]。现研究已证实在头颈部鳞癌[7]、骨髓瘤[2]、乳腺癌[8]、胰腺癌[9]、卵巢癌[10]及肺癌[11]等多种肿瘤中,STAT3增强了癌细胞的生长、侵袭及转移能力。
3.2MiR21促进肿瘤发展MiR21转录自染色体17q23.2,是较为常见并被广泛研究的miRNA之一。已在多个肿瘤中证实,miR-21过表达可以促进癌细胞的增殖、侵袭以及迁移[12]。目前的研究表明,miR-21作为人舌癌的独立预后因子,能够通过促进舌鳞癌细胞的生长、侵袭及转移,影响患者的预后[13]。
3.3STAT3与miR21的关系目前,已有大量的研究表明STAT3可以直接激活miR-21。在多发性骨髓瘤细胞中,miR-21的转录可直接被其上游包含有2个STAT3结合位点的增强子所控制[2]。另外,白细胞介素(IL)-6诱导miR-21的产生是依赖STAT3完成的,敲低STAT3的表达后,会影响IL-6上调miR-21的能力[14-16]。本课题组前期研究发现,口腔鳞癌组织中STAT3及miR-21的表达均明显高于瘤旁组织,并且进一步证实抑制了STAT3通路可以使受miR-21抑制的PTEN、PDCD4、TIMP-3等抑癌基因表达增高,从而影响口腔鳞癌细胞的生长和迁移能力[7]。因此,WP1066作为STAT3磷酸化水平的小分子抑制剂,有望成为口腔鳞状细胞癌新的靶向治疗药物[17]。
3.4WP1066增强DDP抑制舌癌细胞侵袭的能力本研究主要探讨WP1066增加DDP抑制人舌鳞状细胞癌侵袭的能力。3-Dmatrigel基质生长实验模拟了肿瘤细胞降解ECM的过程,并且在一定程度上反映了肿瘤细胞的增殖能力。WP1066+DDP联合处理Tscca和Tca8113P160后,舌癌细胞形成球形克隆的直径较其他2组明显减小。Transwell体外迁移实验模拟了细胞迁移的过程,WP1066+DDP联合处理舌癌细胞,抑制STAT3磷酸化水平后,舌癌细胞穿过Transwell小室膜孔数明显减少,两舌癌细胞系的侵袭能力明显减弱。
MMPs几乎能降解ECM中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用,其中MMP-2和MMP-9最为重要[18]。WP1066+DDP联合处理舌癌细胞,MMP2/9表达较DDP组明显降低,表明细胞降解ECM的能力下降,从而舌癌细胞的侵袭转移能力也大大被削弱。TIMPs是MMPs的特异性抑制剂,它可以共价键的形式与MMPs结合成1∶1复合体,特异性抑制MMPs的活性。其中TIMP-3蛋白的表达受miR-21的抑制,WP1066+DDP联合处理舌癌细胞,miR-21表达水平较DDP组下降明显,并且受miR-21抑制的TIMP-3蛋白表达显著上升。这些数据表明WP1066抑制miR-21的表达可明显增加体外细胞系对DDP的敏感性。
综上所述,经WP1066和DDP联合处理后,2个舌癌细胞系的侵袭能力明显低于DDP单独处理。因此,WP1066可以通过增强舌癌细胞对DDP的敏感性,从而有效抑制细胞侵袭。更重要的是,联合治疗有望降低DDP化疗剂量,减少患者化疗时产生的不良反应。通过阻滞STAT-3信号通路,增加舌癌细胞系对DDP的敏感性,使WP1066成为舌鳞状细胞癌的靶向治疗药物,但还需体内实验进一步探究。
参考文献
[1]machamA,matta A, Kaur J, et al.Prognostic significance of nucle⁃ar pSTAT3 in oral cancer[J].Head Neck, 2011, 33 (4): 482-489.doi: 10.1002/hed.21468.
[2] Loffler D, Brocke-Heidrich K, Pfeifer G, et al.Interleukin-6 depen⁃dent survival ofmultiplemyeloma cells involves the Stat3-mediat⁃ed induction ofmicroRNA-21 through ahighly conserved enhancer [J].Blood, 2007, 110 (4): 1330-1333.doi: 10.1182/blood-2007-03-081133.
[3] Liu AQ, Li SS, Zhou X, et al.Signal transducers and activators of transcription- 3modulateshuman squamous cell carcinoma inva⁃sion via targetingmircoRNA-21 in vitro[J].Chinese Journal of Sto⁃matology, 2013, 48 (9): 539-544.[刘爱芹,李莎莎,周旋,等.信号传导及转录激活因子调控微RNA-21影响人舌鳞状细胞癌细胞侵袭能力的体外研究[J].中华口腔医学杂志,2013,48(9):539-544].
[4] Sun X, Zhang J.STAT3 Decoy ODN Therapy for Cancer[J].Meth⁃odsmol Biol, 2015, 1317: 167-183.doi: 10.1007/978-1-4939-2727-2_11.
[5] Zuom, Li C, Lin J, et al.LLL12, a novel small inhibitor targeting STAT3 forhepatocellular carcinoma therapy[J].Oncotarget, 2015, 6 (13): 10940-10949.
[6]ho Y, Tsao SW, ZengmS, et al.STAT3 as a therapeutic target for Epstein-Barr virus (EBV) - associated nasopharyngeal carcinoma [J].Cancer Letters, 2013, 330 (2): 141- 149.doi: 10.1016/j.can⁃let.2012.11.052.
[7] Zhou X, Ren Y, Liu A, et al.STAT3 inhibitor WP1066 attenuatesmiRNA- 21 to suppresshuman oral squamous cell carcinoma growth in vitro and in vivo[J].Oncol Rep, 2014, 31 (5): 2173-2180.doi: 10.3892/or.2014.3114.
[8] LeehT, Xue J, Chou PC, et al.Stat3 orchestrates interaction be⁃tween endothelial and tumor cells and inhibition of Stat3 suppresses brainmetastasis of breast cancer cells[J].Oncotarget, 2015, 6 (12): 10016-10029.
[9] Fofaria NM, Srivastava SK.STAT3 induces anoikis resistance, pro⁃motes cell invasion andmetastatic potential in pancreatic cancer cells[J].Carcinogenesis, 2015, 36 (1): 142-150.doi: 10.1093/car⁃cin/bgu233.
[10] Tang YJ, Sun ZL, Wu WG, et al.Inhibitor of signal transducer and activator of transcription 3 (STAT3) suppresses ovarian cancer growth,migration and invasion and enhances the effect of cisplatin in vitro[J].Genetmol Res, 2015, 14 (1): 2450-2460.doi: 10.4238/2015.March.30.3.
[11] Bonastre E, Verdura S, Zondervan I, et al.PARD3 inactivation in lung squamous cell carcinomas impairs STAT3 and promotesmalig⁃nant invasion[J].Cancer Res, 2015, 75 (7): 1287- 1297.doi: 10.1158/0008-5472.CAN-14-2444.
[12] Lv L,huang FX,maohP, et al.MicroRNA-21 is overexpressed in renal cell carcinoma[J].Int J Biolmarker, 2013, 28 (2): 201-207.doi: 10.5301/Jbm.2013.10831.
[13] Li J,huangh, Sun L, et al.MiR-21 indicates poor prognosis in tongue squamous cell carcinomas as an apoptosis inhibitor[J].Clin Cancer Res, 2009, 15 (12): 3998-4008.doi: 10.1158/1078-0432.CCR-08-3053.
[14] Rozovski U, Calin GA, Setoyama T, et al.Signal transducer and acti⁃vator of transcription (STAT)-3 regulatesmicroRNA gene expres⁃sion in chronic lymphocytic leukemia cells[J].Mol Cancer, 2013, 12: 50.doi: 10.1186/1476-4598-12-50.
[15] Wang YY, Sun G, Luoh, et al.miR-21modulateshTERT through a STAT3- dependentmanner on glioblastoma cell growth[J].Cns Neurosci Ther, 2012, 18 (9): 722- 728.doi: 10.1111/j.1755-5949.2012.00349.x.
[16] Bourguignon LY, Earle C, Wong G, et al.Stem cellmarker (Nanog) and Stat-3 signaling promotemicroRNA-21 expression and chemo⁃resistance inhyaluronan/CD44-activatedhead and neck squamous cell carcinoma cells[J].Oncogene, 2012, 31 (2): 149- 160.doi: 10.1038/onc.2011.222.
[17] Peng S,Chen ZW.HGF/c-Met pathways for the regulation of tumor cells and the research progress and the correlation of tongue cancer [J].Journal of Dental Prevention And Treatment, 2012,20(10) : 552-555.[彭参,陈仲伟.HGF/c-Met通路对肿瘤细胞的调控及与舌癌的相关性研究进展[J].广东牙病防治,2012,20(10) : 552-555].
[18]maradni A, Khoshnevisan A,mousavi SH, et al.Role ofmatrixme⁃talloproteinases (MMPs) andmMP inhibitors on intracranial aneu⁃rysms: a review article[J].Med J Islam Repub Iran, 2013, 27 (4): 249-254.
(2015-07-20收稿2015-08-03修回)
(本文编辑李鹏)
The STAT-3 inhibitor WP1066 promotes oral squamous cell carcinoma invasiveness by cisplatin in vitro
KONG Lingping1,LIU Aiqin1,ZHOU Xuan1,REN Yu2,HUANG Yuanyuan1,LIU Su1,ZHANG Lun1△
1 Department ofmaxillofacial & E.N.T(ear, nose, and throat)Oncology, Tianjinmedical University Cancer Institute andhospital; National Clinical Research Center of Cancer; Key Laboratory of Cancer Prevention and Therapy,
Tianjin 300060, China; 2 Tianjinmedical University△Corresponding Author E-mail:zhanglun@tjmuch.com
Abstract:Objective To investigate the effect of signal transducers and activators of transcription 3(STAT-3)on sen⁃sitizing oral squamous cell carcinoma to cis-dichlorodiamineplatinum via downregulatingmiRNA-21.Methods Tscca and Tca8113P160human tongue squamous cell carcinoma cell lines were employed in this study.WP1066 was used to suppress STAT-3 signaling pathway.Cells were divided into three groups: dimethyl sulphoxide (DMSO) group, cis-dichlorodiamine⁃platinum (DDP) group and WP1066+DDP group.Transcription level ofmiR-21 was assessed by real-time PCR, while the expression levels of STAT-3, p-STAT-3, tissue inhibitor ofmetalloproteinase-3 (TIMP-3) andmatrixmetalloproteinase-2/9 (MMP-2/9 ) were evaluated by Western blot assay.Matrigelmatrix and transwell assay were used to determine cancer cell colony formation and invasive ability respectively.Expression level ofmiR-21 was examined by luciferase reporter gene as⁃say.Results Expression levels of STAT-3, pSTAT-3 andmiR-21 were significantly suppressed by WP1066 treatment.The diameters of culture colony in cells treated with WP1066 and DDP were smaller than those in control group.The number of tongue cancer cells thatmigrated through the transwellmembrane in WP1066 and DDP treated group was less than that in control group.Additionally,mMP- 2/9 expression decreased while TIMP- 3 increased dramatically in both cell lines in WP1066 + DPP group compared to the other two groups.ConclusionReduction of STAT-3 can sensitize oral squamous cell carcinoma to cis-dichlorodiamineplatinum via downregulatingmiR-21.Our study shows that DDP, in combination with WP1066,might be used as a potential target in the treatment ofhuman oral squamous cell cancer.
Key words:carcinoma, squamous cell;mouth neoplasms;neoplasm invasiveness;STAT3 transcription factor;cisplatin;miR-21
通讯作者△E-mail:zhanglun@tjmuch.com
作者简介:孔令平(1988),女,硕士在读,主要从事头颈部鳞癌基础研究
基金项目:国家自然科学基金资助项目(81172573)
中图分类号:R739.8
文献标志码:A
DOI:10.11958/20150010
作者单位:1天津医科大学肿瘤医院颌面耳鼻咽喉肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(邮编300060);2天津医科大学

