分泌金黄色的真姬菇隐性污染菌包微生物的分离与鉴定*
张职视,李佳欢,詹森然,赖淑芳,王丽芬,陈桂珍,孙淑静,,胡开辉,**
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学(古田)菌业研究院,福建古田352200)
分泌金黄色的真姬菇隐性污染菌包微生物的分离与鉴定*
张职视1,李佳欢1,詹森然1,赖淑芳1,王丽芬2,陈桂珍2,孙淑静1,2,胡开辉1,2**
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学(古田)菌业研究院,福建古田352200)
真姬菇(Hypsizygus marmoreus)凭借独特的风味和优良的保健功效成为工厂化栽培的食用菌之一,但生产过程中易受杂菌污染,为了分析污染原因,降低污染率和生产成本,采用稀释涂平板法从菌袋上部变黄吐黄水的污染菌袋中分离得到5株细菌及5株真菌,通过形态学结合细菌16S rRNA以及真菌ITS保守序列进行鉴定并构建了系统发育树。研究结果表明,5株细菌分别属于芽孢杆菌属(Bacillus)、肠杆菌科(Enterobacter)、西地西菌属(Cedecea)、假单胞菌属(Pseudomonas)、藤黄色杆菌属(Luteibacter),5株真菌分别属于枝孢菌属(Cladosporium)、青霉菌属(Penicillium)、曲霉菌属(Aspergillus)、格孢腔菌目(Pleosporales)、镰孢菌属(Fusarium)。系统发育树分析表明污染菌相互之间的亲缘关系较远。
真姬菇;污染菌;分离;鉴定
真姬菇 [Hypsizygus marmoreus(Peck)Bigelow HE]是近几年福建省工厂化生产的重要品种之一。目前国内外的研究主要集中在其生物学特性[1]、遗传育种[2-3]、子实体营养物质及生理活性物质[4]、原材料的开发与栽培特性[5-14]以及酶活性和蛋白质组学等方面[15-16],但对栽培过程中污染情况缺乏系统的研究。有学者对平菇、金针菇、双孢蘑菇、鸡腿菇、蛹虫草等食用菌病原菌做了研究[17-27],然而关于真姬菇污染菌方面的报道却很少。由于真姬菇为低温结实性品种,在栽培生产中发菌较为缓慢,后熟培养时间长,生产周期长达120 d~150 d以上[28]。故在工厂化生产中,任何一个环节受隐性污染都可能影响出菇的质量。并且真姬菇生产过程中可用秸秆、玉米芯、米糠等工农业副产物和下脚料作其主要培养基,这在一定程度上增加了真姬菇工厂化生产的潜在污染性。受隐性污染的真姬菇会影响其出菇,甚至不能出菇,影响产量和质量,不但增加企业生产成本,而且受隐性污染的真姬菇出菇后的朵型、大小、质地差,难以满足消费者的消费需求,降低相关产品的品牌美誉度。本研究通过隐性污染分离鉴定,分析其群落结构及生物学特性,为真姬菇产业化生产降低隐性污染和检测提供帮助,同时也为其它食(药)用菌隐性污染研究提供借鉴和参考。
1 材料与方法
1.1 菌株
菌株分离自福州市罗源县力生食用菌有限公司真姬菇污染菌包,该菌袋上部分泌有金黄色液体。1.2 试剂
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,定容至1 L,pH自然。液体培养基不加琼脂。
LB培养基:蛋白胨5 g、酵母粉5 g、NaCl 5 g、琼脂20 g,定容至1 L,调节pH至7.0。液体培养基不加琼脂。
2×Power Taq PCR MaterMix为北京百泰克生物技术有限公司产品。
试验所用试剂均为分析纯。
1.3 菌种富集和分离纯化
在无菌条件下,用药匙从菌袋上部变黄处取1 g~2 g分别接种至LB与PDA培养基中,分别于25℃和37℃摇床富集培养16 h,转速为150 r·min-1。采用稀释平板法进行分离[29]。吸取1 mL富集液梯度稀释至10-5,吸取10-3、10-4、10-5稀释液各100 μL,分别均匀涂布于LB与PDA平板上,用封口膜进行封口,分别放入25℃与37℃恒温培养箱中,正置培养30 min,30 min后倒置培养16 h,检查平板菌落生长情况,挑取单菌落于新鲜液体培养基中,于摇床培养16 h,用于提取基因组、形态学分析和保藏菌种。
1.4 菌种的培养与观察
观察细菌的单克隆菌落特征并拍照,用接种针挑取真菌菌丝,制作成显微切片,于光学显微镜下观察菌株的形态特征。
1.5 基因组提取PCR扩增与序列测定
采用细菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司)提取细菌基因组,采用真菌基因组提取试剂盒(上海生工生物工程股份有限公司)提取真菌基因组。
细菌PCR扩增引物为16S rDNA的通用引物:27F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492R:5’-TACCTTGTTACGACTT-3’。
真菌PCR扩增引物为内部间隔序列:ITS4:5’-TCCTCCGCTTATTGATATGC-3’ 和 ITS5: 5’-GGAAGTAAAAGTCGTAACCAAGG-3’。
PCR反应体系:模板DNA 1 μL;上下游引物各1 μL;2×Power Taq PCR MaterMix 10 μL;ddH2O 7 μL。PCR扩增条件:94℃预变性 5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min,4℃保存。
扩增产物以1%琼脂糖凝胶电泳检测。按照美国Omega BioTek公司胶回收试剂盒说明书进行切胶回收后送往上海生工生物工程股份有限公司进行测序。
1.6 序列比对和系统发育树构建
将测序结果在NCBI中GeneBank数据库进行比对,获取前3条相似性高的序列。用MEGA6.0软件将测定序列与相关序列一起用Clustal W算法进行序列比对,用Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 基因组提取
细菌基因组DNA电泳图见图1。
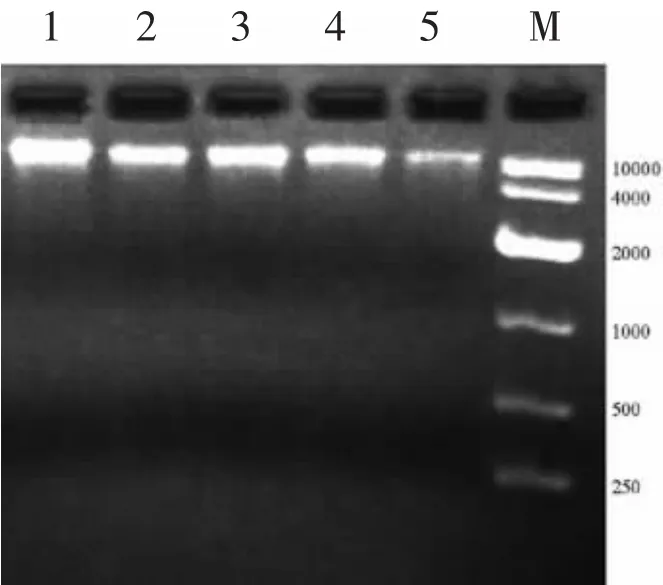
图1 细菌的基因组DNA电泳图Fig.1 Electrophoretic pattern of DNA genome
如图1所示,细菌基因组DNA片段都在10 000 bp以上,没有降解条带,说明提取效果非常好。
2.2 PCR扩增产物
细菌16S rRNA区PCR扩增电泳图见图2。

图2 细菌16S rRNA区PCR扩增电泳图Fig.2 Electrophoretic pattern of PCR amplification in 16S rRNA
由图2可以看出,细菌PCR产物大约为1 500 bp,PCR特异性良好,但还是有一些非特异性条带。真菌ITS区PCR扩增电泳图见图3。

图3 真菌ITS区PCR扩增电泳图Fig.3 Electrophoretic pattern of PCR amplification in ITS
由图3可以看出,真菌PCR产物大约为600 bp,PCR特异性良好,但是还是有一些非特异性条带。
2.3 序列比对及系统发育树分析
2.3.1 污染细菌的序列分析
细菌16S rDNA序列与GenBank数据库比对的结果见表1。
据表1比对结果,用邻近相接法直接构建鉴定菌株与相关近缘菌株的16S rDNA系统发育树,见图4。

表1 细菌16S rDNA序列与NCBI数据库比对结果Tab.1 Nearest match of bacterial 16S rDNA sequences in GenBank
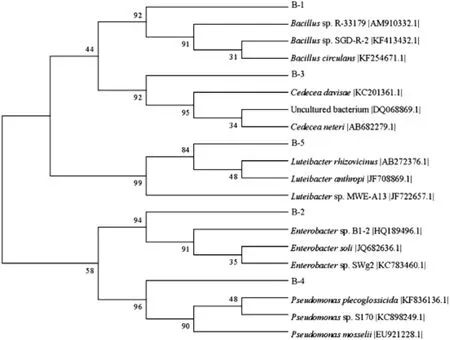
图4 基于16S rDNA构建的系统发育树Fig.4 System developmental tree constituted on the base of 16S rDNA
系统发育分析结果表明,B-1与芽孢杆菌属(Bacillus) 处于同一分支,具有较高的同源性,bootsrap支持率为92%,且三者序列相似性为99%;B-2与肠杆菌科(Enterobacter)处于同一分支,具有较高的同源性,bootsrap支持率为94%,且三者序列相似性为99%;B-3与西地西菌属(Cedece)处于同一分支,具有较高的同源性,bootsrap支持率为92%,且三者序列相似性为99%;B-4与假单胞菌属(Pseudomonas)处于同一分支,具有较高的同源性,bootsrap支持率为96%,且三者序列相似性为99%以上,B-5与藤黄色杆菌属(Luteibacter)处于同一分支,具有较高的同源性,bootsrap支持率为99%,且三者序列相似性为99%以上。
2.3.2 污染真菌的序列分析
真菌ITS rDNA序列与NCBI数据库比对结果见表2。

表2 真菌ITS rDNA序列与NCBI数据库比对结果Tab.2 Nearest match of fungi ITS rDNA sequences in GenBank
据表2比对结果,用邻近相接法直接构建鉴定菌株与相关近缘菌株的ITS系统发育树,见图5。
系统发育分析结果表明,F-1与枝孢菌属(Cladosporium)处于同一分支,具有较高的同源性,bootsrap支持率为99%,且三者序列相似性为100%;F-2与青霉菌属(Penicillium)处于同一分支,具有较高的同源性,bootsrap支持率为97%,且三者序列相似性为100%;F-3与曲霉菌属(Aspergillus) 处于同一分支,具有较高的同源性,bootsrap支持率为97%,且三者序列相似性大于99%;F-4与格孢腔菌目Pleosporales处于同一分支,具有较高的同源性,bootsrap支持率为98%,且三者序列相似性为100%;F-5与镰孢菌属(Fusarium)处于同一分支,具有较高的同源性,bootsrap支持率为98%,且三者序列相似性为98%以上。

图5 基于ITS区rDNA构建的系统发育树Fig.5 System developmental tree constituted on the base of ITSrDNA
2.4 菌株形态学
2.4.1 细菌菌株形态学
单菌落形态及菌落形态比较见图6、表3。由图6可以看出,在37℃培养16 h的5株细菌的颜色形状有明显差别,通过相关形态特征的描述(表3)总结了5株细菌群落的特点。

图6 单菌落形态图Fig.6 Single colony morphology
2.4.2 真菌菌株形态学
真菌菌株菌落形态见图7。
由图7可以看出,5种真菌的菌落形态各不相同。菌落F-1属于枝孢菌属,该菌落与培养基结合紧密,有韧性。正面为棕绿色,有层次感,背面为黑绿色,边缘有一圈棕绿色边带。F-2属于青霉菌属,菌落正面为绿色,外部有细小黄色环形边缘带,有非常多的分生孢子,菌落背面为艳丽的橙黄色,分泌黄色色素,边缘有黄色边带,菌落后期形成红色的子囊,成熟后有更多的子囊孢子散落。F-3属于曲霉菌属,菌落前期为白色,后期形成大量黑色孢子。菌落正面前期为白色,后期为黑色,背面为浅绿色。F-4属于格孢腔菌目,菌落正反面均为白色,没有孢子散落。F-5属于镰孢菌属,菌丝呈放射状,菌落正面为浅红色,背面中心为血红色,边缘为白色。可以与青霉菌共生,共生时菌落正面为黄色,背面中心为黄色,周围为红色,可以通过挑取单孢子进行分离。

表3 细菌菌落形态比较Tab.3 Comparison of bacterial colony on morphology

图7 真菌菌落形态Fig.7 Colony morphology

图8 菌丝形态图Fig.8 The hypha morphology
菌丝形态见图8。
由图8可见,5种真菌菌丝形态各不相同。F-1菌丝分节为绿色。F-2菌丝分节为绿色,可以看到扫帚状的分生孢子。F-3菌丝分节为绿色,可以看见圆形囊状物,可能是分生孢子梗顶端膨大形成的顶囊脱落。F-4菌丝为绿色。F-5菌丝为红色,可以与青霉菌共生,共生时可以明显的看到红色菌丝与绿色菌丝相互交叉生长,红色菌丝附着在绿色菌丝上,连接点有略微膨大。
由图8还可以看出,5种真菌菌丝形态各不相同。F-1菌丝分节为绿色。F-2菌丝分节为绿色,可以看到扫帚状的分生孢子。F-3菌丝分节为绿色,可以看见圆形囊状物,可能是分生孢子梗顶端膨大形成的顶囊脱落。F-4菌丝为绿色。F-5菌丝为红色,可以与青霉菌共生,共生时可以明显的看到红色菌丝与绿色菌丝相互交叉生长,红色菌丝附着在绿色菌丝上,连接点有略微膨大。
3 讨论
菌包上部变黄吐黄水是影响真姬菇出菇的一种现象,严重时变成黄褐色,搔菌后菌丝死亡变黑,不能恢复出菇。经过研究发现这不是由单一微生物引起的现象,是由一特定的菌群相互作用产生的,而其中的芽孢杆菌属是一类能产生抗逆性极强的芽孢细菌。因此对原料进行充分的灭菌,彻底杀死耐热芽孢结构成为灭菌的关键。可以采用分步灭菌法,以及梯度升温法、充分排除冷空气、延长灭菌时间等方法进行彻底灭菌。大肠杆菌的污染可以用来反映环境卫生状况,推断原料是否受到污染。西地西菌属与人类健康有密切关系。假单胞菌属主要着生在土壤等大多数培养料中。藤黄色杆菌属能分泌黄色色素,可能与菌包上部出现黄色水珠相关。枝孢菌、青霉菌、曲霉菌、格孢腔菌、镰孢菌等真菌也是食用菌污染的一个重要原因,可产生抗逆性强、易传播的分生孢子,成为隐性污染的重要来源。
液体菌种因生产周期短,节省劳动力成本[14],逐渐将成为主流,本研究可为其安全生产提供参考。
企业应该严把原材料关,采用先进的灭菌技术,并注意生产过程中各个环节卫生,确保从源头上消除污染隐患,从而降低生产成本,防止真姬菇长期培养过程中造成隐性污染。本研究通过隐性污染菌分离鉴定,通过分析其群落结构及生物学特性,为真姬菇产业化生产降低隐性污染和检测提供帮助,同时也为研究其它食(药)用菌隐性污染提供借鉴和参考。
[1]刘建中,孙淑静,胡开辉,等.姬菇融合菌株生物学特性及生产性能的研究[J].中国食用菌,2010,29(3):22-25.
[2]董岩,陈辉,赵明文,等.真姬菇栽培菌株的ITS和SSR分析[J].上海农业学报,2009,25(3):59-64.
[3]胡开辉,刘建中,孙淑静,等.斑玉蕈育种中漆酶转化体系建立的初步研究[J].菌物学报,2010(4):528-535.
[4]林中宁,陈敏健,刘明香,等.真姬菇菇脚和菌糠氨基酸含量测定及营养评价[J].中国食用菌,2012,31(2):44-46.
[5]翁梁,张科,陈赟,等.玉米秸秆与菌糠栽培真姬菇比较研究[J].北方园艺,2014(17):143-145.
[6]石健林,林中鳞,林雷通,等.烟秆替代部分棉籽壳做培养基栽培真姬菇的效果[J].中国烟草学报,2011,17(2):59-62.
[7]张炳照,闫培生.海带废渣真姬菇发酵产物抗氧化活性研究[J].中国农业科学导报,2013,15(3):157-162.
[8]宋志刚,李艳婷,申挺挺,等.芦笋老茎培养料对杏胞菇、白灵菇和真姬菇多糖含量及抗氧化性的影响[J].广东农业科学,2011(18):32-34.
[9]沙春娥,李富得,王振坤.利用油橄榄冬剪枝栽培真姬菇试验[J].食用菌,2010(4):35.
[10]苏启苞,刘传森.利用木薯、木薯渣栽培真姬菇试验[J].中国食用菌,2008,27(4):59,61.
[11]程继红,冯志勇,高君辉.米糠添加量对真姬菇产量和品质的影响[J].食用菌学报,2004,11(1):42-45.
[12]姚荣锦.用玉米芯栽培真姬菇初探[J].黔东南民族师范高等专科学校学报,2002,20(3):36-37.
[13]黄忠英.金针菇废菌料栽培真姬菇试验[J].食用菌,2014(4):30-31.
[14]孙淑静,颜松,胡开辉.斑玉蕈不同菌种类型的生产性能[J].河南科技大学学报,2010,31(1):66-69.
[15]胡开辉,黄贵英,颜松,等.斑玉蕈低温胁迫下菌丝体酶活变化及差异蛋白质组学研究[J].菌物学报,2009,28(4):584-590.
[16]郭艳艳,阮玲云,冯宏昌,等.不同营养条件下斑玉蕈菌丝生长及产酶特性[J].菌物学报,2014(3):697-705.
[17]张瑞颖,左雪梅,姜瑞波.平菇褐斑病病原菌的分离与鉴定[J].中国食用菌,2007,26(5):58-60.
[18]金丹,李宝聚,石延霞,等.一种平菇褐斑病病原菌的鉴定[J].食用菌学报,2009,16(1):89-91.
[19]李德舜,曹新红,苏静,等.平菇黄腐病病愿菌分离与鉴定[J].山东大学学报,2008,43(1):4-7.
[20]白静,杨洋,张秀云,等.金针菇褐斑病病原菌的分离筛选及防治[J].中国食用菌,2006,25(4):38-40.
[21]赵肖静,石延霞,谢学文,等.一种金针菇新病害病原菌的鉴定[J].食用菌,2013(5):57-58.
[22]黄春燕,张柏松,万鲁长,等.金针菇工厂化生产中黑腐病病原菌的分离与鉴定[J].食用菌学报,2012,19(1):75-78.
[23]张园园.蛹虫草栽培中几种细菌性病原菌分离与鉴定[J].中国食用菌,2014,33(6):46-48,55.
[24]李河,周国英,刘君昂.双孢蘑菇褐腐病病原菌的分离与分子鉴定[J].食用菌学报,2009,16(2):74-76.
[25]支月娥,黄建春,汪毅,等.杏胞菇细菌性病害病原菌研究[J].食用菌,2009,31(2):60-61.
[26]兰玉菲,安秀荣,王庆武,等.一种鸡腿菇病害病原菌的分离及鉴定[J].山东农业科学,2012,44(3):84-87.
[27]陈少珍,黄思良,黄卓忠,等.蘑菇黑斑病病原菌分离与鉴定[J].广西农业科学,2009,40(1):43-46.
[28]胡开辉,出小平.外界因子对蟹味菇菌丝特性的影响[J].中国食用菌,2008,27(2):16-18.
[29]胡开辉.微生物学实验[M].北京:中国林业出版社,2004:37-39.
Isolation and Identification of Latent Contaminating Microorganisms from Hypsizygus marmoreus Bag Secrect Yellow Liquid
ZHANG Zhi-shi1,LI Jia-huan1,ZHAN Sen-ran1,LAI Shu-fang1, WANG Li-fen2,CHEN Gui-zhen2,SUN Shu-jing1,2,HU Kai-hui12
(1.College of Life Sciences,Fujian Agriculture and Forestry University,Fuzhou 350002,China; 2.Gutian Edible Fungi Research Institute,Fujian Agriculture and Forestry University,Gutian 352200,China)
Hypsizygus marmoreus is one of the edible fungi produced by factories.In order to cut down contamination rate and safe cost,five bacteria and five fungi were isolated by spread-plate method,and they were identified by morphological observation and 16S rDNA and ITS sequence analysis respectively.The result showed that five bacteria belonged to Bacillus,Enterobacter,Cedecea,Pseudomonas,Luteibacter.And five fungi belong to Cladosporium,Penicillium,Aspergillus,Pleosporales, Fusarium.Phylogenetic tree showed that their kinship was far.
Hypsizygus marmoreus;contamination;isolation;identification
S646.9
A
1003-8310(2016)02-0061-06
10.13629/j.cnki.53-1054.2016.02.016
福建省高校产学研重大项目(2013N5004);珍稀食用菌品种(斑玉蕈、绣球菌)创新与自动化生产技术产业化工程(2014S1477-8);福建省食用菌产业技术重大研发平台(2014N2001)。
张职视(1991-),男,在读硕士研究生,主要从事食用菌开发与利用研究。E-mail:746830163@qq.com.
**通信作者:胡开辉(1962-),男,学士,教授,主要从事食用菌栽培与遗传育种研究。E-mail:2692609765@qq.com
2016-01-11

