复合生物酶制备抗菌纸的研究
杜 飞 李志健 王吉庆 苗 玉
(陕西科技大学轻工与能源学院,陕西西安,710021)
·复合生物酶·
复合生物酶制备抗菌纸的研究
杜飞李志健王吉庆苗玉
(陕西科技大学轻工与能源学院,陕西西安,710021)
摘要:将葡萄糖氧化酶和溶菌酶单独及复配使用,并以表面涂布的方式将其涂布到到纸张表面,使其在纸张表面发挥最佳抗菌效果,从而得到绿色抗菌纸;通过SEM、TEM及抑菌环实验表征抗菌纸的抗菌效果。结果表明,葡萄糖氧化酶单独使用,在pH值为6.5时,较佳酶用量范围为4000~6000 U/g绝干浆;溶菌酶单独使用,在pH值为5.5时,较佳酶用量为5000~20000 U/g绝干浆。当溶菌酶和葡萄糖氧化酶复配时,葡萄糖氧化酶用量为4000 U/g绝干浆,溶菌酶用量为10000 U/g绝干浆,pH值为6.0时,抗菌纸抑菌效果最好。通过SEM、TEM和抑菌环分析均表明,两种酶复配使用比两种酶分别单独使用时,抗菌纸抑菌效果更明显。
关键词:复合生物酶;抗菌纸;抑菌环
抗菌纸的研究是近几年来抗菌材料应用的一个新领域。目前,赋予纸和纸制品抗菌性能的方法很多,常用的方法是在纸料中加入无机、有机型抗菌剂,可以在一定程度上赋予制备的纸或纸制品一定的抗菌性能[1-3]。目前关于抗菌纸的研究很多,也取得了许多成果。在食品包装用抗菌材料方面,Vliemusedre等人[4]在纸料中加入了占纤维量0.5%~1.0%的有机抗菌剂,制备的鸡蛋包装箱纸具有良好的抗菌防霉性能。余成华等人[5]将漆酶催化香草醛接枝壳聚糖作为抗菌剂添加到纸张中,不但有灭菌效果还可以改善纸张性能。Agarwal等人[6]将番茄、青椒、甘蓝和芹菜分别用厚度为0.2 mm的普通包装纸和厚度为 0.2 mm 的内层涂有l%壳聚糖乳酸液的包装纸包装,测试其在16天储藏期间生理生化指标:失水率、呼吸强度、总糖含量和Vc,结果表明,用1%壳聚糖乳酸液涂布的包装纸比用普通包装纸能更好地储藏蔬菜,壳聚糖特有的抑制霉菌作用可减少蔬菜受感染机会。刘秉钺等人[7]采用CuSO4、Na2S2O3和Na2S对聚丙烯腈(俗称:腈纶)进行改性处理,制备铜系抗菌剂,抗菌剂的加入量为2%时,其72 h抑菌率仍超过90%,随着抗菌剂加入量的提高,纸张白度下降,裂断长减少,而撕裂指数和耐破指数明显升高。俄罗斯实用生物技术研究院在食品包装材料的聚合物中添加了脱水的酸化物、溶菌酶等物质可达杀灭细菌,从而改善包装袋内环境延长保质期的目的。在生活用抗菌材料方面,何金星等人[8]发明了一种有抗菌功能的扑克牌,其制作工艺是在压光过程使用的油墨中加入质量分数0.01%~2%的银系抗菌剂或生物抗菌剂壳聚糖(占油墨质量),此种扑克牌的抗菌性可保持两年。Klofta等人[9]将金属离子复合抗菌剂制成抗菌材料加入到纸币中,可有效杀灭细菌或抑制细菌生长,使纸币“无菌”。在不影响纸币原有的湿强度、韧性和外观的前提下,采用物理方法,将抗菌材料加入到纸币中,运用多重杀菌原理,对纸币上的大肠杆菌、金黄色葡萄球菌等有害细菌进行灭杀,杀灭和抑制细菌可达99%以上。在医用纸基抗菌材料方面,如英国考文垂大学Manbde等人[10]以某种生物季铵盐类物质为抗菌剂,改善了医院员工手的清洁健康,而且它还能帮助防止MRAS病菌传播。Coma V等人[11]用壳聚糖一铜络合物材料制成一次性抗菌纸床单,经Quinn抗菌检测有良好的持久抗菌作用,抗菌纸床单使用1~3天后抑菌率分别为99.5%和92.3%。由上述研究可知,市面上的纸基抗菌材料种类多样,针对纸基抗菌材料所做的研究也各有侧重,同一类型或不同类型的纸基抗菌材料使用的抗菌剂也有所差别。但是值得注意的是目前纸基抗菌材料的生产和应用存在以下2个问题:①纸基抗菌材料的用途有待细化,市面上缺少针对特殊用途或特殊人群的纸基抗菌材料。如初生体弱婴儿、化疗后免疫力低、对金属或某种有机物过敏的人群,没有针对性的抗菌产品。②无机类及有机类纸基抗菌材料很少考虑生产过程中的水污染,而研究证明长期添加无机类及有机类抗菌剂会对造纸过程中循环白水造成一定的污染,尤其是是金属离子类抗菌剂。
本研究选用葡萄糖氧化酶和溶菌酶配合使用作为复合生物酶,该生物酶是一类具有专一催化能力的生物抗菌剂,其对人体完全无害并且在自然界中易降解对环境不产生任何污染。与传统的纸基抗菌材料相比,复合生物酶纸基抗菌材料抗菌效果温和,抗菌剂绿色无害,其产品特别适用于易敏感人群、体质虚弱人群以及婴幼儿。本实验以表面涂布的方式将两种酶涂布到纸张表面,比较两者单独使用以及复配使用时的抗菌效果,进而得出复合生物酶生产抗菌纸的最佳工艺参数。
1实验
1.1原料与仪器
原料与药品:阔叶木浆板。葡萄糖氧化酶:酶活为50000 U/g、溶菌酶:酶活为30000 U/mg。葡萄糖固体、醋酸、醋酸钠,均为分析纯。葡萄糖溶液(浓度为0.5 mol/L)、质量分数0.9%的氯化钠溶液、pH值5.5的醋酸-醋酸钠缓冲液、pH值6.0的醋酸-醋酸钠缓冲溶液、pH值6.5的醋酸-醋酸钠缓冲溶液。菌种:大肠杆菌。
仪器:槽式打浆机(ZQS2-23)、纤维解离器(ZQS4)、纸样抄片器(ZQJ1-B-I);平板培养皿、接种针、高压灭菌锅、接种环、恒温恒湿箱(RHP-150AT)、生物培养箱(YX280B);环境扫描电镜SEM(Q45+EDAX Octane Prime)、透射电镜TEM(FEI Tecnai G2 F20 S-TWIN)。
1.2实验方法
1.2.1抗菌纸制备以及抑菌环测试方法[12]
(1)采用进口阔叶木浆板为原料,在纸样抄片器中抄造定量为60 g/m2的纸张作为抗菌纸原纸。
(2)利用不同pH值的缓冲溶液、溶菌酶和葡萄糖氧化酶原液,配制一定浓度及不同pH值的溶菌酶和葡萄糖氧化酶溶液。
(3)按每克绝干浆酶活用量及酶溶液的浓度将一定量的酶溶液用玻璃棒均匀涂抹在抗菌纸原纸上,在37℃鼓风干燥箱中干燥,取出后用灭菌后的剪刀剪下直径为20 mm的纸片,做好标记。
(4)采用涂布平板法接种大肠杆菌,再用镊子将制备好的纸片置于平板培养皿上。
(5)将培养皿置于30℃生化培养箱中培养48 h。
(6)由于酶的抑菌作用会造成抗菌纸周围大肠杆菌的浓度变化,越接近抗菌纸大肠杆菌浓度越低,这种浓度梯度变化造成其在抑菌纸周围形成一个颜色较浅的圆环,即为抑菌环。实验采用游标卡尺通过纸片圆心测量该圆环的直径,即为抑菌环的直径。
1.2.2大肠杆菌TEM观察方法[13]
(1)将抑菌环边缘的大肠杆菌取出,溶解;
(2)将大肠杆菌在5000 r/min转速下离心分离,并用无菌水洗涤,重复3次;
(3)采用水与二甲基亚砜(DMSO)作为溶剂,将大肠杆菌分散成一定浓度,并滴到铜网上,进行TEM观察。
2结果与讨论
2.1溶菌酶制备抗菌纸的抑菌效果研究
在其他抄造条件不变的情况下,改变溶菌酶在纸张中的用量抄造抗菌纸b1~b5。大肠杆菌经过48 h培养后,添加溶菌酶(酶溶液pH值5.5)制备抗菌纸,产生的抗菌效果(抑菌环)如图1所示,其抑菌环直径变化如图2所示。

图1 溶菌酶制备抗菌纸的抑菌环照片

图3 葡萄糖氧化酶制备抗菌纸的抑菌环照片
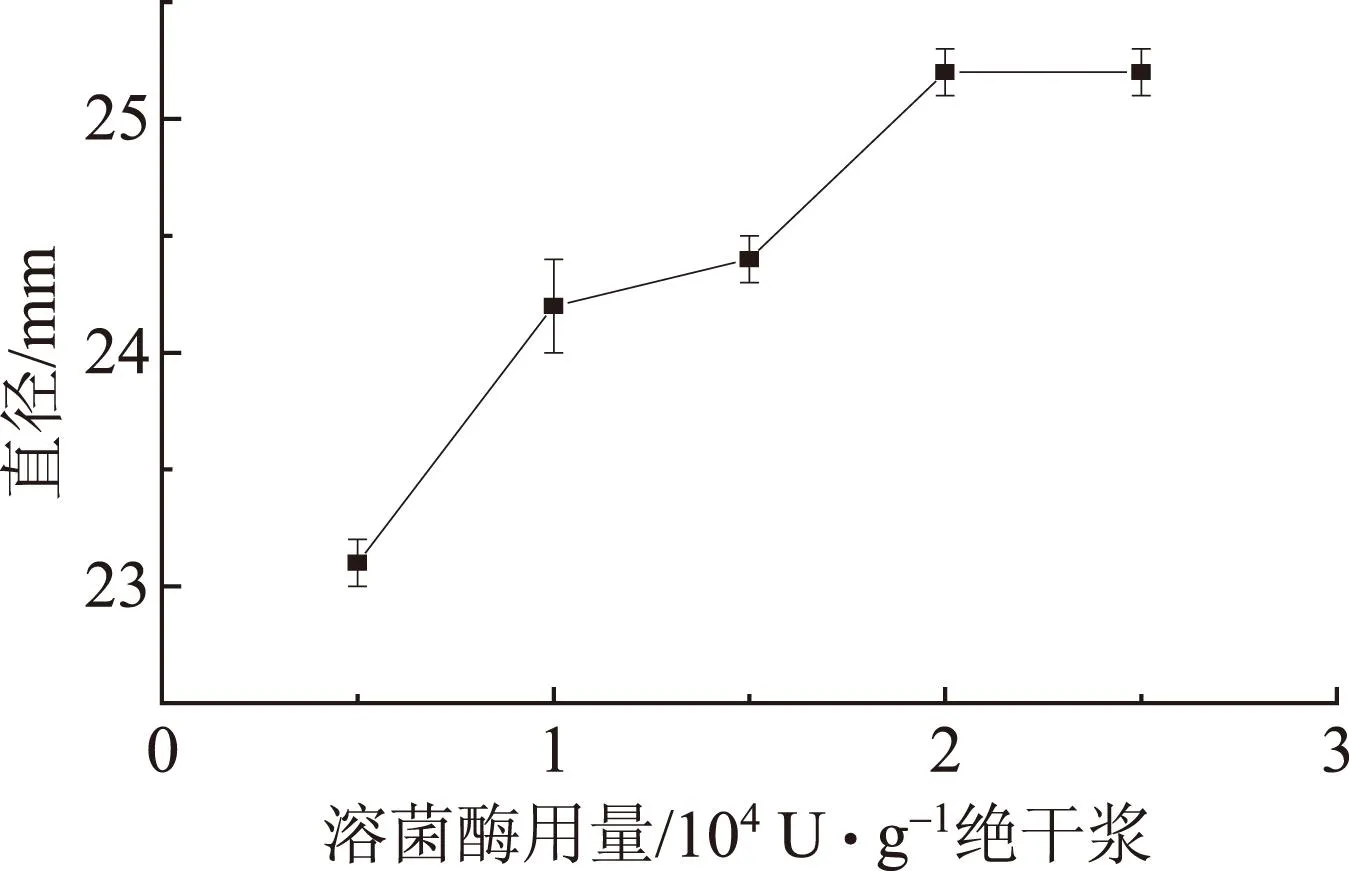
图2 溶菌酶用量对抗菌纸抑菌环直径的影响
由图1可知,在b1~b5的纸片边缘均形成了浅色抑菌环,在抑菌环以及纸面上大肠杆菌生长受到明显的抑制,说明溶菌酶制备的抗菌纸有一定的抑菌效果。由图2可以看出,在pH值5.5的条件下,溶菌酶用量在5000~20000 U/g绝干浆时,增加溶菌酶用量纸张的抑菌效果有较为明显的提高,当溶菌酶用量为2500 U/g时,抑菌环的直径最大,为25.2 mm。当溶菌酶用量超过20000 U/g绝干浆后,增加溶菌酶用量,抗菌纸抑菌效果的变化并不明显。考虑抗菌纸的抑菌效果及抑菌成本,溶菌酶的用量不易超过25000 U/g绝干浆。
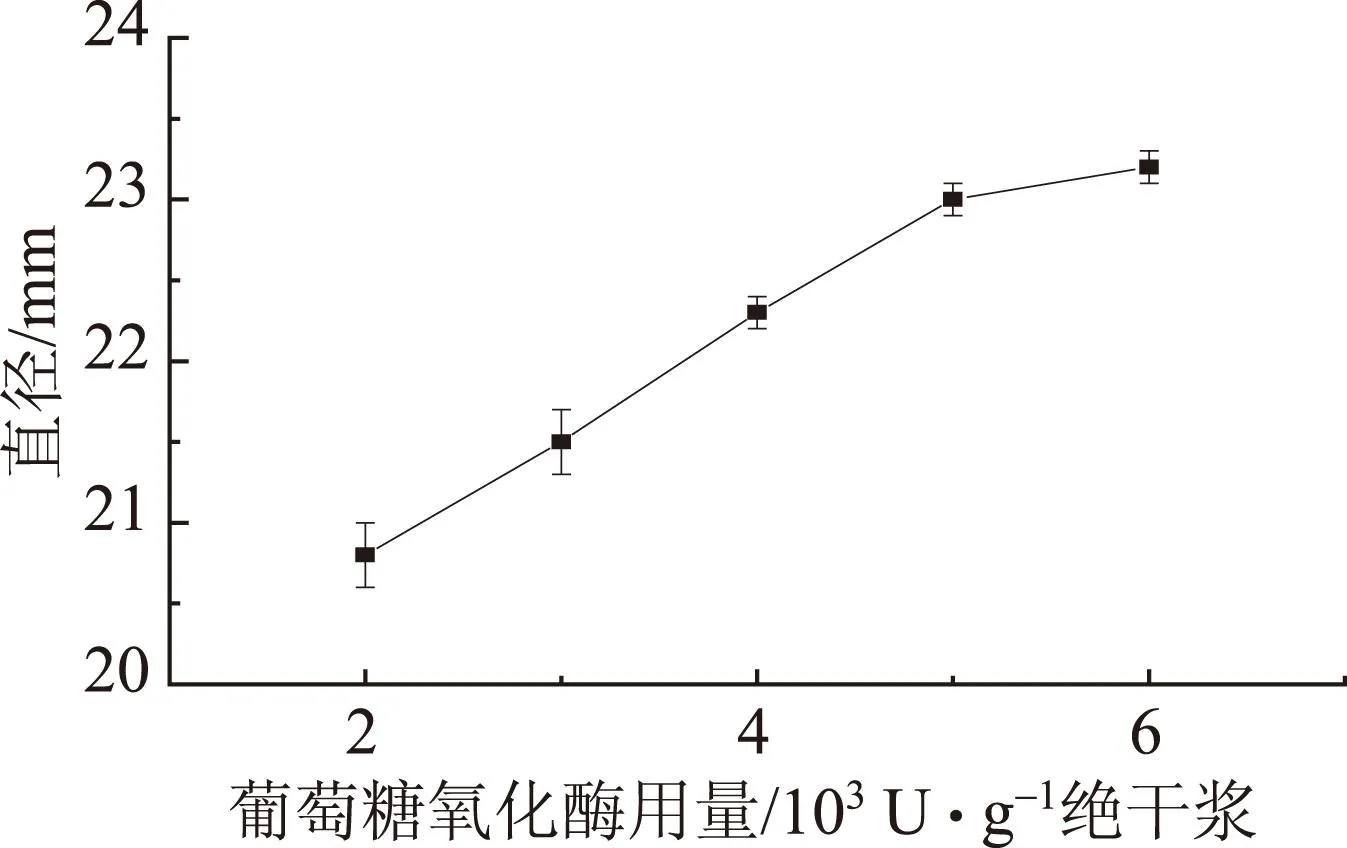
图4 葡萄糖氧化酶对抗菌纸抑菌环直径的影响
2.2葡萄糖氧化酶制备抗菌纸的抑菌效果研究
在其他抄造条件不变的情况下,改变葡萄糖氧化酶在纸张中的用量抄造抗菌纸p1~p5。大肠杆菌经过48 h培养后,添加葡萄糖氧化酶(酶溶液pH值6.5)制备抗菌纸,产生的抗菌效果(抑菌环)如图3所示,其抑菌环直径变化如图4所示。
如图3所示,在p1~p5的纸片边缘均形成了浅色抑菌环,结合图2与图4,从抑菌环大小来看,p1~p5均不如溶菌酶抗菌纸b1~b5的抑菌效果。说明单独使用葡萄糖氧化酶做抑菌剂抄造的纸张抑菌效果不如溶菌酶的显著。分析原因,可能是由于葡萄糖氧化酶的主要抑菌原理为利用纸张周围的氧气使纸面上及纸面周围的好氧菌和微生物由于缺乏氧气而停止代谢。这是一种以隔绝氧气为前提的间接抑菌,而溶菌酶的抑菌效果则体现为以细菌作为作用底物的直接抑菌。从图4可以看出,在pH值6.5的条件下,其抑菌效果随葡萄糖氧化酶用量的提高而增加,当葡萄糖氧化酶用量为6000 U/g绝干浆时,抑菌环直径的最大,为23.2 mm。但当葡萄糖氧化酶用量超过5000 U/g绝干浆后,其增加的幅度减缓。因此,考虑抗菌纸的抑菌效果及抑菌成本,葡萄糖氧化酶的用量不易超过6000 U/g绝干浆。
2.3复合生物酶制备抗菌纸的抑菌效果研究
为了加强抗菌纸的抑菌效果,同时也为了减少抑菌酶的用量,本实验采用葡萄糖氧化酶和溶菌酶配合(作为复合生物酶)来抄造纸张,同时发挥溶菌酶的直接抑菌作用和葡萄糖氧化酶的间接抑菌作用。

表1 正交实验设计表

图5 复合酶制备抗菌纸的抑菌环照片(1~9为正交实验纸样标号)
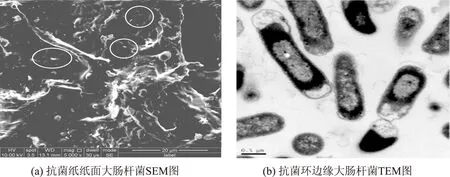
图6 抗菌纸纸面及边缘大肠杆菌SEM、TEM图
表1为以葡萄糖氧化酶用量、溶菌酶用量以及pH值对抗菌纸抑菌效果影响较大的参数设计的3因素3水平的正交实验表,极差分析及结果如表2所示。将复合生物酶作为抑菌剂抄造的抗菌纸接种大肠杆菌后,在生物培养箱中培养48 h,产生的抑菌效果如图5所示。
由表2正交实验极差分析可知,影响抗菌纸抑菌环大小的因素主次顺序分别为:pH值>溶菌酶用量>葡萄糖氧化酶用量,即pH值是抗菌纸生产过程中抑菌效果的主要影响因素。而考虑3个因素在3水平上的变化,通过均值分析,得出复合生物酶抗菌纸产生抑菌效果的最佳条件为pH值6.0,溶菌酶用量为10000 U/g绝干浆,葡萄糖氧化酶用量为4000 U/g绝干浆。由上述结果分析可知,对比前面的研究结果,发现葡萄糖氧化酶在单独使用时抑菌效果不明显,无法达到复合使用时相同的抑菌效果。而由图2分析可知,如果用溶菌酶单独抑菌,要达到相同的抑菌环直径26.2 mm,溶菌酶的用量至少要大于25000 U/g绝干浆。结合正交实验结果,通过图5的观察,可以发现用复合生物酶做抑菌剂生产的抗菌纸抑菌环效果明显,抑菌环边缘清晰可见,在抑菌内部及纸面上基本上看不到大肠杆菌,连抑菌环的周围大肠杆菌的密度也较低。说明采用复合生物酶抄造抗菌纸,比单独使用效果好。达到最佳抑菌效果两种酶的用量比单独使用时均低。由此可见,溶菌酶和葡萄糖氧化酶复配使用时不会产生相互抑制,而且还可相互促进,同时发挥溶菌酶的直接抑菌作用和葡萄糖氧化酶的间接抑菌作用。为了证明两者的促进抑菌作用,实验取抑菌环内部纸张做环境扫描电镜以及抑菌环边缘的大肠杆菌做透射电镜,结果如图6所示。由图6中SEM图可知,在抗菌纸表面大肠杆菌的形态发生了明显的弯曲、折叠;部分大肠杆菌的细胞壁已经不再明显,与周围的植物纤维相粘连;也有部分大肠杆菌菌体已经发生了断裂,其残骸“游离”在纸面纤维上。而由图6中TEM图可知在抑菌环边缘的大肠杆菌均失去了大部分细胞壁,部分的大肠杆菌细胞结构也不完整。由图6可知,在抑菌环内部以及边缘的大肠杆菌均有不同程度细胞壁破损以及结构不完整,造成这种程度的细胞损伤一般由氧压力和外界生物对细胞侵蚀造成的。可见在复合生物酶抄造的抗菌纸表面及周围两种酶均发挥了本身的抑菌作用,并有相互促进的效果。

表2 正交实验极差分析及结果
3结论
通过研究可以看出,无论是葡萄糖氧化酶和溶菌酶单独使用还是二者复配使用来抄造抗菌纸,均可起到较好的抑菌效果,起到真正绿色抗菌抑菌的作用。
3.1当溶菌酶溶液pH值5.5时,溶菌酶较佳用量在5000~20000 U/g绝干浆时,抑菌效果增加明显,但当溶菌酶用量为2500 U/g绝干浆时,抑菌环直径的最大,为25.2 mm。考虑抗菌纸的抑菌效果及抑菌成本,溶菌酶的用量不易超过25000 U/g绝干浆。
3.2单独使用葡萄糖氧化酶做抑菌剂抄造的纸张抑菌效果不如溶菌酶。当葡萄糖氧化酶溶液pH值6.5,其用量为6000 U/g绝干浆时,抑菌环的直径最大,为23.2 mm。葡萄糖氧化酶较佳用量为2000~6000 U/g绝干浆。考虑抗菌纸的抑菌效果及抑菌成本,葡萄糖氧化酶的用量不易超过6000 U/g绝干浆。
3.3用葡萄糖氧化酶和溶菌酶配合使用(作为复合生物酶)做抑菌剂生产的抗菌纸抑菌环效果最佳。产生最佳抑菌效果条件为:pH值6.0,溶菌酶用量为10000 U/g绝干浆,葡萄糖氧化酶用量为4000 U/g绝干浆。
3.4复合生物酶抄造的抗菌纸的SEM与TEM的观察表明,大肠杆菌细胞损伤是由氧压力和外界生物对细胞侵蚀造成的。复合生物酶抄造的抗菌纸表面及周围,既发生了溶菌酶以细菌为底物直接抑菌作用同时也发生了葡萄糖氧化酶以氧气为底物的间接抑菌作用,并且两者可以相互促进。
参考文献
[1]YANG Fei, CHEN Ke-fu, YANG Ren-dang, et al. Anti-Bacteria Agent and Its Application in Antibacterial Paper[J]. China Pulp & Paper, 2006, 25(8): 51.
杨飞, 陈克复, 杨仁党. 抗菌剂及其在抗菌纸中的应用[J]. 中国造纸, 2006, 25(8): 51.
[2]YANG Kai-ji, SU Wen-qiang, CHEN Jing-huan. Development and Application of Multifunctional Antibacterial Paper[J]. China Pulp & Paper, 2007, 26(9): 44.
杨开吉, 苏文强, 等. 多功能抗菌纸的开发与应用[J]. 中国造纸, 2007, 26(9): 44.
[3]Lee H J, Yeo S Y, Jeong S H. Antibacterial effect of nanosized silver colloidal solution on textile fabrics[J]. Journal of Materials Science, 2003, 38(10): 2199.
[4]Vliemusedre, Zhou X, Zhang J, et al. Direct Electrochemical Reduction of Single-Layer Graphene Oxide and Subsequent Function Alization with Glucose Oxidase[J]. Phys. Chem. C., 2009, 113, 14071.
[5]YU Cheng-hua, PEI Ji-cheng. Chitosan Grafted With Vanillin: Its Antioxidant and Antibacterial Activity and Application in Papermaking[J]. China Pulp & Paper, 2014, 33(5): 1.
余成华, 裴继成. 漆酶催化香草醛接枝壳聚糖及其在抗菌纸中的应用[J]. 中国造纸, 2014, 33(5): 1.
[6]Agarwal S, Zhou X, Ye F, et al. Interfacing Live Cells with Nanocarbon Substrates[J]. Langmuir, 2010, 26(112): 2244.
[7]LIU Bing-yue, WANG Jing, YAO Shu-wei, et al. The use of chitin-copper complex in antibacterium paper[J]. China Pulp & Paper Industry[J]. 2004, 25(4): 42.
刘秉钺, 王井, 姚姝娓, 等. 壳聚糖-铜络合物在抗菌纸上的应用[J]. 中华纸业, 2004, 25(4): 42.
[8]HE Jin-xing, CHI Guang-jun, HE Xiao-ming. A kind of antibacterial poker and its preparation method: China, CN1513572[P]: 2004- 07-21.
何金星, 迟广俊, 何小明. 一种抗菌扑克牌及其制备方法: 中国, CN1513572[P]: 2004- 07-21.
[9]Klofta, et al. Anhydrous skin lotions having antimicrobial components for application to tissue paper products which mitigate the potential for skin irritation[P]. US, 6238682. 2001- 05-29
[10]Manbde, Zhou X, Ye F, et al. Interfacing Live Cells with Nanocarbon Substrates[J]. Langmuir, 2014, 26(112): 2244.
[11]Coma V, Deschamps A, Gros M. Bioactive packaging materials from edible chitosan polymer antimicrobial activity assessment on dairy related contaminants[J]. Journal of Food Science, 2003, 68(9): 2788.
[12]Young D H, Knole D H, Kauss H E. Effectof chitosan on membrane permeability of suspension-cultured Glycine max and phaseolus vulgaris cells[J]. Plant Physiology,1982, 70: 1449.

(责任编辑:董凤霞)
Manufacture of Antibacterial Paper by Using Combined Enzyme
DU Fei*LI Zhi-jianWANG Ji-qingMIAO Yu
(SchoolofLightIndustryandEnergy,ShannxiUniversityofScience&Technology,Xi’an,ShaanxiProvince,710021)
(*E-mail: dufeilily@126.com)
Abstract:A kind of green antibacterial paper was manufactured by coating glucose oxidase and lysozyme on the paper. Its antimicrobial effect was evaluated through antibacterial annulus test and SEM. The best antimicrobial performance of using glucose oxidase only could be obtained when pH value was 6.5 and enzyme activity was 4000~6000 U/g (on oven dry pulp). And the best antimicrobial effect of using lsozymein only could be obtained when pH value was 5.5 and enzyme activity was 5000~20000 U/g (on oven dry pulp). Antibacterial annulus test and TEM observation showed that the antimicrobial effect of using combined enzyme was better. When using combined enzyme the optimum condition was enzyme activities of 4000 U/g (on oven dry pulp) and 10000 U/g (on oven dry pulp) for glucose oxidase and lysozymein respectively, and pH value was 6.0.
Key words:combined enzyme; antibacterial paper; antibacterial annulus
基金项目:陕西省教育厅科学研究计划(14JK1109)。
收稿日期:2015- 09-21(修改稿)
中图分类号:TS761.6
文献标识码:A
DOI:10.11980/j.issn.0254- 508X.2016.02.004
作者简介:杜飞女士,讲师;主要研究方向:造纸生物技术、生物抗菌材料。

