刺参海带饲料原料褐藻胶降解菌的分离与鉴定
王熙涛, 李淑英, 王丽丽, 李晓宇, 徐永平,*
(1.动物性食品安全保障技术教育部工程研究中心,辽宁 大连 116620;2.大连赛姆生物工程技术有限公司,辽宁 大连 116620;3.大连理工大学 生命科学与技术学院,辽宁 大连 116024)
刺参海带饲料原料褐藻胶降解菌的分离与鉴定
王熙涛1,2, 李淑英2, 王丽丽3, 李晓宇3, 徐永平1,2,3*
(1.动物性食品安全保障技术教育部工程研究中心,辽宁 大连 116620;2.大连赛姆生物工程技术有限公司,辽宁 大连 116620;3.大连理工大学 生命科学与技术学院,辽宁 大连 116024)
从海带及刺参养殖环境中筛选有效降解褐藻胶,且对刺参无致病性的微生物,对海带饲料原料进行降解处理,以降低海带饲料中刺参难以消化的褐藻胶成分,显著提高饲料利用率,增加海带原料价值。以褐藻胶为唯一碳源选择培养基初筛;DNS法测定褐藻胶裂解酶酶活;16S rDNA测序及生理生化试验对菌种进行鉴定;高浓度腹腔攻毒试验考察筛选所得菌株对刺参的潜在致病性;分子排阻色谱及高效凝胶色谱法对微生物酶解褐藻胶的终产物进行分析。系统发育树分析表明,菌株WB1与Bacillusamyloliquifaciens有最高同源性,对刺参无潜在致病性;其褐藻胶裂解酶酶解褐藻胶的终产物主要为二糖和三糖,相对含量分别为74.1%和25.9%,平均分子量为516 Da。解淀粉芽胞杆菌WB1可作为一种安全的有益微生物用于刺参海带饲料原料中褐藻胶成分的降解。
刺参;解淀粉芽胞杆菌;海带;褐藻胶
近年来,随着刺参养殖的高密度集约化发展, 约占整个养殖成本70%以上的饲料问题成为刺参养殖的瓶颈。其中优质饵料匮乏,对饲料利用率低是关键因素之一。鼠尾藻被认为是刺参的最佳优质饵料,但是随着鼠尾藻资源的大量开采,现已面临供不应求,价格居高不下的困境[1]。而海带由于成本低廉、产量高、营养丰富等优点[2]也常被用作刺参饲料的主要原料成分之一,但是海带细胞壁含有大量的褐藻胶,而刺参体内的褐藻胶裂解酶活性很低,因此其对海带等富含褐藻胶的大型藻类消化能力较弱[3-4],致使大多数饲料成分未经充分消化,便被排出体外,不仅造成饲料的浪费,达不到饲料被充分转化利用的目的,而且水体中大量黏性较高的褐藻胶等残饵,如果处理不当也会导致刺参养殖环境的恶化。褐藻胶是海带、马尾藻、鼠尾藻、裙带菜等褐藻类植物细胞壁的重要组成成分及细胞间的填充物质,其化学本质是一种多糖类的高分子聚合物[5]。研究表明[6-8],自然界特别是海洋环境中存在多种可以降解海带中褐藻胶的微生物。为解决刺参对价格较低廉、资源丰富的海带饲料原料利用率不高的问题,本研究拟采取通过从海带及刺参养殖环境中筛选分离得到可以有效降解海带中褐藻胶,且对刺参无致病性的有益微生物,利用其作为降解海带饲料原料中褐藻胶的目标菌株,以期能有效降低海带饲料中刺参难以消化的褐藻胶成分,从而提高刺参对海带饲料原料的利用率,增加海带作为刺参饲料原料的利用价值。筛选分离的微生物应满足以下两个特征:①具有有效降解海带褐藻胶的能力;②对刺参没有任何潜在的致病性。在上述基础上,对筛选分离所得微生物的生理生化特性进行分析,为进一步开发有利于刺参消化吸收的微生物脱胶海带饲料提供前期理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验用刺参(平均体重为(10±3.20) g),购自大连大连湾某刺参养殖场。沙滤海水中暂养2周,不投喂食物,水质因子为溶氧≥6 mg/L;温度控制到(18±1) ℃;盐度28~30 g/L;pH (8.0±0.4), 每天更换1/3总体积的水体以保证水质并吸底排污一次,至刺参不再排便为止。
1.1.2 培养基 褐藻胶固体选择性培养基:褐藻胶/甘露糖醛酸(褐藻胶M片段)/古罗糖醛酸(褐藻胶G片段)0.5 g,硫酸铵0.5 g,NaCl 3.0 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.001 g,琼脂1.5 g,蒸馏水100 mL,pH 7.5;褐藻胶液体选择性培养基:褐藻酸钠0.5 g,硫酸铵0.5 g,NaCl 3.0 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.001 g,蒸馏水100 mL,pH 7.5。
1.2 方法
1.2.1 褐藻胶选择性培养基进行菌种初筛的方法 ① 从健康刺参肠道中筛菌:利用无菌PBS溶液对解剖所得健康刺参肠道匀浆物进行梯度稀释,并分别涂布到褐藻胶固体选择性培养基中,以不含任何碳源的琼脂平板作为对照。28 ℃恒温培养箱培养72 h后,选取菌落生长较大或者有明显透明圈的菌株进一步划线纯化,重复上述步骤3次,直至确认所分离菌样为单一菌株后移入-70 ℃低温冰箱保藏。② 从海带病烂处筛菌:从采样地点收集具有烂边或明显腐烂症状的海带样品,使用接种环直接从海带病烂处挑取菌样,用无菌PBS溶液对菌样进行梯度稀释按①中方法进行分离纯化。③ 从海泥中筛菌:将海泥样品用无菌PBS溶液进行梯度稀释并充分震荡混匀,按①中方法进行分离纯化。
1.2.2 褐藻胶裂解酶活力测定方法(DNS法) 利用DNS法测定菌株褐藻胶液体选择性培养基中上清液的褐藻胶裂解酶酶活。以反应液中还原糖的增加量作为酶活力的检测指标。还原糖的增加量利用DNS试剂测定。以葡萄糖为标准物做标准曲线,根据反应组和对照组吸光度的差值计算还原糖的生成量。1个酶活力单位定义为反应液在上述条件下,每分钟产生1 μg还原糖所需要的酶量。
1.2.3 具有褐藻胶降解能力的微生物分类鉴定 ①16S rDNA的PCR扩增:使用SmartTaqPre-Mix 试剂盒扩增16S rDNA,PCR扩增通用引物[9]:27F (5′-AGAGTTTGATCC TGGCTCAG-3′);1429R (5′-GGTTAC CTT GTTACGACTT-3′)。 ② 16S rDNA基因测序及菌种鉴定:所得PCR结果送大连万泽贸易有限公司测序。测序结果使用NCBI的Blast软件与GenBank数据库中已知种类微生物的16S rDNA基因序列进行比对,确定序列相似性≥95%的最高序列[10]。将所需菌株应用MEGA 5.0软件利用neighbor-joining方法对测得的DNA序列与NCBI上报到的已知序列进行聚类分析,绘制系统发育树[11-12]。
1.2.4 筛选所得菌株的生理生化鉴定及利用褐藻胶的类型 参照《常见细菌系统鉴定手册》(第8版)的方法,利用细菌生理生化检测试剂盒对所筛选菌株的各生理生化指标进行检测。分别利用褐藻胶甘露糖醛酸(M)和古罗糖醛酸(G)片段代替褐藻胶作为唯一碳源配制选择性固体培养基,考察菌株利用褐藻胶成分的类型。
1.2.5 筛选所得菌株对刺参的安全性试验 以浓度分别为5×109、5×108和5×107cfu/mL筛选菌株的菌悬液为试验组,以灭菌海水为空白对照,以5×108cfu/mL的灿烂弧菌为阳性对照。每组取10只健康刺参于20 cm×15 cm×15 cm的水槽,设置3个平行组。每只刺参一次腹腔注射100 μL菌液或海水,连续注射3 d。每日进行观察,记录各组刺参生存状态,发病率。实验期间保持溶氧量≥5 mg/L、温度(17±1) ℃、盐度30~32 g/L,14 d后,统计结果。
1.2.6 筛选所得菌株的褐藻胶裂解酶对褐藻胶降解终产物的色谱分析 ① 分子排阻色谱法:使用液相色谱仪UltiMate 3000,利用分子排阻色谱法测定降解终产物褐藻寡糖的聚合度。条件如下: 色谱柱:Superdex柱(10 mm×300 mm);流动相:0.1 mol/L 碳酸氢铵溶液,柱温:25 ℃; 流速:0.1 mL/min;样品:褐藻寡糖酶解液;进样量:20 μL;检测器:紫外检测器(230 nm)。② 高效凝胶渗透色谱法(HPGPC):使用液相色谱仪UltiMate 3000,利用高效凝胶渗透色谱法测定降解终产物褐藻寡糖的平均分子量。条件如下:色谱柱:TSKgel PW柱(7.8 mm×300 mm);流动相:0.1 mol/L硫酸钠溶液;柱温:35 ℃,流速:0.5 mL/min;样品:褐藻寡糖酶解液;进样量:20 μL;检测器:示差折光检测器。
2 结果与分析
2.1 褐藻胶降解菌株的初筛及16S rDNA基因序列鉴定结果
利用褐藻胶选择性琼脂平板初筛,经过多轮分离纯化,从健康刺参肠道、腐败海带及海泥样品中,共得到32株具有褐藻胶降解能力的菌株(表1),16S rDNA序列分析显示大多为弧菌属(Vibrio)及假交替单胞菌属(Pseudoalteromonas)的细菌,此两类细菌多数为刺参潜在的条件致病菌[13-14]。在这些菌株中值得关注的是,通过16S rDNA序列分析发现,在海泥样本分离得到的菌株有2株属于水产常用益生菌—芽胞杆菌Bacillussp. WB1及芽胞杆菌Bacillussp. WB2。

表1 褐藻胶降解菌筛选结果
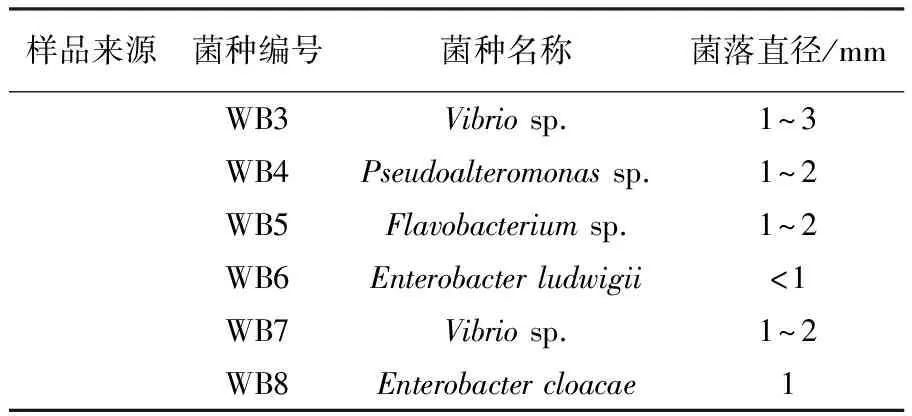
续表1
2.2 褐藻胶降解菌株的褐藻胶裂解酶活性
将初筛所得不同菌属且在褐藻胶选择性固体平板培养基中长势较好的菌株进行进一步褐藻胶裂解酶的酶活考察,结果如图1所示。其中腐败海带样品中筛选所得菌株溶藻弧菌VibrioalginolyticusWH6具有最高的褐藻胶裂解酶活性,其次是刺参肠道中筛选到的假交替单胞菌属的细菌Pseudoalteromonassp. WC5,而芽胞杆菌WB1虽然比上述2种刺参潜在条件致病菌的褐藻胶裂解酶活性稍低,但是相比之下更加安全可靠,也具备生产实践的使用价值,因而初步符合本课题筛选菌株的标准。
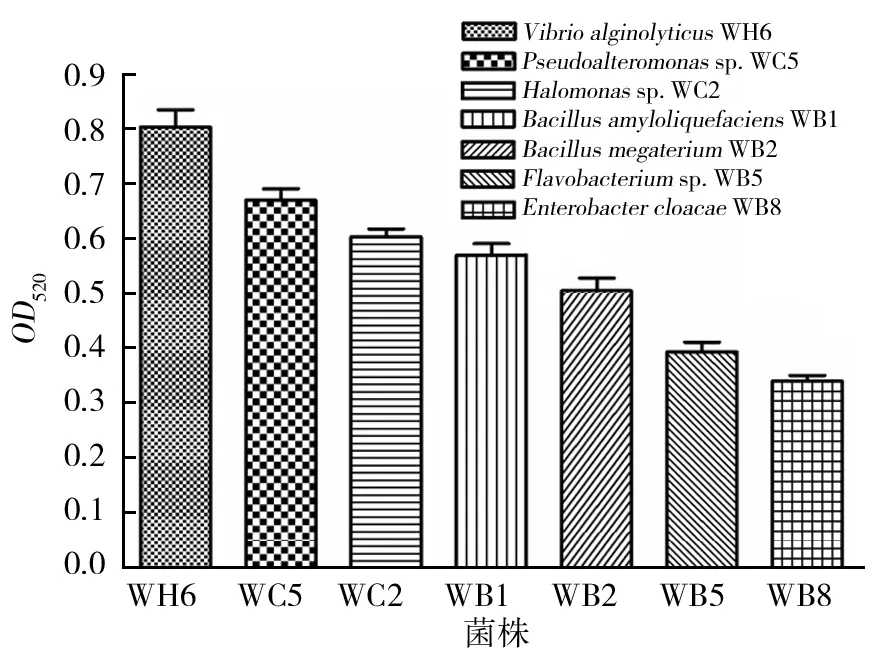
图1 几种不同来源的菌株褐藻胶裂解酶相对酶活Fig.1 The relative alginate lyase activity of the five strains from different samples
2.3 菌株WB1的生理生化鉴定结果及系统发育树分析
菌株WB1的生理生化鉴定结果如表2所示,WB1为革兰阳性细菌,细胞形态为杆状,从生理生化鉴定结果可以看出菌株WB1具有丰富的蛋白酶及糖苷酶活性,并且其既可利用褐藻胶中的甘露糖醛酸(M)片段也可利用古罗糖醛酸(G)片段作为碳源和能源物质进行生长。
基于16S rDNA的系统发育进化树如图3所示,分析表明,与芽胞杆菌WB1同源关系最近的是在ATCC(美国模式培养物集存库)保存的标准菌株解淀粉芽胞杆菌Bacillusamyloliquefaciens23842,因此可以认为本实验中分离得到的菌株WB1是一种解淀粉芽胞杆菌,命名为BacillusamyloliquefaciensWB1。

表2 菌株WB1的生理生化鉴定结果
注:“+”表明试验结果为肯定,“-”表明实验结果为否定
2.4 菌株WB1对刺参安全性试验的结果
经腹腔注射高浓度解淀粉芽胞杆菌WB1菌悬液并观察14 d后,试验组刺参状态良好,背刺坚挺,贴壁正常,未出现腐皮、溃烂或摇头等不良反应(图3A与3B)。而阳性对照组在腹腔注射第1天后就出现大规模吐肠现象,第3天后出现贴壁困难及摇头症状并在随后的观察时间内逐渐出现腐皮溃烂等症状,第8天基本全部死亡(图3C)。综上结果表明,高浓度的解淀粉芽胞杆菌WB1对刺参的生长未表现出潜在致病作用,可以作为刺参安全菌株供下一步试验使用。
2.5 菌株WB1褐藻胶裂解酶对褐藻胶进行降解的终产物分析
分子排阻色谱对酶解液中褐藻寡糖聚合度的分析结果如图4所示。与不饱和三糖标准品的出峰时间作为对照,可以看出菌株WB1褐藻胶裂解酶对褐藻胶进行降解的终产物寡糖主要为二糖和三糖,相对含量分别为74.1%和25.9%。利用高效凝胶渗透色谱(HPGPC)测定酶解液中褐藻寡糖平均分子量的结果如图5所示。以中国药品生物制品检定院的不同分子量右旋糖酐标准品制作标准曲线(图6),通过对回归方程求解,得出酶解液中褐藻寡糖终产物的平均分子量为516 Da。
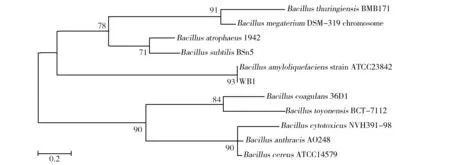
图2 基于16S rDNA序列的芽胞杆菌WB1系统发育进化树Fig.2 Phylogenetic analysis tree of the Bacillus sp. WB1which was obtained by 16S rDNA sequences

图3 腹腔注射WB1菌液14 d后刺参的生长情况Fig.3 Growth situation of sea cucumbers after 14 d when treated with WB1suspension by intraperitoneal injection
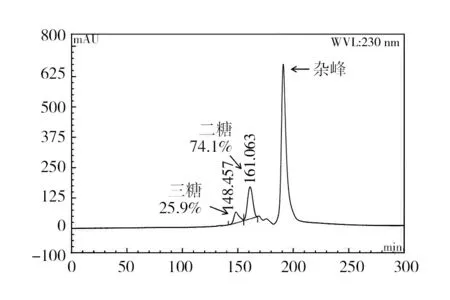
图4 WB1褐藻胶裂解酶降解褐藻酸终产物的分子排阻色谱Fig.4 Molecular exclusion chromatography of the end-products of degradation of algin by WB1 alginate lyase
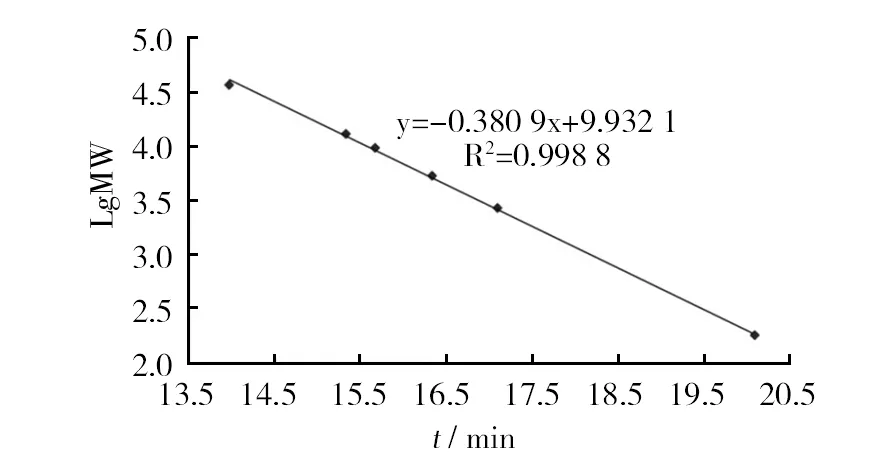
图5 不同分子量右旋糖酐标准曲线Fig.5 Standard curve of dextran with different molecular weight
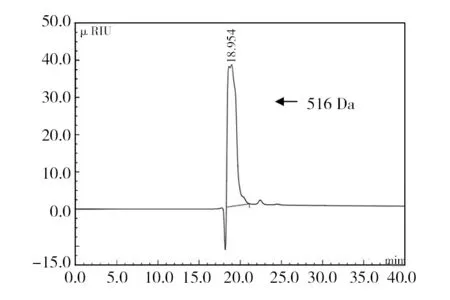
图6 WB1褐藻胶裂解酶降解褐藻酸终产物的凝胶色谱Fig.6 Gel chromatography of the end-products of degradation of algin by WB1 alginate lyase
3 讨 论
海洋环境中具有多种可以降解褐藻胶的微生物,这些微生物大多与海洋藻类或软体动物密切相关[15-17],其或者以褐藻多糖作为主要能源物质,或者在养分贫乏而褐藻多糖丰富的条件下分泌褐藻多糖裂解酶以对其进行分解利用。从与刺参生长紧密相关的环境中筛选菌株是获得有效、稳定且安全的具有褐藻胶降解能力的有益微生物的有效方式。本研究从健康刺参肠道、刺参养殖海域附近的腐败海带及海泥中获取样本,利用褐藻胶作为唯一碳源的选择性培养基,经过多轮分离纯化,初步筛选出32株具有降解褐藻胶能力的菌株,对其进行了16S rDNA测序分析。通过NCBI网站BLAST相似性比较分析发现其多为弧菌属和假交替单胞菌属的细菌,但其中也分离得到两株芽胞杆菌属的细菌。进一步对褐藻胶裂解酶酶活进行比较发现,与腐败海带中筛选得到的能专一降解海带褐藻胶的溶藻弧菌以及刺参肠道中筛选得到的假交替单胞菌相比,芽胞杆菌褐藻胶裂解酶的活性稍低,但相比具有潜在致病性的弧菌及假交替单胞菌,芽胞杆菌属的细菌因普遍作为水产养殖中的益生菌使用而显得更加安全可靠[18-19]。
研究表明,芽胞杆菌属的细菌具有多种益生效果,可作为绿色无害饲料添加剂使用。例如,Rengpipat等[20]以添加芽胞杆菌S11的饵料饲喂斑节对虾后期幼体100 d后,以病原菌哈氏弧菌Vibrioharveyi浸浴感染,10 d后所有芽胞杆菌S11处理组的对虾100%存活,而对照组成活率只有26%;刘克琳等[21]研究认为,芽胞杆菌能显著促进鲤鱼免疫器官的发育,试验组鲤鱼胸腺的皮质增宽、巨噬细胞和粒细胞等表面光滑、绒密集且数量多;实验组胸腺T、B淋巴细胞较多、发育出现分化,T淋巴细胞毛突起少,B淋巴细胞表面突起,绒毛增多。鉴于芽胞杆菌作为常见的益生菌,在降解褐藻胶的同时,可能也会在水体及动物肠道中发挥一定的益生作用,有利于促进养殖动物的生长发育及提高抵御病害的能力,因而符合本研究的菌种选择标准。
对两株筛选所得芽胞杆菌的褐藻胶裂解酶活性进行比较,菌株WB1具有较高的褐藻胶裂解酶活性。进一步的形态学、生理生化鉴定及基于16S rDNA的系统发育树表明其与ATCC中保存的标准菌株BacillusamyloliquefaciensATCC 23842具有最高的同源性,因此将其鉴定为一种解淀粉芽胞杆菌,命名为BacillusamyloliquefaciensWB1。解淀粉芽胞杆菌是农业和水产中常用的一种益生菌,其具有α-淀粉酶及蛋白酶等多种消化酶活性,与枯草芽胞杆菌在形态、培养特征及生理生化特性方面非常相似[22]。通过TLC及分子排阻色谱分析发现,WB1的褐藻胶裂解酶对褐藻多糖降解的终产物以二糖为主,也含有少量三糖,因色谱图中观察不到单糖的存在,提示WB1的褐藻胶裂解酶可能是一种内切酶,这与文献报道的很多褐藻胶裂解酶都为内切酶相符[23]。
虽然很多解淀粉芽胞杆菌都被作为农业或水产中的益生菌使用,但为确保解淀粉芽胞杆菌WB1在生产实践中对刺参没有任何潜在致病性,本研究通过腹腔注射攻毒试验,对解淀粉芽胞杆菌WB1的安全性进行了考察。结果表明即使用高浓度的WB1菌悬液经腹腔注射攻毒,也未对刺参造成任何致病症状,这为WB1作为活菌制剂在刺参饲料中的使用提供了安全性保障。
综上所述,经过大量的菌株分离鉴定试验,解淀粉芽胞杆菌WB1具备良好的褐藻胶降解能力且对刺参没有任何潜在致病性,因此可作为一种降解海带饲料原料中褐藻胶的潜在目标菌株使用。
[1] 宋广军,王丽梅,李世国,等. 大连沿海野生鼠尾藻种群生态调查[J]. 水产科学,2011,30(9):528-532.
[2] 刘增胜, 柳正.中国渔业年鉴[M].北京: 中国农业出版社, 2010: 6-11.
[3] 唐黎,王吉桥,许重,等. 不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J]. 水产科学,2007,26(5):275-277.
[4] 郭娜,董双林,刘慧. 几种饲料原料对刺参幼参生长和体成分的影响[J]. 渔业科学进展,2011,32(1):123-128.
[5] Gacesa P. Alginates[J]. Carbohydpolym,1988, 8(3): 161-182.
[6] Doubet R S, Quatrano R S. Properties of alginate lyases from marine bacteria[J].Appl Environ Microbiol,1984, 47(4): 699-703.
[7] Boyen C, Bertheau Y, Barbeyron T, et al. Preparation of guluronatelyase fromPseudomonasalginovorafor protoplast isolation inLaminaria[J]. Enzyme Microb Technol,1990, 12(11): 885-890.
[8] Hansen J B, Doubet S, Ram J. Alginase enzyme production byBacilluscirculans[J] .ApplEnviMicrob,1984(4), 47: 704-709.
[9] Martin F, Collen M. Bias in template-to-product ratios in multi-template PCR[J]. ApplMicrobiolBiotechnol,1998, 64(10): 3724-3730.
[10]Altschul S F, Gish W, Miller W, et al. Basic local alignment search tool[J]. J Mol Biol,1990, 215(3): 403-410.
[11]Thompson J D, Gibson T J, Plewniak F, et al. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res,1997, 25(24): 4876-4882.
[12]Kumar S, Tamura K, Nei M. MEGA-3: integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment[J]. Brief Bioinform,2004, 5(2): 150-163.
[13]Zhang C Y, Wang Y G, Rong X J. Isolation and identification of causative pathogen for skin ulcerative syndrome inApostichopusjaponicas[J]. J Fish Sci China,2006, 30(1): 118-123.
[14]张莹,姜国良,刘云,等. 仿刺参“腐皮综合症”病灶处优势菌的分离鉴定及AHLs信号分子的检测[J]. 微生物学通报,2009,36(11):1664-1669.
[15]Sutherland I W, Keen G A. Alginases fromBeneckeapelagiaandPseudomonasspp.[J].J ApplBiochem,1981, 3: 48-57.
[16]Riesen V L. Digestion of align byPseudomonasmaltophiliaandPseudomonasputida[J].Appl Environ Microbiol,1980, 39(1): 92-96.
[17]Tseng C H, Yamaguchi K, Kitamikado M. Isolation and some properties of alginate lyase from a marine bacteriumVibriosp. AL-128[J]. Nippon Suisan Gakk,1992, 58(3): 533-538.
[18]José L B, Ignacio B, Imanol R Z, et al. The role of probiotics in aquaculture[J]. Vet Microbiol,2006, 114(3-4): 173-186.
[19]Irianto A, Austin B. Probiotics in aquaculture[J]. J Fish Dis,2002, 25(11): 633-642.
[20]Rengpipat S, Phianphak W, Piyatiratitivorakul S, et al. Effect of a probiotic bacterium on black tiger shrimpPenaeusmonodonsurvival and growth[J]. Aquaculture,1998, 167(3-4): 301-313.
[21]富丽静,王雷,宋文华. 复合微生物在高密度主养鲫池塘中的应用[J]. 水产科学,2002,21(1):23-25.
[22]张娟,杨彩梅,曹广添,等. 解淀粉芽孢杆菌及其作为益生菌的应用[J]. 动物营养学报,2014,26(4):1-4.
[23]Thiang Y W, Lori A P, Neal L S. Alginate lyase: review of major sources and enzyme characteristics, structure-function analysis, biological roles, and applications[J]. Annu Rev Microbiol,2000, 54(31): 289-340.
欢 迎 投 稿 欢 迎 订 阅
Isolation and Identification of Algin-Degrading Bacteria in Kelp (Laminariajaponica) Forage Materials for Spiny Sea Cucumber (ApostichopusJaponicas)
WANG Xi-tao1, 2, LI Shu-ying2, WANG Li-li3, LI Xiao-yu3, XU Yong-ping1, 2, 3
(1.SafetyGuarant.Technol.ofAnim.Food,Engin.Res.Ctr.,Dalian116620; 2.DalianSaimuBio-Technol.Co.Ltd.,Dalian116620; 3.Coll.ofLifeSci. &Technol.DalianUni.ofSci. &Technol.Dalian116024)
An impathogenic microbe that can effectively degrade algin was screened and isolated from kelp and the sea cucumber culturing environment. Using the microbe for degrading and treating kelp forage materials could decrease the algin component that is difficult to digest by spiny sea cucumber (A.japonicas) and increase the utility ratio and the value of kelp forage material. The culture medium with sodium alginate as the sole carbon source was used for preliminary screening; DNS method was used to determine the activity of alginate lyase; 16S rDNA sequencing and physiological and biochemical tests were carried out to characterize the experimental bacterial strain; The strain was investigated by injecting the sea cucumber with a high dose of the bacterial suspension at the coelom to test the toxicity of the microbe for the potential pathogenicity; The end-product of alginate lyase digestion of algin by the strain was analyzed with the method of molecular exclusion chromatography and high gel permeation chromatography. The results showed that the strain WB1 had the highest homology withBacillusamyloliquefaciens, and had no pathogenicity against spiny sea cucumber, the end products of its algin lysis by lyase mainly were disaccharide and trisaccharide with relative contents at 74.1% and 25.9% respectively, and average molecular weight at 516 Da. Therefore, the strainB.amyloliquefaciensWB1 can be used as safety, beneficial microbe to lysate the algin component in spiny sea cucumber forage.
spiny sea cucumber (Apostichopusjaponicas);Bacillusamyloliquefaciens; kelp (Laminariajaponica); algin
国家海洋公益项目(201405003)
王熙涛 男,博士后。主要研究方向为益生菌及微生态制剂做为绿色饲料添加剂在水产养殖中应用。
E-mail:wxt731@sina.com
2016-01-16;
2016-03-25
Q93-331
A
1005-7021(2016)06-0061-07
10.3969/j.issn.1005-7021.2016.06.010
* 通讯作者。男,教授,博士生导师。主要研究方向为噬菌体、益生菌、卵黄免疫球蛋白(IgY)、天然植物活性成分等新型绿色
技术控制动物细菌及病毒性疾病以替代抗生素的研究。E-mail:sembio@126.com

