镉胁迫下蛋白磷酸酯酶Msg5对MAPK蛋白激酶Slt2的调控
夏 婧, 蒋伶活
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
镉胁迫下蛋白磷酸酯酶Msg5对MAPK蛋白激酶Slt2的调控
夏 婧, 蒋伶活*
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
镉离子(Cd2+)是一种对人体具有致癌性的非必需金属离子,能严重影响生物体的生长、发育和生殖。有丝分裂原蛋白激酶(Mitogen-activated protein kinase,MAPK)是调节细胞存活、增殖和分化中的重要信号分子。细胞壁完整性(Cell Wall Integrity,CWI)途径是酿酒酵母细胞(Saccharomycescerevisiae)中的一个MAPK信号传导途径,参与镉胁迫下的细胞应答。镉胁迫导致CWI途径的MAPK蛋白激酶Slt2激活并被磷酸化。在CWI途径中,有4个蛋白磷酸酯酶Ptp2、Ptp3、Sdp1和Msg5可以调控Slt2的磷酸化和活性,但是它们在镉胁迫条件下的功能未知。本研究通过同源重组的原理构建了4个单基因缺失株之间的6个双基因缺失株,利用倍比稀释方法分析了这四个磷酸酯酶基因之间在镉胁迫条件下的遗传相互作用。结果发现Msg5是镉胁迫条件下调控Slt2的主要蛋白磷酸酯酶。
酵母细胞;MAP kinase;细胞壁完整性(CWI)途径;磷酸酯酶;镉胁迫
镉是生物体的非必需金属,可以通过饮食和吸烟摄入人体,危害人类健康[1]。世界卫生组织确认了镉对于公共健康的危害性[2]。镉是一种对人体有致癌作用的严重的环境污染物,在国际癌症研究机构定义的I类人体致癌物中就有镉[3]。另外,人体通过饮食等途径长期、低剂量接触镉可能会导致心血管疾病的发生[4-5]。最近有研究表明,阿尔茨海默病和帕金森综合症等神经性疾病的发生可能也与镉有关[6-7]。细胞内镉离子(Cd2+)可以干扰多条信号传导途径[8]。有丝分裂原蛋白激酶(Mitogen-activated protein kinase, MAPK)信号转导途径是真核生物应答外界刺激的重要途径之一[9-11]。在酿酒酵母(Saccharomycescerevisiae)细胞中存在5个MAPK级联系统[12],其中细胞壁完整性(CWI)途径包括细胞膜感受器Mid2、Wsc1、Wsc2、Wsc3、Hsc77,Slg1及其下游调节因子Rho1,蛋白激酶C(Pkc1),MAPK级联系统及其下游的效应器。其中,MAPK级联系统包括 MAPK kinase kinase (Bck1)、MAPK kinase (Mkk1/2)和MAPK (Slt2,也称为Mpk1)。蛋白激酶Pkc1磷酸化Bck1,进而激活Mkk1/2,最终使Slt2的Tyr192和Thr190位点被磷酸化而激活Slt2[13-14]。被磷酸化的Slt2通过激活转录因子产生一系列细胞应答。我们的前期研究发现酿酒酵母细胞中CWI途径参与了镉胁迫下的细胞应答。镉通过细胞膜上的感受器Mid2,将信号传递给调节因子Rho1,通过激活Pkc1进而激活Slt2[14-15]。在CWI途径中Slt2的磷酸化除了受CWI途径中的蛋白激酶调控外,还受到4个蛋白磷酸酯酶Ptp2、Ptp3、Sdp1和Msg5的调控[16]。本研究分析了镉胁迫条件下这4个蛋白磷酸酯基因间的遗传相互作用,发现Msg5是镉胁迫条件下调控Slt2的主要蛋白磷酸酯酶。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 酿酒酵母菌株:野生型BY4741(MATahis3Δ1、leu2Δ0、met15Δ0、ura3Δ0)和BY4741为背景的酵母细胞单倍体单基因缺失株ptp2::kanMX4、ptp3::kanMX4、sdp1::kanMX4和msg5::kanMX4;质粒:Y43由本实验室保存。
1.1.2 引物实验 所用引物见表1。
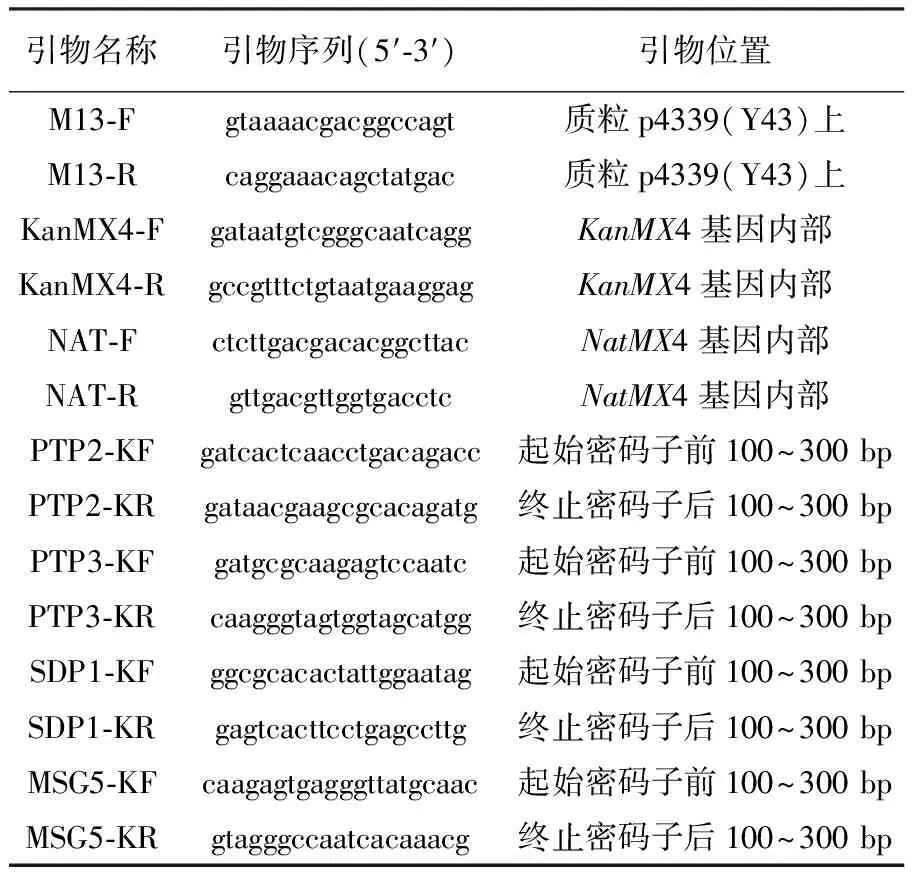
表1 实验所用引物
1.1.3 培养基(质量分数,%) LB培养基:蛋白胨1,酵母提取物0.5,NaCl 1。用1 mol/L NaOH调pH至7.0,定容,0.1 MPa压力下灭菌20 min。配置固体培养基时加1.5%(质量分数)的琼脂粉。YPD培养基:蛋白胨2,葡萄糖2,酵母提取物1,定容后0.1 MPa压力下灭菌20 min,配置固体培养基时加入2%(质量分数)的琼脂粉。
1.1.4 主要试剂 酵母敲除所用ssDNA、LiAc和PEG 3350等试剂购自Sigma公司;实验所用药物NAT和G418分别购自Werner BioAgents和上海生工;DNATaqpolymerase购自TransGene。
1.1.5 主要实验仪器 PCR反应仪(德国艾本德公司)、电热恒温培养箱(江苏荣华仪器制造有限公司)、台式冷冻离心机(日本日立公司)、立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)、凝胶成像系统(Bio-Rad)。
1.2 方法
1.2.1 酵母细胞的敲除 挑取活化的酵母单菌落接种于3 mL YPD 液体培养基中,30 ℃培养过夜至饱和。取500 μL过夜培养物接种到4.5 mL 2×YPD中,30 ℃培养3~4 h至对数期。将5 mL菌液分3管,室温4 000 r/min离心1 min,弃上清,再用1 mL无菌水重悬并合并到1个EP管中,室温4 000 r/min离心1 min。加100 μL 0.1 mol/L LiAc溶液混匀,12 000 r/min瞬时离心10 s收集菌体,再用100 μL 0.1 mol/L LiAc溶液洗一次。向细胞沉淀中依次加入240 μL 50%(质量分数)PEG,36 μL 1 mol/L LiAc,10 μL 10 mg/mL ssDNA,目的DNA(5~10 μg),1 mL吸头上下吸3~4次,涡旋充分混匀,置于30 ℃孵育30 min,42 ℃水浴热激30 min。室温4 000 r/min离心1 min收集菌体,用1 mL无菌水重悬菌体4 000 r/min离心1 min,弃上清,剩余100 μL水涂布到选择性固体平板上,30 ℃培养3 d,获得酵母转化子。
1.2.2 玻璃珠法提取酿酒酵母基因组DNA 挑取酵母单菌落接种于3 mL YPD 液体培养基中,30 ℃培养过夜。将过夜培养物转移到1.5 mL离心管中,12 000 r/min离心1 min收集菌体(约30~50 μL)。加入和细胞体积相当的酸性玻璃珠,将细胞重悬于200 μL STES溶液中,再加入200 μL氯仿和异戊醇的混合液(24∶1)。剧烈震荡10×30 s,加入200 μL的TE,迅速混合,4 ℃、12 000 r/min离心10 min。将上清转移到新的1.5 mL的离心管中,加入1/10体积的3.0 mol NaAc,2倍体积的无水乙醇,混匀后置于-80 ℃大约30 min,在4 ℃下12 000 r/min离心10 min,弃上清。加入500 μL的75%(体积分数)的乙醇溶液后轻轻倒掉,将剩余的乙醇溶液用移液枪吸干净,55 ℃干燥30 min,向离心管中加入50 μL 20 μg/mL RNase水,55 ℃消化30 min使沉淀溶解。琼脂糖凝胶电泳检测,-20 ℃冰箱保存备用。
1.2.3 倍比稀释法表型分析 在无菌超净台上准备5个灭过菌的离心管,依次标号为1、2、3、4、5号管。向2~4号离心管中加入450 μL无菌水,向1号离心管中加入500 μL细胞过夜培养物。从1号离心管中取50 μL加入到2号离心管中,置于涡悬器上混匀,立即取50 μL到3号离心管中,再混匀。依此类推,直至5号离心管,这样菌液就被稀释到10-4倍数。然后将这5个离心管依次排列,用移液器分别吸取2.5 μL点接到含有不同药物的固体培养基平板上,点接之前先将平板标记好位置。要特别注意在点接过程中,每次拿起离心管,必须先涡悬混匀后再吸取菌液。点接完后,将平板倒置于30 ℃培养箱中培养2~4 d。
1.2.4 双基因缺失株的构建 以质粒Y43为模板,用通用引物M13扩增出NAT敲除盒,在NAT敲除盒和KanMX4敲除盒的两端有一段同源臂,因此利用NAT敲除盒在A::kanMX4基因缺失株中做敲除,这样natMX4标记和kanMX4标记发生同源交换,获得对NAT药物耐受重组子A::natMX4,在YPD+100 μg/mL NAT培养基中涂板,30 ℃培养3 d,长出转化子后提基因组进行验证得到正确的重组子进行下一步实验。以B::kanMX4基因缺失株为模板,用B基因的上下游引物扩出B基因的KanMX4敲除盒,用这个敲除盒在重组子A::natMX4中做敲除使KanMX4敲除盒与B基因发生同源交换,获得对NAT药物和G418药物都耐受的重组子,在YPD+100 μg/mL NAT+150 μg/mL G418的培养基上涂板,30 ℃培养3 d,提基因组验证,得到A::natMX4B::kanMX4双基因缺失株(图1)。
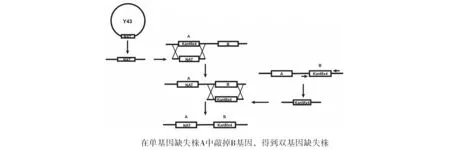
图1 双基因敲除策略Fig.1 The constructionstrategy of double-gene deletion mutants
2 结果与分析
2.1 双基因缺失株的构建及验证
在酿酒酵母的细胞壁完整性(CWI)途径中的Slt2受蛋白激酶和蛋白磷酸酯酶的双重调控,其中调节Slt2的蛋白磷酸酯酶有Ptp2、Ptp3、Sdp1和Msg5。从单倍体单基因缺失株文库(购自美国Invotrogen公司)中活化出这4个单基因缺失株ptp2::kanMX4、ptp3::kanMX4、sdp1::kanMX4、msg5::kanMX4,构建它们之间的6个双基因缺失株。首先需要验证活化出的单倍体单基因缺失株的基因型,用基因的一端引物和KanMX4一端的引物来验证。基因型正确则能扩增出条带(图2)。验证基因型正确后,以Y43质粒为模板,用通用引物M13来扩增出NAT敲除盒,利用1.2.1的方法在ptp2::kanMX4、ptp3::kanMX4、sdp1::kanMX4、msg5::kanMX4菌株中做敲除,使NAT敲除盒与KanMX4敲除盒发生同源交换,在YPD+100 μg/mL NAT培养基中长出单菌落后提基因组验证。用4个基因各自的上下游引物进行PCR,ptp2::natMX4、ptp3::natMX4、sdp1::nat
MX4、msg5::natMX4正确的重组子能够扩增出NAT敲除盒。分别以原始菌株ptp2::kanMX4、ptp3::kanMX4、sdp1::kanMX4、msg5::kanMX4的基因组为对照,扩增KanMX4敲除盒,NAT敲除盒和KanMX4敲除盒的大小不同,所以得到的条带与对照大小不一的即为正确的重组子(图3)。
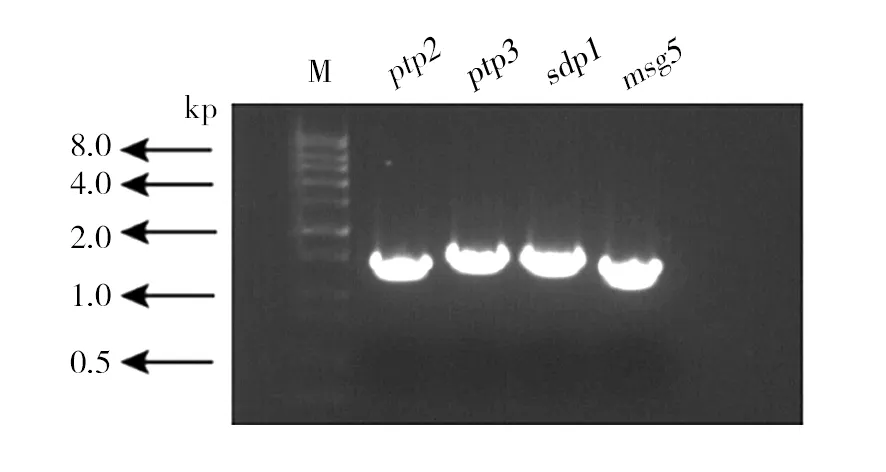
图2 基因缺失株的基因型验证Fig.2 Genotype verification of gene gene deletion mutants从左到右4条泳道的扩增引物依次为KanMx4-F,PTP2-R;KanMx4-F,PTP3-R;KanMx4-F,SDP1-R和KanMx4-F,MSG5-RThe primers of lanes form left to right is KanMx4-F,PTP2-R;KanMx4-F,PTP3-R;KanMx4-F,SDP1-R and KanMx4-F,MSG5-R
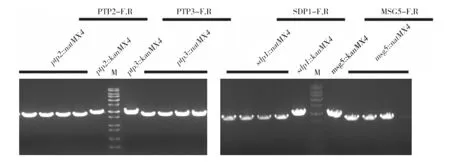
图3 NAT敲除盒与KanMX4敲除盒同源交换后的重组子的基因型验证Fig.3 Genotype verification of recombinant after homologous crossoverNAT and KanMX4
然后,利用原始的单基因缺失株ptp2::kanMX4、ptp3::kanMX4、sdp1::kanMX4、msg5::kanMX4为模板扩增出各自的KanMX4的敲除盒,用KanMX4-ptp2、KanMX4-ptp3、KanMX4-sdp1、KanMX4-msg5来表示(图4)。将KanMX4-ptp2敲除盒转到ptp3::natMX4、sdp1::natMX4、msg5::natMX4菌株中,使KanMX4-ptp2敲除盒与PTP2基因发生同源交换,以敲掉PTP2。在YPD+100 μg/mL NAT+150 μg/mL G418的培养基上涂板,对于长出的重组子提基因组验证,以野生型菌株BY4741做对照,用PTP2两端的引物进行验证。BY4741可以扩增出PTP2的ORF的大小,而正确的重组子ptp3::natMX4ptp2::kanMX4、sdp1::natMX4ptp2::kanMX4、msg5::natMX4ptp2::kanMX4可以扩出的条带是KanMX4敲除盒的大小,可以得到带有编号的重组子即为正确的(图5A)。
同样的方法,将KanMX4-ptp3敲除盒转到ptp2::natMX4、sdp1::natMX4、msg5::natMX4中,敲掉PTP3基因,对于长出的重组子提基因组验证,以野生型菌株BY4741做对照,用PTP3两端的引物进行验证,BY4741可以扩出PTP3的ORF的大小,而正确的重组子ptp2::natMX4ptp3::kanMX4、sdp1::natMX4ptp3::kanMX4、msg5::natMX4ptp3::kanMX4可以扩增出的条带是KanMX4敲除盒的大小,可以得到带有编号的重组子即为正确的(图5B)。
利用KanMX4-sdp1敲除盒在ptp2::natMX4、ptp3::natMX4、msg5::natMX4中敲掉SDP1基因,对于长出的重组子提基因组验证,以野生型菌株BY4741做对照,用SDP1两端的引物进行验证,BY4741可以扩增出SDP1的ORF的大小,而正确的重组子ptp2::natMX4sdp1::kanMX4、ptp3::natMX4sdp1::kanMX4、msg5::natMX4sdp1::kanMX4可以扩增出的条带是KanMX4敲除盒的大小,可以得到带有编号的重组子即为正确的(图5C)。
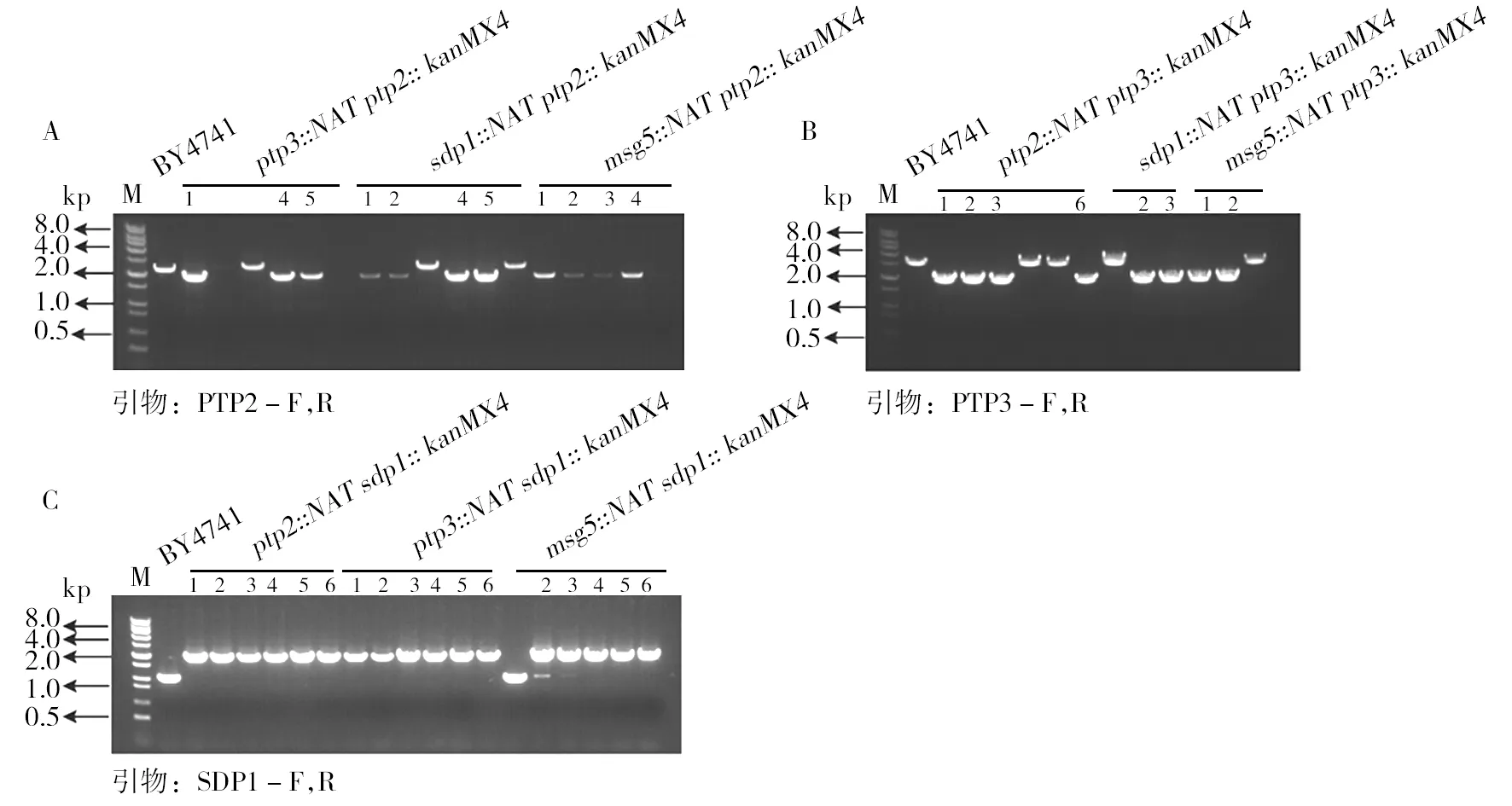
图5 双基因缺失株基因型验证Fig.5 Genotype verification of double-gene deletion mutants
2.2 Cd2+对单基因缺失株和双基因缺失株的表型实验
用1.2.3的方法对构建成功的单倍体双基因缺失株和各自的单基因缺失株进行倍比稀释法表型分析,分别在YPD培养基、YPD+1 mol/L NaCl培养基、YPD+100 μmol/L CdCl2培养基和YPD+150 μmol/L CdCl2培养基进行点样,30 ℃培养2~3 d后进行表型分析(图6)。以YPD培养基和YPD+1 mol/L NaCl培养基为对照,在对照培养基中,单基因缺失株和双基因缺失株的表型与野生型的表型基本是一致的。单基因缺失株ptp2、ptp3、sdp1及双基因缺失株ptp2ptp3、ptp2sdp1、ptp3sdp1在YPD+100 μmol/L CdCl2培养基和YPD+150 μmol/L CdCl2培养基中,也没有表现出明显的敏感或抗性。然而,单基因缺失株msg5和双基因缺失株ptp2msg5、ptp3msg5和sdp1msg5虽然在YPD+100 μmol/L CdCl2培养基中没有表现出抗性,但这些基因缺失株却对150 μmol/L CdCl2有抗性。由于有YPD+1 mol/L NaCl培养基作为对照,说明在YPD+150 μmol/L CdCl2培养基中表现出的抗性不是由Cl-引起的,而是由Cd2+引起的。结果表明,4个蛋白磷酸酯酶基因中,只有MSG5基因的缺失使酵母细胞对高浓度的Cd2+表现出抗性,因此初步表明Msg5可能是镉胁迫下负调控CWI途径中Slt2的主要蛋白磷酸酯酶。

图6 不同基因缺失株在不同浓度Cd2+条件下的表型Fig.6 Phenotypes of different double genes mutants in reponse to cadmium stress
3 讨 论
本研究利用同源重组的原理,通过NAT和G418两种药物抗性标记,构建了酵母细胞的单倍体双基因缺失株,并对ptp2、ptp3、sdp1、msg5四个单基因缺失株和它们之间的六个双基因缺失株进行Cd2+敏感性表型分析。发现PTP2、PTP3、SDP1基因的缺失并没有影响基因缺失株对Cd2+的敏感程度,而MSG5基因的缺失使菌株对高浓度Cd2+表现出抗性。有研究表明MSG5基因对CWI途径中的Slt2起到负调控作用[16],而Slt2是通过磷酸化来传导镉胁迫下的信号[14-15]。由此可以推测,MSG5基因的缺失可能导致Slt2的活性增加,所以酵母耐受镉胁迫的能力增强。研究了磷酸酯酶对CWI途径中应答镉胁迫的作用,为进一步研究CWI途径对镉胁迫调控机理提供了参考,有助于酵母细胞内Cd2+稳态调控机理的深入研究。
[1] Thévenod F, Lee WK. Cadmium and cellular signaling cascades: interactions between celldeath and survival pathways[J]. Arch Toxicol, 2013, 87(10): 1743-1786.
[2] Satarug S. Long-term exposure to cadmium in food and cigarette smoke, liver effects and hepatocellular carcinoma[J]. Current Drug Metabolism, 2012, 13(3): 257-271.
[3] Hartwig A. Metal interaction with redox regulation: an integrating concept in metalcarcinogenesis[J]. Free RadicBiol Med, 2013, 55: 63-72.
[4] Person RJ, Tokar EJ, Xu Y, et al. Chronic cadmium exposure in vitro induces cancer cell characteristics in human lung cells[J]. ToxicolApplPharmacol, 2013, 273(2): 281-288.
[5] Lin YS, Caffrey JL, Lin JW, et al. Increased risk of cancer mortality associated with cadmium exposures in older Americans with low zinc intake[J]. J Toxicol Environ Health, 2013, 76 (1): 1-15.
[6] Wang B, Du Y. Cadmium and its neurotoxic effects[J]. Oxid Med Cell Longev, 2013, 2013: 898034.
[7] Jiang LF, Yao TM, Zhu ZL, et al.Impacts of Cd(II) on the conformation and self-aggregation of Alzheimer′s tau fragment corresponding to the third repeat of microtubule-binding domain [J]. BiochimBiophysActa, 2007, 1774 (11): 1414-1421.
[8] Frank Thévenod.Cadmium and cellular signaling cascades: To be or not to be[J].Toxicology and Applied Pharmacology,2009,238(3):221-239.
[9] Herskowitz I. MAP kinase pathways in yeast: for mating and more[J]. Cell, 1995,80(2): 187-197.
[10]Seger R, Krebs E.The MAPK signaling cascade[J].The FASEB journal, 1995, 9(9): 726-735.
[11]Kyriakis JM, AvruchJ. Proteinkinasecascadesactivated by stressand inflammatorycytokines[J]. BioEssays, 1996, 18(7): 567-577.
[12]阮海华, 李西川, 兰蓓, 等. 高渗透压甘油(HOG)信号转导途径[J]. 细胞生物学杂志,2006,28(5):651-655.
[13]Leng G, Song K. Direct interaction of Ste11 and Mkk1/2 through Nst1 integrates high-osmolarity glycerol and pheromone pathways to the cell wall integrity MAPK pathway[J]. FEBS Letter, 2016, 590(1):148-160.
[14]Xiong B, Zhang L, Xu H, et al. Cadmium induces the activation of cell wall integrity pathway in budding yeast[J]. Chemico-Biological Interactions, 2015, 240:316-323.
[15]Jiang L, Cao C, Zhang L, et al.Cadmium-induced activation of high osmolarity glycerol pathway through its Sln1 branch is dependent on the MAP kinase kinasekinase Ssk2, but not its paralog Ssk22, in budding yeast[J].FEMS Yeast Research, 2014, 14(8):1263-1272.
[16]David E. Levin. Cell Wall Integrity Signaling inSaccharomycescerevisiae[J].Microbiology And Molecular Biology Reviews,2005,69(2): 262-291.
诚征广告
《微生物学杂志》由中国微生物学会、辽宁省微生物学会、辽宁省微生物科学研究院主办,为中国科技论文核心期刊、中国生物学核心期刊,被美国《化学文摘(CA)》、《英联邦农业文摘(CAB)》、《中国生物学文摘》、中国科学引文数据库、CNKI中国期刊全文数据库、中国核心期刊(遴选)数据库等国内外重要检索刊物及数据库摘引和收录,是包括工业微生物学、农业微生物学、医学微生物学、兽医微生物学、生物质资源、食用菌学、生物工程学、加工技术及各相关领域的综合性刊物,是国内外科研人员、大中专院校师生、企业人士、医生及生物学爱好者必读的刊物。
《微生物学杂志》创刊于1978年,国内外发行,双月刊。发行面覆盖国内各地的图书馆、科研院所、高校、企业、医院及港、澳、台、北美、澳州、西欧、日本、东南亚等地。
本刊于2013年全面改版升级。目前诚征广告业务,真诚欢迎国内外厂商和读者来此发布产品、技术和服务信息,刊登试验及生产设备、仪器、试剂等各方面的广告。
地址:辽宁省朝阳市双塔区龙山街四段820号《微生物学杂志》编辑部
邮编:122000 信箱:lnwswxh@126.com
帐户:工行朝阳市燕都支行 户名:辽宁省微生物学会
帐号:0713020209249067528
电话:0421-2976841 0421-2914613 联系人:孙翠焕
Regulation of MAPK Protein Kinase Slt2 by Protein Phosphatase Msg5 under Cadmium Coercion
XIA Jing, JIANG Ling-huo
(Schl.ofBiotech.,theNat’lEngin.Lab.forCerealFerment’nTechnol.,JiangnanUni.,Wuxi214122)
Cadmium ion is an inessential metal ion for human body, yet oncogenic. It could seriously affect the growth, development and reproduction of organisms. Mitogen-activate protein kinases (MAPKs) are important signaling molecules regulating cell survival, proliferation and differentiation. The cell wall integrity (CWI) pathway is one of the MAPK signaling pathways inSaccharomycescerevisiae, and is involved in the response to cadmium stress. Cadmium stress activates the CWI_MAPK SLT2 and leads to its phosphorylation. There are four protein phosphatases Ptp2, Ptp3, Sdp1 and Msg5 that regulate the phosphorylation of Slt2. However, their functions in cadmium stress are unknown. In this study, six double-gene deletion strains between these four protein phosphatase genes were constructed, and analyzed their genetic interactions in the response to cadmium stress. The data indicated that Msg5 is the major protein phosphatase in the regulation of Slt2 under cadmium stress.
Saccharomycescerevisiae; MAP kinase; Cell wall integrity (CWI) pathway; protein phosphatase; cadmium stress
国家自然科学基金项目 (81371784,81571966);江南大学自主研究计划重点项目(JUSRP51313B);江苏市农业支撑项目(BE2014306)
夏婧 女,硕士研究生。从事酵母遗传学与分子生物学研究。E-mail:1049698379@qq.com
* 通讯作者。男,博士,教授,博士生导师。从事酵母和丝状真菌遗传学与分子生物学研究。E-mail:linghuojiang@jiangnan.edu.cn
2016-03-07;
2016-03-31
Q814
A
1005-7021(2016)06-0017-07
10.3969/j.issn.1005-7021.2016.06.003

