阿哌沙班片溶出度测定方法研究
郭兆元, 聂忠莉, 胡一冰, 曾 吉, 王晓玲,叶 丁, 张 勇, 萧茂玲, 郭 瑞
(1.成都大学 四川抗生素工业研究所, 四川 成都 610052;2.成都大学 药学与生物工程学院, 四川 成都 610106;3.成都克莱蒙医药科技有限公司, 四川 成都 610041)
阿哌沙班片溶出度测定方法研究
郭兆元1, 聂忠莉2, 胡一冰2, 曾 吉2, 王晓玲3,叶 丁3, 张 勇3, 萧茂玲3, 郭 瑞3
(1.成都大学 四川抗生素工业研究所, 四川 成都 610052;2.成都大学 药学与生物工程学院, 四川 成都 610106;3.成都克莱蒙医药科技有限公司, 四川 成都 610041)
建立了以高效液相色填充谱法测定阿哌沙班片溶出度的测定方法,采用0.1%CTAB-pH 6.8的磷酸盐缓冲溶液900 mL为溶出介质,温度为37 ℃±0.5 ℃,转速为75 r/min,溶出介质经脱气处理,取样时间为30 min.结果显示,6批供试品及对照药品30 min的溶出度均在80%以上,均符合规定.方法专属性强,灵敏度高,结果准确,可用于测定阿哌沙班片的溶出度.
阿哌沙班片;溶出度;高效液相色谱法
0 引 言
阿哌沙班是一类新型的强效可逆性凝血因子抑制剂.据报道,阿哌沙班已完成预防全髋关节和全膝关节成形术后静脉血栓栓塞(VTE)的相关临床试验,并于2011年5月得到欧盟对其用于此适应症的上市许可[1-2].目前,阿哌沙班被广泛用于针对术后静脉血栓栓塞(VTE)的治疗[3]、预防重病住院患者出现VTE与房颤患者[4],以及其他血栓栓塞事件的Ⅲ期临床试验研究[5-6].药品溶出度试验作为一种模拟固体口服制剂在胃肠道中崩解和溶出的体外试验方法,常被作为一种体外替代方法为体内生物等效性研究和体内外相关性研究提供信息和指导[7]。此外,溶出度试验还被作为小分子药物的质量控制手段,用来保证产品批间的一致性以及后续的上市产品与临床实验样品的一致性.贮藏过程中,产品溶解速率的变化体现出固体口服制剂稳定性的差异,因此,溶出度试验在药物固体口服制剂的研发过程中具有重要的作用[8].本研究依据《化学药物制剂研究技术指导原则》、《化学药物质量标准建立的规范化过程技术指导原则》以及《中国药典》2015年版四部通则中有关的指导原则对阿哌沙班片溶出度方法进行了探讨,通过对阿哌沙班片溶出度方法学验证,证明本方法适合阿哌沙班片的溶出度测定,结果准确可靠.
1 仪器与试药
1.1 试 药
实验所用试药包括:阿哌沙班片(供试品,批号,140101、140102、140103、140201、140202、140203),由成都克莱蒙医药科技有限公司提供,阿哌沙班片(对照品,批号,AP130901);十二烷基磺酸钠(AR)、磷酸钠(AR)、磷酸(AR)、十六烷基三甲基溴化铵(CTAB)(AR)、纯化水、醋酸(AR)、盐酸(AR)、乙腈(AR)、三乙胺(AR).
1.2 仪 器
实验所用仪器包括:ZRS-8G型智能溶出试验仪(天津大学无线电厂);ACS-30-JC11型电子秤(广东香山衡器集团有限公司);MS分析天平(梅特勒—托利多);Agilent-1200型液相色谱仪(山东金普分析仪器有限公司);PHS-3C型PH计(上海雷磁仪器厂);TU-1901型紫外可见分光光度计(北京普析通用仪器有限责任公司).
2 方 法
2.1 阿哌沙班片溶出度含量测定方法学研究
2.1.1 测定波长扫描及空白干扰试验.
1)辅料空白溶液的制备.取空白辅料约60 mg(相当于1片的辅料),置100 mL量瓶中,加4 mL乙腈,充分振摇使润湿,超声处理15 min,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,滤过,精密量取1 mL置10 mL量瓶中,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,即得.同法制得在0.05%CTAB-水、0.5%CTAB-pH 4.5的醋酸缓冲液、0.5%CTAB-0.1 mol/L的盐酸溶液中的空白辅料溶液.
2)对照品溶液的制备.精密称取阿哌沙班对照品约11 mg,置于100 mL量瓶中,加4 mL乙腈溶解后,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,精密量取1 mL置于10 mL量瓶中,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,即得.同法制得在0.05%CTAB-水、0.5%CTAB-pH 4.5的醋酸缓冲液、0.5%CTAB-0.1 mol/L的盐酸溶液中的对照品溶液.
3)供试品溶液的制备.精密称取阿哌沙班片粉末约70 mg(相当于阿哌沙班10 mg),置于100 mL量瓶中,加4 mL乙腈,充分振摇使润湿,超声处理15 min,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,滤过,精密量取1 mL置于10 mL量瓶中,加0.1%CTAB-pH 6.8的磷酸缓冲液稀释至刻度,摇匀,即得.同法制得在0.05%CTAB-水、0.5%CTAB-pH 4.5的醋酸缓冲液、0.5%CTAB-0.1 mol/L的盐酸溶液中的供试品溶液.
分别取上述溶液在200~400 nm波长范围内扫描.结果表明,4种溶出介质中阿哌沙班对照品和供试药品均在270±5 nm波长处有最大吸收,辅料在此范围内无明显吸收峰,表明辅料不干扰该法测定.因此,将270 nm作为阿哌沙班溶出度测定的检测波长.
2.1.2 色谱条件.
阿哌沙班溶出度检测的色谱条件为:除检测波长为270 nm外,用十八烷基硅烷键合硅胶为填充剂,柱温为35 ℃,以水(1 000 mL水,加入三乙胺1 mL,用磷酸调pH值至3.0)—乙腈(45∶55)为流动相,流速为1.0 mL/min;理论板数按阿哌沙班主峰计算不低于5 000.
2.1.3 线性关系考察.
取阿哌沙班对照品约11 mg,加4 mL乙腈溶解后,用0.1%CTAB-pH 6.8的磷酸盐缓冲溶液稀释并制成每1 mL含阿哌沙班0.11 mg的溶液,作为储备液.分别精密量取储备液适量,加0.1%CTAB-pH 6.8的磷酸盐缓冲溶液稀释成表1所示浓度,摇匀,分别进样测定.以对照溶液的浓度为横坐标,以峰面积为纵坐标,进行线性回归处理.计算回归方程及相关系数,结果见表1及图1.

表1 溶出度线性实验结果

图1 阿哌沙班片溶出度线性图
实验结果表明,阿哌沙班在0.61 μg/mL~19.90 μg/mL浓度范围内,其浓度与吸收度呈良好线性关系.
2.1.4 重复性实验.
取线性实验项下5号样品(10.85 μg/mL),重复进样6次,记录图谱,按外标法以峰面积计算测定,结果见表2.

表2 重复性实验结果
实验结果表明,阿哌沙班样品溶出度测定重复性良好.
2.1.5 稳定性考察.
取线性实验项下5号样品(10.85 μg/mL),室温放置,分别于0、30、60、90、120、180、240、360 min取样,测定,并计算RSD(%)值,结果见表3.
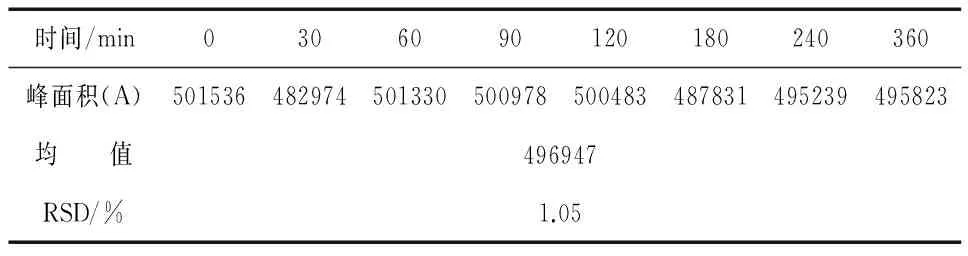
表3 稳定性实验结果
实验结果表明,阿哌沙班样品在360 min内保持稳定.
2.1.6 回收率实验.
取阿哌沙班对照品11 mg,精密称定,置100 mL量瓶中,加少量乙腈使其溶解,用0.1%CTAB-pH6.8的磷酸盐缓冲溶液稀释至刻度,作为储备液.分别精密量取2.0、4.0、6.0、8.0、10.0 mL溶液置于100 mL量瓶中,再按处方比例加入空白辅料,模拟溶出条件使其溶解,用0.1%CTAB-pH 6.8的磷酸盐缓冲溶液稀释至刻度,滤过,取续滤液,制得供试品溶液.另取上述储备液适量,用pH 6.8的磷酸盐缓冲溶液稀释并制成每1 mL含阿哌沙班11 μg/mL的溶液,摇匀,制得对照品溶液.
取上述对照品溶液和供试品溶液10 μL,注入液相色谱仪,记录图谱,按外标法以峰面积计算其回收率,结果见表4.

表4 溶出度测定回收率实验结果
实验结果表明,阿哌沙班样品回收率良好,方法可靠.
2.2 溶出度实验方法研究
2.2.1 溶出介质确定.
取供试药品6片,按照溶出度测定法(《中国药典》2015年版四部 通则0931),采用桨法,以900 mL 0.05%CTAB-水、0.5%CTAB-pH 4.5的醋酸缓冲液、0.5%CTAB-0.1 mol/L的盐酸溶液、0.1%CTAB-pH 6.8的磷酸缓冲液作为溶出介质,温度为37 ℃±0.5 ℃,溶出介质均经脱气处理,转速为75 r/min,分别在5、10、15、30、45、60、90、120 min时取样10 mL,并补加等温等体积的溶出介质10 mL,滤过,取续滤液作为供试品溶液.另取阿哌沙班对照品适量,用相应的溶出介质溶解并稀释制成每1 mL中含阿哌沙班11 μg的溶液,摇匀,作为对照品溶液.除检测波长为270 nm外,按照含量测定项下色谱条件测定,取上述种溶液10 μL,注入液相色谱仪,记录图谱,计算出每片不同时间的累计百分溶出度,计算公式为,

测定结果如表5及图2所示.
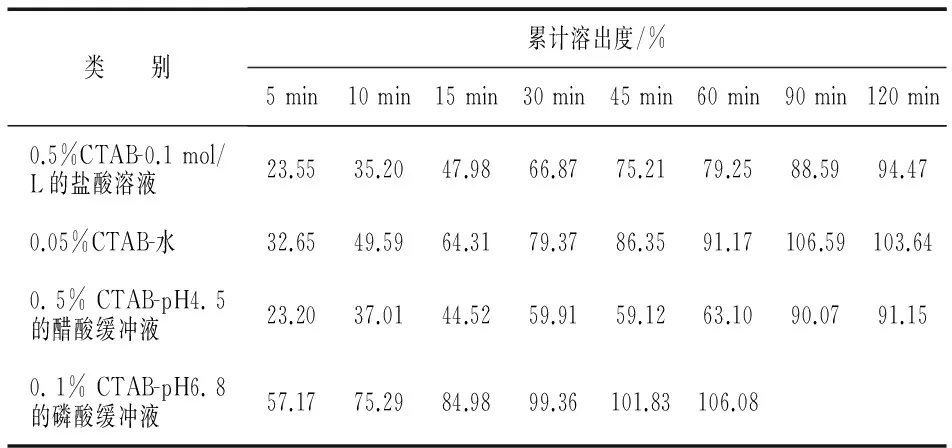
表5 供试品在不同溶出介质中的累积溶出度测定结果(n=6)
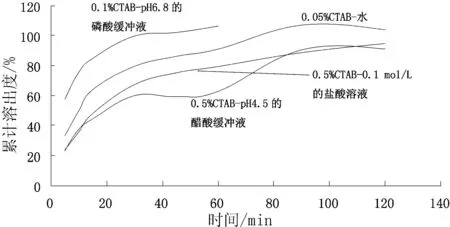
图2 不同溶出介质的溶出曲线比较图
由上述结果可知,本品在0.1%CTAB-pH 6.8的磷酸盐缓冲溶液中的溶出最快.因此,选择0.1%CTAB-pH 6.8的磷酸盐缓冲溶液作为本品的溶出介质.
2.2.2 溶出体积选择.
取阿哌沙班原料药约10 mg置于250 mL量瓶中加0.1%CTAB-pH 6.8的磷酸盐缓冲溶液100 mL振摇5 min,结果未完全溶解,再加入0.1%CTAB-pH 6.8的磷酸盐缓冲溶液50 mL,振摇5 min,完全溶解,即10 mg阿哌沙班能完全溶解于150 mL 0.1%CTAB-pH 6.8的磷酸盐缓冲溶液中,符合漏槽条件的溶液体积至少应为450 mL.因此,将溶出介质的体积暂定为900 mL.
2.2.3 溶出转速选择.
取供试药品6片,按照溶出度测定法(《中国药典》2015年版四部 通则0931),以900 mL的0.1%CTAB-pH 6.8的磷酸盐缓冲溶液作为溶出介质,转速分别为50 r/min和75 r/min,温度为37 ℃±0.5 ℃,溶出介质均经脱气处理,分别在5、10、15、30、45、60 min时取样10 mL,并补加等温等体积的溶出介质10 mL,滤过,取续滤液作为供试品溶液.另取阿哌沙班对照品适量,用相应的溶出介质溶解,并制成每1 mL含阿哌沙班15 μg的溶液,摇匀,作为对照品溶液.除检测波长为270 nm外,按照含量测定项下色谱条件测定,取上述种溶液10 μL,注入液相色谱仪,记录图谱,计算出每片不同时间的累计百分溶出率.
测定结果见表6,溶出曲线比较如图3所示.

图3 不同转速的溶出度曲线比较图
由上述结果可知,供试药品在相同的取样时间点,75 r/min的溶出速率总体稍高于50 r/min的溶出速率,故选择转速为75 r/min.
2.2.4 取样时间选择.
对于普通制剂,在大多数情况下,药品标准中采用单点控制即可,取样时间点一般为30~60 min,溶出限度通常应在70%~不少于85%.从本品的溶出曲线可以看出,15 min时溶出限度就已经达到85%左右,因此选取30 min为取样点.
2.2.5 阿哌沙班片溶出度测定方法确定.
根据以上实验结果,将阿哌沙班片溶出方法确定为:取本品,按照溶出度测定法(《药典》2015年版四部 通则0931),以0.1%CTAB-pH 6.8的磷酸盐缓冲溶液900 mL为溶出介质,转速为75 r/min,经30 min时,取溶液10 mL,滤过,取续滤液作为供试品溶液.另精密称取阿哌沙班对照品适量,加0.1%CTAB-pH6.8的磷酸盐缓冲溶液制成每1 mL含11 μg的溶液,作为对照品溶液.按照高效液相色谱法(《药典》2015年版二部附录ⅤD)测定:用十八烷基硅烷键合硅胶为填充剂,柱温为35 ℃,以水(1 000 mL水,加入三乙胺1 mL,用磷酸调pH值至3.0)-乙腈(45∶55)为流动相,流速为1.0 mL/min,检测波长为270 nm.精密量取对照品溶液10 μL,注入液相色谱仪,记录色谱图,理论板数按阿哌沙班主峰计算不低于5 000.精密量取对照品溶液和供试品溶液各10 μL,注入液相色谱仪,按外标法以峰面积计算每片溶出量,限度为标示量的80%.
2.3 溶出度测定结果
依据上述溶出度测定法,测定6批供试品的溶出度,结果见表7.

表7 溶出度检查结果
由表7结果可知:6批供试品及对照药品30 min的溶出度均在80%以上,均符合规定.
3 结 论
通过对阿哌沙班片溶出度含量检测方法和溶出度实验方法的研究,建立了可控制其质量的溶出度测定方法.该方法操作方便快捷,测量结果准确.
[1]黄仲义.口服凝血因子Xa直接抑制剂阿哌沙班的临床药理学[J].中国新药与临床杂志,2013,32(7):530-533.
[2]Wong P C,Crain E J,Xin B,et al.Apixaban,anoral,directandhighlyselectivefactorXainhibitor:invitro,antithromboticandantihemostaticstudies[J].J Thromb Haemost,2008,6(5):820-829.
[3]刘羽,戴德银,陈路佳,等.阿哌沙班防治静脉血栓栓塞概述[J].中国药业,2015,24(24):251-253.
[4]田国祥,编译.阿哌沙班在心房颤动患者中的应用[J].中国循证心血管医学杂志,2011,3(1):33-33.
[5]王磊,钟静芬,时惠麟.口服Xa因子直接抑制剂阿哌沙班的临床研究进展[J].上海医药,2012,33(17):17-20.
[6]黄仲义.口服凝血因子Xa直接抑制剂阿哌沙班的临床药理学[J].中国新药与临床杂志,2013,32(7):530-533.
[7]Haidar S H,Davit B,Chen M L,et al.Bioequivalenceapproachesforhighlyvariabledrugsanddrugproducts[J].Pharm Res,2008,25(1):237-241.
[8]Zhang H,Yu L X.Dissolutiontestingforsolidoraldrugproducts:theoreticalconsiderations[J].Am Pharm Rev,2004,7(5):26-30.
Study on Dissolution Determination Method of Apixaban
GUOZhaoyuan1,NIEZhongli2,HUYibing2,ZENGJi2,WANGXiaoling3,YEDing3,ZHANGYong3,XIAOMaoling3,GUORui3
1.Sichuan Industrial Institute of Antibiotics, Chengdu University, Chengdu 610052, China;2.School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China;3.Chengdu Climb Phamaceutical Technology Co., Ltd., Chengdu 610041, China)
The paper is going to establish a method of dissolution determination of Apixaban.The establishment of the determination method for dissolution of Apixaban tablets is based on High Performance Liquid Chromatography.Phosphate buffer solution of 0.1% CTAB-pH 6.8 is used as dissolution medium which is degassed at 37±0.5 ℃,with the rotate speed of 75 r/min and the sampling time of 30 min.The results show that the dissolution of six batches of test samples and reference drug is over 80% in 30 min.It is in compliance with the regulations.The method can be used to determine the dissolution of Apixaban tablets with its selective,sensitive and accurate traits.
Apixaban tablets;dissolution;High Performance Liquid Chromatography(HPLC)
1004-5422(2016)04-0317-04
2016-11-02.
郭兆元(1991 — ), 男, 硕士研究生, 从事药物制剂与分析研究.
R927.11
A

