葡萄糖发酵液在双室光电化学池的制氢研究
钟宜霏, 闫康平, 孙 艳
(1.四川大学 化学工程学院, 四川 成都 610065; 2.成都大学 机械工程学院, 四川 成都 610106)
葡萄糖发酵液在双室光电化学池的制氢研究
钟宜霏1, 闫康平1, 孙 艳2
(1.四川大学 化学工程学院, 四川 成都 610065; 2.成都大学 机械工程学院, 四川 成都 610106)
将酵母接种于葡萄糖培养基中连续发酵,采用高速回转离心机分离酵母得到葡萄糖发酵液,并将其作为以TiO2纳米管为光阳极的双室光电化学池的阳极电解液,在无任何外加电压条件下制备氢气.通过光催化制氢及光电化学性能测试,系统地研究了葡萄糖发酵液发酵时间对TiO2纳米管产氢速率、光电压与光电流密度的影响.实验结果表明,TiO2纳米管的光电化学性能受酵母培养基发酵时间影响,并随着发酵时间的延长而升高,将酵母培养基发酵48 h时,TiO2纳米管产氢速率达到21.3 μmol/(cm2·h),比未发酵时增加2.13倍.
酵母;葡萄糖培养基;TiO2纳米管;制氢
0 引 言
随着能源危机以及使用传统能源带来的环境污染问题的日益加剧,寻求和开发可再生能源显得格外重要[1].利用太阳能分解水制氢因其直接且反应体系简单而受到相关科研人员的广泛关注[2].目前,以TiO2为光催化剂,利用太阳能光解水制氢的体系主要分为粉末悬浮体系、光电催化体系及双室光电化学池体系3种.其中,双室光电化学池制氢体系被大多数研究者认为是最为有效的光解水制氢方法[3-7].然而,TiO2光生电子—空穴对复合率高,通常需向反应体系中添加电子给体来不可逆地消耗空穴,以降低电子—空穴对的复合率,进而提高TiO2的光电转换效率和产氢速率.电子给体通常为易溶于水且易被氧化的物质,比如醇类、醛类、EDTA等[8-14],其中以醇类居多.由于甲醇、乙醇、甘油等醇类物质结构简单,易被氧化,且可通过生物质能转化而来,属于可再生的资源,因此可大规模地应用于光解水制氢.例如,Lianos[15]详细介绍了醇—水电解液体系中光解水的反应机理,醇作为电子给体在酸性电解液中生成CO2.
生物发酵制作乙醇作为生物质燃料和原料的主要发展领域之一,成本低廉,方便制取,是生产乙醇的一种重要手段[16-17].本研究拟以经过酵母发酵后含有乙醇的葡萄糖发酵液作为阳极电解液,构建双室光电化学池体系,探究不同发酵时间的发酵液对TiO2纳米管光电特性与产氢性能的影响,为太阳能光解水制氢提供一种新思路.
1 实验及测试
1.1 样品制备
1)采用6 cm×0.5 cm的Ti箔试片(纯度99.6%,厚度2 cm,宝鸡蕴杰金属制片有限公司),使用阳极氧化法,以Pt作阴极,电解液使用乙二醇+2 v% H2O+0.25 wt% NH4F混合液,保持外加恒压60 V,氧化时间1 h,在室温下制备出无定型TiO2纳米管,马弗炉450 ℃退火热处理1 h,制得TiO2纳米管电极.
2)采用工业用耐高温酿酒活性干酵母(湖北安琪酵母股份有限公司),取3 g干酵母在温度为35 ℃且含2.5 g葡萄糖的自来水中复活20 min作种子液,倒入260 mL培养液中分别培养6、12、24、36、48 h,培养液组成如表1所示.
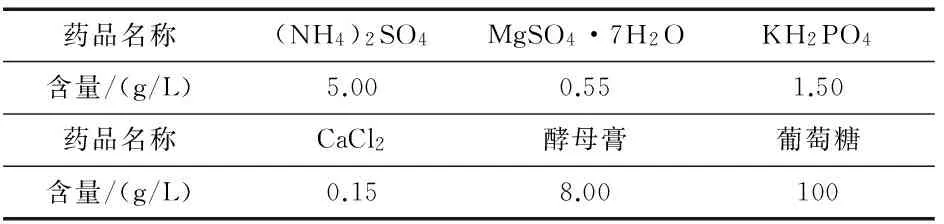
表1 酵母培养基组成
发酵期间通过向培养液中加入葡萄糖使溶液中葡萄糖含量维持稳定,培养后用TG-17型台式高速离心机分离酵母,将得到的上清液作为阳极电解液,该溶液pH值为4.0,取样将一定体积的溶液用密度仪(DMA 4500/5000,奥地利Anton Paar公司生产)测定乙醇浓度,并由此计算出发酵液中乙醇浓度.
1.2 性能表征
光电化学性能的测试在一带有石英窗口的双室光电化学池中进行(见图1).测试采用标准的3电极测试体系:以TiO2纳米管试片作为工作电极(有效面积,0.5 cm×2.0 cm),饱和甘汞电极(SCE)为参比电极,Pt电极为对电极.同时,通过电化学工作站(Princeton Applied Research Versa STAT3)连接计算机,测定模拟太阳光条件下光电化学池的光电化学性能,包括开路电位—时间曲线,瞬态光电流—时间曲线.所有光照测试均采用350 W球形氙灯模拟太阳光光源,其光照的功率密度为150 W/cm2.

图1 光电性能测试光电示意图
实验中,酵母葡萄糖发酵液作为阳极电解液的双室光电化学池制氢性能测试在改进的双室光电解槽中进行,该电解槽被全氟羧酸/磺酸复合离子交换膜(Nafion膜)分为阴极室和阳极室,两室中分别填充等量0.5 mol/L的H2SO4和葡萄糖发酵液.TiO2纳米管(有效面积,0.5 cm×2.0 cm)作为阳极,Pt电极作为阴极,两电极之间以导电铜线连接形成电子回路.采用排水集气法,以一带有刻度的倒置试管在Pt电极一侧收集氢气,通过液面的变化可直接读取氢气体积.
2 结果与讨论
1)通过密度仪测定的葡萄糖发酵液中乙醇浓度随时间变化曲线如图2所示.
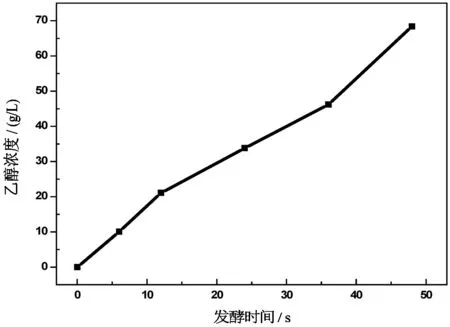
图2 葡萄糖发酵液中乙醇浓度随时间变化关系
由图2可知,6 h时,发酵液中乙醇含量大幅提高至10.1 g/L,而后42 h内,乙醇含量持续增加,每12 h内增加量在11~13 g/L之间,48 h时,葡萄糖发酵液中的乙醇含量达到最高,为68.4 g/L.
2)TiO2纳米管电极在不同发酵时间的电解液中测得的开路电位随时间的变化曲线如图3所示,光照间隔为100 s.
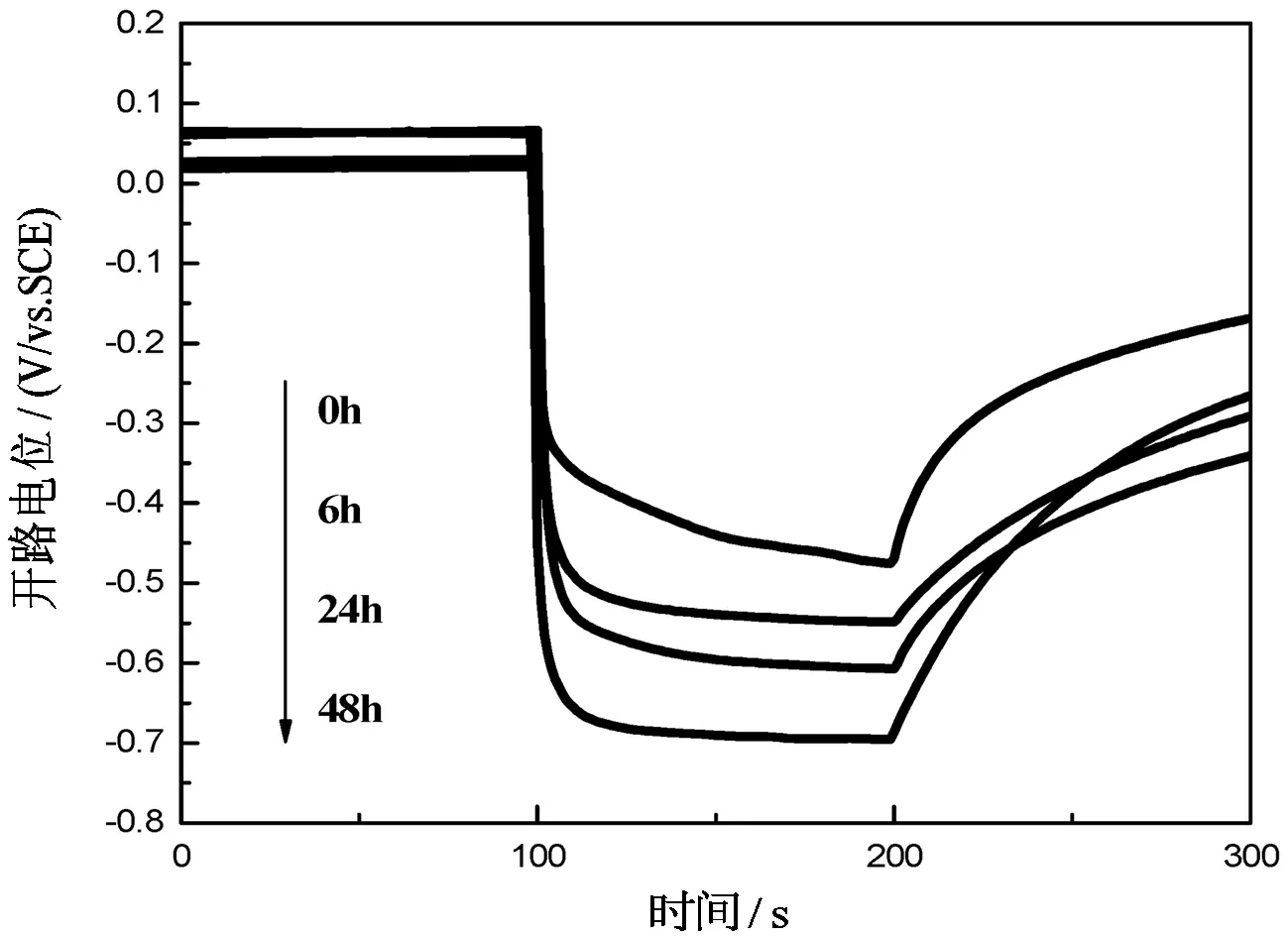
图3 TiO2纳米管电极在发酵液中不同发酵时间的开路电位曲线
由图3可知,无光照时,TiO2纳米管电极在不同发酵液中的开路电位较接近,在0~0.06 V(vs SCE)之间波动.光照瞬间,TiO2纳米管电极的开路电位迅速发生负移,其中,在培养基中测得的光照开路电位持续增大,而在发酵液中测得的光照开路电位均保持稳定,此显示了TiO2纳米管电极在发酵液中良好的光电响应性能优于培养基.
根据公式,V=Vdark-Vlight,可计算出TiO2纳米管在发酵液中不同时间的光电压值.由图3可知,以未经发酵的培养基为电解液时,TiO2的光电压较小,约为0.35 V;当将培养基发酵6 h时,光电压大幅升至0.54 V,比未发酵时的光电压值提高了54%.随着发酵时间的增加,光照时TiO2纳米管的开路电位不断负移,光电压值不断增大.当发酵时间为48 h时,TiO2纳米管的光电压高达0.7 V,是在培养基中光电压的2倍.结果表明,乙醇的存在促使了光生电子—空穴对的有效分离,发酵液中较低浓度的乙醇即可大大提高TiO2纳米管的光电压.
3)在无外加电压时,不同发酵时间的发酵液作为阳极电解液进行瞬时光电流测试的结果如图4所示.

图4 TiO2纳米管电极在不同发酵时间发酵液中的瞬时光电流
由图4可知,暗态条件下,TiO2纳米管在不同发酵液中的电流较接近,几乎为0(微安数量级),光照条件下,光电流急剧增大,30 s后再次挡光,光电流又很快下降至零.当电解液为未经发酵的培养基时,TiO2纳米管的光电流密度为0.75 mA/cm2.当电解液发酵6 h后,光电流密度提高到1.25 mA/cm2.随着发酵时间的增加,光电流不断增大,当发酵时间为48 h时,光电流增至2.05 mA,是TiO2纳米管电极在培养基电解液中的光电流的2.7倍.由此可见,随着发酵时间的延长,乙醇在反应体系中充当了电子给体,消耗了部分空穴,从而有效地抑制了光生电子—空穴对的复合,使电子传输效率得到提高,TiO2纳米管的光电流也随之显著提高.
4)葡萄糖发酵液中TiO2纳米管的光催化活性可以其在双室光电化学池中的产氢速率来评估.本研究的双室系统利用葡萄糖发酵液中的乙醇为电子给体,协同光照TiO2纳米管产生的光电压,在无任何外加电压情况下,即可有效制备氢气.分别光照60 min收集氢气,得到不同发酵时间的发酵液中单位面积TiO2纳米管产氢速率结果如图5所示.
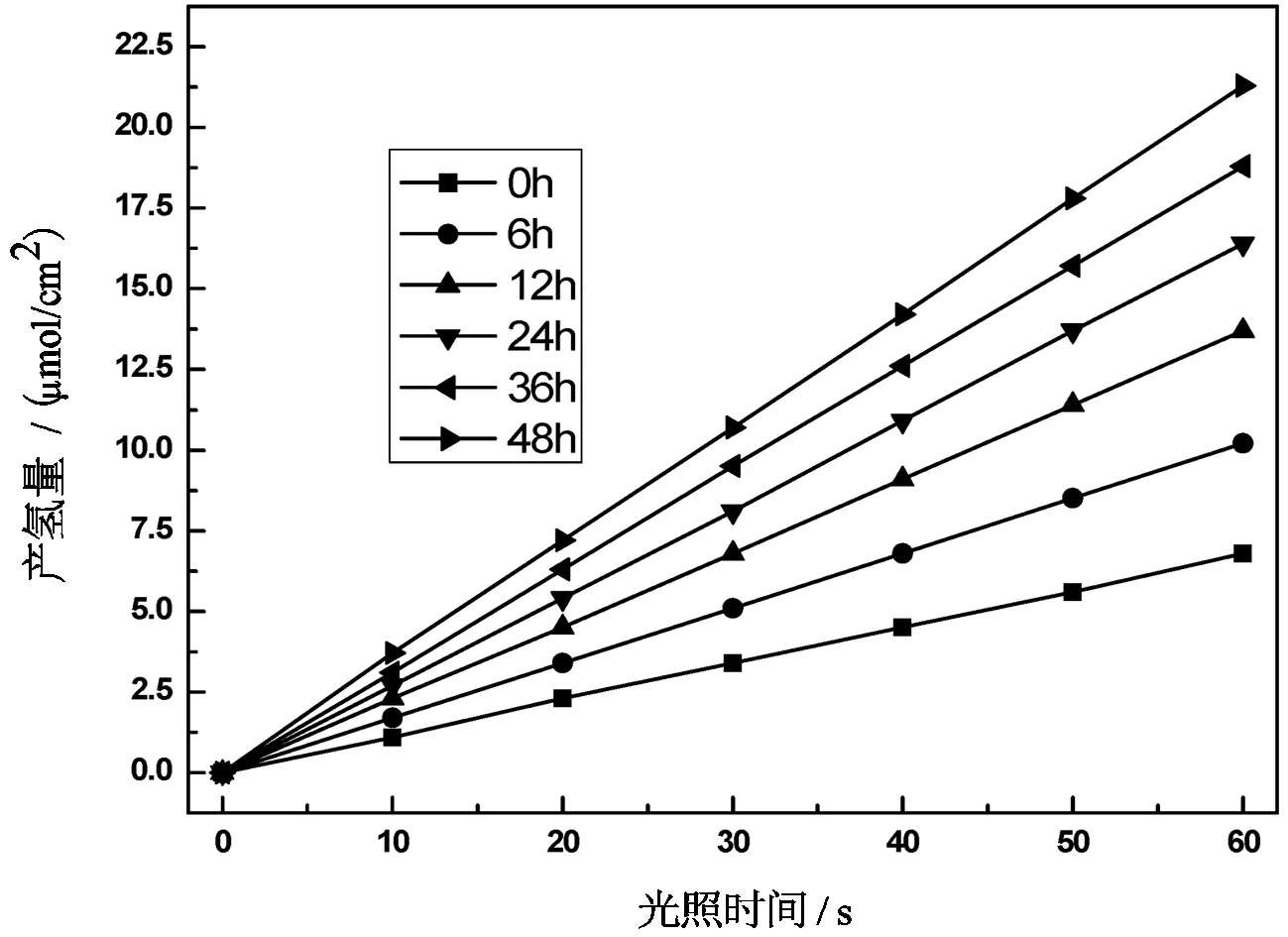
图5 TiO2纳米管电极在不同发酵时间发酵液中的
产氢量与光照时间关系
由图5可知,TiO2纳米管电极在不同发酵时间发酵液中的产氢量与光照时间呈良好的线性关系,产氢量随着光照时间呈正比例增加.此表明,TiO2纳米管电极在以葡萄糖发酵液为阳极电解液的双室光电化学池中的制氢反应是稳定进行的.随着发酵时间的延长,单位面积产氢速率逐渐升高,当阳极电解液未发酵时,TiO2纳米管在酵母培养基中的产氢速率为6.8 μmol/h,当阳极电解液发酵6 h时,TiO2纳米管的产氢量得到明显提高,相对未发酵电解液的产氢量提高了50%.其后,随着发酵时间的延长,体系的产氢速率也逐渐增大,当发酵48 h时,产氢速率达到最大值21.3 μmol/h,为TiO2纳米管电极在培养基电解液中产氢速率的3.1倍.发酵液中的乙醇在酸性介质与光生空穴反应最终转化为CO2,随着发酵时间延长,乙醇的增加使之不可逆地消耗光生空穴,提高了光生载流子的分离效率,产氢速率也随之增大,该结果与TiO2纳米管在葡萄糖发酵液中的光电化学性能测试结果吻合.
3 结 论
本研究采用酵母葡萄糖发酵液为双室光电化学池的阳极电解液,在无外加偏压条件下成功制备了氢气.通过光电性能及制氢性能测试,对比研究了不同发酵时间的发酵液中TiO2纳米管电极的光催化活性.实验结果表明,葡萄糖发酵液的发酵时间对体系光催化活性有重要影响.酵母在培养基中发酵48 h内,TiO2纳米管的光电化学性能及产氢性能均随发酵时间的延长而升高.以酵母培养基为阳极电解液时,无外加电压条件下,双室光电化学池的产氢速率为6.8 μmol/(cm2·h),而将酵母培养基发酵48 h时,双室光电化学池产氢速率达到21.3 μmol/(cm2·h),增加了2.13倍.
[1]Bak T, Nowotny J,Rekas M,et al.Photo-electrochemicalhydrogengenerationfromwaterusingsolarenergymaterials-relatedaspects[J].Int J Hydrogen Energ,2002,27(10):991-1022.
[2]上官文峰.太阳能光解水制氢的研究进展[J].无机化学学报,2001,17(5):619-626.
[3]Aroutiounian V M,Arakelyan V M,Shahnazaryan G E.Metaloxidephotoelectrodesforhydrogengenerationusingsolarradiation-drivenwatersplitting[J].Solar Energ,2005,78(5):581-592.
[4]Antoniadou M,Kondarides D Ι,Labou D,et al.Anefficientphotoelectrochemicalcellfunctioninginthepresenceoforganicwastes[J].Solar Energ Mat Solar Cells,2010,94(3):592-597.
[5]Arakelyan V M,Aroutiounian V M,Shahnazaryan G E,et al.Thinfilmn-titaniumoxidephotoanodesforphotoelectrochemicalproductionofhydrogen[J].Renew Energ,2008,33(2):299-303.
[6]Antoniadou M,Lianos P.Photoelectrochemicaloxidationoforganicsubstancesovernanocrystallinetitania:optimizationofthephotoelectrochemicalcell[J].Catal Today,2009,144(1):166-171.
[7]Ampelli C,Centi G,Passalacqua R,et al.Synthesisofsolarfuelsbynovelphotoelectrocatalyticapproach[J].Energ Environ Sci,2010,3(3):292-301.
[8]Nada A A,Barakat M H,Hamed H A,et al.StudiesonthephotocatalytichydrogenproductionusingsuspendedmodifiedTiO2photocatalysts[J].Int J Hydrogen Energ,2005,30(7):687-691.
[9]Kandiel T A,Dillert R,Robben L,et al.Photonicefficiencyandmechanismofphotocatalyticmolecularhydrogenproductionoverplatinizedtitaniumdioxidefromaqueousmethanolsolutions[J].Catal Today,2011,161(1):196-201.
[10]Lu H,Zhao J,Li L,et al.SelectiveoxidationofsacrificialethanoloverTiO2-basedphotocatalystsduringwatersplitting[J].Energ Environ Sci,2011,4(9):3384-3388.
[11]Halasi G,Ugrai I,Solymosi F.PhotocatalyticdecompositionofethanolonTiO2modifiedbyNandpromotedbymetals[J].J Catal,2011,281(2):309-317.
[12]Galin′ska A,Walendziewski J.PhotocatalyticwatersplittingoverPt-TiO2inthepresenceofsacrificialreagents[J].Energ Fuels,2005,19(3):1143-1147.
[13]Siemon U,Bahnemann D,Testa J J,et al.HeterogeneousphotocatalyticreactionscomparingTiO2andPt/TiO2[J].J Photochem Photobiol A,2002,148(1-3):247-255.
[14]Antoniadou M,Bouras P,Strataki N,et al.Hydrogenandelectricitygenerationbyphotoelectrochemicaldecompositionofethanolovernanocrystallinetitania[J].Int J Hydrogen Energ,2008,33(19):5045-5051.
[15]Lianos P.ProductionofelectricityandhydrogenbyphotocatalyticdegradationoforganicwastesinaphotoelectrochemicalcelltheconceptofthePhotofuelcell:Areviewofare-emergingresearchfield[J].J Hazard Mater,2011,185(2-3):575-590.
[16]Balat M,Balat H.Recenttrendsinglobalproductionandutilizationofbio-ethanolfuel[J].Appl Energ,2009,86(11):2273-2282.
[17]常春,王铎,王林风,等.高底物浓度纤维乙醇同步糖化发酵工艺的比较[J].化工学报,2012,63(3):935-940.
Hydrogen Production Performance of Glucose Fermentation Broth in Two-compartment Photoelectrochemical Cell
ZHONGYifei1,YANKangping1,SUNYan2
(1.College of Chemical Engineering, Sichuan University, Chengdu 610065, China;2.School of Mechanical Engineering, Chengdu University, Chengdu 610106, China)
In this study,the yeast is inoculated in glucose medium for continuous fermentation.The high-speed rotating centrifuge is used to separate yeast to obtain glucose fermentation solution,which is then used as the anolyte in a two-compartment photoelectrochemical cell with TiO2nanotubes as the anode,and hydrogen is produced without any external voltage.By photocatalytic hydrogen production and PEC performance testing,this paper systematically studies the influence of glucose fermentation time on hydrogen production rate,photovoltage and photocurrent density.The experimental results show that the photoelectrochemical properties of TiO2nanotubes are affected by fermentation time and they increase with the extension of fermentation time.After 48 hours of fermentation,the hydrogen production rate is up to 21.3 μmol/(cm2·h),2.13 times longer than that of the original one which is not fermented.
yeast;glucose medium;TiO2nanotubes;hydrogen production
1004-5422(2016)04-0406-04
2016-09-16.
钟宜霏(1991 — ), 女, 硕士研究生, 从事电化学与新能源材料研究.
TQ116.2;O646
A

