二甲双胍影响人结直肠癌细胞增殖和凋亡的机制研究
王春芳,刘兵,孙光,徐瑜杰,彭勃
(海口市人民医院胃肠外科,海南 海口 570208)
二甲双胍影响人结直肠癌细胞增殖和凋亡的机制研究
王春芳,刘兵,孙光,徐瑜杰,彭勃
(海口市人民医院胃肠外科,海南 海口 570208)
目的 探讨二甲双胍对人结直肠癌细胞增殖、凋亡的影响及其作用机制。方法二甲双胍处理体外常规培养人结直肠癌细胞HCT-15、COLO205,通过MTT检测结直肠癌细胞的生长活力;流式细胞仪检测细胞的周期及凋亡;Western blot检测凋亡相关蛋白Bad、Bcl-2、Cleaved caspase-3及信号通路蛋白Akt、p-Akt、mTOR、p-mTOR、S6K、p-S6K的表达变化。结果不同浓度的二甲双胍作用HCT-15、COLO205细胞72 h后细胞活力明显受到抑制,并呈现浓度依赖性;经流式细胞术分析,二甲双胍能够促使细胞停滞于G0/G1期,同时上调细胞早期及晚期凋亡所占比率;Western blot分析发现,Bad、cleaved caspase-3表达量随着二甲双胍浓度的升高而上调,Bcl-2表达量随着二甲双胍浓度升高而下降;同时,p-Akt及p-mTOR、p-S6K的表达量均明显被抑制,但Akt、mTOR、S6K总蛋白表达量无明显变化。结论二甲双胍能够抑制结直肠癌细胞增殖,促进细胞凋亡;而具体机制可能与抑制Akt及mTOR通路活性有关。
二甲双胍;结直肠癌;细胞增殖;细胞凋亡
人类消化道恶性肿瘤中,结直肠癌(colorectal cancer,CRC)发病率较高,仅次于食管癌和胃癌。由于受到遗传、环境和生活方式等相关因素的影响,我国结直肠癌的发病率呈现逐年增加趋势,成为中国致死率较高的肿瘤之一。结直肠癌患者中早期症状较为隐蔽,多数患者发现时已处中晚期。单纯手术治疗后局部复发和远处转移的发生率高;手术联合放化疗的综合治疗是中晚期直肠癌患者的标准治疗模式[1],但其毒副作用及个体的耐受性限制肿瘤治疗的疗效。
二甲双胍(metformin)是广泛治疗Ⅱ型糖尿病的一线药物。最近发现,其同样具有抗肿瘤的作用[2]。二甲双胍能够降低乳腺癌[3-4]、肠癌[5]及胰腺癌[6]生长。但是,具体的作用机制不详。本研究利用二甲双胍分别干预结直肠癌细胞HCT-15及COLO205细胞,检测二甲双胍对结直肠癌细胞增殖、凋亡的影响并初步探讨可能作用机制,为二甲双胍更好地应用于临床辅助治疗结直肠癌提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 人结直肠癌细胞HCT-15、COLO205购自于中国科学院细胞库;二甲双胍购自于美国Sigma-Aldrich公司;MTT、Annexin V-FITC/PI试剂盒、RIPA组织细胞快速裂解液购自于碧云天生物技术研究所;胎牛血清、RPMI-1640培养基购自美国GIBCO公司;胰蛋白酶购自美国HYCLONE公司;硝酸纤维素膜、发光液为美国Millipore公司;X光胶片购自伊士曼柯达公司;Anti-pan-AKT antibody、Anti-pan-AKT(phospho T308)antibody、Anti-Bax antibody、Anti-Bcl-2 antibody、Anti-p27、Anti-cleaved-caspase-3、Anti-S6K、Anti-S6K(phospho T389)购自英国Abcam公司;GAPDH(14C10)Rabbit mAb购自美国Cell Signaling Technology公司;辣根过氧化酶标记山羊抗兔IgG购自武汉Proteintech公司;其他常用生化试剂均为国产分析纯。
1.1.2 主要仪器 CO2培养箱及Multiskan spectrum全波长酶标仪购自美国Thermo公司;流式细胞仪BD FACSCalibur购自于美国BD公司;超净工作台购自苏州净化设备有限公司;电泳仪、电转移购自美国Bio-Rad公司;水浴锅购自德国Leica公司;暗匣购自深圳市富明威实业有限公司。
1.2 方法
1.2.1 细胞培养及传代 结直肠癌细胞HCT-15、COLO205利用RPMI-1640培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)37℃、5%CO2培养。细胞长至对数生长期,弃去培养液,磷酸盐缓冲液(PBS)冲洗,0.25%胰蛋白酶消化,加培养液吹打均匀成单细胞悬液,按1:3的比例传代培养。
1.2.2 MTT检测 HCT-15、COLO205细胞传于96孔板,37℃、5%CO2培养24 h。分别加入0、5 mmol/L、10 mmol/L、15 mmol/L二甲双胍分别处理72 h,每组设置5复孔。每孔加MTT溶液(5 mg/mL) 20 μL,37℃、5%CO2培养箱孵育4 h。终止培养,小心吸弃孔内培养上清。每孔加150 μL DMSO,震荡10 min,使结晶物充分溶解。全波长多功能酶标仪测定570 nm波长下每孔的吸光值(OD),以DMSO调零,按公式求出各组细胞的活力=(实验组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)×100%。
1.2.3 细胞周期检测 HCT-15、COLO205细胞分别设置:空白对照组、二甲双胍处理组(5 mmol/L、10 mmol/L),作用48 h。收集细胞悬液,1 000 r/min离心5 min,吸取上清液;PBS重悬漂洗细胞;缓慢加入700 μL预冷的乙醇,使乙醇终浓度为70%;4℃固定过夜;1 000 r/min离心5 min,预冷PBS漂洗2次;加入100 μL RNaseA(50 μg/mL),37℃水浴30 min;加入400 μL PI(50 μg/mL),4℃避光染色30 min;流式细胞仪检测。
1.2.4 细胞凋亡检测 HCT-15、COLO205细胞分别设置:空白对照组、二甲双胍处理组(5 mmol/L、10 mmol/L),作用48 h。收集细胞,加入Annexin V-FITC及PI染色,随即进行流式细胞仪检测分析。
1.2.5 Western blot检测 HCT-15、COLO205细胞分别设置:空白对照组、二甲双胍处理组(5 mmol/L、10 mmol/L),电泳,半干式电转至硝酸纤维素膜后,封闭缓冲液(含5%脱脂奶粉TBST),室温封闭1 h,浸于一抗(Akt,1:500、p-Akt,1:500、Bax,1:1 000、Bcl-2,1:800、p27,1:800、cleaved caspase-3,1:800、CyclinD1,1:1 200、S6K,1:1 000、p-S6K,1:500、mTOR,1:800、p-mTOR,1:500)4℃孵育过夜,加羊抗兔二抗(1:10 000)37℃孵育1 h,TBST洗涤3次,采用ECL发光显影,并用Quantity One软件对蛋白条带进行灰度分析。
1.3 统计学方法 应用SPSS13.0统计软件进行数据分析,所有数据用平均值±标准差(±s)表示,各组均数比较采用单因素方差分析(One-Way ANOVA),以P<0.05为差异具有统计学意义。
2 结果
2.1 二甲双胍对结直肠癌细胞增殖影响 不同的浓度二甲双胍(5 mmol/L、10 mmol/L、15 mmol/L)作用HCT-15及COLO205细胞不同浓度72 h后MTT检测细胞活力,与对照组比较细胞活力明显下降,差异有显著统计学意义(P<0.01)。说明二甲双胍能够有效抑制结直肠癌细胞的增殖,见图1。
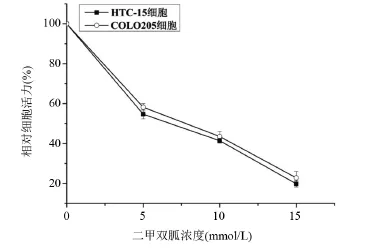
图1 不同浓度的二甲双胍对结直肠癌细胞活力的影响
2.2 二甲双胍对结直肠癌细胞周期影响 利用5 mmol/L、10 mmol/L的二甲双胍分别作用结直肠癌细胞HCT-15、COLO205细胞48 h后,流式细胞术检测周期分布变化。HCT-15对照组G1/G0期细胞所占比率为(42.31±0.28)%、5 mmol/L二甲双胍处理组G1/G0期细胞所占比率为(56.65±0.54)%、10 mmol/L二甲双胍处理组G1/G0期细胞所占比率为(68.92±0.39)%,与对照组比较,5 mmol/L、10 mmol/L的二甲双胍组极显著上调G0/G1期比率(P<0.01)。二甲双胍作用与COLO205细胞的效应与HCT-15类似。说明二甲双胍能够引起结直肠癌细胞G0/G1期停滞,见图2。
2.3 二甲双胍对结直肠癌细胞凋亡影响 5mmol/L、10 mmol/L的二甲双胍分别作用结直肠癌细胞HCT-15、COLO205细胞48 h后,流式细胞术检测细胞凋亡比率变化。HCT-15细胞对照组早期凋亡细胞所占比率为(4.11±0.21)%,5 mmol/L早期凋亡细胞所占比率为(22.83±0.49)%,10 mmol/L早期凋亡细胞所占比率为(47.97±0.35)%,与对照组比较,5 mmol/L、10 mmol/L的二甲双胍组极显著上调细胞早期凋亡比率(P<0.01),并具有浓度依赖性;二甲双胍作用与COLO205细胞的效应与HCT-15类似,见图3。
2.4 二甲双胍对结直肠癌细胞周期蛋白的表达影响 5 mmol/L、10 mmol/L的二甲双胍分别作用结直肠癌细胞HCT-15、COLO205细胞48 h后收集细胞,RIPA裂解细胞,提取蛋白,通过Western blot检测周期蛋白p27及CyclinD1的表达。与对照组比较,CyclinD1的表达量显著降低(P<0.01),p27的表达量显著升高(P<0.01),并呈现浓度依赖性,见图4。
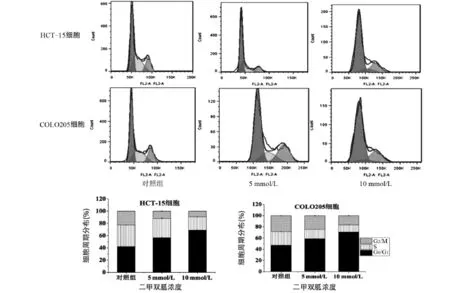
图2 二甲双胍作用48 h后结直肠癌细胞周期分布
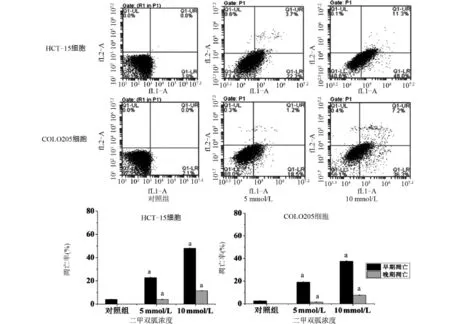
图3 二甲双胍作用48 h后对结直肠癌细胞凋亡的影响
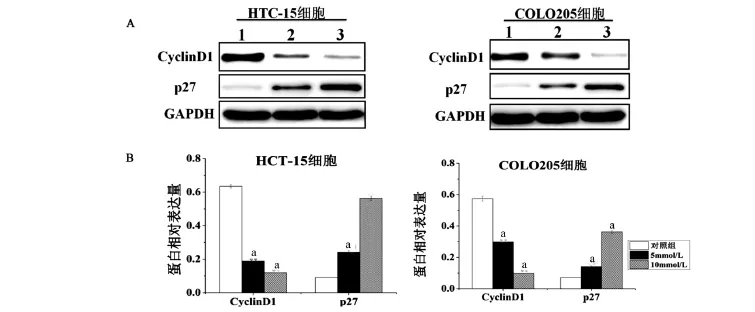
图4 二甲双胍作用48 h对结直肠癌细胞周期蛋白表达的影响
2.5 二甲双胍对结直肠癌细胞Akt及mTOR信号通路活性影响 二甲双胍作用结直肠癌细胞48 h后,利用Western blot检测mTOR及Akt信号通路主要蛋白的表达,结果如图5所示。与对照组比较,p-Akt的表达量显著降低(P<0.01),而Akt总蛋白的表达量无显著变化(P>0.05);p-mTOR及p-S6K的表达量显著降低(P<0.01),而mTOR及S6K总蛋白的表达量无显著变化(P>0.05)。
2.6 二甲双胍对结直肠癌细胞凋亡相关蛋白的表达影响 Western blot检测结果如图6所示。与对照组比较,促凋亡蛋白Bad的表达量显著升高(P<0.01);抗凋亡蛋白Bcl-2的表达量显著降低(P<0.01);Cleaved caspase-3的表达量显著升高(P<0.01);说明二甲双胍能够引起细胞凋亡效应。
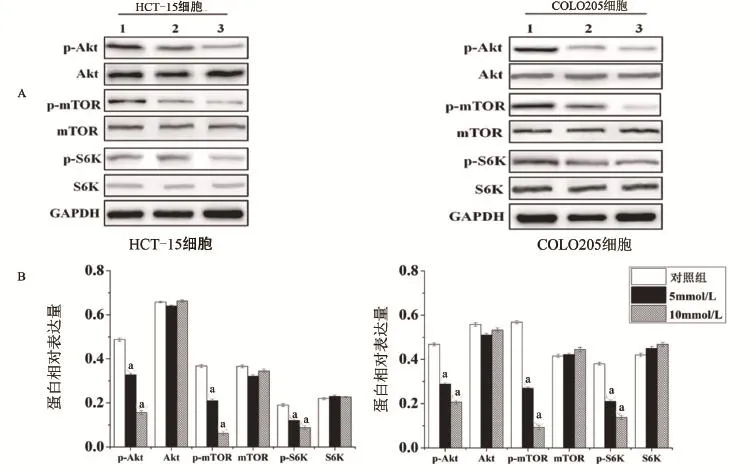
图5 二甲双胍对结直肠癌细胞Akt及mTOR信号通路的影响
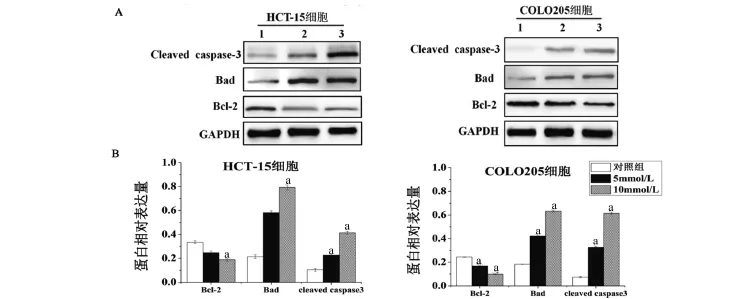
图6 二甲双胍作用48 h,对结直肠癌细胞凋亡相关蛋白表达的影响
3 讨 论
二甲双胍是一种口服双胍类药物,广泛应用于治疗Ⅱ型糖尿病患者已经超过40多年的历史,具有很好的治疗效果及成本低廉的优点。除了用于治疗糖尿病以外,流行病学研究及基础实验发现,二甲双胍同样能够降低糖尿病患者罹患癌症风险[7-8]。此外,大量的临床试验已经证明,二甲双胍能够提高肿瘤患者的生存期[9-10]。这种效应与二甲双胍能够激活mTOR抑制剂AMPK通路有关[11]。
本研究通过MTT检测发现,不同浓度的二甲双胍作用人结直肠癌细胞72 h后细胞活力明显受到抑制,并且呈现浓度依赖性。同时,流式细胞术检测发现,5 mmol/L、10 mmol/L二甲双胍作用结直肠癌细胞48 h后能够显著抑制细胞周期进程,促进细胞G0/G1期停滞。进一步Western blot检测发现,p27蛋白表达量显著上调,而CyclinD1的表达量显著下调;同时流式细胞术检测发现,二甲双胍能够显著上调凋亡细胞所占比率。
CyclinD1在多种肿瘤细胞中呈现高表达[12-13],并且和肿瘤的生长及耐药相关[14]。研究认为,周期蛋白依赖性蛋白激酶(cyclin-dependent protein kinases,Cdks)抑制剂如p27能够对抗二甲双胍对细胞的影响[15]。本研究通过Western blot检测发现,二甲双胍能够下调CyclinD1的表达,上调p27的表达量。说明二甲双胍抑制结直肠癌增殖作用可能与p27及CyclinD1有关。
Akt信号通路在机体起到重要的作用,发挥多种的磷酸化功能,调节包括细胞周期进程、细胞生存、蛋白合成、细胞凋亡等细胞生物学行为[16-17]。活化的Akt可调节mTOR,mTOR进一步调控凋亡相关蛋白GSK3β、S6K、4EBP1、Cleaved Caspase-3[18],最终通过Caspase-3引起细胞凋亡[19-20]。本研究通过Western blot检测发现,二甲双胍能够显著降低Akt、mTOR及S6K的磷酸化,但总的蛋白表达水平无明显变化。说明二甲双胍能够降低Akt、mTOR信号通路的活性,最终引起细胞凋亡的发生。
综上所述,二甲双胍能够抑制结直肠癌细胞的增殖,上调细胞凋亡比率,促进细胞出现G0/G1停滞。其作用机制可能与Akt及mTOR信号通路被抑制有关,但具体的机制需要更进一步的研究。深入探讨二甲双胍对结直肠癌的作用机制,对临床上更好利用二甲双胍辅助治疗结直肠癌具有重要意义。
[1]Gastrointestinal Tumor Study Group.Prolongation of the disease-free interval in surgically treated rectal carcinoma.Gastrointestinal Tumor Study Group[J].N Engl J Med,1985,312(23):1465-1472.
[2]Evans JMM,Donnelly LA,Emslie-Smith AM,et al.Metformin and reduced risk of cancer in diabetic patients[J].British Medical Journal,2005,330(7503):1304-1305.
[3]Hirsch HA,Iliopoulos D,Tsichlis PN,et al.Metformin selectively targets cancer stem cells,and acts together with chemotherapy to block tumor growth and prolong remission[J].Cancer Research,2009,69 (19):7507-7511.
[4]Liu B,Fan Z,Edgerton SM,et al.Metformin induces unique biological and molecular responses in triple negative breast cancer cells[J]. Cell Cycle,2009,8(13):2031-2040.
[5]Ben Sahra I,Laurent K,Loubat A,et al.The antidiabetic drug metformin exerts an antitumoral effect in vitro and in vivo through a decrease of cyclin D1 level[J].Oncogene,2008,27(25):3576-3586.
[6]Kisfalvi K,Eibl G,Sinnett-Smith J,et al.Metformin disrupts crosstalk between G protein-coupled receptor and insulin receptor signaling systems and inhibits pancreatic cancer growth[J].Cancer Research,2009,69(69):6539-6545.
[7]Zhang ZJ,Zheng ZJ,Kan H,et al.Reduced risk of colorectal cancer with metformin therapy in patients with type 2 diabetes:Ameta-analysis[J].Diabetes Care,2011,34(10):2323-2328.
[8]Emami Riedmaier A,Fisel P,Nies AT,et al.Metformin and cancer: From the old medicine cabinet to pharmacological pitfalls and prospects[J].Trends Pharmacol Sci,2013,34(2):126-135.
[9]He X,Esteva FJ,Ensor J,et al.Metformin and thiazolidinediones are associated with improved breast cancer-specific survival of diabetic women with HER2+breast cancer[J].Ann Oncol,2012,23(7): 1771-1780.
[10]Lega IC,Austin PC,Gruneir A,et al.Association between metformin therapy and mortality after breast cancer:A population-based study [J].Diabetes Care,2013,36(10):3018-3026.
[11]Liu J,Li M,Song B,et al.Metformin inhibits renal cell carcinoma in vitro and in vivo xenograft[J].Urol Oncol,2013,31(2):264-270.
[12]Luo Q,Hu D,Hu S,et al.In vitro and in vivo anti-tumor effect of metformin as a novel therapeutic agent in human oral squamous cell carcinoma[J].BMC Cancer,2012,12(1):1-10.
[13]Zhang T,Guo P,Zhang Y,et al.The antidiabetic drug metformin inhibits the proliferation of bladder cancer cells in vitro and in vivo [J].International Journal of Molecular Sciences,2013,14(12): 24603-24618.
[14]Xiao-Ping H,Tie-Hua R,Peng L,et al.Cyclin D1 overexpression in esophageal cancer from southern China and its clinical significance [J].Cancer Letters,2006,231(1):94-101.
[15]Zhuang Y,Miskimins WK.Cell cycle arrest in metformin treated breast cancer cells involves activation of AMPK,downregulation of cyclin D1,and requires p27Kip1 or p21Cip1[J].Journal of Molecular Signaling,2008,3(1):1-11.
[16]Carracedo A,Pandolfi PP.The PTEN-PI3K pathway:of feedbacks and cross-talks[J].Oncogene,2008,27(41):5527-5541.
[17]Markman B,Dienstmann R,Tabernero J.Targeting the PI3K/Akt/ mTOR pathway-beyondrapalogs[J].Oncotarget,2010,1(7): 530-543.
[18]He C,Klionsky DJ.Regulation mechanisms and signaling pathways of autophagy[J].Annu Rev Genet,2009,43:67-93.
[19]Zhai B,Sun XY.Mechanisms of resistance to sorafenib and the corresponding strategies in hepatocellular carcinoma[J].World J Hepatol, 2013,5(7):345-352.
[20]Serova M,de Gramont A,Tijeras-Raballand A,et al.Benchmarking effects of mTOR,PI3K,and dual PI3K/mTOR inhibitors in hepatocellular and renal cell carcinoma models developing resistance to sunitinib and sorafenib[J].Cancer Chemother Pharmacol,2013,71 (5):1297-1307.
Mechanism of metformin on the cell proliferation and apoptosis of human colorectal cancer cells.
WANG Chun-fang,LIU Bing,SUN Guang,XU Yu-jie,PENG Bo.Department of Gastrointestinal Surgery,Haikou People's Hospital,Haikou 570208,Hainan,CHINA
ObjectiveTo study the effect of metformin on cell proliferation and apoptosis of human colorectal cancer and to explore the potential mechanism.MethodsHuman colorectal cancer cell HCT-15 and COLO205 were cultured and treated with metformin in vitro.The cell viability was assessed by MTT assay,and the cell cycle and apoptosis were tested by flow cytometry.Western blot assay was performed to analyze the changed expression of apoptosis-related proteins(Bad,Bcl-2,cleaved caspase-3),Akt,p-Akt,mTOR,p-mTOR,S6K,p-S6K.ResultsMTT assay showed metformin could significantly inhibit cell proliferation of HCT-15 cells and COLO205 cells in a dose-dependent manner after 72 h.Meanwhile,metformin could induce G0/G1 arrest,and increase the rate of apoptosis cell.The results of Western blot showed that the expression of Bad and cleaved caspase-3 were significantly increased by metformin treatment,and the expression of Bcl-2 was significantly decreased.Furthermore,the phosphorylation of AKT,mTOR and S6K(p-Akt,p-mTOR,p-S6K)were significantly inhibited,but the total protein expression of AKT,mTOR and S6K were not significantly changed.ConclusionMetformin could inhibit the proliferation of human colorectal cancer cell, and induce the apoptosis via inhibiting the activity ofAkt and mTOR.
Metformin;Colorectal cancer;Cell proliferation;Cell apoptosis
R735
A
1003—6350(2016)23—3802—06
10.3969/j.issn.1003-6350.2016.23.006
2016-06-27)
彭勃。E-mail:pengbohk2016@163.com

