全身应用神经生长因子在兔下颌骨牵张成骨中的作用
符涛,杨擎天,张雅博,石东岳,杜兆杰
(中国人民解放军第425医院五官科,海南 三亚 572000)
全身应用神经生长因子在兔下颌骨牵张成骨中的作用
符涛,杨擎天,张雅博,石东岳,杜兆杰
(中国人民解放军第425医院五官科,海南 三亚 572000)
目的 研究全身应用神经生长因子(NGF)促进兔下颌骨牵张成骨的作用。方法24只新西兰白兔按随机数表法分为四组,每组6只,分别为:固定期2周NGF组、固定期2周NaCl组(即空白组)、固定期4周NGF组、固定期4周NaCl组(即空白组)。全麻后双侧下颌骨行骨劈开并植入牵张器,经4 d延迟期,牵引10 d,速度为0.5 mm/12 h。按组别分别给予NGF(0.6µg/d×20 d)和相当量生理盐水(1 mL/d×20 d)肌注。于牵张期10 d及固定期2、4周行X线、HE染色及生物力学检测。结果X线示:NGF组较空白组牵张区有更多新骨形成,骨钙化程度更高;HE染色示:NGF组较空白组新生骨小梁数量更多,排列更加规则;生物力学检测示:固定期2周NGF组最大载荷为(12.18±1.65)N、挠曲强度为(11.54±1.27)MPa,均比空白组高25.9%(P<0.05);固定期4周NGF组最大载荷为(17.83± 1.92)N、挠曲强度为(16.28±1.74)MPa,均比空白组高14.9%(P<0.05)。结论全身注射神经生长因子能促进牵张成骨中牵张区下颌骨的骨再生。
新西兰白兔;神经生长因子;牵张成骨;下颌骨
牵张成骨技术(distraction osteogenesis,DO)技术是利用牵张应力的刺激促进牵张区骨再生的技术,已经广泛应用于骨畸形、骨缺损等的临床修复,但较长的固定期仍制约着这一技术的推广。大量学者在动物实验中,采用局部应用重组人骨形成蛋白、富血小板血浆、神经生长因子及骨髓间充质干细胞等方法来促进成骨,缩短了固定期[1-4]。很多研究发现,DO中神经生长因子(nerve growth factor,NGF)及其受体出现高表达,NGF能促进成骨细胞向分化并抑制其凋亡,起着直接促进成骨的作用,同时NGF还能促进血管的生成,而牵张区的血管化是成骨的关键,说明NGF也能间接促进骨再生[5-7]。NGF还能促进外周感觉神经的再生,诱导神经进入骨髓腔,最终促进骨再生[8]。以往研究多集中于各种因子的局部应用,不可避免会带来局部疼痛不适、感染等多种副作用,临床接受度较低,因此我们考虑采用全身注射的方法。在前期研究中,我们已明确全身注射NGF能促进下牙槽神经的修复[9]。本文旨在研究全身注射NGF对兔下颌骨牵强成骨的作用。
1 材料与方法
1.1 实验动物及分组 24只雄性成年新西兰白兔,购自海南医学院实验动物中心,口颌系统无明显异常,体质量2.8~3.2 kg,实验前普通饮食并适应性分笼饲养1周。根据取材时间及干预方法,将兔按随机数字表法分为四组:A组固定期2周组6只(空白组):全身注射NaCl;B组固定期2周组6只:全身注射NGF;C组固定期4周组6只(空白组):全身注射NaCl;D组固定期4周组6只:全身注射NGF。每组牵引速度均为0.5 mm/12 h,牵引长度为10 mm。
1.2 实验材料及试剂 内置式双侧兔下颌骨钛合金牵张器购自西安中邦钛生物材料公司(牵张器全长35 mm,最大牵张距离10 mm,加力螺杆的螺距0.5 mm,固位螺钉直径1.5 mm,长7.0 mm)。生长因子为人胚胎提取神经生长因子,购自Abcam公司(粉剂,20µg),4℃下配置为0.6µg/mL(生理盐水)。
1.3 牵张器植入手术 新西兰白兔术前30 min肌注青霉素30万单位。全身麻醉,术前氯胺酮50 mg/kg肌注,苯巴比妥钠40 mg/kg静注,麻醉满意后,仰卧位固定四肢,颌下三角区备皮,0.5%碘伏消毒,铺巾,含1:200 000肾上腺素的1%利多卡因2.5 mL术区浸润麻醉。沿颌下三角正中做一约3 cm的纵行切口,切开皮肤、皮下,钝性分离双侧下颌下缘,沿下颌骨下缘纵行切开骨膜向颊侧翻瓣,暴露保护颏神经,植入牵张器,双侧骨劈开。术中注意保护下齿槽神经血管束,完全固定牵张器,确定骨断端无移位以避免下牙槽神经(IAN)受到下牙槽管断端的刺激。生理盐水反复冲洗,分层严密缝合骨膜、皮下及皮肤。为避免下颌前移后上切牙对下颌牙龈创伤,将上前牙磨短至原牙冠的一半,并每周调磨上前牙一次。
1.4 术后处理及标本获取 兔完全苏醒后,软食分笼饲养,严密监测精神、饮食和体重情况。术后伤口每日清洁消毒并涂红霉素软膏2次。术后青霉素30万单位/12 h×4 d肌注。术后按组别给予肌注NGF 0.6µg/d×20 d(总量12µg/只)和生理盐水1 mL/d×20 d。经4 d延迟期,各组均按照0.5 mm/12 h的速度连续牵张,总距离10 mm。分别于牵张期10 d、固定期2、4周,全麻下双侧颈总动脉置管,4.0%多聚甲醛灌注固定,解剖分离兔双侧下颌骨标本。
1.5 X线、HE染色及生物力学检测 所获取的双侧下颌骨从颏部离断行X线检查。取双侧牵张区组织标本经常规脱钙、石蜡包埋等处理,硬组织切片机(DM IRB型,德国Leica)沿牵张方向将标本制作为厚5µm切片,行HE染色。金刚砂片切割下颌骨标本制备成18 mm×8 mm×2 mm试件,切割时生理盐水冷却,采用万能电子力学试验机(AGS-10kNG,日本SHIMADZ公司)测定试件在三点弯曲状态下的应力-应变指标:试件横向固定于试验台,跨度15 mm,于中点以0.75 mm/min速度匀速加载,直到试件断裂,X-Y函数记录仪记录应力、应变曲线,记录试件破坏时的最大载荷并测定各组应力-应变曲线线性段的斜率、应力和应变值,计算挠曲强度(MPa)=3FL/2BH2,其中F为最大载荷值(N),L为试件跨距(mm),B为试件宽度(mm),H为试件高度(mm)。
1.6 统计学方法 应用SPSS13.0统计软件进行数据分析,计量数据以用均数±标准差(±s)表示,采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 术中及术后情况 全部实验兔中,有3只(A,C,D组各1只)牵张区有脓性分泌物无新生骨质,故排除。其余21只均耐受手术且无术后感染。实验期间,动物体质量损失量均低于10%。各组牵张加力时无明显阻力。牵张结束时,所有兔颏部均明显前凸。
2.2 X线检查 牵张器固定在位,牵张区低密度影,骨折线清晰,骨皮质离断,见图1。固定期第2周,骨折线模糊,骨皮质仍离断。两组相比:NGF组牵张区有较高的钙化影密度,可见较多新骨填充,见图2A、2B。固定期第4周,骨折线消失,骨皮质连续,并有少量骨质增生,见图2C、2D。两组相比:NGF组牵张区钙化影密度明显高于空白组,新生骨量更多,矿化程度更高。
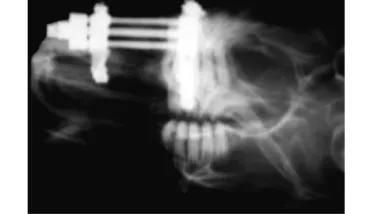
图1 牵张期10 d
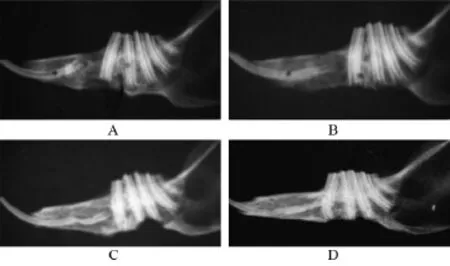
图2 X线检查结果
2.3 HE染色 牵张完成时,牵张区内充满大量胶原组织和成骨细胞,胶原纤维束沿牵张应力的方向排列(图3)。固定期第2周,两组牵张区出现幼稚新生骨质,沿牵张应力方向呈网格状充满骨髓腔,新生骨小梁间隙充满大量新生血管、纤维等结缔组织,成骨细胞聚集于新生骨小梁周围(图4A、4B、4C、4D)。固定期第4周,两组新生骨小梁均增多,纤维结缔组织减少,骨小梁周围有大量成骨细胞分布,排列方向与应力一致(图4E、4F、4G、4H)。不同时间点,NGF组的新生骨小梁数量均多于空白组,排列更规则,融合更加广泛。牵张区骨小梁周围及间隙的成骨细胞明显较空白组更加密集。
2.4 生物力学检测 牵张区新生骨痂的三点弯曲最大载荷和挠曲强度结果示:NGF组最大载荷及挠曲强度在固定期2周时均比空白组高25.9%(P<0.05),见表1;在固定期4周比空白组高14.9%(P<0.05),见表2。
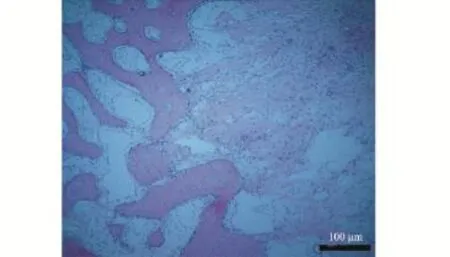
图3 HE染色牵张期10 d
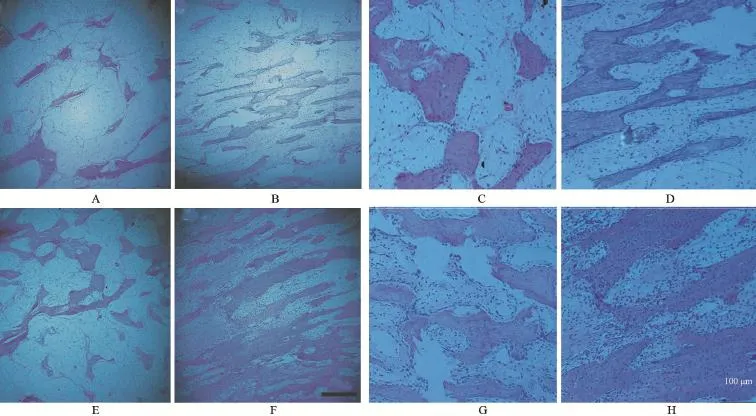
图4 HE染色
表1 固定期2周牵张区新生骨痂三点弯曲试验(±s)
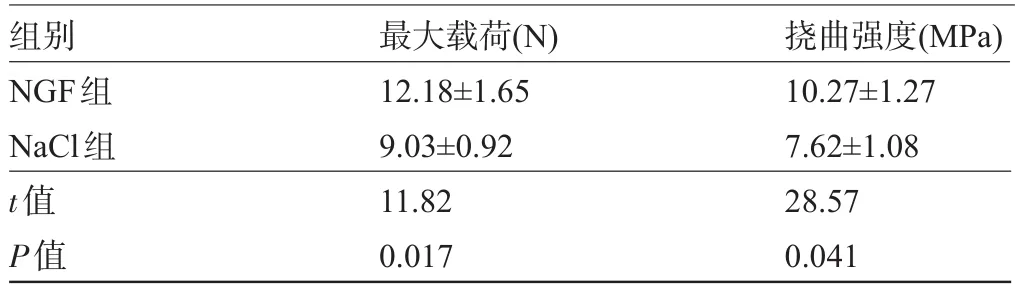
表1 固定期2周牵张区新生骨痂三点弯曲试验(±s)
组别NGF组NaCl组t值P值最大载荷(N) 12.18±1.65 9.03±0.92 11.82 0.017挠曲强度(MPa) 10.27±1.27 7.62±1.08 28.57 0.041
表2 固定期4周牵张区新生骨痂三点弯曲试验(±s)
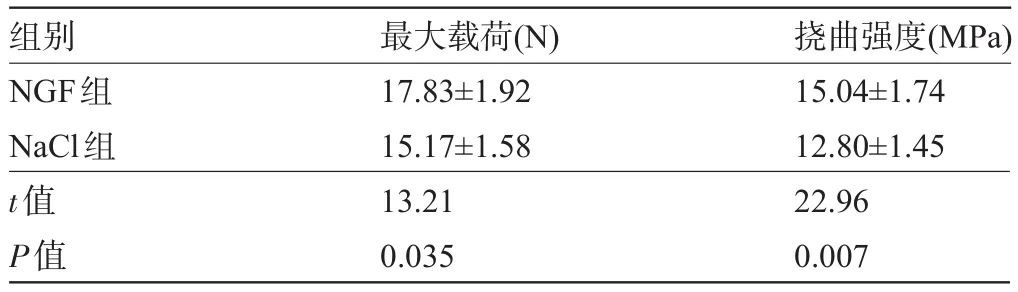
表2 固定期4周牵张区新生骨痂三点弯曲试验(±s)
组别NGF组NaCl组t值P值最大载荷(N) 17.83±1.92 15.17±1.58 13.21 0.035挠曲强度(MPa) 15.04±1.74 12.80±1.45 22.96 0.007
3 讨 论
针对牵张成骨技术固定期过长的问题,人们局部应用多种外源性因子旨在能促进DO中新骨生成和新生骨质成熟,从而缩短固定期。大量的研究已证实,局部应用如凝血酶受体激活肽(TP508)、hNGF及重组人骨形成蛋白等均能促进DO成骨,特别是NGF不仅能促进成骨细胞向分化直接促进成骨,而且能促进局部组织血管化间接促进成骨,同时能促进术区外周神经的修复进一步促进成骨[10-11]。但是也有DO中外源性生长因子局部应用后无效的发现,其原因可能是由于所选择因子生物效应不同、干预方法及时机等因素所致。目前大多研究均采用局部干预的方法,可能是考虑到局部应用可控性较高,可避免如全身干预后出现因代谢或流失而无法直接作用靶部位或到达靶单位目标因子浓度过低等所致的效用减低情况,但局部干预操作复杂,不可避免会增加医疗风险及费用,相对于全身干预临床可接受度较低。2006年Fowlkes等[12]在小鼠DO模型中发现,全身和局部应用IGF-1均能明显的促进牵张区骨质的再生和重建,且两种方法的效果无明显差别。鉴于DO中NGF和IGF-1相似的表达规律,我们推测全身应用NGF也可能促进DO成骨。
目前普遍认为,神经与骨再生关系密切,其中感觉神经促进成骨而交感神经能抑制成骨[13-15],在DO中,早期截骨术和后续牵张应力势必会造成局部的组织血液循环障碍及缺氧,而延迟下颌骨的同时也会对下齿槽神经造成牵拉而导致髓鞘崩解和巨噬细胞入侵等神经损伤,应急条件下局部各种内源性因子表达反应性明显增高,内源性因子在刺激消除后才逐渐降低至正常水平[5]。因此,笔者认为DO固定期更需要外源性因子的介入,但考虑到DO手术创伤和牵张应力会造成下齿槽神经早期和牵张期持续的损伤,NGF不仅能直接促进成骨,而且是神经再生修复的关键因子,同时参考临床上治疗外周神经损伤的时机、方法、剂量及疗程[16-18],笔者在DO术后即持续给予NGF直到固定期1周,干预手段我们选用更为方便的肌肉注射,这样可充分发挥NGF的生物学效能。
本实验中,牵张期结束时,牵张区组织X线检查未见明显低密度影,无明显成骨;固定期2周,牵张区有弥散钙化影,新生骨密度明显低于正常骨质,有大量沿应力方向分布的纤维组织出现,其间骨基质沉积,并有少量细针状骨小梁;固定期4周,牵张区灰度明显增加,但新生骨质密度仍低于正常骨质,骨小梁排列尚不规则,有含哈佛系统的密致骨出现,骨小梁增粗相互连接,有大量成骨细胞环绕,同时破骨细胞活跃,髓腔区新生骨部分吸收,骨再生与吸收并存,骨痂改建开始。同时我们发现,牵张成骨符合胶原纤维增生、间充质干细胞分化、基质分泌、纤维骨化,骨小梁融合改建等膜内成骨特点,但在部分固定期4周的标本中发现散在软骨岛,类似于软骨成骨,这可能由于局部低氧环境,导致干细胞软骨向分化有关。在三点弯曲试验中我们发现,NGF组新生骨痂的生物力学强度明显高于空白组,证明NGF组骨小梁更加的致密成熟。在NGF组和空白组的比较中发现,NGF组骨小梁体积较大和矿化程度也较高;同时HE染色示NGF组成骨细胞的活性更高,骨小梁增粗,而且新生骨小梁数量更多,相互融合更广,排列更规则,也与生物力学检测结果相符合,均提示全身注射NGF不仅能促进新骨生成,而且能促进新骨改建。全身注射NGF与局部注射NGF的差异以及联合应用的效果尚不明确。在实验中,全身注射NGF所采用的剂量和疗程均基本依照临床应用,如何能达到最佳的干预效果尚待进一步研究。
总之,全身注射人NGF可以促进兔下颌骨牵张成骨中新生骨的再生和成熟,结合全身干预的优点,以期为临床上缩短牵张成骨固定期提供了一种更为简便、有效的辅助治疗方法。
[1]Terbish M,Yoo SH,Kim HJ,et al.Accelerated bone formation in distracted alveolar bone after injection of recombinant human bone morphogenetic protein-2[J].J Periodontol,2015,86(9):1078-1086.
[2] Swennen GRJ,Schutyser F,Mueller MC,et al.Effect of platelet-rich-plasma on cranial distraction osteogenesis in sheep:Preliminary clinical and radiographic results[J].International Journal of Oral and Maxillo-facial Surgery,2005,34(3):294-304.
[3]Cao J,Wang L,Lei DL,et al.Local injection of nerve growth factor via a hydrogel enhances bone formation during mandibular distraction osteogenesis[J].Oral Surgery,Oral Medicine,Oral Pathology and Oral Radiology,2012,113(1):48-53.
[4]Dehghan MM,Baghaban Eslaminejad M,Motallebizadeh N,et al. Transplantation of autologous bone marrow mesenchymal stem cells with platelet-rich plasma accelerate distraction osteogenesis in a canine model[J].Cell J,2015,17(2):243-252.
[5]Aiga A,Asaumi K,Lee YJ,et al.Expression of neurotrophins and their receptors tropomyosin-related kinases(Trk)under tension-stress during distraction osteogenesis[J].Acta Med Okayama,2006,60(5): 267-277.
[6]Park BW,Kim JR,Lee JH,et al.Expression of nerve growth factor and vascular endothelial growth factor in the inferior alveolar nerve after distraction osteogenesis[J].Int J Oral Maxillofac Surg,2006,35 (7):624-630.
[7]Wang L,Zhao Y,Cheng X,et al.Effects of locally applied nerve growth factor to the inferior alveolar nerve histology in a rabbit model of mandibular distraction osteogenesis[J].Int J Oral Maxillofac Surg,2009,38(1):64-69.
[8]雷德林,王磊,赵英华,等.兔下颌骨牵张成骨中神经生长因子对骨痂钙化的作用[J].中国口腔颌面外科杂志,2007,5(5):355-359.
[9]Zhao-jie Du,Lei Wang,De-lin Lei,et al.Nerve growth factor injected systemically improves the recovery of the inferior alveolar nerve in a rabbit model of mandibular distraction osteogenesis[J].British Journal of Oral and Maxillofacial Surgery,2011,49(7):557-561.
[10]Cakarer S,Olgac V,Aksakalli N,et al.Acceleration of consolidation period by thrombin peptide 508 in tibial distraction osteogenesis in rats[J].Br J Oral Maxillofac Surg,2010,48(8):633-636.
[11]Wang L,Zhou SX,Liu BL,et al.Locally applied nerve growth factor enhances bone consolidation in a rabbit model of mandibular distraction osteogenesis[J].Journal of Orthopeadic Resarch,2006,24(12): 2238-2245.
[12]Fowlkes JL,Thrailkill KM,Liu LC,et al.Effects of systemic and local administration of recombinant human IGF-I(rhIGF-I)on de novo bone formation in an aged mouse model[J].J Bone Miner Res,2006, 21(9):1359-1366.
[13]Méndez-Ferrer S,Michurina TV,Ferraro F,et al.Mesenchymal and haematopoietic stem cells form a unique bone marrow niche[J].Nature,2010,446(7308):829-834.
[14]Wang T,Cao J,Du ZJ,et al.Effects of sympathetic innervation loss on rat mandibular distraction osteogenesis[J].J Craniofac Surg, 2012,23(5):1524-1528.
[15]Zhao-jie Du,Lei Wang,Ying-hua Zhao,et al.Sympathetic denervation-induced MSC mobilization in distraction osteogenesis associates with inhibition of MSC migration and osteogenesis by norepinephrine/adrb3[J].PLoS One,2014,9(8):e105976.
[16]陈燕涛,何清,刘尚礼,等.神经生长因子治疗周围神经损伤的前瞻性研究[J].中华创伤骨科杂志,2006,8(8):744-746.
[17]韩汝政,李化伟,耿正顺.神经生长因子治疗颅神经损伤的临床研究[J].中华实用中西医杂志,2005,18(10):1457-1458.
[18]陈庆真,施明祥,刘盛飞,等.鼠神经生长因子不同给药方式修复周围神经损伤[J].中国组织工程研究,2014,33(1):5356-5360.
Effect of systemic application of nerve growth factor in rabbit models of mandibular distraction osteogenesis.
FU Tao,YANG Qing-tian,ZHANG Ya-bo,SHIDong-yue,DU Zhao-jie.DepartmentofOphthalmologyand Otorhinolaryngology,No.425 Hospital of Chinese PLA,Sanya 572000,Hainan,CHINA
ObjectiveTo evaluate the ability of systemic application of nerve growth factor(NGF)to enhance callus mineralization in rabbit models of mandibular distraction osteogenesis.MethodsTwenty-four New Zealand white rabbits were randomly divided into 4 groups(each with 6 rabbits):consolidation 2 weeks NGF group,consolidation 2 weeks NaCl group(control group),consolidation 4 weeks NGF group,consolidation 4 weeks NaCl group(control group),under bilateral distraction osteogenesis at a rate of 0.5 mm/12 h for 10 days,with a delay period of 4 d.Immediately after surgery,NGF(0.6µg/d×20 d)and considerable amount of sodium chloride(1 mL/d×20 d)were intramuscularly injected respectively.The rabbits were sacrificed at consolidation time of 2 and 4 weeks for X-ray,histomorphometric and Biomechanical testing.ResultsNGF groups showed higher degree of mineralization and a greater amount of new bone trabeculae in the distracted area.Biomechanical testing showed that the maximum loading and flexural strength of consolidation 2 weeks NGF group were(12.18±1.65)N and(11.54±1.27)Mpa,which were 25.9%higher than those in the control group(P<0.05),and the maximum loading and flexural strength of consolidation 4 weeks NGF groups were(17.83±1.92)N and(16.28±1.74)Mpa,which were 14.9%higher than those in the control group(P<0.05).ConclusionSystematic application of NGF can accelerate callus mineralization in distraction osteogenesis.
New Zealand white rabbits;Nerve growth factor;Distraction osteogenesis;Mandible
R-332
A
1003—6350(2016)23—3794—04
10.3969/j.issn.1003-6350.2016.23.004
2016-08-25)
海南省三亚市卫生科技创新项目(编号:2014YW48)
杜兆杰。E-mail:duzhaojie222@aliyun.com

