FoxO3a对胶质瘤细胞株T98G和A172侵袭能力的影响
许可,李亮,林英姿
(海南医学院热带医学与检验医学院,海南 海口 571101)
FoxO3a对胶质瘤细胞株T98G和A172侵袭能力的影响
许可,李亮,林英姿
(海南医学院热带医学与检验医学院,海南 海口 571101)
目的 探讨叉形框蛋白3a(FoxO3a)对胶质瘤细胞系T98G、A172细胞侵袭能力的影响。方法将FoxO3a的RNAi干扰序列嵌入慢病毒载体pHY-LV-KD1.1产生重组病毒载体pHY-FoxO3a-KD;FoxO3a DNA序列克隆入慢病毒表达载体PHY-LV-OE1.6。通过Trans-Lentiviral Packaging System和Vira Power Lentiviral Expression System(Invitrogen)对重组载体进行病毒包装。重组后的慢病毒感染T98G、A172细胞,检测相应细胞株侵袭能力的改变,并通过Western blot检测胶质瘤侵袭相关的靶基因表达水平的变化。结果在T98G细胞中敲低FoxO3a后,肿瘤细胞侵袭能力下降并且侵袭相关基因MMP9表达水平下调;相反A172细胞中过表达FoxO3a肿瘤细胞侵袭能力增强。结论FoxO3a可以影响T98G、A172细胞的侵袭能力。
胶质瘤;T98G;A172;叉形框蛋白3a;基质金属蛋白酶9;细胞侵袭
脑胶质瘤是起源于神经外胚层的肿瘤,是颅内最常见的恶性肿瘤,年发病率为5/100 000[1]。目前治疗方法是以手术治疗为主联合放射及化学治疗等综合治疗方案。然而患者的预后并没有得到明显改善,平均存活时间只有12~15个月。在老年人群中,生存期不足一年[4]。叉形框蛋白3a(FoxO3a)蛋白是FoxO家族重要的成员,它在许多癌症的病理过程中起着重要作用。尽管大多数报道认为FoxO3a是抑癌因子[3],近来的研究表明FoxO3a在某些癌细胞中可以促进癌细胞侵袭[4],但在胶质瘤细胞系T98G、A172中未见关于FoxO3a的报道。本文旨在探讨FoxO3a对胶质瘤细胞T98G、A172侵袭能力的影响。
1 材料与方法
1.1 细胞系和细胞培养 T98G、A172细胞系从中国科学院细胞库购得(上海,中国),人正常星形胶质细胞从美国标准菌库(Manassas,VA,USA)购得。该细胞在37℃、5%CO2的环境下培养。培养基选用Dulbecco's modified Eagle's medium(DMEM;Gibco,Paisley,UK)添加10%胎牛血清(FBS)以及100 μg/mL链霉素和1 U/mL青霉素。
1.2 慢病毒载体的构建与感染 通过BLOCK-iT RNAi designer(Invitrogen)设计针对FoxO3a干扰序列:FoxO3a-knockdown 3'-nockdown NAi designer',并将合成后的序列克隆进pHY-LV-KD1.1表达载体(本实验室保存)产生重组载体pHY-FoxO3a-KD。同时,设计一条无关序列克隆入pHY-LV-KD1.1载体作为阴性对照(NC)。人全长的FoxO3a cDNA从Open Biosystems购得。通过FoxO3a表达引物,正向:5'-ATGGCAGAGGCACCGGCTT-3',反向:5'-GCCTGGCACCCAGCTC TGAG-3'进行扩增。通过XhoI/BamHⅠ酶切,胶回收纯化处理后,克隆到PHY-LV-OE1.6(本实验室保存)重组载体用于表达FoxO3a,命名为pHY-FoxO3a-OE;空载体作为阴性对照。通过Trans-Lentiviral Packaging System和Vira Power Lentiviral Expression System(In-vitrogen)包装病毒颗粒,并感染相应细胞株。
1.3 细胞侵袭实验 2×104稳定株细胞24孔带有8 μm孔径的聚碳酸酯膜并包被30 μg Matrigel(BD Biosciences,San Jose,CA,USA)的Boyden小室(Corning Costar,Cambridge,MA,USA)。细胞置于上室并用200 μL无血清培养基进行孵育。在下室加入20%FBS作为趋化因子。孵育36 h后,用磷酸盐缓冲液(PBS)进行3次清洗。上室中未发生侵袭的细胞用棉签擦去。发生侵袭的细胞用多聚甲醛固定15 min。风干后,用0.1%的结晶紫染色15 min。用数码相机拍照记录。
1.4 免疫印迹法 提取出总蛋白进行SDS-Page电泳,然后通过湿转膜法转移至硝化纤维膜上,用相应的一抗过夜4℃孵育。一抗孵育使用抗体MMP9和MMP2(Santa Cruz)。
1.5 统计学方法 图表上显示的数据为三次独立重复标准方差的平均值(±s),组内差异通过ANOVA分析,两组间的比较通过the Student's t-test完成。以P<0.05表示差异有统计学意义。以上统计分析均通过GraphPad Prism6.0软件分析完成。
2 结 果
2.1 FoxO3a对T98G、A172细胞侵袭的影响 笔者已检测FoxO3a在胶质瘤细胞系T98G、U251、A172和T98G以及人正常星形胶质细胞中的表达。相对于其他细胞系,T98G细胞高表达FoxO3a而A172细胞低表达FoxO3a。因此,本组通过在T98G细胞中敲低FoxO3a,同时在A172细胞中过表达FoxO3a,探究该基因对胶质瘤细胞侵袭能力的影响。如图1所示,通过Transwell试剂盒我们检测了阴性对照组(NC)和FoxO3a敲低组之间T98G细胞侵袭能力的差异(各组内平行重复通过ANOVA分析。NC组P=0.413;FoxO3a敲低组P=0.570。结果表明在病毒FoxO3a-KD感染肿瘤细胞48 h后,与对照组比较,敲低组T98G的侵袭能力显著下降(采用Student's t-test分析t=6.154,P=0.0003) (图1)与这一结果基本一致的是,过表达FoxO3a的A172细胞的侵袭能力显著增强(t=13.37,P<0.0001),见图1。
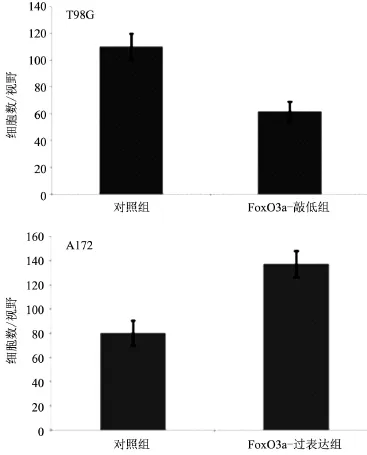
图1 FoxO3a对胶质瘤细胞侵袭的影响
2.2 FoxO3a对MMP9蛋白表达的影响 在胶质瘤中与侵袭密切相关的主要是金属蛋白酶家族成员matrix-metalloproteinases(MMPs)的MMP9和MMP2[4]。通过Western blot技术试图探究FoxO3a影响T98G侵袭的同时是否也影响了这两个关键蛋白的表达。图2表明敲低FoxO3a主要影响MMP9的表达而对MMP2的表达影响不显著。
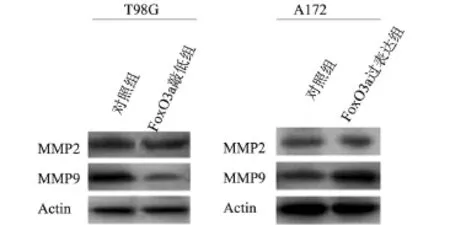
图2 FoxO3a对MMP9蛋白表达的影响
3 讨 论
尽管之前的研究认为FoxO3a是肿瘤抑制因子,近来的报道表明FoxO3a可促进肿瘤细胞的侵袭。乳腺浸润性导管癌中,FoxO3a与淋巴结侵袭和预后差相关[5]。结肠癌中过表达FoxO3a可引起癌细胞侵袭能力的增强并发生转移[6]。这些研究提示:FoxO3a在某些癌细胞中可能表现为另一种功能特性——促癌作用。有报道称FoxO3a促使胶质瘤干细胞(glioma stem cells,GSCs)增殖和自我更新[7]。然而关于是否FoxO3a促进胶质瘤细胞的侵袭未有报道。我们的结果表明在T98G、A172细胞中FoxO3a促进肿瘤细胞的侵袭。
恶性胶质瘤预后差,其中一个重要原因是胶质瘤细胞会侵袭到周边正常组织内,这使得手术治疗和放射性治疗难以将这些肿瘤细胞彻底清除。侵袭的发生主要是由MMPs降解细胞外基质(extracellular matrix,ECM)导致。许多报道已经证实MMP2和MMP9的表达上调易引起肿瘤细胞侵袭。通过检测MMPs蛋白水平的表达笔者发现FoxO3a可以显著影响MMP9的蛋白表达,这提示FoxO3a可能是通过MMP9影响T98G、A172胶质瘤细胞的侵袭。我们的研究可能为未来的靶向药物治疗胶质瘤提供新思路和新理论依据。
[1]Gavin MM,Nicholas P,Sally M,et al.PhaseⅡstudy of thalidomide in the treatment of recurrent glioblastoma multiforme[J].Journal of Neurooncology,2001,54(1):31-38.
[2]James JV,Annick D,James EH,et al.PhaseⅡtrial of bevacizumab and irinotecan in recurrent malignant glioma[J].Clinical Cancer Research,2007,13(4):1253-1259.
[3]Richard SN,Polla H.FoxO3a and disease progression[J].World J Biol Chem,2014,5(3):346-354.
[4]Ivy P,Richard CC,Kounosuke W,et al.Mechanisms regulating glioma invasion[J].Cancer Letters,2015,362(1):1-7.
[5]Jie C,Ana RG,Lara JM,et al.Constitutively nuclear FOXO3a localization predicts poor survival and promotes Akt phosphorylation in breast cancer[J].PLoS One,2010,5(8):e12293.
[6]Stephan PT,Paloma OM,Isabel P,et al.[beta]-catenin confers resistance to PI3K and AKT inhibitors and subverts FOXO3a to promote metastasis in colon cancer[J].Nature Medicine,2012,18(6): 892-901.
[7]Satoru O,Oltea S,Takatsune S,et al.IGF1 receptor signaling regulates adaptive radioprotection in glioma stem cells[J].Stem Cells, 2013,31(4):627-640.
Effect of FoxO3a on the invasion ability of human glioma cell line T98G and A172.
XU Ke,LI Liang,LIN Ying-zi. School of Tropical Medicine and Laboratory,Hainan Medical University,Haikou 571101,Hainan,CHINA
ObjectiveTo explore the effect of forkhead box protein O3A(FoxO3a)on the invasion ability of human glioma cell line T98G and A172.MethodsFoxO3a RNAi sequence was inserted into pHY-LV-KD1.1(a lentivirus interference vector)to generate a recombinant expressing specific RNAi against FoxO3a.FoxO3a cDNA sequence was cloned into PHY-LV-OE1.6(a lentivirus expression vector).The recombinants were packaged into lentivirus particles by Trans-Lentiviral Packaging System and Vira Power Lentiviral Expression System(Invitrogen).Following infection of T98G and A172 cells by the lentiviruses,we evaluated the cell invasion by Transwell assay as well as the protein levels of glioma invasion related target genes by Western blot.ResultsAfter knocking down FoxO3a in T98G cells, the invasion ability of tumor cells decreased and the matrix metallo proteinase-9(MMP9)expression of invasion related genes was down regulated.By contrast,overexpression ofA172 in FoxO3a cells enhanced invasion ability of tumor cells.ConclusionFoxO3a can affect the invasion ability of T98G andA172 cells.
Glioma;T98G;A172;Forkhead box protein O3A(FoxO3a);Matrix metallo proteinase-9(MMP9); Cell invasion
R739.4
A
1003—6350(2016)23—3788—03
10.3969/j.issn.1003-6350.2016.23.002
2016-04-26)
海南省自然科学基金(编号:20158310)
林英姿。E-mail:Alan-dd-shore@hotmail.com

