亚临床间质性肺疾病四例并文献复习
赵婷婷,李燕,马苗,高玉娟,徐庆庆,丁晶晶,苗立云
(南京大学医学院附属鼓楼医院呼吸科,江苏 南京 210008)
亚临床间质性肺疾病四例并文献复习
赵婷婷,李燕,马苗,高玉娟,徐庆庆,丁晶晶,苗立云
(南京大学医学院附属鼓楼医院呼吸科,江苏 南京 210008)
亚临床间质性肺疾病;危险因素;临床特点;急性加重
2014年美国国家心肺血液研究所(NHLBI)针对间质性肺疾病(interstitial lung disease,ILD)进行了重新定义:是一组以细胞增殖、细胞浸润和/或纤维化为主要病理基础的异质性的、非肿瘤、非感染的肺实质性疾病[1]。该定义不再强调ILD患者必须具有临床症状和异常的呼吸音或肺功能,这主要是由于越来越多的亚临床ILD(subclinical ILD)患者被发现的缘故[1]。
所谓的“亚临床ILD”是包括有特征性放射学、生理学或某种特定病理学表现的、但个体缺乏明显症状或具有的症状与ILD本身无关的一类ILD[2]。该定义并不是对ILD进行新分类,也不是提出ILD的新概念,而是强调那些无临床症状和体征(这些并不是由于患者或者接诊的医师对疾病不认识而导致的)早期的ILD。早在约30年前就有亚临床ILD的报道[3],但并没有被临床重视。近年来,随着胸部高分辨率CT (HRCT)的普及应用,越来越多的亚临床ILD患者被发现[4-5]。不断有文献报道胸外科手术[6-7]、放疗[8-10]甚至是成分输血[11]均可导致亚临床ILD患者出现致死性的急性加重,因此认识并重视亚临床ILD,严密观察其转归并提前处理,可能使这类患者获益。
关于亚临床ILD的临床特点、影像学特点、诱发加重因素等,国外多个杂志均给予了讨论。但国内文献还未见亚临床ILD的相关报道,因此将我们临床实践中所遇到的4例典型病例进行报道,以飨读者。
1 病例简介
1.1 病例1 患者女,59岁,办公室职员。因“背部不适1个月余”于2012年7月20日入院。患者无咳嗽、咳痰、胸闷、气喘,无畏寒、发热,无咯血。既往无长期服药及接触放射性物质史,无粉尘接触史,无吸烟史。家族中无类似疾病。查体无阳性体征。遂行胸部HRCT:两肺胸膜下磨玻璃影、细网格影(图1a),完善血常规、血沉、C反应蛋白(CRP)、自身抗体、抗中性粒细胞胞浆抗体均阴性。肺功能检查(表1)示弥散功能占预计值的75.5%。由于该患者无不适症状,权衡治疗利弊后予以随访。1年后胸部HRCT(图1b,为避免重力坠积效应采用了俯卧位):网格影、磨玻璃影较1年前略增多。2年后胸部HRCT(图1c):胸膜下网格影较前略加重,肺功能(表1)通气基本正常,弥散量也较前略加重,但患者仍无临床症状,故仍予以随访。
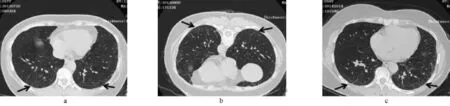
图1 病例1胸部HRCT

表1 病例1两次肺功能结果
1.2 病例2 患者男,58岁。因“活动后气喘3个月余”于2015年6月2日入院。无特殊职业接触史,有2型糖尿病病史3年,有吸烟史10年,10支/d,已戒1年。患者2012、2013年体检查胸部CT均未提示异常,2014年6月查胸部CT提示两肺胸膜下间质性改变(图2a),当时无不适症状,未予重视。3+个月前,患者出现活动后气喘并进行性加重,伴轻微咳嗽、咳痰、乏力,无关节痛、雷诺现象。2015年5月复查胸部CT双肺病灶较前明显增多(图2b)。入院后查体:颜面部及颈部皮肤稍发红,双下肺可闻及捻发音。查血尿粪常规及生化全套正常,CRP:17.5 mg/L;血沉:20 mm/h;自身抗体:抗核抗体HEP2/猴肝均质型1:100阳性,ENA抗SSB/La阳性,抗dsDNA抗体可疑;p-ANCA阳性;肺功能示:中度限制性通气功能障碍(MVV占预计值54%),弥散功能轻度减退(占预计值66.1%)。唇腺活检为慢性炎症细胞浸润Ⅲ级,泪流量及角膜荧光染色均阳性。诊断继发性ILD、干燥综合征。给予泼尼松、羟氯喹治疗。目前随访中。
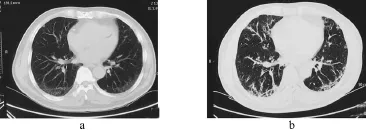
图2 病例2胸部CT
1.3 病例3 患者男,52岁,公务员。因“面部红斑及关节疼痛1个月”于2013年7月8日就诊免疫科。发病时有面部红斑,后双肘、背部及臀部出现红斑、丘疹,并伴肘、膝和髋关节的疼痛、活动受限,全身乏力、低热;无皮肤瘙痒、无晨僵、口腔溃疡、眼干、口干,无呼吸系统症状。住院期间患者的血常规、免疫常规、抗中性粒细胞胞浆抗体、抗核抗体以及抗原谱正常;血沉、C反应蛋白、肌酶谱中谷草转氨酶、乳酸脱氢酶升高,抗突变型瓜氨酸波形蛋白抗体:45.4 U/L;抗环瓜氨酸抗体阴性;肌电图提示可疑肌源性损害,双腕关节X线提示月骨内可见囊性透亮区;双膝关节X线提示退行性变;超声提示关节腔积液;骨髓活检正常;皮肤活检病理提示:角化过度伴角化不全,棘层略肥厚,真皮毛细血管扩张,管周见轻度-中度淋巴-单核细胞浸润。肺功能提示轻度限制性通气功能障碍,弥散功能正常。胸部CT提示两下肺胸膜下磨玻璃影及网格影(图3a)。诊断考虑未分化结缔组织病,并给予糖皮质激素以及雷公藤治疗。因肺部病变就诊于我科,考虑患者亚临床ILD属于继发病变且没有症状,建议治疗原发病并且密切随访。2014年11月10日因“进行性梗阻感20+d”,患者就诊于某肿瘤医院,诊断为食管鳞形细胞癌Ⅲ级。胸部CT下肺胸膜下网格影更加突出(图3b),外科考虑患者长期口服激素和免疫抑制剂,不适合手术。2014年11月17日开始给予调强放疗:食管瘤床(PTGV1 62 Gy/28 f)和锁骨上及纵隔淋巴结(CTV 50 Gy/28 f)。2015年4月15日因“进行性呼吸困难1个月”就诊。吸氧10 L/min的血气分析提示:PO252 mmHg(1 mmHg=0.133 kPa);PCO235 mmHg;胸部CT提示以两下肺为主的弥漫性磨玻璃影、索条影,与照射野不吻合(图3c)。给予呼吸机辅助通气,并以间质性肺炎急性加重处理,后来,患者病情仍加重,家属放弃治疗。
1.4 病例4 患者男,69岁,因“进行性梗阻感1个月”于2015年3月13日就诊。既往体健。无特殊职业接触史,有吸烟史40年,每天约2包。入院后胃镜确诊为中下段食管鳞形细胞癌。术前查体肺底可闻及捻发音。术前胸部CT提示两下肺胸膜下间隔旁肺气肿以及蜂窝肺改变(图4a、4b)。肺功能提示FVC占预计值的65%;FEV1/FVC占预计值的109%;TLC占预计值的141%;RV/TLC占预计值的165%。提示阻塞性肺气肿和亚临床间质性肺炎存在。术后第四天出现进行性呼吸困难,无发热、咳嗽、咳痰等症状。吸氧5 L/min,指脉氧可维持在90%。血常规白细胞正常,中性粒细胞75%,B型尿钠肽等正常。复查胸部CT(图4c):右侧胸腔胃,两侧胸腔积液,下肺野受压显示不清,两肺弥漫性磨玻璃影。考虑ILD急性加重,给予糖皮质激素、对症及支持治疗后渐缓解出院。

图3 病例3胸部CT
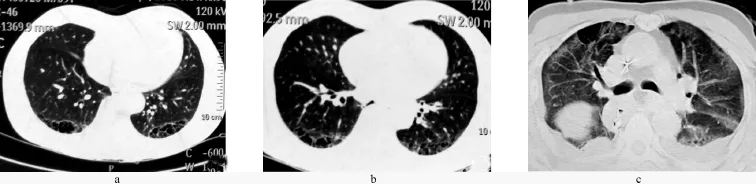
图4 病例4胸部CT
2 讨 论
以“亚临床间质性肺疾病”、“亚临床间质性肺炎”为检索词通过万方数据库及中国知网检索中文文献,时间截至2015年10月,未见相关报道。以“subclinical interstitial lung disease”为检索词通过PubMed数据库进行检索,检索时间截至2015年10月,共检索到亚临床ILD相关文献18篇,其中有个案报道2篇,论著性文章8篇。主要集中在危险因素及加重因素两方面。
亚临床ILD是随着HRCT的普及逐渐被人们认识的疾病。由于目前尚无大规模流行病学研究,其患病率不清楚,仅在吸烟、结缔组织病(CTD)、家族性肺纤维化(FIP)人群以及外科术后的患者中有所报道,其中吸烟者患病率相对较低,在3%~8%,其他波动于11%~57%之间[2]。亚临床ILD的危险因素主要有年龄、吸烟、CTD以及FIP。关于年龄,Copley等[12]及Washko等[13]的研究发现年龄大者其肺部间质性改变更为明显,提示年龄与亚临床ILD的发生、发展有一定的关系。无症状性吸烟者HRCT上的肺间质性改变比不吸烟者更常见[5];正在吸烟者影像学较不吸烟者或已经戒烟者严重,部分戒烟者影像学未再进展[14],提示吸烟有促使ILD恶化趋势。
亚临床ILD的发生与吸烟量的多少以及是否正在吸烟有关[13]。CTD是继发性ILD的重要病因,包括类风湿关节炎[15]、硬皮病[16]、干燥综合征[17]等,其肺部间质性改变的发病率均较高。在FIP的家族成员中,罹患亚临床ILD者8%~22%[18-19],并且比IPF的平均年龄小20余岁。在这些危险因素中,多数又相互影响与交叉。如在FIP人群中[18],亚临床ILD患者的吸烟比例明显高于正常个体,并且吸烟是促使这类患者进展为IPF因素。我们报道的这4例患者年龄均大于50岁,1例为重度吸烟患者,2例为CTD患者。
亚临床ILD无明显特异性症状。捻发音是ILD的特征性体征[20-21],而在亚临床ILD中是否存在捻发音目前亦并不是很明确,但对于高危人群,捻发音的出现则有助于亚临床ILD的诊断[22]。病例2、3均有CTD,诊断时其肺部也均可听到捻发音。实验室检查对于诊断亚临床ILD的价值不大。近年来一些新的血清学指标及基因异常的检测显示出了一定的价值。如血清MMP7(基质金属蛋白酶7)[23],表面蛋白A、D (SP-A,SP-D)、KL-6[14]的升高与亚临床ILD相关。端粒酶基因的突变、SFTPC的突变可能与FIP有关[24-25]。因此对于高危人群进行相关分子或基因检测可能有助于亚临床ILD发现。
亚临床ILD患者的肺功能改变,在不同人群中其表现不尽相同。在对吸烟者的研究中,有亚临床ILD者其肺功能主要表现为肺总量的降低及限制性通气功能障碍,而出现阻塞性通气功能障碍的较少[13]。在FIP的相关研究中,未发现有限制性通气功能障碍的证据[18]。而在CTD中,单纯RA患者与有亚临床ILD者的肺通气功能无明显差异,但弥散量却明显下降,且肺泡-动脉血氧分压差明显增高[15]。而在上述两类患者中吸烟者的弥散下降更为明显。本次报道的4例患者,病例1表现为弥散障碍,病例2病初未行肺功能检查,有症状后表现为限制性通气功能障碍,弥散功能障碍;病例3表现为限制性通气功能障碍,而弥散正常。病例4表现为混合型通气功能障碍,弥散功能因未检测而不详。
HRCT是发现并确诊亚临床ILD的重要手段。Lederer等[26]将亚临床ILD的CT定义为肺野内高衰减区域(HAAs)的CT值界于-600 HU~-250 HU之间者。亚临床ILD的最常见的影像学表现为磨玻璃样阴影、网格影、弥漫性小叶中央型结节、蜂窝、牵拉性支气管扩张、非肺气肿样的囊腔[2]。亚临床ILD不同类型的影像学表现与预后的关系目前研究较少。Tsushima等[14]发现最常见的影像学异常为小叶间隔增厚,而不同的影像学表现中,除了小叶间隔增厚者,其他类型的改变随着时间的推移其病灶均有所增加。本研究中病例1胸部HRCT为缓慢进展,而病例2则在1年内明显进展。
亚临床ILD如何治疗目前还缺少研究。但有研究发现,术前发现合并ILD的患者,围手术期提前预处理有可能预防亚临床ILD患者术后出现急性加重[27-28]。关于亚临床ILD患者的预后和转归目前还不十分清楚。多数认为随着时间推移,大部分可保持长期稳定,但部分患者可因不同的影响因素在短期内出现急性加重,目前研究较多的导致急性加重的因素集中在胸部外科手术[6-7]和放射治疗[8-10],并认为组织病理学提示ILD是术后发生呼吸窘迫的唯一预测因素[7]。肺部放疗也可诱发亚临床ILD急性加重。Launay等[16]对胸部肿瘤的患者行立体定位放疗(SBRT)治疗后发生放射性肺炎(RP)研究认为亚临床ILD是2~5级RP危险因素,并与5级RP的发生相关。而对于有CTD的患者比如RA,则可能缓慢进展[15],并成为这类患者死亡的高危因素[29]。亦有因成分输血导致亚临床ILD急性加重的报道[11]。本研究中病例1无明确的基础疾病,病情基本保持稳定,病例2有干燥综合征,在1年之内逐渐进展为较典型的ILD,病例3为继发于未分化结缔组织病的亚临床ILD,因食管癌放疗诱发的急性加重并死亡,病例4则属于手术诱发加重治疗后好转。
综上所述,亚临床ILD临床上易被忽略,其诊断主要依靠HRCT。HRCT上有上述表现而无明显咳嗽、咳痰、胸闷、气喘症状者,均需警惕该疾病的发生。特别对于有危险因素的亚临床ILD患者,需密切随访,预防急性加重的发生,对于患者的预后有重大意义。
[1]Rosas IO,Dellaripa PF,Lederer DJ,et al.Interstitial lung disease: NHLBI Workshop on the primary prevention of chronic lung diseases[J].AnnAm Thorac Soc,2014,11(Suppl 3):S169-177.
[2]Doyle TJ,Hunninghake GM,Rosas IO.Subclinical interstitial lung disease:why you should care[J].Am J Respir Crit Care Med,2012, 185(11):1147-1153.
[3]Bitterman PB,Rennard SI,Keogh BA,et al.Familial idiopathic pulmonary fibrosis.Evidence of lung inflammation in unaffected family members[J].N Engl J Med,1986,314(21):1343-1347.
[4]Washko GR,Lynch DA,Matsuoka S,et al.Identification of early interstitial lung disease in smokers from the COPD Gene Study[J]. Acad Radiol,2010,17(1):48-53.
[5]King TE Jr.Smoking and subclinical interstitial lung disease[J].N Engl J Med,2011,364(10):968-970.
[6]Chida M,Ono S,Hoshikawa Y,et al.Subclinical idiopathic pulmonary fibrosis is also a risk factor of postoperative acute respiratory distress syndrome following thoracic surgery[J].Eur J Cardiothorac Surg,2008,34(4):878-881.
[7]Saito H,Minamiya Y,Nanjo H,et al.Pathological finding of subclinical interstitial pneumonia as a predictor of postoperative acute respiratory distress syndrome after pulmonary resection[J].Eur J Cardiothorac Surg,2011,39(2):190-194.
[8]Takeda A,Sanuki N,Enomoto T,et al.Subclinical interstitial lung disease:is it a risk factor for fatal radiation pneumonitis following stereotactic body radiotherapy[J].Lung Cancer,2014,83(1):112.
[9]Yamaguchi S,Ohguri T,Matsuki Y,et al.Radiotherapy for thoracic tumors:association between subclinical interstitial lung disease and fatal radiation pneumonitis[J].Int J Clin Oncol,2015,20(1):45-52.
[10]TakedaA,Enomoto T,Sanuki N,et al.Acute exacerbation of subclinical idiopathic pulmonary fibrosis triggered by hypofractionated stereotactic body radiotherapy in a patient with primary lung cancer and slightly focal honeycombing[J].Radiat Med,2008,26(8):504-507.
[11]Woodske M,Donahoe MP,Yazer M,et al.Acute exacerbation of subclinical pulmonary fibrosis after red blood cell transfusion:a case report[J].Transfusion,2012,52(3):589-594.
[12]Copley SJ,Wells AU,Hawtin KE,et al.Lung morphology in the elderly:comparative CT study of subjects over 75 years old versus those under 55 years old[J].Radiology,2009,251(2):566-573.
[13]Washko GR,Hunninghake GM,Fernandez IE,et al.Lung volumes and emphysema in smokers with interstitial lung abnormalities[J].N Engl J Med,2011,364(10):897-906.
[14]Tsushima K,Sone S,Yoshikawa S,et al.The radiological patterns of interstitial change at an early phase:over a 4-year follow-up[J]. Respir Med,2010,104(11):1712-1721.
[15]Gochuico BR,Avila NA,Chow CK,et al.Progressive preclinical interstitial lung disease in rheumatoid arthritis[J].Arch Intern Med, 2008,168(2):159-166.
[16]Launay D,Remy-Jardin M,Michon-Pasturel U,et al.High resolution computed tomography in fibrosing alveolitis associated with systemic sclerosis[J].J Rheumatol,2006,33(9):1789-1801.
[17]Uffmann M,Kiener HP,Bankier AA,et al.Lung manifestation in asymptomatic patients with primary Sjogren syndrome:assessment with high resolution CT and pulmonary function tests[J].J Thorac Imaging,2001,16(4):282-289.
[18]Rosas IO,Ren P,Avila NA,et al.Early interstitial lung disease in familial pulmonary fibrosis[J].Am J Respir Crit Care Med,2007,176 (7):698-705.
[19]Steele MP,Speer MC,Loyd JE,et al.Clinical and pathologic features of familial interstitial pneumonia[J].Am J Respir Crit Care Med, 2005,172(9):1146-1152.
[20]Cordier JF,Cottin V.Neglected evidence in idiopathic pulmonary fibrosis:from history to earlier diagnosis[J].Eur Respir J,2013,42 (4):916-923.
[21]Cottin V,Cordier JF.Velcro crackles:the key for early diagnosis of idiopathic pulmonary fibrosis[J].Eur Respir J,2012,40(3):519-521.
[22]Cottin V,Cordier JF.Subclinical interstitial lung disease:no place for crackles[J].Am J Respir Crit Care Med,2012,186(3):289-290.
[23]Rosas IO,Richards TJ,Konishi K,et al.MMP1 and MMP7 as potential peripheral blood biomarkers in idiopathic pulmonary fibrosis[J]. PLoS Med,2008,5(4):e93.
[24]El-Chemaly S,Ziegler SG,Calado RT,et al.Natural history of pulmonary fibrosis in two subjects with the same telomerase mutation [J].Chest,2011,139(5):1203-1209.
[25]Crossno PF,Polosukhin VV,Blackwell TS,et al.Identification of early interstitial lung disease in an individual with genetic variations in ABCA3 and SFTPC[J].Chest,2010,137(4):969-973.
[26]Lederer DJ,Enright PL,Kawut SM,et al.Cigarette smoking is associated with subclinical parenchymal lung disease:the Multi-Ethnic Study of Atherosclerosis(MESA)-lung study[J].Am J Respir Crit Care Med,2009,180(5):407-414.
[27]Yamaguchi S,Ohguri T,Ide S,et al.Stereotactic body radiotherapy for lung tumors in patients with subclinical interstitial lung disease: the potential risk of extensive radiation pneumonitis[J].Lung Cancer,2013,82(2):260-265.
[28]Ito H,Nakayama H,Yokose T,et al.Prophylaxis for acute exacerbation of interstitial pneumonia after lung resection[J].Asian Cardiovasc ThoracAnn,2014,22(8):948-954.
[29]Doyle TJ,Lee JS,Dellaripa PF,et al.A roadmap to promote clinical and translational research in rheumatoid arthritis-associated interstitial lung disease[J].Chest,2014,145(3):454-463.
R563
D
1003—6350(2016)22—3772—04
10.3969/j.issn.1003-6350.2016.22.057
2016-04-18)
苗立云。E-mail:liyunmiao462@163.com

