帕金森病与血管性帕金森综合征嗅觉功能改变的研究
李嘉,顾承志,朱连海,李丹,黄怀宇
(南通大学第二附属医院神经内科,江苏 南通 226001)
帕金森病与血管性帕金森综合征嗅觉功能改变的研究
李嘉,顾承志,朱连海,李丹,黄怀宇
(南通大学第二附属医院神经内科,江苏 南通 226001)
目的 研究帕金森病(PD)与血管性帕金森综合征(VP)的嗅觉功能改变及其影响因素,探讨Sniffin' Sticks方法(SST)嗅觉功能检查在PD诊断和鉴别诊断中的应用价值。方法选取2015年3~12月在南通大学第二附属医院就诊的PD、VP患者及性别、年龄匹配的同期体检正常对照者(HC组)各40例。采用SST检查方法分别评价PD、VP、HC三组受检者的嗅觉阈值(OT)、嗅觉辨别阈值(OD)、嗅觉识别阈值(OI)及三项得分之和(TDI)总分,比较三组受检者间嗅觉功能的差异,并评估其嗅觉功能与年龄、性别、简易精神状态量表(MMSE)、病程、H-Y分级、统一帕金森病评定量表(UPDRS-Ⅲ)等变量的相关性。应用受试者工作特征曲线(ROC)评价TDI在PD诊断中的价值。结果PD、VP、HC三组受检者间基线资料比较差异均无统计学意义(P>0.05);PD组嗅觉障碍发生率为92.5%,显著高于VP组(37.5%)及HC组(35.0%),差异有统计学意义(P<0.05);PD、VP、HC三组受检者的TDI总分分别为(20.07±4.45)分、(30.53±5.90)分和(31.00±4.99)分,PD组TDI总分明显低于HC组和VP组(P<0.05),而VP组与HC组间比较差异无统计学意义(P>0.05);HC组TDI总分与年龄呈负相关(r=-0.987,P<0.05),与MMSE呈正相关(r= 0.866,P<0.05);PD组TDI总分与病程呈负相关(r=-0.484,P<0.05),与MMSE呈正相关(r=0.618,P<0.05),与性别、年龄、H-Y分级及UPDRS-Ⅲ评分无关;VP组TDI总分与年龄、病程、H-Y分级均呈负相关(分别为r=-0.989,P<0.05;r=-0.770,P<0.05;r=-0.353,P<0.05),与MMSE呈正相关(r=0.838,P<0.05),与性别、UPDRS-Ⅲ评分无关;区分PD组和HC组时TDI总分曲线下面积(AUC)为0.944,临界值为23.313,灵敏度为82.5%,特异度为97.5%;区分PD组和VP组时,TDI总分AUC为0.911,临界值为23.563,灵敏度为87.5%,特异度为82.5%。结论SST嗅觉检测方法临床应用简单、结果可靠、可操作性强;PD存在较为显著的嗅觉障碍,VP嗅觉功能与HC比较无显著差异;使用SST能够为PD的诊断和鉴别诊断提供重要的参考信息。
帕金森病;血管性帕金森综合征;Sniffin'Sticks方法;嗅觉功能
帕金森病(Parkinson's disease,PD)是目前中老年最常见的神经变性疾病之一,其发病率随人口老龄化呈逐年上升趋势,预计2030年PD的发患者数将达到现在的两倍以上[1]。血管性帕金森综合征(vascular parkinsonism,VP)继发于脑血管疾病,占全部继发性帕金森综合征3%~12%[2],临床表现与PD存在重叠,且相当比例的VP患者在病程中对左旋多巴的治疗有较好的反应,临床鉴别较为困难。嗅觉功能减退作为PD的主要非运动症状之一,其发病率高达90%[3],且多早于运动症状数月甚至数年出现[4]。因此嗅觉功能检测为早期识别、诊断PD提供了新的切入点,2013年欧洲神经病学社团联合会(EFNS)及运动障碍学会(MDS-ES)联合推荐运用嗅觉评价鉴别PD与不典型或继发性帕金森综合征(A级证据)[5]。Sniffin'Sticks嗅觉检测方法(Sniffin'Sticks test,SST)在欧洲应用广泛,因操作性强、稳定性好,较其他方法更加适合老年人嗅觉检测。本研究应用SST比较PD、VP及正常对照(healthy control,HC)三者的嗅觉功能及其可能的影响因素,初步探讨SST在PD诊断和鉴别诊断中的应用价值。
1 资料与方法
1.1 一般资料 选取2015年3~12月南通大学第二附属医院神经内科诊治的PD患者40例,所有患者均符合英国帕金森病协会脑库(UKBB)诊断标准[6]。其中男性22例,女性18例,年龄48~84岁,平均(68.40± 9.61)岁;病程0.5~16.5年,平均(7.64±3.95)年;H-Y分级1~4级,平均(2.36±0.74)级;UPDRS-Ⅲ评分15~42分,平均(27.48±6.92)分;MMSE评分23~30分,平均(26.78±2.21)分。选取同期就诊VP患者40例,均符合Winikates临床诊断标准[7]。其中男性23例,女性17例,年龄50~85岁,平均(68.95±8.41)岁;病程0.5~13.5年,平均(6.96±3.00)年;H-Y分级1.5~4级,平均(2.20± 0.60)级;UPDRS-Ⅲ评分18~38分,平均(26.65±5.37)分;MMSE评分23~30分,平均(26.28±2.08)分。按照1:1病例对照匹配原则,匹配同期体检的健康老年人,匹配因素为性别与年龄(匹配范围±5岁)。其中男性24例,女性16例,年龄49~88岁,平均(68.08±9.78)岁;MMSE评分23~30分,平均(26.58±2.46)分。所有纳入受试者都对本研究内容知情并同意;无身体其他不适和家族性遗传疾病史;无头颈部外伤史和鼻部手术史;无化学性及有毒物质暴露史;前鼻镜检查正常,无严重鼻中隔偏曲、鼻甲肥厚、鼻息肉等;两周内无上呼吸道感染;MMSE评分>23分能够配合完成SST主观嗅觉检查。
1.2 嗅觉功能检查方法 ST嗅觉检查套装购自于德国Burghart公司,主要由3部分组成,分别测试嗅觉阈值(odor threshold,OT)、嗅觉辨别阈(odor discrimination,OD)、嗅觉识别阈(odor identification,OI)。三项测试结束后将OT、OD、OI值相加得到TDI总分,用以评估嗅觉功能。满分48分,TDI总分>28分为嗅觉功能正常,16~28分之间为嗅觉减退,<16分为嗅觉丧失。OT测试由48支嗅棒组成,每3支为一组,共16组。以正丁醇作为嗅剂,最高浓度为4%,倍比稀释分为1~16个等级,浓度等级越低,分值越高。给予最高浓度正丁醇的嗅棒熟悉测试气味后开始进行嗅阈测定。每组测试为1支含有正丁醇的嗅棒,另外2支为空白对照,同一浓度下测试2次均答对后下降1个浓度,直到受试者不能嗅出,记录该等级。随后将浓度逐级上升,直到可以正确嗅出正丁醇嗅棒并记录等级。OD测试也由48支嗅棒组成,每3支为一组,共16组,每组嗅棒中有1支嗅棒的气味与另外两支不同,嗅棒放置方法与OT相同,以受试对象正确辨别出目标嗅棒的次数计分。OI测试由16支嗅棒组成,每组1支,共16组。选取橙子、皮革、桂皮、薄荷、香蕉、柠檬、甘草、松节油、大蒜、咖啡、苹果、丁香花、菠萝、玫瑰、茴香、鱼16种味道进行识别,受试者嗅完每支嗅棒后需从提供的4种气味选项中选择认为正确的一项,以受试对象选择嗅棒数计分。
1.3 统计学方法 应用SPSS22.0软件进行数据分析。计量资料采用均数±标准差(±s)进行描述,计数资料采用例数及百分比进行描述。HC、PD和VP组间年龄、性别、MMSE、病程、H-Y及UPDRS的差异性分析采用独立样本t检验、方差分析及χ2检验。HC、PD和VP组间OT、OD、OI、TDI差异性分析及两两比较采用方差分析及LSD多重比较。年龄、性别、MMSE、病程、H-Y、UPDRS与TDI的相关性分析采用Spearman相关分析。OT、OD、OI及TDI的诊断价值采用受试者工作特征曲线(receiver operator characteristic curve,ROC)曲线进行分析。
2 结 果
2.1 三组患者的一般资料比较 PD、VP、HC三组性别、年龄、MMSE评分比较,差异均无统计学意义(P>0.05),见表1。PD、VP两组病程、H-Y分级、UPDRS-Ⅲ评分比较,差异均无统计学意义(P>0.05),见表2。

表1 三组人口学基本信息
表2 PD、VP临床基线资料(±s)
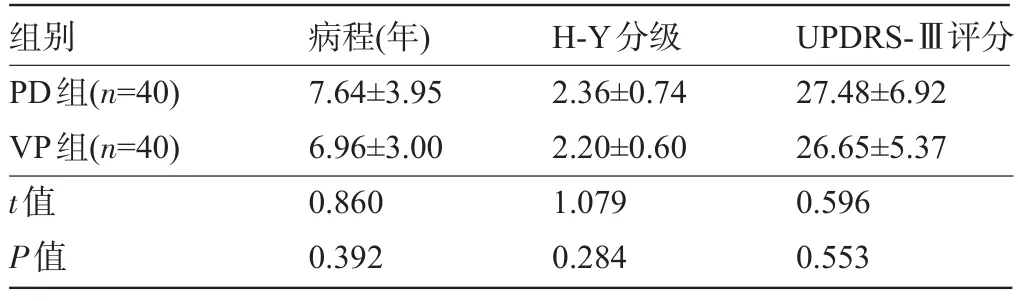
表2 PD、VP临床基线资料(±s)
组别PD组(n=40) VP组(n=40) t值P值病程(年) 7.64±3.95 6.96±3.00 0.860 0.392 H-Y分级2.36±0.74 2.20±0.60 1.079 0.284 UPDRS-Ⅲ评分27.48±6.92 26.65±5.37 0.596 0.553
2.2 三组患者的嗅觉功能比较 PD组嗅觉障碍发生率为92.5%(37/40),VP组为37.5%(15/40),HC组为35.0%(14/40),PD组嗅觉障碍发生率明显高于HC组及VP组。三组间嗅觉功能比较显示OT、OD、OI、TDI差异具有统计学意义(P<0.05)。PD和HC组间OT、OD、OI、TDI差异均有统计学意义(P<0.05)。PD和VP组间OT、OD、OI、TDI差异亦具有统计学意义(P<0.05)。HC和VP组间OT、OD、OI、TDI差异无统计学意义(P>0.05),见表3。
表3 三组间SST嗅觉功能结果(±s)

表3 三组间SST嗅觉功能结果(±s)
注:与HC组比较,aP<0.05;与PD组比较,bP<0.05。
组别HC组(n=40) PD组(n=40) VP组(n=40) F值P值OT 9.03±1.17b5.76±1.81a8.99±1.11b71.778<0.01 OD 10.89±1.73b6.76±1.96a11.09±1.83b70.229<0.01 OI 11.08±2.19b7.55±2.36a10.45±3.01b21.826<0.01 TDI 31.00±4.99b20.07±4.45a30.53±5.90b57.540<0.01
2.3 嗅觉功能影响因素 HC组内,TDI和年龄呈负相关,(r=-0.987,P<0.05);和MMSE呈正相关,(r= 0.866,P<0.05)。PD组内,TDI和MMSE呈正相关,r= 0.618(P<0.05);和病程呈负相关,(r=-0.484,P<0.05);与性别、年龄、H-Y分级及UPDRS-Ⅲ评分无关。VP组内,TDI和年龄呈负相关,r=-0.989(P<0.05);和MMSE呈正相关,(r=0.838,P<0.05);和病程呈负相关,(r=-0.770,P<0.05);和H-Y分级呈负相关,(r=-0.353,P<0.05);与性别、UPDRS-Ⅲ评分无关。
2.4 嗅觉功能ROC曲线 在区分PD组和HC组时,TDI总分ROC曲线见图1;曲线下面积(AUC)为0.944(P<0.001),临界值为23.313,灵敏度为82.5%,特异度为97.5%。OT、OD、OI三项的临界值、灵敏度及特异度见表4。在区分PD组和VP组时,TDI总分ROC曲线见图2;AUPC为0.911(P<0.001),临界值为23.563,灵敏度为87.5%,特异度为82.5%。OT、OD、OI三项的临界值、灵敏度及特异度见表5。

图1 PD组和HC组TDI总分ROC曲线

图2 PD组和VP组TDI总分ROC曲线

表4 PD组和HC组嗅觉功能ROC曲线分析

表5 PD组和VP组嗅觉功能ROC曲线分析
3 讨 论
嗅觉为主观感觉,不易量化,迄今为止,国际尚无统一的嗅觉检查和评定标准。SST是由德国的Kobal和Hummel提出的一种嗅觉量化评价工具,不仅能够定性、定量分析受试对象嗅觉功能水平,还能够客观反应嗅觉损害特点(OT、OD、OI下降),具有携带方便、耗费低、可多次使用的优点。Hummel等[8]发现SST嗅觉评价在65岁以上老年人群中均有更高的灵敏度和特异度。本研究在嗅觉评价过程中,单个受试对象SST测试时间30~40 min,测试内容能够被很好的理解并顺利完成,提示该方法在具有较好的临床可操作性。
本研究中,PD组嗅觉障碍的发生率达92.5%,显著高于VP组及HC组,这与以往国内外相关报道基本一致[9-11]。PD、VP、HC三组内相关分析发现TDI总分均与MMSE呈正相关,提示认识功能是影响嗅觉功能评价的重要因素。HC组内相关分析提示TDI总分与年龄呈负相关,说明年龄也是影响嗅觉功能的重要因素,正常人随年龄增长可存在不同程度的嗅觉减退,与Hummel等[12]报道一致。PD组嗅觉功能较HC组及VP组明显下降,且OT、OD、OI三个分项均显著下降,说明PD确实存在嗅觉障碍,其特点为嗅觉阈值、辨别阈值及识别阈值的全面损害。PD组相关分析结果提示TDI总分与病程呈负相关,与性别、年龄、H-Y分级及UPDRS-Ⅲ等因素无关,推测PD嗅觉障碍于病程平行,出现于疾病的早期,先于临床运动症状群出现,与以往的研究结果相似[13-14]。因此嗅觉障碍可作为PD早期诊断、识别的重要临床指标。
VP组OT、OD、OI及TDI总分与HC组比较差异均无统计学意义,提示VP患者嗅觉功能相对保留。与PD组比较,VP组各项嗅觉功能分值均显著高于PD组,提示SST嗅觉功能检查可以用于区分PD与VP。VP组相关分析结果提示TDI总分与年龄呈负相关,与UPDRS-Ⅲ不相关,提示VP患者嗅觉功能与疾病严重程度无关,可以认为VP的病理过程并不累及嗅觉系统。目前VP患者嗅觉功能的研究较少,Katzenschlager等[15]使用UPSIT方法测定PD与VP嗅觉功能得出的结论与本文一致。本研究中VP嗅觉障碍的发生率与HC组相近也支持此观点。
ROC曲线分析结果TDI总分及OT、OD、OI三个分项在鉴别PD与HC及PD与VP时均有较高的灵敏度和特异度。当TDI总分临界值取23.313时,区分PD与HC的灵敏度为82.5%,特异度为97.5%;TDI总分取临界值23.563时,区分PD与VP的灵敏度为87.5%,特异度为82.5%。两个ROC曲线的AUC值分别为0.944和0.911,说明TDI总分在区别PD与HC及PD与VP时具有较高的诊断价值,提示SST嗅觉功能检查能够为PD的诊断和鉴别诊断提供重要的参考信息。
综上所述,SST嗅觉检测方法临床应用简单、结果可靠、可操作性强。PD存在较为显著的嗅觉障碍,VP嗅觉功能与HC比较无显著差异。使用SST能够为PD的诊断和鉴别诊断提供重要的参考信息。
[1]Schapira AHV.Recent developments in biomarkers in Parkinson disease[J].Current Opinion in Neurology,2013,26(4):395-400.
[2]Thanvi B,Lo N,Robinson T.Vascular parkinsonism—an important cause of parkinsonism in older people[J].Age and Ageing,2005,34 (2):114-119.
[3]Doty RL.Olfaction in Parkinson's disease and related disorders[J]. Neurobiology of Disease,2012,46(3):527-552.
[4]Ross GW,Petrovitch H,Abbott RD,et al.Association of olfactory dysfunction with risk for future Parkinson's disease[J].Annals of Neurology,2008,63(2):167-173.
[5]Berardelli A,Wenning GK,Antonini A,et al.EFNS/MDS-ES/ENS [corrected]recommendations for the diagnosis of Parkinson's disease [J].Eur J Neurol,2013,20(1):16-34.
[6]Hughes AJ,Daniel SE,Kilford L,et al.Accuracy of clinical-diagnosis of idiopathic Parkinson's disease—a clinicopathological study of 100 cases[J].Journal of Neurology Neurosurgery and Psychiatry, 1992,55(3):181-184.
[7]Winikates J,Jankovic J.Clinical correlates of vascular parkinsonism [J].Archives of Neurology,1999,56(1):98-102.
[8]Hummel T,Sekinger B,Wolf SR,et al.'Sniffin'Sticks':Olfactory performance assessed by the combined testing of odor identification, odor discrimination and olfactory threshold[J].Chemical Senses, 1997,22(1):39-52.
[9]Haehner A,Hummel T,Hummel C,et al.Olfactory loss may be a first sign of idiopathic Parkinson's disease[J].Movement Disorders, 2007,22(6):839-842.
[10]杨凌,魏永祥,任媛媛,等.Sniffin'Sticks嗅觉心理物理测试方法的临床应用[J].中华耳鼻咽喉头颈外科杂志,2013,48(9):741-745.
[11]罗懿,万赢,干静,等.Sniffin'Sticks方法评价帕金森病患者的嗅觉功能[J].中华神经科杂志,2014,47(6):370-374.
[12]Hummel T,Kobal G,Gudziol H,et al.Normative data for the"Sniffin'Sticks"including tests of odor identification,odor discrimination, and olfactory thresholds:an upgrade based on a group of more than 3, 000 subjects[J].European Archives of Oto-Rhino-Laryngology, 2007,264(3):237-243.
[13]Haehner A,Boesveldt S,Berendse HW,et al.Prevalence of smell loss in Parkinson's disease—A multicenter study[J].Parkinsonism& Related Disorders,2009,15(7):490-449.
[14]Ross GW,Petrovitch H,Abbott RD,et al.Association of olfactory dysfunction with risk for future Parkinson's disease[J].Annals of Neurology,2008,63(2):167-173.
[15]Katzenschlager R,Zijlmans J,Evans A,et al.Olfactory function distinguishes vascular parkinsonism from Parkinson's disease[J].Journal of Neurology Neurosurgery and Psychiatry,2004,75(12): 1749-1752.
Changes of olfactory function in patients with Parkinson's disease and vascular parkinsonism.
LI Jia,GU Cheng-zhi,ZHU Lian-hai,LI Dan,HUANG Huai-yu.Department of Neurology,the Second Affiliated Hospital of Nantong University,Nantong 226001,Jiangsu,CHINA
ObjectiveTo study the changes of olfactory function in patients with Parkinson's disease(PD)and vascular parkinsonism(VP)and their influence factors,and to explore the application value of olfactory function examination by Sniffin'Sticks test(SST)in diagnosis and differential diagnosis of PD.MethodsForty participants with PD (PD group),40 participants with VP(VP group)and 40 healthy controls(HC group)were included in the study.All of the participants were treated in the Second Affiliated Hospital of Nantong University from March 2015 to December 2015 with gender and age matched.Sniffin'Sticks test(SST)was used to assess olfactory function of all participants in three groups,including odor threshold(OT),odor discrimination(OD),odor identification(OI)and TDI total score.TDI score comparison was performed among PD,VP and HC groups.The relationships between olfactory function and age, gender,Minimum Mental State Examination(MMSE),disease duration,H-Y rating and UPDRS-Ⅲ score were analyzed.Receiver operator characteristic curve(ROC)was used to evaluate the application value of TDI score in diagnosis of PD.ResultsThe baseline characteristic information among PD,VP and HC group showed no statistically significant difference(P>0.05).The prevalence of olfactory dysfunction in PD group was 92.5%,which was significantly higher than that in VP group(37.5%)and HC group(35.0%),P<0.05.The TDI score was(20.07±4.45)in PD group,(30.53± 5.90)in VP group and(31.00±4.99)in HC group.Compared to VP and HC group,TDI score was significantly decreased in PD group,while no statistically significant difference was found between VP and HC groups.In HC group,TDI score was negatively correlated with age(r=-0.987,P<0.05)and positively correlated with MMSE score(r=0.866,P<0.05).In PD group,TDI score was negatively correlated with disease duration(r=-0.484,P<0.05)and positively correlated with MMSE score(r=0.618,P<0.05),but had nothing to do with age,gender,H-Y rating and UPDRS-Ⅲscore.In VP group, TDI score was negatively correlated with age,disease duration and H-Y rating(r=-0.989,P<0.05;r=-0.770,P<0.05;r=-0.353,P<0.05 respectively)and positively correlated whth MMSE(r=0.838,P<0.05),while not correlated with gender and UPDRS-Ⅲscore.The area under ROC curve(AUC)of TDI for discriminating PD group and HC group was 0.944,with cut-off value of 23.313,sensitivity of 82.5%and specificity of 97.5%.The AUC of TDI score for discriminating PD group and VP group was 0.911,with cut-off value of 23.563,sensitivity of 87.5% and specificity of 82.5%.ConclusionSST is a simple,reliable tool for evaluating olfactory function.Obvious olfactory dysfunction was observed in PD patients,and no significant difference was found in olfactory function between VP and HC groups.The use of SST may provide important clinical information with its high sensitivity and specificity in the diagnosis and differential diagnosis of PD.
Parkinson's disease;Vascular parkinsonism;Sniffin'Sticks test;Olfactory function
R742.5
A
1003—6350(2016)22—3618—04
2016-08-30)
江苏省南通市民生示范推广项目(编号:MS32015033)
黄怀宇。E-mail:huanghy6311@163.com

