利妥昔单抗联合丙种球蛋白治疗复发难治性自身免疫性溶血性贫血疗效观察
曹海武,赵晓红,陆时运,周仲昊,柳萍,王智
(南京医科大学附属无锡市第二人民医院血液科,江苏 无锡 214002)
利妥昔单抗联合丙种球蛋白治疗复发难治性自身免疫性溶血性贫血疗效观察
曹海武,赵晓红,陆时运,周仲昊,柳萍,王智
(南京医科大学附属无锡市第二人民医院血液科,江苏 无锡 214002)
目的 观察利妥昔单抗联合丙种球蛋白治疗复发难治性自身免疫性溶血性贫血的临床疗效及不良反应。方法回顾性分析2009年2月至2016年2月我科收治的13例复发难治性自身免疫性溶血性贫血患者的临床资料。7例患者利妥昔单抗采用标准剂量375 mg/m2,第1、8、15、22天;6例患者因高龄或者较差的体能状态原因采用小剂量100~200 mg,每周1次,连用4次。每次于利妥昔单抗给药前1 d使用丙种球蛋白10~20 g。观察疗效及不良反应。结果13例患者CR 7例,PR 4例,NR 2例,CR率为53.8%,总有效率为84.6%。中位反应时间为55 d (21~92 d),中位随访时间为15(3~31)个月,12个月的无复发生存率为90.9%。所有患者耐受性好,不良反应轻微。结论利妥昔单抗联合丙种球蛋白可作为治疗复发难治性自身免疫性溶血性贫血患者的一种有效方法。对于高龄或者较差的体能状态患者使用小剂量利妥昔单抗治疗安全有效。
利妥昔单抗;贫血;溶血性;自身免疫性;丙种球蛋白
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是一种具有特征性的人类自身免疫性疾病。由于机体免疫功能紊乱,产生了自身抗成熟红细胞抗体和(或)补体,其可与位于红细胞表面的抗原相结合,加速破坏红细胞,从而导致不同程度的溶血性贫血的发生[1]。肾上腺皮质激素目前仍是温抗体型AIHA的一线治疗药物,起效时间约3周,总有效率约80%,长期缓解率约为30%[2-3]。但是大多数患者仍然会遭遇复发。临床上对于复发难治性AIHA患者的治疗,除脾切除术外,长期以来常加用细胞毒药物来提高疗效,常用的有环磷酰胺、硫唑嘌呤、长春新碱等。抗CD20的单克隆抗体利妥昔单抗(商品名:美罗华)作为一种新型的生物制剂,能特异性结合B淋巴细胞表面CD20抗原,从而清除体内B淋巴细胞,常用于血液系统恶性肿瘤,特别是惰性和侵袭性非霍奇金淋巴瘤的治疗。考虑到利妥昔单抗能够清除体内B淋巴细胞,近年来,国际上研究报道采用标准剂量或小剂量利妥昔单抗治疗AIHA,均取得较好的疗效[4-6]。笔者应用利妥昔单抗联合丙种球蛋白治疗13例复发难治性AIHA患者,取得了比较满意的疗效,报道如下:
1 资料与方法
1.1 一般资料 2009年2月至2016年2月我科收治的复发难治性AIHA患者13例,其中男性5例,女性8例,年龄39~84岁,中位年龄61岁。其中AIHA 11例,Evans综合征2例。2例有结缔组织病,1例有全身多发淋巴结肿大。复发9例,难治4例。13例患者既往均使用过激素,6例使用过大剂量丙种球蛋白,5例使用过免疫抑制剂(硫唑嘌呤或环磷酰胺),2例曾行血浆置换。13例患者Coombs试验均为阳性,抗体类型为温抗体型12例,1例为冷抗体型。IgG+C3型10例,IgA+C3型1例,IgG型1例,IgM型1例。治疗前血红蛋白为46~87 g/L,中位数63 g/L。2例Evans综合征患者血小板分别为17×109/L和29×109/L。中位网织红细胞为10.7%(1.4%~27.5%)。
1.2 治疗方法 利妥昔单抗采用罗氏制药公司的制剂美罗华,7例患者采用标准剂量375 mg/m2,第1、8、15、22天,6例患者因高龄或者较差的体能状态原因采用小剂量100~200 mg,每周1次,连用4次。为预防过敏反应,利妥昔单抗使用前半小时肛塞吲哚美辛栓50 mg,口服西替利嗪10 mg,静滴地塞米松5 mg,使用利妥昔单抗时监测血压、心率、血氧饱和度变化。所有患者每次均于利妥昔单抗给药前1天使用丙种球蛋白10~20 g,静脉滴注。每周复查血常规、网织红细胞、肝肾功能、血糖、电解质,定期复查Coombs试验。利妥昔单抗治疗前后定期检查外周血淋巴细胞亚群。
1.3 疗效评价标准 疗效评价参照国内通用诊断标准[7]:完全缓解(CR):临床症状消失,血红蛋白、血小板达正常,网织红细胞在正常范围;血清间接胆红素测定在正常范围;直接及间接Coombs试验转为阴性。部分缓解(PR):临床症状基本消失;血红蛋白>80 g/L,网织红细胞比值<0.05;血清总胆红素≤34 μmol/L;Coombs试验阴性,或仍为阳性,但效价较治疗前明显下降。无效(NR):治疗后仍有不同程度的贫血或溶血症状,实验室检查结果未能达到部分缓解标准者。总有效为CR+PR。
1.4 不良反应 观察患者治疗过程中有无畏寒、发热、恶心、呕吐、胸闷、气促、皮疹、皮肤瘙痒等情况,有无合并感染,并且监测血压、血糖、电解质变化。
2 结 果
2.1 治疗效果 13例患者CR 7例,PR 4例,NR 2例,CR率为53.8%,总有效率为84.6%。中位反应时间55 d(21~92 d)。根据利妥昔单抗使用剂量分为标准剂量组和小剂量组,7例标准剂量组中CR 4例,PR 2例,NR 1例,CR率为57.1%,总有效率为85.7%。平均反应时间为(45.17±23.72)d。6例小剂量组中CR 3例,PR 2例,NR 1例,CR率为50%,总有效率为83.3%。平均反应时间为(58.00±22.66)d。小剂量组平均反应时间相对标准剂量组有延迟的趋势。9例患者治疗后抗球蛋白试验转为阴性,2例患者效价较治疗前明显降低。2例有结缔组织病患者中经治疗后1例抗核抗体转阴,1例抗体滴度显著下降。外周血淋巴细胞亚群显示13例患者治疗前中位B淋巴细胞比例为17.97%(2.99%~22.08%),治疗两周后均下降至1%以下,中位B淋巴细胞比例为0.36%(0.13%~0.89%),治疗两个月后中位B淋巴细胞比例为0.57%(0.15%~1.32%),见表1。
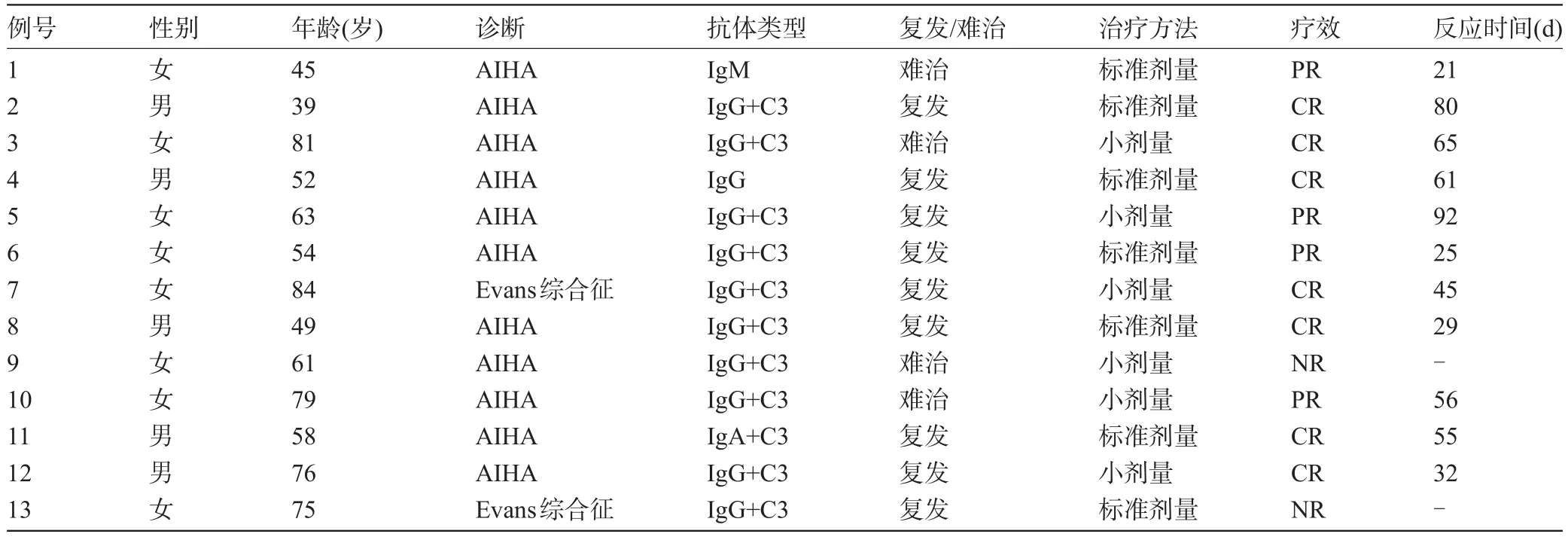
表1 13例患者临床特征及疗效
2.2 不良反应 13例患者中有1例于治疗2周后出现肺部感染,经使用广谱抗生素后感染控制。所有患者均未观察到畏寒发热、胸闷气喘、皮疹等不良反应发生。使用利妥昔单抗后未见血压、血糖升高。
2.3 随访结果 本组患者中位随访时间为15 (3~31)个月,1例伴有全身多发淋巴结肿大患者治疗21 d达PR,但1.5个月后复发,后放弃治疗自动出院。另1例Evans综合征复发患者使用小剂量利妥昔单抗治疗1.5个月后达CR,随访至23个月后疾病再次复发,再次予每周1次小剂量利妥昔单抗治疗3周后达到PR。
3 讨 论
AIHA每年发病率为1~3/10万人,是一种比较罕见的疾病[8]。肾上腺皮质激素作为一线治疗通常认为对80%~85%的AIHA患者有效[9]。对于复发难治性AIHA患者常采取脾切除、免疫抑制剂等二线治疗,有效率分别为60%~70%、40%~60%[3,10]。而利妥昔单抗通常作为二线、三线治疗选择方案[11]。Reynaud等[12]对21个应用利妥昔单抗治疗AIHA的研究进行Meta分析,患者平均年龄50岁,总体反应率(ORR)为73%,CR率为37%,取得CR的时间在治疗的2~4个月后。Barcellini等[13]使用小剂量利妥昔单抗(100 mg,每周1次,连用4次)联合短疗程的类固醇激素作为一线或二线方案治疗23例原发性AIHA,2个月时总反应率为82.6%,所有温抗体型AIHA在随访至6个月及12个月均无复发,而冷抗体型AIHA 6个月及12个月的无复发生存率分别为89%和59%。
由于利妥昔单抗能够清除体内B淋巴细胞,治疗后会产生低丙种球蛋白血症,增加了感染的风险[14]。鉴于此,我科采用利妥昔单抗联合丙种球蛋白治疗复发难治性AIHA患者。研究结果显示CR率为53.8%,总有效率为84.6%,均比文献[12]报导的稍高,可能是因为本研究中无继发于淋巴肿瘤的AIHA。其次,联合应用丙种球蛋白较单独应用利妥昔单抗提高了疗效。国外研究报道在体外试验中大约1/6标准剂量的小剂量利妥昔单抗足够下调自身抗体的产生[5]。因此,对于高龄或者较差的体能状态患者,我们采用了个体化的小剂量利妥昔单抗治疗,结果显示CR率为50%,总有效率为83.3%,平均反应时间相对于标准剂量组有延长的趋势,但因为我们研究病例数量较少,尚需进一步扩大样本量来验证。
使用利妥昔单抗治疗后观察到的毒性包括中性粒细胞减少,长期感染,血液系统恶性肿瘤等等[15]。在我们的研究中,因为每次使用利妥昔单抗前均补充了丙种球蛋白,显著降低了感染发生率。所有患者耐受性良好。
本研究结果显示,12个月的无复发生存率为90.9%(10/11例),因随访时间短,缺乏更长期的无复发生存结果。并且,我们的研究病例数量有限,未能进一步进行单因素多因素分析。
综上所述,个体化联合使用利妥昔单抗和丙种球蛋白治疗复发难治性AIHA,疗效高,不良反应轻微,患者可耐受,值得临床推广应用。
[1]Salama A.Treatment options for primary autoimmune hemolytic anemia:A short comprehensive review[J].Transfus Med Hemother, 2015,42(5):294-301.
[2]Barros MM,Blajchman MA,Bordin JO.Warm autoimmune hemolytic anemia:recent progress in understanding the immunobiology and the treatment[J].Transfus Med Rev,2010,24(3):195-210.
[3]Petz LD.Treatment of autoimmune hemolytic anemias[J].Curr Opin Hematol,2001,8(6):411-416.
[4]Ono K,Sato T,Iyama S,et al.Successful treatment with rituximab in a patient with refractory mixed-type autoimmune hemolytic anemia [J].Rinsho Ketsueki,2013,54(11):2053-2055.
[5] Barcellini W,Zaja F,Zaninoni A,et al.Sustained response to low-dose rituximab in idiopathic autoimmune hemolytic anemia[J]. Eur J Haematol,2013,91(6):546-551.
[6]Moriya K,Matsuhashi T,Onuma M,et al.Successful treatment with rituximab of an infant with refractory autoimmune hemolytic anemia [J].Int J Hematol,2013,98(2):237-239.
[7]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社, 2007:68-71.
[8]Gehrs BC,Friedberg RC.Autoimmune hemolytic anemia[J].Am J Hematol,2002,69(4):258-271.
[9]King KE,Ness PM.Treatment of autoimmune hemolytic anemia[J]. Semin Hematol,2005,42(3):131-136.
[10]Patel NY,ChilsenAM,Mathiason MA,et al.Outcomes and complications after splenectomy for hematologic disorders[J].Am J Surg, 2012,204(6):1014-1019.
[11]Maung SW,Leahy M,O'Leary HM,et al.A multi-centre retrospective study of rituximab use in the treatment of relapsed or resistant warm autoimmune haemolytic anaemia[J].Br J Haematol,2013,163 (1):118-122.
[12]Reynaud Q,Durieu I,Dutertre M,et al.Efficacy and safety of rituximab in auto-immune hemolytic anemia:A meta-analysis of 21 studies[J].Autoimmun Rev,2015,14(4):304-313.
[13]Barcellini W,Zaja F,Zaninoni A,et al.Low-dose rituximab in adult patients with idiopathic autoimmune hemolytic anemia:clinical efficacy and biologic studies[J].Blood,2012,119(16):3691-3697.
[14]Besada E,Koldingsnes W,Nossent JC.Serum immunoglobulin levels and risk factors for hypogammaglobulinaemia during long-term maintenance therapy with rituximab in patients with granulomatosis with polyangiitis [J].Rheumatology (Oxford),2014,53(10): 1818-1824.
[15]Garvey B.Rituximab in the treatment of autoimmune haematological disorders[J].Br J Haematol,2008,141(2):149-169.
Clinical study of rituximab combined with gamma globulin in the treatment of relapsed or refractory autoimmune hemolytic anemia.
CAO Hai-wu,ZHAO Xiao-hong,LU Shi-yun,ZHOU Zhong-hao,LIU Ping,WANG Zhi.Department of Hematology,the Second Hospital of Wuxi City Affiliated to Nanjing Medical University,Wuxi 214002,Jiangsu,CHINA
ObjectiveTo observe the clinical efficacy and adverse reactions of rituximab combined with gamma globulin protein in the treatment of recurrent and refractory autoimmune hemolytic anemia(AIHA).MethodsThe clinical data of 13 cases of recurrent and refractory autoimmune hemolytic anemia patients,who admitted to Department of Hematology of our hospital from February 2009 to February 2016,were retrospectively analyzed.Seven patients were treated by rituximab with standard dose of 375 mg/m2on the first day,eighth day,fifteenth day and twenty-second day, and six cases for old ages or poor physical conditions were treated by small dose of 100-200 mg once a week for four weeks.One day before each administration of rituximab,gamma globulin of 10-20 g was administrated.The clinical effects and side effects of patients were evaluated.ResultsAmong the 13 cases,7 case were complete remission(CR), 4 cases were partial remission(PR),and 2 cases were no remission(NR).The CR rate was 53.8%,and the total clinical effectiveness rate was 84.6%,with the median response time of 55(21-92)days.The median follow-up time was 15 (3-31)months,and the relapse-free survival rate of 12 months was 90.9%.All patients were well tolerated and the adverse reactions were mild.ConclusionRituximab combined with gamma globulin is an effective treatment for patients with relapsed and refractory autoimmune hemolytic anemia.For patients with old ages or poor physical conditions,rituximab of small doses is safe and effective.
Rituximab;Anemia;Hemolytic;Autoimmune;Gamma globulin
R556
A
1003—6350(2016)22—3637—03
10.3969/j.issn.1003-6350.2016.22.008
2016-06-01)
南京医科大学科技发展基金面上项目(编号:2012NJMU254)
王智。E-mail:drwang1965@163.com

