康复新液与顺铂、伊立替康联用对大肠癌HCT116荷瘤小鼠肿瘤生长和造血系统的影响*
邹俊波,熊永爱
(成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室省部共建国家重点实验室培育基地 成都 610075)
康复新液与顺铂、伊立替康联用对大肠癌HCT116荷瘤小鼠肿瘤生长和造血系统的影响*
邹俊波**,熊永爱
(成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室省部共建国家重点实验室培育基地 成都 610075)
目的:考察康复新液与顺铂、伊立替康等用人结肠癌细胞HCT116荷瘤小鼠的联合用药效果。方法:SPF级C57BL/6小鼠110只,分别腹水接种HCT116制备种鼠模型,6-7天后,分离肿瘤组织制备HCT116荷瘤小鼠模型90只,随机分为模型组、康复新液组、顺铂组、康复新液联合顺铂组、伊立替康组、康复新液联合伊立替康组共6组,按实验方案给药16天,期间每3天测定一次动物体质量,16天后荷瘤小鼠摘眼球取血,测定血常规,处死后剥离肿瘤组织,测定肿瘤体积,计算小鼠FBW/IBW比值,分取骨髓,测定骨髓DNA含量,观察造血祖细胞集落,流式细胞仪检测骨髓细胞CD34+抗原的表达。结果:与模型组相比,各给药组瘤重均显著减轻(P<0.05),康复新液及联合用药组动物PLT、RBC、HGB水平均显著升高(P<0.05,P<0.01),顺铂组、伊立替康组小鼠血常规各项水平和骨髓DNA含量、造血祖细胞集落数量以及骨髓细胞CD34+抗原表达率均显著下降(P<0.05,P<0.01);与顺铂组、伊立替康组相比,与康复新液联合使用可明显抑制化疗药物导致的体质量下降(P<0.05),升高实验动物血常规水平(P<0.05,P<0.01),提升小鼠骨髓DNA含量、造血祖细胞集落数量以及骨髓细胞CD34+抗原表达率(P<0.05,P<0.01)。结论:康复新液具有明显抑制HCT116荷瘤小鼠肿瘤生长的作用,且与顺铂、伊立替康联合应用,可有效改善后二者引起的骨髓抑制作用,康复新液联合一线抗肿瘤药物的应用前景广阔。
康复新液 结肠癌 顺铂 伊立替康 联合用药
近年来,中药对抗化疗方案引起的副作用具有显著的效果[1]。康复新液为美洲大蠊提取物制备的国家二类新药,最主要用于消化系统溃疡,如胃溃疡、十二支肠溃疡、结肠炎等以及外部创伤,如烧烫伤、金创伤等的修复。康复新液在抗肿瘤方面的应用受到越来越多的重视,众多学者的研究表明其对呼吸系统肿瘤、生殖系统肿瘤、消化系统肿瘤等均具有明显的抑制作用。
由此推测,康复新液既具有良好的修复作用,还对肿瘤细胞生长具有一定的抑制作用。因此,具备与化疗药物联合用药的理论基础。日本学者研究[1]表明,中药在对抗化疗方案引起的副作用方面,具有显著的效果。本实验拟开展康复新液与顺铂、伊立替康等药物联合用于异体移植结肠癌小鼠的实验研究,相关研究未见国内外文献报道。
1 实验材料
1.1 实验动物
SPF级C57BL/6小鼠,体质量16-20 g,雌雄各半,由成都达硕生物科技有限公司提供,动物合格证号:川实动管质SCXK(川)2013-24。由成都中医药大学药学院动物观察室饲养,实验动物设施条件合格证号:川实动管使第2009-124号。
1.2 实验药物及试剂
康复新液(100 mL/瓶,湖南中南科伦药业有限公司,批号:M140937);盐酸伊立替康注射液(40 mg/支,美国辉瑞制药有限公司,批号:15050611);顺铂注射液(30 mg/支,太极集团四川太极制药有限公司,批号:14080014);重组人粒细胞集落刺激因子(Recombinant Human Granulocyte-Colony Stimulating Factor,rhG-CSF)注射液(齐鲁制药有限公司,国药准字:S19990049,批号:140812);重组小鼠干细胞因子(Recombinat Mouse Stem Cell Factor,rmSCF)、重组小鼠白介素3(Recombinant Mouse Interleukin-3,rmIL-3)、重组小鼠促血小板生成素(Recombinant Mouse Thrombopoietin,rmTPO)(以色列ProSpec公司,批号分别为CYT-275、CYT-371 CYT-346);鼠抗人CD34+单克隆抗体(北京博奥森公司,批号:BA0763);胎牛血清(Fetal Calf Serum,FBS)、PBS缓冲液(美国Hyclone公司,批号分别为:SH30084.03、AWJ20601);青链霉素双抗,青霉素10 000 U·mL-1,链霉素10 000 μg·mL-1(北京友康基业生物科技有限公司,批号:RS0008;牛血清白蛋白(Bovine Serum Albumin,BSA)、L-谷氨酰胺、二巯基乙醇(美国sigma公司,编号分别为:sigma7888、sigma49419、M3148;RPMI 1640培养基(美国Gibco公司,批号:12633012)。
1.3 肿瘤细胞
人结肠癌HCT116肿瘤细胞,由四川大学华西医学中心肿瘤生物治疗实验室提供。
1.4 实验仪器
十万分之一分析天平(北京赛多利斯仪器系统有限公司);BPH-300倒置相差显微镜(上海比目仪器有限公司);MEK6318K全自动血细胞分析仪(上海广电医用电子仪器有限公司); BD FACSCalibur流式细胞仪(北京东迅天地医疗仪器有限公司)。
2 实验方法
2.1 HCT116荷瘤小鼠模型制备
将HCT116肿瘤细胞从液氮罐中取出,37℃迅速解冻,将浓度调整至1×108个/mL以供注射。腹腔接种HCT116细胞小鼠6-7 天后腹水形成明显[1],将生长7天的腹水模型种鼠颈椎脱臼处死,蜡版固定,用碘伏、75%乙醇腹部局部消毒,在无菌条件下取出乳白色浓稠活体腹水,与生理盐水注射液1:3稀释,移植于用75%乙醇消毒的受试小鼠,每只小鼠按照0.2 mL接种于右腋下皮肤[2]。
2.2 动物分组及给药
小鼠接种肿瘤细胞后次日按照体质量随机分为 6组,每组15只,即模型组(0.5% CMC-Na溶液)、康复新液组、顺铂组、康复新液联合顺铂组、伊立替康组、康复新液联合伊立替康组。给药剂量及方式见表1。
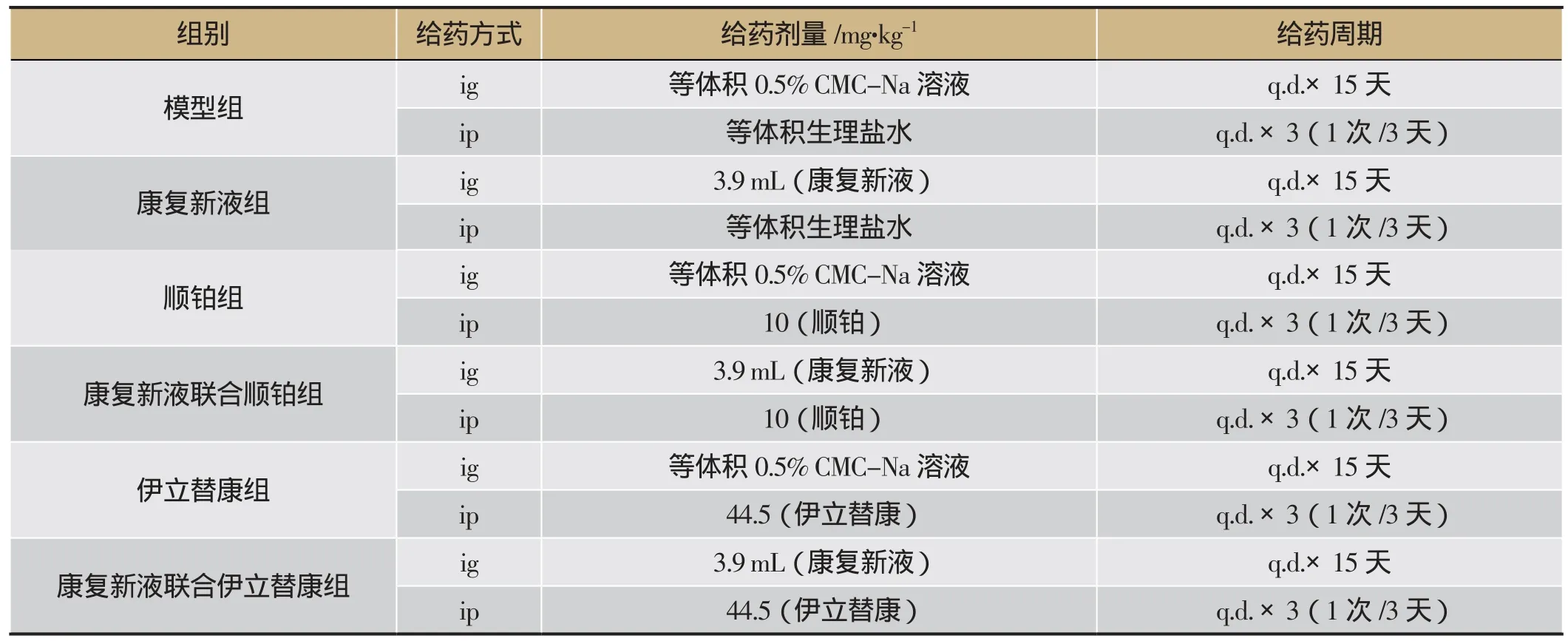
表1 康复新液联合用药实验药物给药方案
2.4 抑瘤率的测定
按表1给药方案给药。第16 天处死小鼠,取肿瘤组织称瘤重,计算抑瘤率。
抑瘤率(%)=(模型组的平均瘤重-治疗组平均瘤重)/模型组的平均瘤重×100%
2.5 小鼠给药前后体质量、体质量比值(FBW / IBW)、死亡情况
IBW为给药前小鼠体质量,FBW为16天时小鼠去除瘤重的体质量。采用FBW/IBW比值大小衡量药物的毒性作用大小。FBW/IBW>0.85,提示药物的毒副作用不明显,小鼠能耐受;比值小于0.85则提示药物对小鼠有一定的毒副作用;治疗期间如给药组动物死亡超过20%,表示药物具有毒性反应。
2.6 血常规测定
各组动物摘眼球取血,至于含EDTA-2K的抗凝管中,测定血常规。
2.7 骨髓细胞DNA含量
各组实验动物脱颈处死后,以75%酒精浸泡5 min,在超净工作台取左侧股骨,用0.005 mol·L-1CaCl2冲洗骨髓至3 mL 淋巴细胞分离液中,2 000 r·min-1离心20 min。收集单个核细胞层细胞,用无钙、镁离子PBS 液洗涤3次后配成每管109/L 的细胞悬液,离心弃上清,各管加入0.5 mL 碘化丙啶(PI)染液,置4℃冰箱30 min 混匀,用300目尼龙网过滤后待测。
2.8 造血祖细胞集落观察
2.8.1 单个有核细胞悬液(BMC)制备及计数
取小鼠胫骨,6号针头RPMI 1640冲出骨髓细胞,4号针头过滤制成骨髓单个有核细胞悬液,用培养液调配成1×106/mL有核细胞悬液,置于4℃冰箱备用。
2.8.2 造血祖细胞培养
将造血祖细胞粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E、CFU-E)、巨核系祖细胞(CFUMeg)培养于96孔培养板中培养,每组8孔,培养条件见下表2。将培养板放于在37℃、5% CO2、饱和湿度条件下培养7天,并于第3天倒置显微镜计数CFU-E细胞集落数,于第7天分别计数CFU-GM、BFU-E、CFU-Meg。其中,BFU-E、CFU-GM以多于50个细胞为一个集落,CFU-E以8-32个细胞为一个集落,CFU-Meg以多于3个细胞为一个集落。
2.9 骨髓细胞CD34+抗原表达检测
用含0.2%牛血清白蛋白的PBS 1640缓冲液冲洗小鼠右侧股骨骨髓细胞,取约106个细胞混悬液,离心,弃去上清液,加30 μL 正常小鼠血清以封闭非特异结合位点,再加入10 μL FITC 标记的大鼠抗小鼠CD34+抗体,对照管加入10 μL 相应对照抗体,4℃避光反应30 min。加入2 mL 红细胞裂解液,作用5 min,洗涤细胞2次,加入终浓度为3 μg·mL-1的PI 染液,采用流式细胞仪检测骨髓细胞CD34+抗原表达。

表2 造血祖细胞培养体系
2.10 统计方法

图1 康复新液联合用药对HCT116 结肠癌荷瘤小鼠体质量(含瘤重)的影响
3 实验结果
3.1 抑瘤率测定结果
由表3可知,康复新液(3.9 mL·kg-1)连续灌胃给药15天,可显著减轻瘤重(P<0.01),抑瘤率为30.14%,表明康复新液具有较好的抑制HCT116肿瘤生长的作用;顺铂抑瘤率为41.45%,具有明显抑瘤作用(P<0.05),康复新液联合顺铂可显著减轻瘤重(P<0.01),抑瘤率54.78%;伊立替康可显著减轻瘤重(P<0.01),抑瘤率42.90%,康复新液联合伊立替康组瘤重显著减轻(P<0.01),抑瘤率为56.23%。康复新液联合用药后具有增加顺铂、伊立替康抑制肿瘤作用的趋势。
3.2 小鼠给药前后体质量变化结果
由图1可知,实验结束时体质量与模型组相比,顺铂、伊立替康组实验动物体质量自第3天开始,即第2次称量动物体质量时明显下降(P<0.05),随着时间推移,体质量下降幅度越来越大(P<0.05);与康复新液联用后,可明显抑制化疗药物引起的实验动物体质量下降(P<0.05)。
3.3 小鼠给药前后体质量比值(FBW / IBW)及死亡比例测定结果
由表4可知,顺铂组FBW /IBW值小于0.85,提示顺铂毒副作用明显,联合应用康复新液后,FBW / IBW值达到0.85,表明康复新液对顺铂的副作用有明显改善;伊立替康组FBW /IBW值小于0.85,提示其有副作用,与康复新液联合应用后FBW /IBW值显著提高至0.86,表明康复新液对伊立替康的副作用减少。各给药组连续灌胃给药16天,康复新液组因动物打架意外致死1只,伊立替康组因接种操作的失误(可能由于接种时肿瘤细胞液外漏),致使1只小鼠无肿瘤生长,顺铂组及相关联合用药组动物各死亡2只,进行数据统计时未计入这些小鼠的体质量数据。
表3 康复新液联合用药对HCT116 结肠癌荷瘤小鼠抑瘤率的影响(±s)
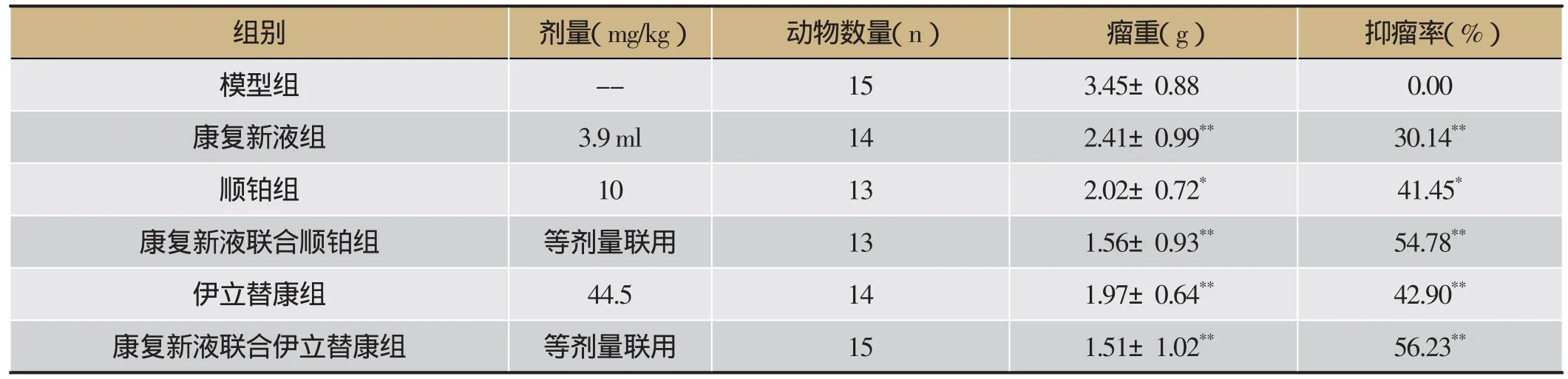
表3 康复新液联合用药对HCT116 结肠癌荷瘤小鼠抑瘤率的影响(±s)
注:与模型对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01;与伊立替康组比较,ΔP<0.05,ΔΔP<0.01,下同。
组别 剂量(mg/kg) 动物数量(n) 瘤重(g) 抑瘤率(%)模型组 -- 15 3.45±0.88 0.00康复新液组 3.9 ml 14 2.41±0.99** 30.14**顺铂组 10 13 2.02±0.72* 41.45*康复新液联合顺铂组 等剂量联用 13 1.56±0.93** 54.78**伊立替康组 44.5 14 1.97±0.64** 42.90**康复新液联合伊立替康组 等剂量联用 15 1.51±1.02** 56.23**
3.4 实验动物外周血象测定结果
由表5、6可知,①PLT水平:与模型组相比,康复新液联合用药组动物PLT水平显著升高(P<0.05,P<0.01),与顺铂组、伊立替康组相比,康复新液联合用药组动物PLT水平显著升高(P<0.05,P<0.01)。②HGB水平:与模型组相比,康复新液组以及康复新液联合用药组HGB水平显著升高(P<0.05,P<0.01),顺铂、伊立替康组HGB水平显著下降(P<0.01),联用康复新液后显著升高(P<0.05,P<0.01)。③RBC水平:与模型组相比,康复新液及联合用药组RBC水平显著升高(P<0.05,P<0.01),与顺铂、伊立替康组相比,联合应用康复新液后动物RBC水平显著升高(P<0.01)。④WBC水平:与模型组相比,康复新液均可显著升高实验动物WBC水平(P<0.05,P<0.01),顺铂、伊立替康组WBC水平显著下降(P<0.05,P<0.01),联用康复新液可显著提高顺铂、伊立替康导致的WBC水平下降(P<0.01)。⑤NEU水平及NEU百分比:与模型组相比,各实验组无显著差异(P>0.05),与顺铂、伊立替康组组相比,康复新液组实验动物NEU水平及NEU百分比显著升高(P<0.05,P<0.01)。
3.5 骨髓DNA含量测定结果
由图2可知,与模型组比较,顺铂组、伊立替康组小鼠骨髓DNA极含量显著下降(P<0.01);与顺铂组比较,康复新液联合顺铂组小鼠骨髓DNA含量显著升高(P<0.05);与伊立替康组相比,康复新液联合伊立替康组小鼠骨髓DNA含量显著升高(P<0.05)。
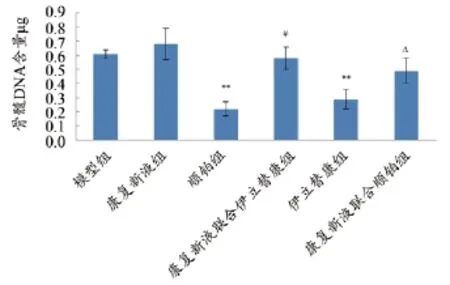
图2 康复新液联合用药对HCT116 结肠癌荷瘤小鼠骨髓DNA含量的影响(±s)
表4 康复新液联合用药对HCT116 结肠癌荷瘤小鼠体质量及死亡比例的影响(±s)
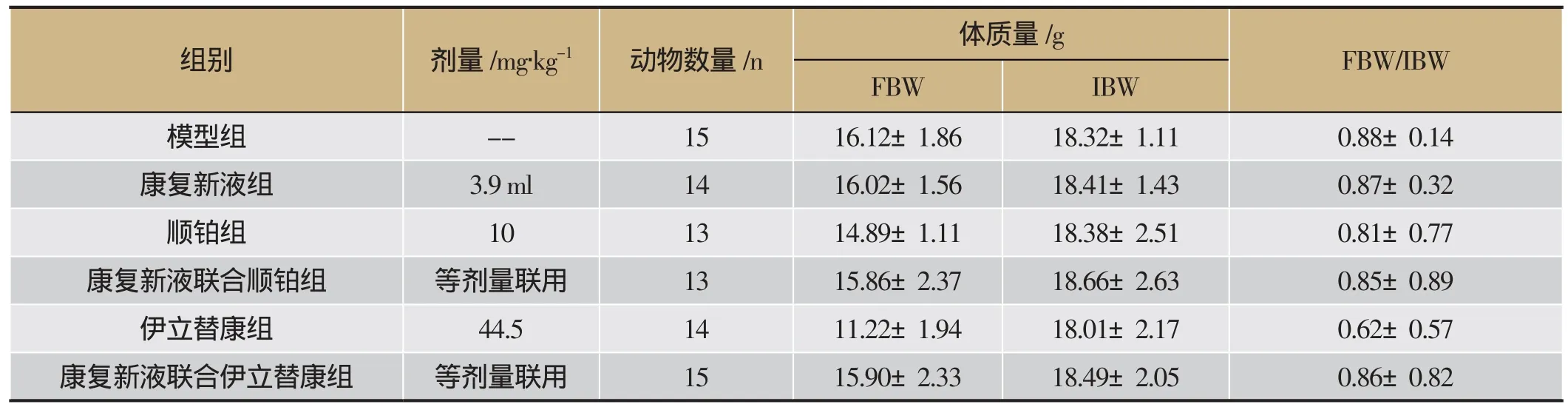
表4 康复新液联合用药对HCT116 结肠癌荷瘤小鼠体质量及死亡比例的影响(±s)
组别 剂量/mg∙kg-1 动物数量/n 体质量/g FBW/IBW FBW IBW模型组 -- 15 16.12±1.86 18.32±1.11 0.88±0.14康复新液组 3.9 ml 14 16.02±1.56 18.41±1.43 0.87±0.32顺铂组 10 13 14.89±1.11 18.38±2.51 0.81±0.77康复新液联合顺铂组 等剂量联用 13 15.86±2.37 18.66±2.63 0.85±0.89伊立替康组 44.5 14 11.22±1.94 18.01±2.17 0.62±0.57康复新液联合伊立替康组 等剂量联用 15 15.90±2.33 18.49±2.05 0.86±0.82
表5 康复新液联合用药对HCT116 结肠癌荷瘤小鼠外周血象的影响(±s)
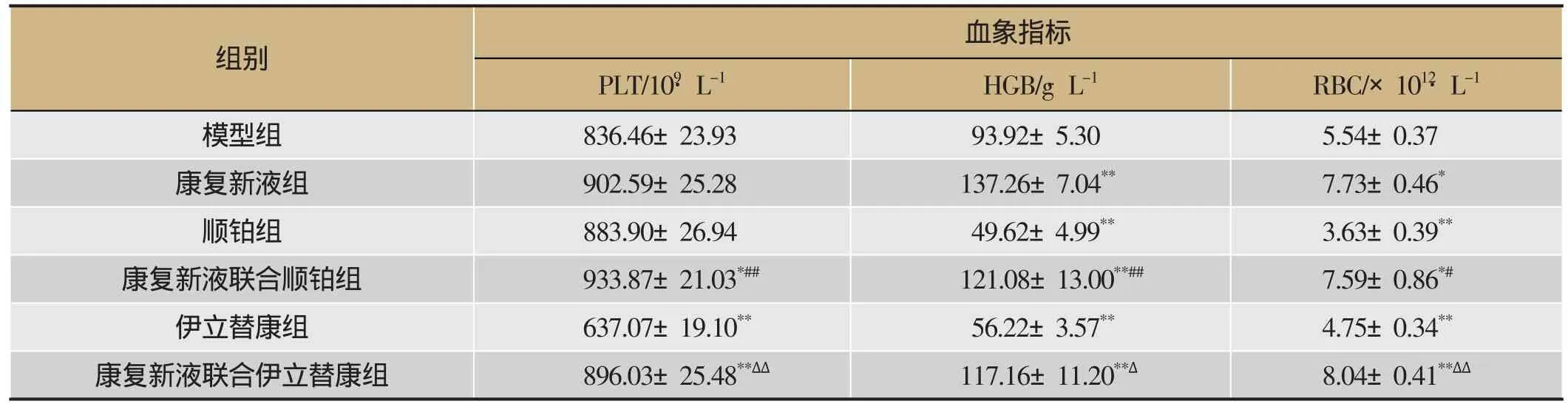
表5 康复新液联合用药对HCT116 结肠癌荷瘤小鼠外周血象的影响(±s)
血象指标PLT/109·L-1 HGB/g·L-1 RBC/×1012·L-1模型组 836.46±23.93 93.92±5.30 5.54±0.37康复新液组 902.59±25.28 137.26±7.04** 7.73±0.46*顺铂组 883.90±26.94 49.62±4.99** 3.63±0.39**康复新液联合顺铂组 933.87±21.03*## 121.08±13.00**## 7.59±0.86*#伊立替康组 637.07±19.10** 56.22±3.57** 4.75±0.34**康复新液联合伊立替康组 896.03±25.48**ΔΔ 117.16±11.20**Δ 8.04±0.41**ΔΔ组别
表6 康复新液联合用药对HCT116 结肠癌荷瘤小鼠外周血象的影响(±s)
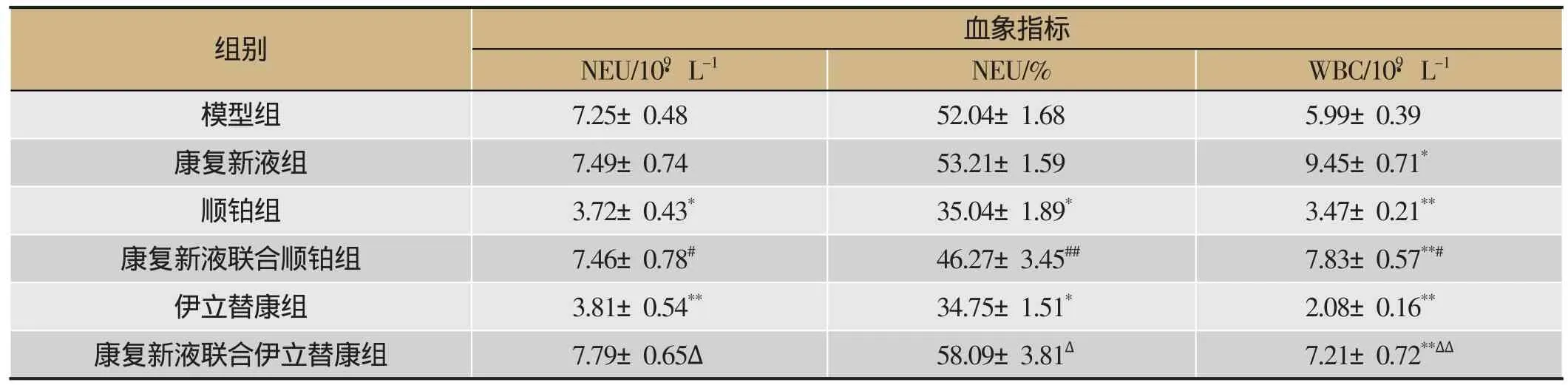
表6 康复新液联合用药对HCT116 结肠癌荷瘤小鼠外周血象的影响(±s)
血象指标NEU/109·L-1 NEU/% WBC/109·L-1模型组 7.25±0.48 52.04±1.68 5.99±0.39康复新液组 7.49±0.74 53.21±1.59 9.45±0.71*顺铂组 3.72±0.43* 35.04±1.89* 3.47±0.21**康复新液联合顺铂组 7.46±0.78# 46.27±3.45## 7.83±0.57**#伊立替康组 3.81±0.54** 34.75±1.51* 2.08±0.16**康复新液联合伊立替康组 7.79±0.65Δ 58.09±3.81Δ 7.21±0.72**ΔΔ组别
3.6 对造血祖细胞的影响
由表7可知,与模型组相比,顺铂组、伊立替康组以及相关联合用药组骨髓CFU-GM、BFU-E、CFU-E与CFU-Meg集落数量均显著下降(P<0.05,P<0.01);与顺铂组相比,康复新液联合顺铂组能显著升高骨髓CFU-GM、BFU-E、CFU-E与CFU-Meg集落数(P<0.05,P<0.01);与伊立替康组相比,康复新液联合伊立替康组能显著升高BFU-E、CFU-GM、CFU-E与CFU-Meg集落数(P<0.05,P<0.01)。
3.7 骨髓细胞CD34+表达率测定结果
由图3可知,与模型组比较,除康复新液组外,其余各组小鼠骨髓细胞CD34+表达率显著下降(P<0.05,P<0.01);与顺铂组比较,康复新液联合顺铂组骨髓细胞CD34+表达率明显升高(P<0.05);与伊立替康组比较,康复新液联合伊立替康组骨髓细胞CD34+表达率极显著升高(P<0.01)。各实验组小鼠骨髓造血干细胞CD34+流式细胞检测分别见图4-9。

图3 康复新液联合用药对HCT116 结肠癌荷瘤小鼠骨髓细胞CD34+表达率的影响(±s)
4 讨论
大肠癌,又称结肠癌,是常见的消化道恶性肿瘤,可发生在结肠的任何部位。在北美、西欧发病率有较高,美国结肠癌占全部癌死亡原因的第2位。在中国大部分省市死亡率占全部恶性肿瘤死亡率的第5-6位,近年来有上升趋势。其发病率随年龄而增长,从40岁开始上升,60-75岁达到峰值。
大肠癌目前常用的治疗方案仍为单一药物化疗,较为有效的化疗药物主要包括顺铂类(DDP)、伊立替康(CPT-11)、氟尿嘧啶类、亚硝脲类、丝裂霉素(MMC)、蒽环类抗生素等,但这些药物的疗效仍有一定的局限。
如顺铂是以二价铂同两个氯原子和两个氨分子结合的重金属络合物,类似于双功能烷化剂,可抑制DNA的复制过程[2-4]。骨髓抑制为最主要的剂量限制性毒性[5]。1995年WHO(世界卫生组织)对上百种化疗药进行综合排名,顺铂名列第2;另据统计在中国以顺铂为主的化疗方案或含顺铂的联合化疗方案占所有化疗方案的70%-80%[6]。
伊立替康是喜树碱的半合成衍生物。中性粒细胞减少症为该药的剂量限制性毒性[7]。在伊立替康单药治疗中:78.7%的患者均出现过中性粒细胞减少症,严重者(中性粒细胞计数<500/mm3)占22.6%。在可评价的周期内,18%出现中性粒细胞计数<1 000/mm3,其中7.6%中性粒细胞计数<500/mm3。通常在第22天完全恢复正常。62%的患者,按周期为17%,出现严重中性粒细胞减少症合并发热。10.3%的患者(按周期为2.5%)出现感染;5.3%的患者(按周期为1.1%)出现严重中性粒细胞减少症引起的感染,2例出现过中性粒细胞减少症,严重者(中性粒细胞计数<500/mm3)占22.6%。
表7 康复新液联合用药对HCT116 结肠癌荷瘤小鼠造血祖细胞的影响(±s)
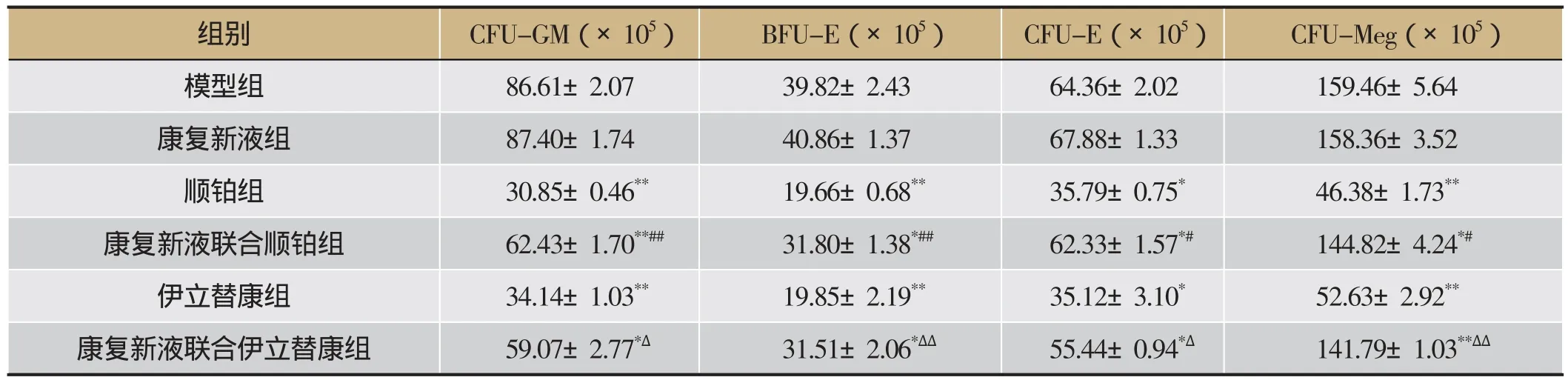
表7 康复新液联合用药对HCT116 结肠癌荷瘤小鼠造血祖细胞的影响(±s)
组别 CFU-GM(×105) BFU-E(×105) CFU-E(×105) CFU-Meg(×105)模型组 86.61±2.07 39.82±2.43 64.36±2.02 159.46±5.64康复新液组 87.40±1.74 40.86±1.37 67.88±1.33 158.36±3.52顺铂组 30.85±0.46** 19.66±0.68** 35.79±0.75* 46.38±1.73**康复新液联合顺铂组 62.43±1.70**## 31.80±1.38*## 62.33±1.57*# 144.82±4.24*#伊立替康组 34.14±1.03** 19.85±2.19** 35.12±3.10* 52.63±2.92**康复新液联合伊立替康组 59.07±2.77*Δ 31.51±2.06*ΔΔ 55.44±0.94*Δ 141.79±1.03**ΔΔ
近年来,在这些药物基础上制定了针对结肠癌的化疗方案,主要包括FM方案、5-FU/CF方案、5-FU/LV和5-FU/CF/LV方案,上述方案成本高昂,带给患者沉重的经济负担,更重要的是化疗药物引起的副作用严重影响了患者的生活质量,其中最突出的仍是骨髓抑制作用,表现为骨髓造血功能低下,血细胞前体活性下降,周围血细胞数量减少,骨髓抑制进一步限制了相关化疗药物的临床使用,目前尚无理想应对方案。

图4 模型组小鼠骨髓细胞CD34+抗原表达
图5 康复新液组小鼠骨髓细胞CD34+抗原表达

图6 顺铂组小鼠骨髓细胞CD34+抗原表达
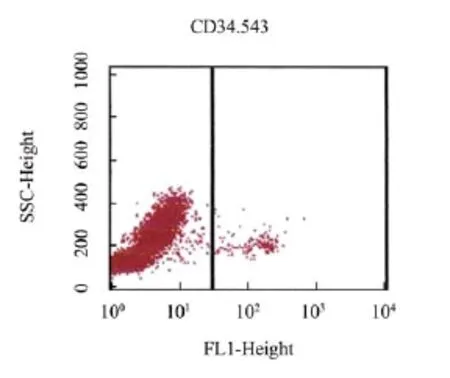
图7 康复新液联合顺铂组小鼠骨髓细胞CD34+抗原表达
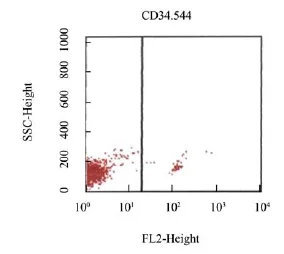
图8 伊立替康组小鼠骨髓细胞CD34+抗原表达

图9 康复新液联合伊立替康组小鼠骨髓细胞CD34+抗原表达
目前康复新液最主要用于消化系统溃疡,如胃溃疡、十二支肠溃疡、结肠炎等以及外部创伤,如烧烫伤、金创伤等的修复。近年来其在抗肿瘤方面的应用受到越来越多的重视,有学者研究表明康复新液具有诱导胃癌BGC-823细胞凋亡的作用,且抑制作用呈时间浓度依赖关系[8],美洲大蠊提取物通过上调Fas、Fas R和P53等凋亡基因,下调Bcl-2抑制凋亡基因,阻止细胞于G0/G1期从而抑制细胞增殖,诱导细胞凋亡而显著抑制3LL细胞肺癌在小鼠体内的生长[9],通过线粒体途径诱导该细胞凋亡抑制人肝癌细胞Bel-7402的增殖[10],下调小鼠血管内皮生长因子的表达,抑制肿瘤血管生成从而抑制H22肝癌小鼠肿瘤生长[11]。尚有研究表明美洲大蠊醇提取物对白血病细胞和生殖系统肿瘤细胞具有显著的细胞毒性,可明显抑制相关肿瘤细胞的增殖[12-13]。
从本实验可知,康复新液(3.9 ml/kg)连续给药15 d,均具有明显抑制HCT116荷瘤小鼠肿瘤生长的作用,且与顺铂、伊立替康联合应用,可有效改善后二者引起的骨髓抑制,也可改善顺铂、伊立替康导致的骨髓抑制状况。
与顺铂联合应用后,康复新液可明显提高顺铂的抑瘤率,与其所含CⅡ-3等抗肿瘤活性成分相关;同时康复新液修复作用明显,因此其对顺铂引起的副作用具有一定的干预作用,本实验中表现为有效缓解动物体质量的下降,提高FBW/IBW值,增加外周血PLT、RBC水平,增加骨髓DNA含量,增加小鼠骨髓细胞CD34+抗原表达,升高骨髓CFUGM、BFU-E、CFU-E与CFU-Meg集落数。与伊立替康联用后,康复新液同样表现为在提升抑瘤率的同时,有效缓解化疗药物导致的骨髓抑制情况,具体表现为有效提高实验动物外周血白细胞水平和中性粒细胞数量,升高骨髓CFU-GM、BFU-E、CFU-E与CFU-Meg集落数,增加骨髓DNA含量,提高小鼠骨髓细胞CD34+抗原的表达。但本实验未考察康复新液与不同剂量化疗药物的联用效果,即康复新液可能通过减少顺铂、伊立替康的用量而降低化疗药物的相关副作用,此为后续研究应重点考察的方向。从实验结果看,康复新液具有与一线抗肿瘤药物联合应用的广阔前景。
1 Mochiki E,Yanai M,Ohno T,et al. The effect of traditional Japanese medicine (Kampo) on gastrointestinal function. Surg Today,2010,40(12): 1105-1111.
2 郗照勇,刘扬中. 顺铂耐药的分子机制. 中国科学:化学,2014,4: 410-422.
3 刘敏. 顺铂联合电离辐射在肺癌细胞杀伤作用机制的研究.吉林大学博士学位论文,2014.
4 史春山. 顺铂/聚(L-谷氨酸)接枝聚(乙二醇)纳米粒体内外抗肿瘤效果研究. 吉林大学博士学位论文,2015.
5 唐春兰,杨和平,周向东. DNA损伤修复与肺癌顺铂耐药机制的研究进展. 中国肺癌杂志,2011,14(12): 960-964.
6 杨一昆,普绍平,高文桂. 顺铂的应用及铂族金属抗癌药物的研究进展. 中国新药杂志,1999,8(12): 797-800.
7 王丽焱. 抗肿瘤药伊立替康的研究进展. 国外医学.药学分册,2004,31(1): 7-11.
8 蒋永新,王熙才,金从国,等. 康复新体外诱导胃癌BGC-823细胞凋亡的实验研究. 昆明医科大学学报,2006,27(2): 5-9.
9 蒋永新,王熙才,金从国,等. 美洲大蠊提取物对小鼠3LL肺癌的抑制作用及其机制探讨.中国肺癌杂志,2006,9(6): 488-491.
10 王晶,李鑫. 美洲大蠊提取物对人肝癌细胞Bel-7402作用机制的研究. 中国现代应用药学,2012,29(10): 876-880.
11 陈俊雅,耿玲,张旭强,等. 美洲大蠊提取物CⅡ-3对H22肝癌小鼠血管生成作用的研究. 肿瘤学杂志,2012,18(4): 274-276.
12 何正春,胡明辉,王晓雨,等. 美洲大蠊提取物对3株人及小鼠白血病细胞的细胞毒性研究.云南中医中药杂志,2009,30(5): 56-57.
13 何正春,王晓雨,杨雷香,等. 美洲大蠊提取物对3株人体生殖系统肿瘤细胞的细胞毒性研究. 西北药学杂志,2009,24(4): 271-272.
Impacts of Kangfuxin Decoction Combined with Cisplatin and Irinotecan on Cancer Cell Reproduction and Hemopoietic System in Tumor-Bearing Mice
Zou Junbo,Xiong Yongai
(The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine / Key Laboratory of Systematic Research / Development and Utilization of Chinese Medicine Resources in Sichuan Province Key Laboratory Breeding Base of Co-Founded by Sichuan Province and MOST,Pharmacy College,Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China)
This study aimed to investigate the effects of Kangfuxin decoction (KFXD) combined with cisplatin and irinotecan on HCT116 cells reproduction and hemopoietic system in tumor-bearing mice. 110 C57BL/6 mice were implanted with HCT116 cells through abdominal injection,while 90 mice were randomly divided into the model group,the KFXD group,the cisplatin group,KFXD + cisplatin group,the irinotecan group and KFXD + irinotecan group. Mice of each group had been administered by corresponding medication for 16 days. The body weight were detected every 3 days. Blood routine examination were observed,while neoplastic tissues were separated and measured,FBW / IBW was counted,and DNA content of marrow,progenitor colony assay and expression rates of medullary cell CD34+were also measured and analyzed,respectively. It was found that in the medication groups the weights of neoplastic tissues were decreased compared with the model group (P< 0.05),while the levels of WBC,PLT,RBC and HGB of KFXD and the relevant combination groups were obviously increased (P < 0.05,P < 0.01,respectively). Routine blood indexes,DNA content of marrow,progenitor colony assay and expression rates of medullary cell CD34+in the cisplatin group and the irinotecan group were decreased(P < 0.05,P < 0.01,respectively). Compared with the cisplatin geoup and the irinotecan group, levels of PLT,RBC and HGB of relevant the combination groups were increased (P < 0.05,P < 0.01,respectively),DNA content of marrow,progenitor colony assay and expression rates of medullary cell CD34+in the relevant combination groups were also increased (P < 0.05,P < 0.01,respectively). It was concluded that KFXD inhibited the growth of HCT116 cells in the tumor tissues of mice,and improved the suppressant of bone marrow caused by cisplatin and irinotecan in the drug combination. The prospect of combination of KFXD and initial antitumor drugs were spacious.
Kangfuxin decoction,colorectal cancer,cisplatin,irinotecan,drug combination
10.11842/wst.2016.05.022
R285.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2015-12-12
修回日期:2016-03-12
* 国家自然科学基金委青年项目(30902005):基于本草挖掘的中药药效物质基础与作用机理研究—蜣螂抗良性前列腺增生症的实验研究,负责人:谭承佳;四川省科技厅项目(2014TD0007):中药药理四川省青年科技创新研究团队,负责人:曾南。
** 通讯作者:邹俊波,博士,主要研究方向:中药药效与毒理学。

