米诺环素对新生鼠缺氧后脑室周围区域谷氨酸清除的影响*
李虹椿, 李 霞, 马雪涛, 肖 婕,3, 牛之瑞, 冯 雷, 李 凡△
(1昆明医科大学病理学与病理生理学系,云南 昆明 650500;2云南省产品质量监督检验研究院,云南 昆明 650223;3黄石中心医院理科,湖北 黄石435000)
米诺环素对新生鼠缺氧后脑室周围区域谷氨酸清除的影响*
李虹椿1,李霞1,马雪涛2,肖婕1,3,牛之瑞2,冯雷2,李凡1△
(1昆明医科大学病理学与病理生理学系,云南 昆明 650500;2云南省产品质量监督检验研究院,云南 昆明 650223;3黄石中心医院理科,湖北 黄石435000)
[摘要]目的: 探讨米诺环素对新生大鼠缺氧后脑室周围区域谷氨酸的作用及其可能的机制。方法: 对出生后1 d的大鼠给予系统性缺氧构建缺血缺氧性脑损伤模型(hypoxic-ischemic brain damage,HIBD)。采用液相色谱-串联质谱联用技术检测缺氧后4 h和1 d脑室周围区域谷氨酸水平;Western blot观察该区域EAAT1和EAAT2发育期变化以及EAAT1、EAAT2、Iba-1、IL-1β、TNF-α和TGF-β1蛋白在缺氧后4 h和1 d的动态变化,并同时观察给予米诺环素后对谷氨酸水平及上述蛋白的影响。结果: 谷氨酸水平检测发现,缺氧后4 h和1 d,脑室周围区域谷氨酸水平明显上升;给予米诺环素(45 mg/kg)后,谷氨酸水平显著下降。Western blot结果显示,出生后第1周EAAT1和EAAT2低表达,但在出生后第2周表达显著上升;缺氧后1 d,EAAT1、EAAT2、Iba-1、IL-1β和TGF-β1表达上调;给予米诺环素后能促进EAAT1和TNF-α的表达,但却抑制EAAT2的产生。结论: 缺氧后早期,米诺环素能降低脑室周围区域谷氨酸水平,其机制可能与它选择性调控谷氨酸转运体,而非抑制该区域炎症反应有关。
[关键词]米诺环素; 脑室周围区域; 缺氧; 谷氨酸; 谷氨酸转运体
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是指围产期由各种因素引起的缺氧和脑血流减少或暂停而引发胎儿和新生儿的脑损伤,该病是导致儿童神经系统伤残的常见原因之一,而缺氧为其病理生理基础。近年来研究发现,HIE存在脑室周围区域易损现象[1],该区域受损是导致患儿神经系统功能紊乱和认知功能障碍的主要原因。
谷氨酸(glutamate)是脑内含量最多的兴奋性神经递质,在突触信号传递及认知功能的维系中发挥重要作用。缺血缺氧(hypoxia-ischemia,HI)后,大脑白质,尤其脑室周围白质区域的谷氨酸水平升高[2]。胞外过多的谷氨酸会持续激活谷氨酸受体并使胞内Ca2+持续增高,引发一系列毒性反应,最终导致神经元变性、坏死、诱发脑损伤。该过程也被称为谷氨酸所介导的兴奋性毒性作用。可见HI后,谷氨酸在脑室周围区域易损中起着重要的作用,维持该区域谷氨酸水平的稳定将有助于减轻HI后脑损伤。
研究认为谷氨酸清除主要受谷氨酸转运体调节。人类已发现5种位于细胞膜上的谷氨酸转运体,分别是兴奋性氨基酸转运体1~5(excitatory amino acid transporter 1~5,EAAT1~5);而在啮齿类动物中也发现4种同系物。其中EAAT1和EAAT2是调节谷氨酸的主要转运蛋白,并大量分布在星形胶质细胞上。在神经系统发育过程中,EAAT1是清除谷氨酸的主要蛋白;而EAAT2则主要负责成人脑组织中谷氨酸的转运。目前,对出生后早期脑室周围区域谷氨酸转运体的表达情况未见报道,缺氧后与谷氨酸水平变化的关系不清。
近年研究发现,谷氨酸的产生与HI后脑内炎症反应密切相关。脑内炎症反应主要以小胶质细胞活化为特征。小胶质细胞在受到各种刺激(包括HI)后由静息状态变为活化状态并启动脑内炎症反应。活化的小胶质细胞除产生和释放过多炎症介质外,还能释放谷氨酸。而炎症介质(IL-1β、TNF-α等)可通过损伤神经元并导致其产生和释放更多的谷氨酸[3],诱发星形胶质细胞膜上谷氨酸转运体功能障碍[4]等方式,使胞外谷氨酸水平升高。同样抗炎因子(TGF-β1等)在HI后也会高表达,它能促进神经元存活,减轻脑内炎症反应,抑制谷氨酸产生。因此,缺氧后新生大鼠脑室周围区域的炎症反应及其与谷氨酸间可能的关系还有待进一步研究。
米诺环素(minocycline,M)是一种四环素类广谱抗生素。由于其脂溶性好,易透过血脑屏障,在多种脑损伤模型中发挥神经保护作用,也包括HIE后脑损伤。其保护机制与抑制小胶质细胞活化,继而减轻脑内炎症反应有关。既然米诺环素能抑制HI后脑内炎症反应,那么它是否也对谷氨酸的清除产生影响,这成为本研究的目的。
据此,本研究采用谷氨酸转运体EAAT1和EAAT2,炎症介质IL-1β和TNF-α,抗炎因子TGF-β1以及小胶质细胞活化的标志物Iba-1为研究对象,观察缺氧后脑室周围区域谷氨酸水平的改变,并结合谷氨酸转运体以及炎症介质表达的变化,揭示缺氧后该区域谷氨酸变化可能的机制以及米诺环素对其的影响。
材料和方法
1实验动物
SD新生大鼠体重(6±1)g,SPF级,雌雄各半,由昆明医科大学动物饲养和使用委员会提供。每窝新生鼠10~12只与母鼠同笼饲养,保证食物及水供应,动物许可证编号为SYXK(滇)2011-0004。
2药品和试剂
米诺环素(Sigma);水合氯醛(索莱宝公司); PVDF膜(Millipore);脱脂奶粉(BD);anti-EAAT1和anti-TGF-β1(Santa Cruz);anti-EAAT2、anti-IL-1β、anti-TNF-α和anti-β-actin(Abcam);anti-Iba-1(Wako);anti-mouse IgG-HRP和anti-rabbit IgG-HRP(Abmart)。
3实验方法
作为食品领域的高风险行业,我国特殊食品管理要求最高、制度最多、措施最严。如今,在各界的共同努力下,我国特殊食品管理制度不断完善,产业环境日趋向好,安全指数逐年攀升,消费者信心不断增强。据统计,2017年国产婴幼儿配方乳粉合格率达99.1%,保健食品监督抽检总体样品合格率达98.1%,特殊食品安全达到历史最好水平。
3.1动物系统性缺氧及药物干预本实验采用同窝出生后1 d的SD大鼠幼崽,置入恒温缺氧实验装置,在28 ℃、5% O2+ 95% N2混合气体中暴露3.5 h[5]。系统性缺氧结束后,大鼠随机分为缺氧(hypoxic,Hy)组(缺氧后2 h腹腔注射生理盐水8 μL)和米诺环素(Hy+M)组(缺氧后2 h腹腔注射米诺环素45 mg/kg[6]),并设置同龄正常组(normal group,NG)。NG组置于21% O2、28 ℃的环境中,不予处理。
3.2液相色谱-串联质谱联用技术检测谷氨酸缺氧后4 h和1 d,对各组大鼠腹腔注射10%水合氯醛麻醉(0.3 mL/100 g)后,分离脑室周围区域,见图1。用高效液相串联质谱分析仪检测该区域单位重量脑组织中谷氨酸的浓度。样品前处理:使用色谱级甲酸与样本一起进行超声乳化匀浆后,12 000 r/min离心20 min,吸取上清液,经0.2 μm的滤膜进行过滤。然后按条件[色谱柱: 1.7 μm,100 mm×2.0 mm,柱温30 ℃,流动相乙腈(A)-0.1%甲酸(B),流速0.3 mL/min,进样量5 μL]进行分析,流动相梯度洗脱程序见表1。质谱条件为电喷雾电离(ESI),正离子化模式,多反应监测模式(MRM),毛细管喷雾电压(IS)5 500 V;气帘气(CUR):15.0 psi;碰撞室碰撞气(CAD):5 psi;离子源温度(TEM):650 °C;雾化气(GS1):60 psi;辅助气(GS2):65 psi;所用气体均为高纯氮气(纯度99.999%);去簇电压(DP):13 V;其它条件见表2。优化后母离子为148.0,定性子离子为m/z 84.1和m/z 130.1,定量离子为m/z 84.1,检测方式为多反应监测(MRM)模式。在完成谷氨酸标准品色谱分析后,建立标准曲线,并对样本进行分析,将计算得出的峰面积代入方程,算出样本中谷氨酸浓度。

Figure 1.Periventricular zone.
图1脑室周围区域
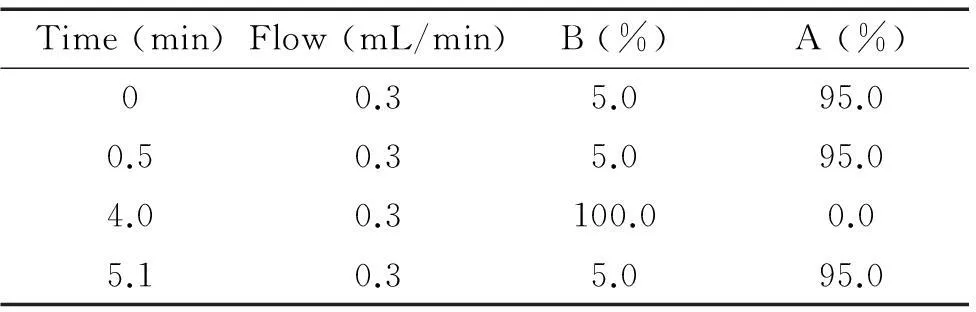
表1 流动相洗脱程序

表2 串联质谱条件
3.3Western blot 检测目标蛋白对出生后1 d、2 d、4 d、8 d和15 d的正常大鼠观察脑室周围区域EAAT1和EAAT2发育期表达动态变化;对缺氧后4 h和1 d的各组大鼠检测该区域EAAT1、EAAT2、Iba-1、IL-1β、TNF-α和TGF-β1蛋白表达情况。腹腔注射10%水合氯醛麻醉(0.3 mL/100 g)后断头取脑,分离脑室周围区域。每组取处理过的蛋白样品20 μg进行SDS-PAGE,并将蛋白质转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。转膜结束后,5%脱脂牛奶封闭1 h后结合I抗,室温孵育1 h,4 ℃过夜。第2天结合含有辣根过氧化物酶(horseradish peroxidase,HRP)的II抗,室温孵育2 h。Bio-Rad Chemical XRS+显影系统扫描,用ImageJ 3.0软件测量所有目标蛋白以及内参照的灰度值。
4统计学处理
使用SPSS 20.0统计软件对实验数据进行统计处理。数据均采用均数±标准差(mean±SD)表示。对各组数据进行正态性和方差齐性检验后发现,数据呈非正态分布,因此采用非参数的Mann-Whitney和Wilcoxon检验对两样本进行统计学分析。以P<0.05为差异有统计学意义。
结果
1EAAT1和EAAT2发育期动态变化
2缺氧后4 h和1 d,米诺环素对脑室周围区域谷氨酸及谷氨酸转运体的作用
缺氧后4 h和1 d,对新生大鼠脑室周围区域谷氨酸水平测定后发现谷氨酸水平持续增高(P<0.05)。给予米诺环素后,在缺氧后1 d,该区域谷氨酸水平显著下降(P<0.05)。缺氧后4 h,EAAT2的表达明显增加(P<0.05),缺氧后1 d,EAAT1和EAAT2的表达均高于正常组(P<0.05);Hy+M组与Hy组相比, EAAT1的表达升高(P<0.05),而EAAT2的表达降低(P<0.05),见图3。结果提示缺氧早期,米诺环素能降低脑室周围区域谷氨酸水平和EAAT2的表达,但同时促进EAAT1的上调。
3缺氧后4 h和1 d,米诺环素对脑室周围区域炎症反应的作用
系统性缺氧后4 h和1 d,脑室周围区域IL-1β的表达持续增高(P<0.05)。在缺氧后1 d,该区域Iba-1以及TGF-β1的表达也上升(P<0.05)。给予米诺环素后,IL-1β、Iba-1及TGF-β1的表达均没有变化,但TNF-α的表达却升高(P<0.05),见图4。结果提示米诺环素未能干预缺氧后早期脑室周围区域的炎症反应。

Figure 2.The time course of EAAT1 (A) and EAAT2 (B) protein expression in the periventricular zone. Mean±SD.n=7~8.**P<0.01vspostnatal 15 d group.
图2脑室周围区域EAAT1和EAAT2发育期动态变化

Figure 3.The effect of minocycline on glutamate level (A) and the protein expression of EAAT1 (B) and EAAT2 (C) in the periventricular zone after 4 h and 1 d of hypoxic exposure. Mean±SD.n=3~7.*P<0.05vsNG;#P<0.05vsHy.
图3米诺环素对缺氧后脑室周围区域谷氨酸以及谷氨酸转运体EAAT1和EAAT2的作用
讨论
缺氧后,谷氨酸水平升高所介导的兴奋性毒性作用能导致脑室周围区域受损。因此维持该区域谷氨酸水平的稳定,对HIE患儿在神经系统的发育和认知功能的改善都有着重要作用。本实验通过对新生大鼠系统性缺氧构建HIE动物模型,探讨米诺环素对缺氧后脑室周围区域谷氨酸清除的作用及其可能的机制。
本研究发现脑室周围区域,EAAT1和EAAT2在出生后第1周表达水平较低,可能与出生后第1周谷氨酸转运体的启动子快速下调有关[7]。由于谷氨酸转运体在出生后低表达,新生大鼠在出生早期经系统性缺氧后,是否更易引起谷氨酸水平升高,据此我们测定了该区域缺氧后早期谷氨酸水平的动态变化。

Figure 4.The effect of minocycline on the protein expression of Iba-1 (A), IL-1β (B), TGF-β1 (C) and TNF-α (D) in the periventricular zone after 4 h and 1 d of hypoxic exposure. Mean±SD.n=6~9.*P<0.05vsNG;#P<0.05vsHy.
图4米诺环素对缺氧后脑室周围区域炎症介质Iba-1、IL-1β、TNF-α和抗炎因子TGF-β1的作用
结果揭示缺氧后该区域谷氨酸水平升高,给予米诺环素后能下调谷氨酸水平。因此,本研究进一步对该区域炎症介质和谷氨酸转运体的表达进行观察,探讨缺氧后早期米诺环素减轻谷氨酸水平的病理生理学机制。
EAAT1和EAAT2在缺氧后所发挥的作用有所不同。出生后早期EAAT1主要负责谷氨酸转运[8],它能清除脑内多余的谷氨酸。2013年Nijboer等[8]发现,G蛋白偶联受体激酶2(G protein-coupled receptor kinase 2,GRK2)敲除的小鼠经HI造模后脑损伤程度明显轻于野生型小鼠, 该保护机制与GRK2缺失后,星形胶质细胞膜上EAAT1表达增多、清除谷氨酸能力增强有关。相反缺氧后,EAAT2则表现出逆转运作用[9],可将胞内的谷氨酸释放到组织间隙,提高谷氨酸水平。体外实验也证实,少突胶质细胞前体细胞经氧糖剥夺(oxygen-glucose deprivation,OGD)后,给予EAAT2特异性拮抗剂二氢卡因酸盐(dihydrokainate,DHK),能显著抑制胞外谷氨酸的产生,并降低少突胶质细胞前体细胞死亡的数量[10]。在我们的研究中发现缺氧后4 h,谷氨酸水平升高可能与EAAT2高表达有关,因为缺氧后它可能发挥了逆转运作用。近年来对米诺环素的研究中,Colovic等[11]发现给药后4 h脑内米诺环素的浓度逐渐上升,并在6 h后其血药浓度逐渐达到稳定。因此缺氧后4 h,米诺环素未对谷氨酸及其转运体产生影响,这可能与其还未及时透过血脑屏障到达中枢,未对它们进行调控有关。因此,缺氧后1 d,米诺环素能降低谷氨酸水平,这也许与其促进EAAT1(负责将谷氨酸转运入胞)表达的同时抑制EAAT2(负责将谷氨酸转运出胞)有关。
缺氧后早期脑室周围区域炎症介质表达增多,反映该区域炎症反应可能是一个早期过程;此时谷氨酸水平升高,提示谷氨酸的产生与炎症反应可能存在联系。最近Wixey[6, 12]团队对出生后3 d的新生大鼠进行右侧颈总动脉结扎后,经系统性缺氧构建HIE动物模型,同样在缺氧后2 h给予米诺环素发现在造模后第1周和第6周,其能抑制皮质、丘脑和中缝背核部位的小胶质细胞活化和炎症反应。在我们的模型中按相同的给药方式和给药剂量后观察到,米诺环素未能干预脑室周围区域炎症介质的表达,这可能与观察部位的解剖结构[13],新生大鼠不同脑区的小胶质细胞活化后功能及其对神经元的毒性作用存在差异[14],造模的方式和观察的时点不同有关,其具体机制还需进一步研究。近期有研究发现小胶质细胞能表达TGF-β1[15],而TGF-β1阳性的小胶质细胞在机体中起到抗炎、抗氧化、保护受损后的神经元的作用。本研究发现缺氧后TGF-β1表达增加,或许与EAAT1一样,是机体面对损伤后的代偿反应。Boycott等[4]在对培养的星形胶质细胞进行缺氧后发现有大量TNF-α产生,而TNF-α对EAAT1和EAAT2具有选择性作用,它能显著性抑制EAAT2的产生,但不能对EAAT1的表达产生影响。在我们研究中发现给予米诺环素后,TNF-α表达上升,而EAAT2的表达却下降。这说明米诺环素对EAAT2表达的调控可能与其促进该区域TNF-α水平升高存在关联。
综上所述,缺氧后早期米诺环素能降低脑室周围区域谷氨酸水平,其作用机制可能与其选择性调控谷氨酸转运体(促进EAAT1表达的同时抑制了EAAT2),而非抑制该区域炎症反应有关。通过降低该区域谷氨酸水平,减轻由谷氨酸介导的兴奋性毒性作用,将有助于改善HIE患儿神经系统功能紊乱和认知能力障碍。在今后的研究中,我们将进一步证实米诺环素选择性地调控谷氨酸转运体的信号转导机制,为其在临床治疗HIE提供更有力的证据。
[参考文献]
[1]Suryana E, Jones NM. The effects of hypoxic preconditioning on white matter damage following hypoxic-ischaemic injury in the neonatal rat brain[J]. Int J Dev Neurosci, 2014, 37:69-75.
[2]Loeliger M, Watson CS, Reynolds JD, et al. Extracellular glutamate levels and neuropathology in cerebral white matter following repeated umbilical cord occlusion in the near term fetal sheep[J]. Neuroscience, 2003, 116(3):705-714.
[3]Olmos G, Lladó J. Tumor necrosis factor alpha: a link between neuroinflammation and excitotoxicity[J]. Mediators Inflamm, 2014, 2014:861231.
[4]Boycott HE, Wilkinson JA, Boyle JP, et al. Differential involvement of TNF alpha in hypoxic suppression of astrocyte glutamate transporters[J]. Glia, 2008, 56(9):998-1004.
[5]Kaur C, Sivakumar V, Zou Z, et al. Microglia-derived proinflammatory cytokines tumor necrosis factor-alpha and interleukin-1beta induce Purkinje neuronal apoptosis via their receptors in hypoxic neonatal rat brain[J]. Brain Struct Funct, 2014, 219(1):151-170.
[6]Wixey JA, Reinebrant HE, Spencer SJ, et al. Efficacy of post-insult minocycline administration to alter long-term hypoxia-ischemia-induced damage to the serotonergic system in the immature rat brain[J]. Neuroscience, 2011, 182:184-192.
[7]Regan MR, Huang YH, Kim YS, et al. Variations in promoter activity reveal a differential expression and physiology of glutamate transporters by glia in the developing and mature CNS[J]. J Neurosci, 2007, 27(25):6607-6619.
[8]Nijboer CH, Heijnen CJ, Degos V, et al. Astrocyte GRK2 as a novel regulator of glutamate transport and brain damage[J]. Neurobiol Dis, 2013, 54:206-215.
[9]Back SA, Rosenberg PA. Pathophysiology of glia in perinatal white matter injury[J]. Glia, 2014, 62(11):1790-1815.
[10]Deng W, Rosenberg PA, Volpe JJ, et al. Calcium-permeable AMPA/kainate receptors mediate toxicity and preconditioning by oxygen-glucose deprivation in oligodendrocyte precursors[J]. Proc Natl Acad Sci U S A, 2003, 100(11):6801-6806.
[11]Colovic M, Caccia S. Liquid chromatographic determination of minocycline in brain-to-plasma distribution studies in the rat[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2003, 791(1-2):337-343.
[12]Wixey JA, Reinebrant HE, Buller KM. Inhibition of neuroinflammation prevents injury to the serotonergic network after hypoxia-ischemia in the immature rat brain[J]. J Neuropathol Exp Neurol, 2011, 70(1):23-35.
[13]Hou G, Yang X, Yuan TF. Hippocampal asymmetry: differences in structures and functions[J]. Neurochem Res, 2013, 38(3):453-460.
[14]Lai AY, Dhami KS, Dibal CD, et al. Neonatal rat microglia derived from different brain regions have distinct activation responses[J]. Neuron Glia Biol, 2011, 7(1):5-16.
[15]Butovsky O, Jedrychowski MP, Moore CS, et al. Identification of a unique TGF-beta-dependent molecular and functional signature in microglia[J]. Nature Neurosci, 2014, 17(1):131-143.
(责任编辑: 陈妙玲, 罗森)
Effect of minocycline on glutamate uptake in periventricular zone of neonatal rats after hypoxiaLI Hong-chun1, LI Xia1, MA Xue-tao2, XIAO Jie1,3, NIU Zhi-rui2, FENG Lei2, LI Fan1
(1DepartmentofPathologyandPathophysiology,KunmingMedicalUniversity,Kunming650500,China;2YunnanTestingInstituteforProductQualitySupervision,Kunming650223,China;3DepartmentofPathology,HuangshiCentralHospital,Huangshi435000,China.E-mail:leefan623@sina.com)
[ABSTRACT]AIM: To investigate the role of minocycline on glutamate uptake in the periventricular zone and its putative mechanism after hypoxic exposure in neonatal rats. METHODS: A model of hypoxic-ischemic brain damage (HIBD) was developed by putting postnatal 1 d rat pups in 5% O2for 3.5 h. The glutamate level in periventricular zone was measured by liquid chromatography coupled with tandem mass spectrometry assay (LC-MS/MS) after hypoxic exposure for 4 h and 1 d. The dynamic changes of glutamate transporters EAAT1, and EAAT2 during developmental period in periventricular zone were determined by Western blot. Moreover, the expression of EAAT1, EAAT2, Iba-1, IL-1β, TNF-α and TGF-β1 was also detected by Western blot after hypoxic exposure for 4 h and 1 d in that region. The effects of minocycline on all parameters mentioned above were tested after minocycline treatment at the same time points and in the same region. RESULTS: After hypoxic exposure, glutamate level was increased, but it was decreased after minocycline treatment. EAAT1 and EAAT2 kept a low expression level at the first postnatal week, but a predominant elevation was found at the end of the second postnatal week. The expression of EAAT1, EAAT2, Iba-1, IL-1β and TGF-β1 was increased at 1 d after hypoxic exposure. EAAT1 and TNF-α expression was significantly up-regulated, while EAAT2 was down-regulated after minocycline treatment. CONCLUSION: Minocycline inhibits the increase in the glutamate level after hypoxia in periventricular region of the neonatal rats. The mechanism may relate to the selective regulation of glutamate transporters, rather than the inhibition of neuroinflammation in periventricular zone.
[KEY WORDS]Minocycline; Periventricular zone; Hypoxia; Glutamate; Glutamate transporters
doi:10.3969/j.issn.1000- 4718.2016.02.017
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 0871-65922858; E-mail: leefan623@sina.com
*[基金项目]国家自然科学基金资助项目(No. 81200939; No. 31260242);云南省科技计划(No. 2011FB060)
[收稿日期]2015- 08- 27[修回日期] 2015- 11- 25
[文章编号]1000- 4718(2016)02- 0290- 06

