内皮源性吲哚胺2,3-双加氧酶抑制周细胞迁移及收缩蛋白表达
岳莉英, 关志明, 裴志强
(山西医科大学第二医院1心内科,2呼吸科,3太原市中心医院心内科,山西 太原 030001)
内皮源性吲哚胺2,3-双加氧酶抑制周细胞迁移及收缩蛋白表达
岳莉英1△,关志明2,裴志强3
(山西医科大学第二医院1心内科,2呼吸科,3太原市中心医院心内科,山西 太原 030001)
[摘要]目的: 探讨内皮源性吲哚胺2,3-双加氧酶(IDO)对周细胞迁移及收缩蛋白表达的影响。方法: 体外培养人肺动脉内皮细胞(HPAECs)及大鼠脑微血管周细胞。建立过表达IDO的HPAECs模型(IDO-HPAECs)。实验分为3组:对照组,以HPAECs条件培养基干预周细胞;处理组,以IDO-HPAECs条件培养基干预周细胞;抑制组,以含1-甲基色氨酸(1-mT)的IDO-HPAECs条件培养基干预周细胞。测定共培养体系一氧化氮(NO)、色氨酸及犬尿氨酸浓度。观察周细胞活性、迁移及收缩蛋白表达情况。结果: IDO-HPAECs条件培养基干预周细胞6~48 h对其活性无显著影响。处理组的周细胞迁移能力显著低于对照组(P<0.01),抑制组显著高于处理组(P<0.01)。共培养体系的NO浓度在各组间差异无统计学意义(P>0.05)。处理组的色氨酸浓度显著低于对照组(P<0.01),而抑制组显著高于处理组(P<0.01)。处理组的犬尿氨酸浓度显著高于对照组(P<0.01),而抑制组显著低于处理组(P<0.01)。处理组的α-平滑肌肌动蛋白与结蛋白表达水平显著低于对照组(P<0.01),抑制组显著高于处理组(P<0.01)。结论: 内皮源性IDO抑制周细胞迁移及收缩蛋白表达,可能参与机体微血管功能调控。
[关键词]吲哚胺2, 3-双加氧酶; 内皮细胞; 周细胞
肺动脉高压是严重危害人体健康的疾病,血管平滑肌细胞和内皮细胞功能改变是影响肺动脉高压进展的重要因素。近年来研究显示:内皮源性吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)通过将色氨酸代谢为犬尿氨酸舒张动脉血管并参与血压调节[1]。最近有研究发现内皮源性IDO可调控血管平滑肌细胞表型改变,抑制血管重塑,从而减缓肺动脉高压的进展[1-2]。周细胞参与调控微血管血流[3],与内皮细胞之间通过间隙连接进行信号传递,调节内皮细胞分化、增殖及迁移等病理生理学过程[4]。由此我们推测内皮源性IDO也可能对周细胞的生物学行为产生影响,进而参与微血管系统血流调控。本研究在体外探讨内皮细胞高表达IDO对周细胞增殖、迁移及收缩功能的影响。
材料和方法
1材料
内皮细胞培养基(ScienCell);兔抗大鼠β-actin、血小板衍生生长因子受体β(platelet-derived growth factor receptor-β,PDGFR-β)、神经元胶质抗原2(neuron-glial antigen 2,NG2)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和结蛋白抗体,小鼠抗人血管内皮钙黏素(vascular endothelial cadherin,VE-cadherin)和IDO抗体,ECL发光试剂盒(Santa Cruz);一氧化氮(nitric oxide,NO)检测试剂盒购自南京建成生物有限公司;细胞裂解液及小鼠抗人β-actin抗体(CST);Transwell系统(Corning);1-甲基色氨酸(1-methyl-DL-tryptophan,1-mT)购自Sigma;ViraPower腺病毒表达系统试剂盒(Life Technologies);3周龄雄性Wistar大鼠(10只)购自山西医科大学医学实验动物中心。动物实验经太原市中心医院医学伦理委员会审核批准。
2方法
2.1细胞培养人肺动脉内皮细胞(human pulmonary artery endothelial cells,HPAECs)株购自ScienCell。采用内皮细胞培养基培养。构建高表达IDO的腺病毒载体及其对照的重组腺病毒表达载体。具体方法参照试剂盒说明书。通过感染HPAECs 60 h建立高表达IDO的内皮细胞株(IDO-HPAECs)。脑微血管周细胞原代分离自3周龄雄性Wistar大鼠,采用2次酶消化及1次密度梯度离心分离脑微血管片段,进行原代培养并鉴定,具体步骤参照文献[5]。采用DMEM培养基,添加物包括谷氨酰胺(2 mmol/L)及双抗(青霉素1×105U/L,链霉素100 mg/L)。以上细胞培养于37 ℃、5% CO2的孵箱中,经免疫学鉴定后使用3~7代细胞进行实验。实验分为对照组(以HPAECs条件培养基干预周细胞)、处理组(以IDO-HPAECs条件培养基干预周细胞)和抑制组(以含1 mmol/L 1-mT的IDO-HPAECs条件培养基干预周细胞)。
2.2周细胞活力的测定考察过表达IDO的HPAECs条件培养基是否会影响周细胞活力。取对数生长期的周细胞,以每孔5×103个接种于96孔板。各孔加入200 μL不同IDO-HPAECs培养时间(0 h、6 h、12 h、24 h和48 h)的内皮细胞培养基,每份设5个复孔,20 h后每孔加入5 g/L的四甲基偶氮唑盐(MTT)20 μL,培养4 h。弃上清后,每孔加入150 μL二甲基亚砜(DMSO),混匀10 min。采用多功能酶标仪检测570 nm处吸光度(A)值。以对照组(0 h)周细胞活性为100%,各处理组:细胞活力(%)=(处理孔A值/对照孔A值)×100%。
2.3周细胞迁移的测定采用Transwell系统进行HPAECs与周细胞共培养。先将HPAECs以1×105/cm2密度接种于Transwell系统下层,待细胞生长至汇合后再将周细胞以同样密度接种于8 μm孔嵌套膜上层。共培养48 h后,用棉签将仍位于嵌套膜上层的周细胞拭去。将嵌套膜取出,0.1%结晶紫(溶于20%乙醇)染色。显微镜下观察迁移至嵌套膜底面的周细胞。每孔取5个随机视野计数,每种处理设3个复孔。
2.4共培养体系活性物质的测定共培养48 h后,采用硝酸还原酶法检测共培养体系中培养液上清NO浓度。采用高效液相色谱法检测培养液上清色氨酸与犬尿氨酸浓度。每种处理设6个复孔。
2.5Western blot实验鉴定IDO-HPAECs模型及分析周细胞收缩蛋白表达情况后者以3组不同的条件培养基干预周细胞24 h后进行实验,实验重复3次。将细胞裂解物以20 μg蛋白上样于10% SDS凝胶进行电泳分离,湿法转印于PVDF膜上。5%牛血清白蛋白(bovine serum albumin,BSA)封闭,I 抗4 ℃过夜。以相应 II 抗孵育后,最终以ECL试剂盒产生光信号。分别检测内皮细胞IDO、β-actin与周细胞α-SMA、结蛋白及β-actin表达情况。
3统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 14.0软件进行统计分析,组间比较使用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1HPAECs与周细胞的形态学观察与鉴定
相差显微镜下,HPAECs细胞呈多边形、边界清,细胞核位于中央(图1A);经鉴定,VE-cadherin特异性表达于细胞膜上(图1B)。周细胞体积大、形状不规则,周边常见突起,汇合后接触抑制不明显(图1C);经鉴定,PDGFR-β与NG2阳性表达(图1D~F)。
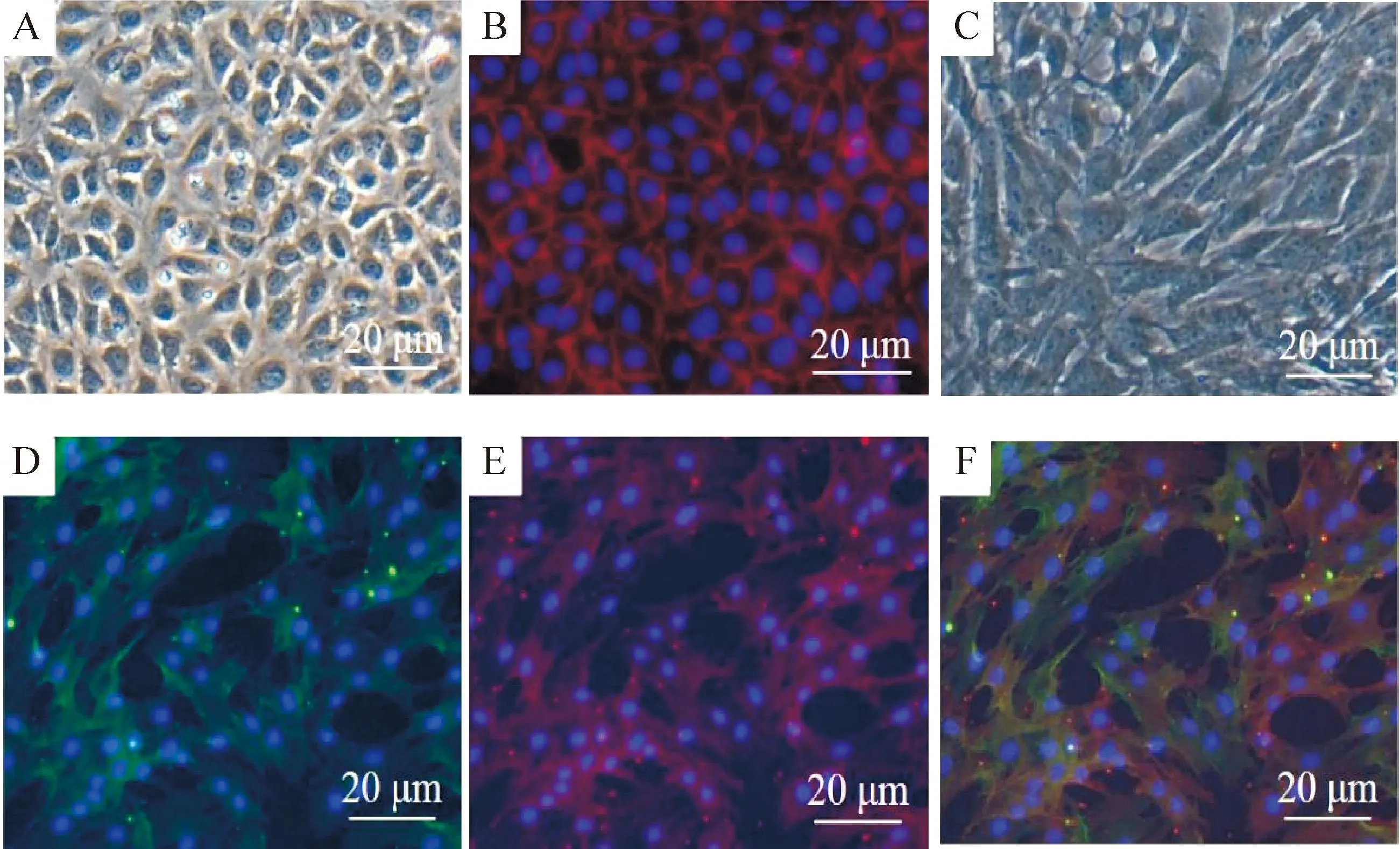
Figure 1.Morphology and identification of HPAECs and pericytes. A: HPAECs under phase-contrast microscope; B: VE-cadherin expressed on the membrane of HPAECs; C: the pericytes under phase-contrast microscope; D: the positive expression of PDGFR-β; E: the positive expression of NG2; F: merged image of D and E.
图1HPAECs与周细胞形态学观察与鉴定
2IDO-HPAECs条件培养基对周细胞活力的影响
观察不同培养时间IDO-HPAECs 条件培养基对周细胞活力的影响,结果表明周细胞在培养时间分别为6 h、12 h、24 h及48 h的条件培养基作用下,细胞活力在各组间差异无统计学意义(P>0.05),且接近对照组,可用于进一步研究,见图2。

Figure 2.The effects of conditioned medium of IDO-HPAECs on the viability of pericytes. Mean±SD.n=5.
图2IDO-HPAECs条件培养基对周细胞活性的影响
3内皮源性IDO对周细胞迁移的影响
HPAECs与周细胞共培养48 h后,对照组迁移至嵌套膜底面的单视野周细胞数为376.3±20.5。过表达IDO的处理组单视野周细胞数为154.4±16.1,显著低于对照组(P<0.01)。含有1-mT的抑制组单视野周细胞数为347.9±17.8,显著高于抑制组(P<0.01),见图3。
4共培养体系NO、色氨酸及犬尿氨酸浓度测定
HPAECs与周细胞共培养48 h后,培养基上清液中NO浓度在3组间差异无统计学意义。处理组色氨酸浓度显著低于对照组(P<0.01),而抑制组色氨酸浓度则显著高于处理组(P<0.01)。相反的,处理组犬尿氨酸浓度显著高于对照组(P<0.01),而抑制组犬尿氨酸浓度显著低于处理组(P<0.01),见图4。
5内皮源性IDO对周细胞收缩蛋白表达的影响
经携带IDO的腺病毒载体转染HPAECs后,可见IDO蛋白的高表达。对照HPAECs及空载体转染表达量很低。经条件培养基处理后的周细胞,与对照组相比,处理组α-SMA与结蛋白表达水平显著降低。与处理组相比,抑制组α-SMA与结蛋白表达水平显著增高,见图5。
讨论
多种病因导致肺动脉高压时均存在炎症反应。当炎症反应发生时,内皮细胞IDO可催化色氨酸代谢为犬尿氨酸,与一氧化氮合酶2(nitric oxide syn-thase 2, NOS2)催化精氨酸产生的NO协同调节血管平滑肌张力[6]。在小鼠的研究发现,体内内毒素导致炎症反应时,内皮细胞IDO表达增高,可降低血浆色氨酸浓度并提高犬尿氨酸水平,继而引发低血压[1]。当前该领域的研究热点在于内皮源性IDO对血管平滑肌细胞可塑性的调控。其实验依据在于自肺动脉高压患者或实验性肺高血压动物体内分离、培养的具有病理表型的平滑肌细胞在体外可经过外界信号的诱导恢复生理表型[7-8]。

Figure 3.The effects of endothelial IDO on the migration of pericytes (crystal violet staining, ×100). Mean±SD.n=15.**P<0.01vscontrol group;##P<0.01vstreatment group.
图3内皮源性IDO对周细胞迁移的影响

Figure 4.Detection of NO, tryptophan and kynurenine in the co-culture system. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vstreatment group.
图4共培养体系NO、色氨酸及犬尿氨酸浓度测定
周细胞通过许多长的突起环绕微血管壁,并与内皮细胞共用基底膜[9-10]。周细胞对微血流的调控作用依赖于其类平滑肌的收缩特性[11-12]。目前未见内皮细胞通过IDO与周细胞相互作用的报道。本研究利用Transwell系统观察周细胞与内皮细胞共培养时的迁移情况。结果表明,与过表达IDO的HPAECs共培养的周细胞迁移能力显著下降,而此现象并非由于其细胞活力下降所致。此外,应用IDO抑制剂1-mT可逆转IDO-HPAECs条件培养基对周细胞迁移的抑制作用。提示内皮细胞可通过表达IDO对其周围的细胞(周细胞)产生作用,影响其生物学行为。我们同时检测了共培养体系中NO、色氨酸及犬尿氨酸的浓度。其中,NO浓度在3组中未见统计学差异,说明NOS系统不是引起本研究模型中周细胞生物学行为变化的原因。色氨酸及犬尿氨酸的浓度在各组中的相应变化与IDO将色氨酸代谢为犬尿氨酸的过程相一致。
为确定内皮细胞是否可能通过IDO影响周细胞的舒缩行为并进而调控微血管的血流,我们观察了IDO-HPAECs条件培养基对α-SMA及结蛋白2种与收缩行为相关蛋白的表达情况。结果发现,过表达IDO后,内皮细胞的条件培养基可下调周细胞α-SMA及结蛋白表达,而应用1-mT后可部分减轻IDO对α-SMA及结蛋白表达的抑制。提示内皮细胞可能通过表达IDO调控周细胞的舒缩行为。

Figure 5.The effects of endothelial IDO on the expression of contractile proteins in the pericytes. Mean±SD.n=3.**P<0.01vsHPAECs alone;##P<0.01vsHPAECs+vehicle;△△P<0.01vscontrol group;▲▲P<0.01vstreatment group.
图5内皮源性IDO对周细胞收缩蛋白表达的影响
综上所述,本研究首次发现内皮源性IDO可能通过调控周细胞收缩蛋白的表达影响包括迁移在内的生物学行为,为深入研究周细胞调控微血管血流的机制提供实验依据,并为肺动脉高压研究提供了新的方向。然而本研究在这一新领域中仅为细胞水平的初步探索,在动物实验和细胞学中深入研究IDO是如何作用于周细胞及可能的分子机制,会有更积极的意义。
[参考文献]
[1]Wang Y, Liu H, McKenzie G, et al. Kynurenine is an endothelium-derived relaxing factor produced during inflammation [J]. Nat Med, 2010, 16(3):279-285.
[2]Xiao Y, Christou H, Liu L, et al. Endothelial indolea-mine 2,3-dioxygenase protects against development of pulmonary hypertension [J]. Am J Respir Crit Care Med, 2013, 188(4):482-491.
[3]Peppiatt CM, Howarth C, Mobbs P, et al. Bidirectional control of CNS capillary diameter by pericytes [J]. Nature, 2006, 443(7112):700-704.
[4]Bowers SL, Meng CX, Davis MT, et al. Investigating human vascular tube morphogenesis and maturation using endothelial cell-pericyte co-cultures and a doxycycline-inducible genetic system in 3D extracellular matrices [J]. Methods Mol Biol, 2015, 1189:171-189.
[5]秦伟伟,鹿文葆,刘淑英,等. 大鼠脑微血管周细胞的分离和鉴定[J]. 国际脑血管病杂志, 2011, 8(7):535-538.
[6]Hofmann F. Ido brings down the pressure in systemic inflammation [J]. Nat Med, 2010, 16(3):265-267.
[7]Courboulin A, Paulin R, Giguere NJ, et al. Role for miR-204 in human pulmonary arterial hypertension [J]. J Exp Med, 2011, 208(3):535-548.
[8]Li X, Zhang X, Leathers R, et al. Notcp signaling promotes the development of pulmonary arterial hypertension [J]. Nat Med, 2009, 15(11):1289-1297.
[9]Winkler EA, Bell RD, Zlokovic BV. Central nervous system pericytes in health and disease [J]. Nat Neurosci, 2011, 14(11):1398-1405.
[10]杜彬,周序珑. 血管生成素的特点及其对血管生成的调节作用[J]. 中国病理生理杂志,2003, 19(2):275-278.
[11]Kornfield TE, Newman EA. Regulation of blood flow in the retinal trilaminar vascular network [J]. J Neurosci, 2014, 34(34):11504-11513.
[12]张旭,刘明明,程明,等. 1型糖尿病小鼠胰岛微血管内皮细胞超微结构受损[J]. 中国病理生理杂志,2015, 31(8):1520-1524.
(责任编辑: 林白霜, 罗森)
Endothelial indoleamine 2,3-dioxygenase inhibits migration and expression of contractile proteins in pericytesYUE Li-ying1, GUAN Zhi-ming2, PEI Zhi-qiang3
(1DepartmentofCardiology,2DepartmentofRespiration,TheSecondHospitalofShanxiMedicalUniversity;3DepartmentofCardiology,TaiyuanCentralHospital,Taiyuan030001,China.E-mail:yly6673@sina.cn)
[ABSTRACT]AIM: To explore the effects of endothelial indoleamine 2,3-dioxygenase (IDO) on the migration and the expression of contractile proteins in the pericytes. METHODS: Human pulmonary artery endothelial cells (HPAECs) and rat cerebral microvascular pericytes were culturedinvitro. Over-expression of IDO in the HPAECs (IDO-HPAECs) was established. The pericytes were treated with HPAEC-conditioned medium (control group), IDO-HPAEC conditioned medium (treatment group), or IDO-HPAECs-conditioned medium containing 1-methyl-DL-tryptophan (1-mT) (inhibition group). The concentrations of nitric oxide (NO), tryptophan and kynurenine in the co-culture system were determined. The viability, migration and the expression of the contractile proteins in the pericytes were compared. RESULTS: No statistical difference of the pericyte viability after treatment with IDO-HPAEC-conditioned medium at 6~48 h was observed (P>0.05). The migratory ability of the pericytes significantly decreased in treatment group compared with control group (P<0.01), and significantly increased in inhibition group compared with treatment group (P<0.01). The concentration of NO in the co-culture system had no significant difference among groups (P>0.05). The concentration of tryptophan was significantly lower in treatment group than that in control group (P<0.01), and significantly higher in inhibition group than that in treatment group (P<0.01). The concentration of kynurenine was significantly higher in treatment group than that in control group (P<0.01), and significantly lower in inhibition group than that in treatment group (P<0.01). The expression of α-smooth muscle actin and desmin was significantly lower in treatment group than that in control group (P<0.01), and significantly higher in inhibition group than that in treatment group (P<0.01). CONCLUSION: Endothelial IDO inhibits the migration and the expression of the contractile proteins in the pericytes, and may play essential roles in the regulation of microvasculatures.
[KEY WORDS]Indoleamine 2,3-dioxygenase; Endothelial cells; Pericytes
doi:10.3969/j.issn.1000- 4718.2016.02.011
[中图分类号]R543;R363.2
[文献标志码]A
通讯作者△Tel: 0351-3365536; E-mail: yly6673@sina.cn
[收稿日期]2015- 07- 17[修回日期] 2015- 10- 10
[文章编号]1000- 4718(2016)02- 0256- 05

