青贮玉米优良乳酸菌的分离与筛选
席琳乔, 吴书奇, 史卉玲, 刘 慧, 马春晖
(1. 塔里木大学 动物科学学院/兵团塔里木畜牧科技重点实验室, 新疆 阿拉尔 843300; 2.新疆生产建设兵团 第一师十二团畜牧兽医工作站, 新疆 阿拉尔 843300; 3.石河子大学 动物科学技术学院, 新疆 石河子 832000)
青贮玉米优良乳酸菌的分离与筛选
席琳乔1, 吴书奇1, 史卉玲2, 刘 慧1, 马春晖3*
(1. 塔里木大学 动物科学学院/兵团塔里木畜牧科技重点实验室, 新疆 阿拉尔 843300; 2.新疆生产建设兵团 第一师十二团畜牧兽医工作站, 新疆 阿拉尔 843300; 3.石河子大学 动物科学技术学院, 新疆 石河子 832000)
为改善和提高青贮饲料的品质提供优良菌种,采用MRS平板分离、生理生化分析和16S rDNA鉴定相结合的方法对新疆阿克苏地区青贮玉米(ZeamaysL.)中乳酸菌的种类、形态学及生理生化特性进行研究。结果表明:从青贮玉米分离到10个菌株,其中,2株为地衣芽孢杆菌(Bacilluslichenniformis),2株为面包乳杆菌(Lactobacilluscrustorum),4株为鼠李糖乳杆菌(L.rhamnosus),2株为干酪乳杆菌(L.casei),均为异型乳酸菌。地衣芽孢杆菌(B.lichenniformis)在pH 3.0~3.5能生长,其他菌不生长或者生长较弱,但在pH 4.0~8.0均能生长;10个菌株均可在6.5%和8.0% NaCl条件下生长;地衣芽孢杆菌(B.lichenniformis)的生长速度快、产酸性能好,可作为制作青贮饲料的优良菌株。
青贮玉米; 乳酸菌; 分离; 鉴定; 新疆
青贮饲料发酵是一个复杂的过程,为提高青贮稳定性,越来越多的添加剂被应用于青贮饲料。目前应用最多的添加剂是乳酸菌[1],乳酸菌是一类能利用可发酵碳水化合物发酵产生乳酸的厌氧菌或微需氧菌的总称,是促使秸秆饲料发酵的主要有益微生物[2]。在饲料青贮发酵中起作用的乳酸菌约20多种[3],可以分成同型乳酸菌和异型乳酸菌。越来越多的研究表明,同型发酵乳酸菌和异型发酵乳酸菌同时作用,更有利于青贮饲料营养成分的保存和有氧条件下的稳定[4-5]。也有很多研究表明,同型发酵乳酸菌能加速青贮饲料的腐败变质[6-7]。刘晗璐[3]从禾本科牧草筛选的一株蒙氏肠球菌(Enterococcusmundtti),同时指出肠球菌属(Enterococcus)粪肠球菌(E.faecalis)较适合做青贮启动菌株的菌种。王小芬等[8]率先从苜蓿中筛选出对苜蓿发酵有显著促进效果的乳酸菌复合系AL2,并从青贮苜蓿中分离出一株戊糖乳杆菌(L.pentosus)。热娜·米吉提[9]研究发现,布氏乳杆菌CF10所产类细菌素Lactobacillin FC-10在酸性条件下稳定且活性高,对革兰氏阴性菌、酵母菌和真菌有明显的抑制作用。葛红莲等[10]从乳酸杆菌中分离得1种广谱的微生物化合物,对G+菌、G-菌以及真菌都有抑菌活性。张满昌[11]研究了快速氨化、微贮玉米秸秆对绵羊瘤胃发酵及生长性能的影响。
青贮玉米(ZeamaysL.)产量高、机械化程度高,可长期保存和均衡供应,是解决草食动物规模化饲养所需粗饲料的有效途径之一[12],青贮玉米和玉米秸秆的低水分青贮得到广泛应用,深受农牧民喜欢。由于新疆南疆地区夏季气温高,紫外线强,植物表面附着特殊的乳酸菌,加之青贮饲料的含水量高,青贮品质差,二次发酵现象严重,导致严重浪费[13-14]。因此,分离筛选优质的乳酸菌对提高青贮品质尤为重要。为此,笔者通过对阿克苏地区青贮玉米的乳酸菌进行分离、筛选,以期为改善和提高青贮饲料的质量提供优良菌种。
1 材料与方法
1.1 供试材料
青贮饲料为采自新疆阿克苏地区第一师五团牛场、十团牛场和十二团牛场的青贮玉米。
10×Buffer(sigma公司),2.5 mmol/L dNTP Mixture (sigma公司),X-gal,IPTG,蛋白酶K,过硫酸铵,丙烯酰胺,甲叉丙烯酰胺,尿素,去离子甲酰胺(sigma公司);T4连接盒,5 U/μL Taq酶,细菌提取试剂盒,质粒小提试剂盒,大肠杆菌(DH5α)来自新疆生产建设兵团塔里木畜牧科技重点实验室。细菌基因组提取试剂盒、PCR产物回收试剂盒(Bioteke corporation);琼脂糖;氨苄青霉素、溶菌酶、蛋白酶K(Takara 公司);M1200,DL2000 (西安沃尔森公司);引物8f:5’-AGAGTTTGATCCTGGCTCAG-3’;1492r:5’-GGTTACCTTGTT ACGACTT-3’(华大基因合成);TIANamp Bacteria DNA Kit(天根生化科技有限公司)。
1.2 乳酸菌的分离与筛选
1) 分离。称取10 g青贮饲料样品放入液体MRS培养基,室温发酵24 h,吸取1 mL上清液加入到9 mL无菌水中,漩涡震荡,以此稀释成10-3、10-4和10-53个梯度,分别吸取3个梯度的菌液50 μL涂布于固体MRS平板培养基上,37 ℃培养48~72 h,挑取单菌落,分离纯化3次后保存[15-16]。
2) 测定生长曲线。将OD值为0.5的乳酸菌菌液以6.0%的接种量接种于MRS液体培养基中,37 ℃培养。每隔2 h测其OD值,波长600 nm,测定时间为12~24 h[17]。
3) pH测定。将OD值为0.5的乳酸菌菌悬液以10%的接种量接种到pH 6.5的MRS液体培养基中,培养温度37 ℃,培养时间24 h。
4) 生长条件试验。将OD值为0.5的菌液分别接种于以下处理的MRS液体培养基中,培养48 h,测定OD值。温度为5℃、10℃、40℃和45℃;pH为3.0、3.5、4.0、4.5、5.0、5.5、7.0和8.0(26℃);盐浓度为6.5%、8.0%(26℃)。
5) 产酸速率测定。每隔2 h测定发酵液pH,培养温度为37 ℃,培养时间为12 h。
1.3 乳酸菌的鉴定
1.3.1 生化鉴定 对纯化后菌株活化24 h,进行革兰氏染色,观察菌落的颜色、形态及大小等。参照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》进行乳酸菌生理生化特性鉴定[18]。
1.3.2 分子生物学鉴定 PCR扩增乳酸菌16S rDNA基因序列,扩增引物为27 f和1492 r。PCR、电泳、染色。用PCR仪对各个菌株的DNA进行扩增,所使用扩增反应的体系为20 μL,体系如下:5 μL 10×Buffer,1 μL dNTP Mixture,0.50 μL Taq酶,1 μL DNA模板,上下游引物(10 μmol/L)各1 μL,无菌超纯水补足至20 μL后进行PCR扩增反应。反应条件:95℃,3 min;94℃,1 min;53℃,1 min;72℃延伸90 s,30个循环,72℃延伸8 min,用0.8%的琼脂糖凝胶电泳对扩增的PCR产物进行检测。
2 结果与分析
2.1 乳酸菌筛选
从图1可见,从青贮玉米中筛选出乳酸菌10株,其在24 h内均可将MRS液体培养基pH从6.5降至4.2以下,产酸能力较强。其中,Q1和Q2的产酸能力最强,pH降至3.8;M4和Q4的产酸能力最弱,pH降至4.2。各菌株产酸能力的强弱依次为Q1、Q2、Q7、Q9、Q10、Q11、Q4、M2、L、Q4和M4。
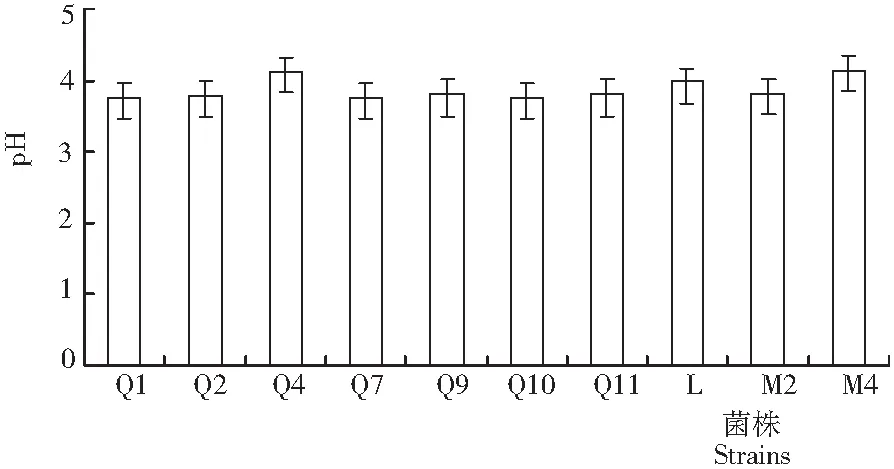
图1 试验筛选出的10株乳酸菌株的产酸能力
Fig.1 Acid-producing ability of 10 identified lactic acid bacterium strains
2.2 乳酸菌的鉴定
2.2.1 乳酸菌菌株的生理生化特性 从图2可见:1) 产酸速率。菌株Q1、Q2、Q4、Q7、Q9、Q10和Q11的产酸能力强。其中,0~6 h时产酸速率较快,6~12 h时产酸速率变化平缓,在12 h之内菌株Q1、Q2、Q4、Q7、Q9、Q10和Q11的pH均降至4.2以下,能快速产生酸,降低pH;在0~12 h时菌株M2、M4和L的产酸速率较慢,Q2在4~6 h时产酸速率最快。2)生长曲线。菌株Q1、Q2、Q4、Q7、Q9、Q10和Q11在0~8 h时生长最快,在8~12 h时生长速度较慢;整体上,菌株M4和M2的生长较慢,M4在4~8 h时生长速度较快,M2在4~10 h时生长速度较快。
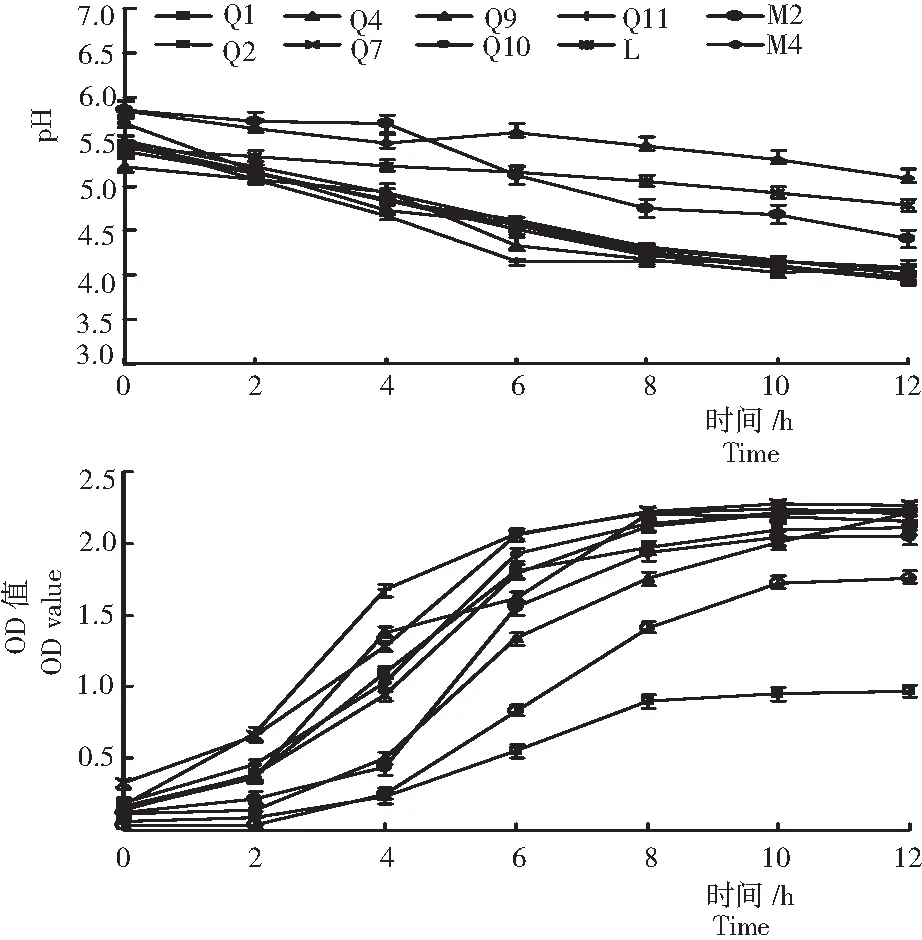
图2 试验筛选出的10株乳酸菌株的产酸速率和生长曲线
Fig.2 Acid-producing rate and growth curve of 10 identified lactic acid bacterium strains
从表可见,所有乳酸菌菌株均为革兰氏阳性菌,触酶均为阴性,且不产硫化氢。菌株在5~45℃、pH 4.0~8.0均能生长;菌株Q1在pH 3.0~3.5能生长,其他菌不生长或者生长较弱。试验筛选出的10株乳酸菌株均可在6.5%和8.0% NaCl条件下生长。
2.2.2 分子生物学鉴定 提取乳酸菌的基因组DNA后,采用细菌通用引物对其16S rDNA序列扩增,片段大小为1 500 bp左右(图3)。测序获得的16S rDNA序列通过BLAST与GenBank数据库中已知序列进行比对分析发现,菌株Q7、Q9、Q10和Q11与编号AB288235的鼠李糖乳杆菌(L.rhamnosus)序列同源性达99%;菌株M2、M4与编号HQ259722的干酪乳杆菌(L.casei)序列同源性达98%,菌株Q4和L与编号AM285451的面包乳杆菌(L.crustorum)序列同源性达99%;菌株Q1和Q2与编号JN366760的地衣芽孢杆菌(Bacilluslichenniformis)序列同源性达99%。
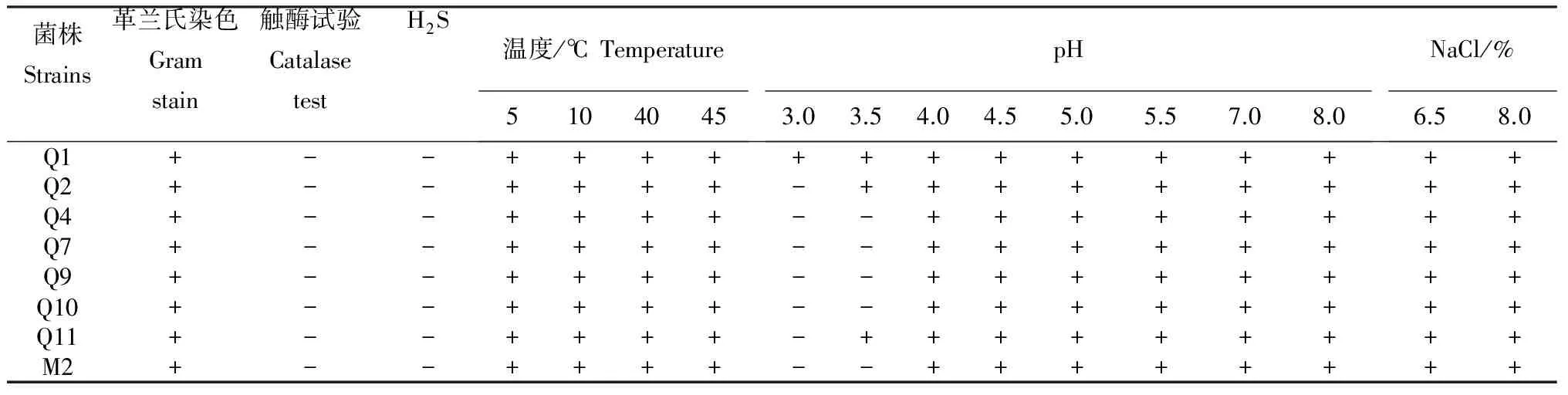
表 试验筛选出的10株乳酸菌株的生理生化特性
注:+,表示阳性;-,表示阴性反应。
Note: +,positive;-, negative.
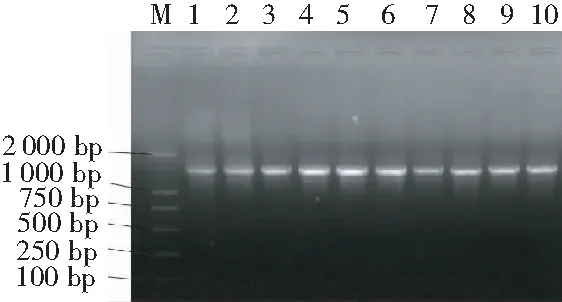
注:M为DL2000; 1~10分别为菌株Q1, Q2, Q4, Q7, Q9, Q10, Q11, M2, M4和L。
Note: M, DL2000; 1~10, Q1, Q2, Q4, Q7, Q9, Q10, Q11, M2, M4 and L strain respectively.
图3 试验筛选出的10株乳酸菌株的16S rDNA扩增图谱
Fig.3 16S rDNA amplification of 10 identified lactic acid bacterium strains
3 结论与讨论
阿克苏地区青贮玉米中的优良乳酸菌主要为地衣芽孢杆菌(B.lichenniformis)、面包乳杆菌(L.crustorum)、鼠李糖乳杆菌(L.rhamnosus)和干酪乳杆菌(L.casei)。其中,地衣芽孢杆菌(B.lichenniformis)生长速度快,pH下降能力强,可以作为制作青贮饲料乳酸菌的优良菌株。
有关研究表明,青贮原料中活性乳酸菌至少为1×105cfu/g·个才能保证制作良好的青贮饲料[19]。该试验分离到菌株Q1和Q2为地衣芽孢杆菌(B.lichenniformis),与张慧杰等[20]分离的菌株相同,该菌株可以产生纤维素降解酶,有利于青贮发酵过程中纤维素的降解;菌株Q4和L为面包乳杆菌(L.crustorum);菌株Q2、Q7、Q9、Q10和Q11为鼠李糖乳杆菌(L.rhamnosus),而在青贮料中筛选出该菌的报道较少。王佳[21]从益生4乳制品中分离出鼠李糖乳杆菌,该菌产生L-型乳酸在青贮饲料生产中发挥着重要作用;菌株M2和M4为干酪乳杆菌(L.casei),与刘飞[1]从青贮料中分离到的菌株相同。后期将对该菌株的发酵条件进行进一步研究。
[1] 刘 飞.青贮饲料中优良乳酸菌的分离鉴定及其应用[D].哈尔滨:东北农业大学,2005.
[2] 张 刚.乳酸细菌—基础技术和应用[M].北京:化学工业出版社,2007.
[3] 刘晗璐.禾本科牧草乳酸菌发现及发酵品质检测与动物生产性能影响研究[D].呼和浩特:内蒙古农业大学,2008.
[4] Haigh P M,Parker J W G. Effect of silage additives and wilting on silage fermentation, digestibility and intake,and on liveweight change of young cattle[J].Grass and Forage Science,1985,40:429-436.
[5] Ranjit N K,Taylor C C,Kung Jr L.Effect of lactobacillus buchneri 40788 on the fermentation,aerobic stability and nutritive value of maize silage[J].Grass and forage sci.,2002,57:73-81.
[6] Filya I,Sucu E,Karabulut A.The effect of Lactobacillus buchneri on the fermentation,aerobic stability and ruminal degradability of maize silage[J].Journal of Applied Microbiology,2006,101:1216-1223.
[7] Kleinschmit D H,Kung L.The effects of lactobacillus buchneri 40788 and pediococcus pentosaceus R1094 on the fermentation of corn silage[J].J.dairy sci.,2006,89:3999-4004.
[8] 王小芬,高丽娟,杨洪岩,等.苜蓿青贮过程中乳酸菌复合系Al2的接种效果及菌群的追踪[J].农业工程学报,2007(1):217-222.
[9] 热娜·米吉提.新疆饲料乳酸菌分离鉴定及多样性分析[D].乌鲁木齐:新疆大学,2012.
[10] 葛红莲,郭翠红,张军令.两株乳酸菌的分离鉴定及产酸性能的研究[J].周口师范学院学报,2009,26(2):89-90.
[11] 张满昌.快速氨化、微贮玉米秸秆对绵羊瘤胃发酵及生长性能的影响[D].哈尔滨:东北农业大学,2005.
[12] 林 红,何晶丽.玉米在畜牧养殖业中的有效利用[J].黑龙江农业科学,2014(7):77-79.
[13] 韩吉雨.青贮发酵体系中乳酸菌多样性的研究[D].呼和浩特:内蒙古农业大学,2009.
[14] 花 梅.不同地区青贮玉米发酵特性及微生物多样性[D].北京:中国农业科学院,2013.
[15] 凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:82-125.
[16] 魏日华,桂 荣,塔 娜.牧草中异型发酵乳酸菌的分离与鉴定[J].草业科学,2010(10):149-153.
[17] 钱存柔,黄仪秀.微生物学实验指导[M].北京:北京大学出版社,1999.
[18] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[19] 赵子夫.乳酸菌的分离筛选及其对玉米青贮品质和有氧稳定性的影响[D].呼和浩特:内蒙古农业大学,2009.
[20] 张慧杰,玉 柱,王 林,等.青贮饲料中乳酸菌的分离鉴定及优良菌株的筛选[J].草地学报,2011,19(1):137-141.
[21] 王 佳.鼠李糖乳杆菌与干酪乳杆菌发酵大豆乳工艺研究[D].保定:河北农业大学,2009.
(责任编辑: 王 海)
Solation and Identification of Good Lactic Acid Bacteria from Silage Maize
XI Linqiao1, WU Shuqi1, SHUI Huiling2, LIU Hui1, MA Chunhui3*
(1.CollegeofAnimalScience,TarimUniversity/TarimKeyLaboratoryofAnimalHusbandryScienceandTechnology,XinjiangProduction&ConstructionCorps,Alar,Xinjiang843300; 2.StationofAnimalHusbandryandVeterinary, 12thRegiment,theFirstDivision,XinjiangProductionandConstructionCorps,Alar,Xinjiang843300; 3.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang832000,China)
The lactic acid bacteria strains were isolated from silage maize in Akesu Prefecture, Xinjiang by MRS plate method and the isolated strains were identified by determining the physiological-biochemical indexes and 16S rDNA method to discuss species, morphology and physiological-biochemical property of lactic acid bacteria in silage maize and provide good strains for improvement of silage quality. Results: 10 strains are successfully isolated from silage maize and they all are heteromorphosis lactic acid bacteria including 2Bacilluslichenniformisstrains, 2Lactobacilluscrustorumstrains, 4L.rhamnosusstrains and 2L.caseistrains. 2Bacilluslichenniformisstrains can grow at pH 3.0~3.5 and other strains can not grow or grow weakly at pH 3.0~3.5 but 10 strains all can grow at pH 4.0~8.0. 10 strains all can grow under the conditions of 6.5% NaCl and 8.0% NaCl.B.lichenniformisstrains with fast growth rate and good acid-producing performance can be used as good strains in additive for silage by determining its lactic acid bacteria growth curve and acid-producing velocity.
silage maize; lactic acid bacteria; isolation; identification; Xinjiang
2015-04-22; 2016-02-13修回
农业部国家牧草产业体系综合试验站项目(CARS35-44);兵团畜牧科技重点实验室开放课题“暴露时间对袋装玉米青贮产气消长机理研究”(HS201404)
席琳乔(1978-),男,副教授,博士,从事饲料资源开发与利用。E-mail: gsxlq666@163.com
*通讯作者:马春晖(1966-),男,教授,博士,从事饲料资源开发与利用。E-mail: chunhuima@126.com
1001-3601(2016)03-0123-0102-04
S816.53
A

