江鳕精子的形态及超微结构观察
李胜忠, 程先友, 董亚菲, 周桂珍, 张娟利, 张玉娇
(1.新疆农业大学 动物科学学院, 新疆 乌鲁木齐 830052; 2.新疆水产科学研究所, 新疆 乌鲁木齐 830000)
江鳕精子的形态及超微结构观察
李胜忠1, 程先友2, 董亚菲1, 周桂珍1, 张娟利1, 张玉娇1
(1.新疆农业大学 动物科学学院, 新疆 乌鲁木齐 830052; 2.新疆水产科学研究所, 新疆 乌鲁木齐 830000)
为江鳕精子活力及人工繁殖受精率的提高提供参考,应用扫描电镜和透射电镜观察了江鳕精子的外部形态和超微结构。结果表明:江鳕精子由头部、颈部和尾部3部分构成,没有植入窝。头部呈椭球形,长(1.6±0.3)μm;颈部前宽后窄,长(0.6±0.2)μm;尾部细长,长(16.1±4.3)μm。江鳕精子头部有背腹之分,背部有少量细胞质;腹部主要是细胞核,其中染色质的电子密度呈均匀、致密分布,没有网络状间隙,细胞核前端无顶体。江鳕精子颈部由中心粒复合体和袖套构成。中心粒复合体分为近端中心粒和远端中心粒(基体),近端中心粒由9组三联微管组成,没有中央微管,近端中心粒的长轴与细胞核的长轴呈垂直关系。江鳕精子尾部的核心结构是轴丝,由9组外周二联微管和1对中央微管组成,是典型的“9+2”微管结构,尾部外表面有由质膜向两侧突出而成的侧鳍,左右侧鳍大小不同。
江鳕; 精子; 形态; 超微结构
江鳕(Lotalota)隶属鳕形目(Gadiformes)、鳕科(Gadidae)、江鳕属(Lota),是分布于北极淡水区系类群的冷水性鱼类,多见于北纬45°以北的欧洲、亚洲和北美洲的内陆河湖和海湾处。在我国主要分布于黑龙江、鸭绿江、乌苏里江、松花江和新疆额尔齐斯河水系[1]。近年来,由于环境污染、气候变暖和人为过度捕捞等因素,导致新疆额尔齐斯河水系江鳕自然种群数量急剧下降,捕捞种群出现低龄化和小型化现象,种群生存受到威胁。因此,开展江鳕的相关研究意义重大。杨雨壮等[2]对镜泊湖水域江鳕性腺发育演替规律研究表明,江鳕第二性征与生殖洄游期间的成熟系数、肝指数和摄食指数间存在阶段性同步变化。钱龙等[3]对江鳕受精卵的孵化条件研究表明,1℃无光条件下,江鳕的出苗率最高,光照和孵化温度升高均会降低孵化率、提高畸形率。高晓田等[4]研究表明,江鳕仔鱼体长的缓慢增长具有阶段性,体长的生长期与停止期交替出现。田永胜等[5]研究了额尔齐斯河江鳕精子冷冻保存的条件。但到目前为止,未见江鳕精子形态结构的研究报道。为此,笔者应用扫描电镜和透射电镜,观察江鳕精子的外部形态和超微结构,以期为江鳕精子活力及人工繁殖受精率的提高提供参考。
1 材料与方法
1.1 江鳕亲鱼及精液采集
江鳕亲鱼采集于新疆额尔齐斯河,体长60~92 cm,体重0.86~2.1 kg,暂养于乌鲁木齐市米东区新疆盛汇生态渔业有限公司。选择活跃健壮、体表鲜亮完好的成熟期雄鱼个体,擦干体表水分,用手轻压鱼腹部使精液流出滴入干燥冰浴玻璃瓶中,精液为乳白、黏稠,无血、尿、黏液等污染。采精时注意避免高温和阳光直射。
1.2 精液预处理
固定:取新鲜精液0.5 mL,加2.5%戊二醛(0.2 mol/L,pH 7.4,磷酸缓冲液配制)溶液1.0 mL,固定0.5~24 h。清洗:吸取样品1 mL,加0.1 mol/L磷酸盐缓冲液(PBS,pH 7.4)5 mL离心清洗(1 000 r/min,10 min)3次,缓慢倒出上清液,每次管底应留有不少于0.5 mL。脱水:使用30%、50%、70%、80%、90%和100%浓度乙醇进行梯度脱水,每梯度脱水15 min,1 000 r/min离心10 min。置换:使用无水乙醇/丙酮(1∶1)、无水乙醇/丙酮(1∶4)、纯丙酮进行置换,每次置换30 min,1 000 r/min离心10 min,去除上清液,留存管底白色絮状物。
1.3 精子扫描电镜观察
用滴管吸取预处理后的白色絮状物至载物台上,自然干燥,然后进行喷金导电处理:HITCH-1010离子溅射仪,时间80 s,电流15 mA,真空7~10 pa。喷金处理后的样品在电镜(日立S-570型)下观察,电镜参数遵照默认设定。选取结构清晰、分界明显的图片拍照进行分析。
1.4 精子透射电镜观察
白色絮状物使用EPon812包埋剂/丙酮(4∶1)、纯EPon812包埋剂对细胞进行渗透,最后用EPon812包埋剂对细胞进行包埋,分别在37℃、42℃和60℃温度下聚合72 h,然后进行超薄切片(厚度100 nm),并用铜网捞取切片,用醋酸铀和柠檬酸铅双重染色后清洗多余染料,在电镜(日立H-600型)下观察。
2 结果与分析
2.1 江鳕精子的外部形态
江鳕精子主要由头部、颈部(中段)和尾部3部分构成(图1-A),没有植入窝。头部呈椭球形,表面光滑,长(1.6±0.3)μm;颈部即精子中段较短(图1-B),前宽后窄,长(0.6±0.2)μm;尾部细长,长(16.1±4.3)μm。
2.2 江鳕精子超微结构
2.2.1 头部 江鳕精子头部呈橄榄球形(图2-A),长轴为(1.6±0.3)μm,短轴为(1.0±0.2)μm;精子头部有背腹之分,背部有少量细胞质,其中可见电子密度较小、大小不一的囊泡;腹部几乎全由细胞核占据,细胞核中染色质的电子密度呈均匀、致密分布,没有明显的网络状间隙,细胞核前端无顶体,细胞核后端没有植入窝。

注:A为完整精子,B为精子颈部,H示精子头部,MP示精子中段,T示精子尾部。
Note:A is intact sperm,B is sperm neck,C is sperm head,D is sperm tail.
图1 江鳕精子的外部形态
Fig.1 Morphology of the spermatozoon ofL.lota
2.2.2 颈部 江鳕精子颈部即中段较短,长(0.6±0.2)μm,主要结构由中心粒复合体和袖套构成。中心粒复合体位于精子细胞核之后,精子中段的中间分为近端中心粒和远端中心粒(基体),近端中心粒由9组三联微管组成,没有中央微管,近端中心粒的长轴与细胞核的长轴呈垂直关系(图2-A,B)。
袖套前端较发达,与细胞核后端相连,中央的空腔为袖套腔。袖套两侧不对称,其中分布有丰富的电子密度较大的线粒体,排列无规则,部分线粒体彼此融合,形成复合线粒体。袖套中有大量大小不一、电子密度较小的囊泡分布(图2-A,B)。
2.2.3 尾部 江鳕精子尾部即精子的鞭毛细长,长(16.1±4.3)μm,其核心结构是轴丝,由基体生长而来,贯穿于整个鞭毛。轴丝的起始端与远端中心粒相连,轴丝由9组外周二联微管和1对中央微管组成,是典型的“9+2”微管结构(图2-C,D)。轴丝与鞭毛的质膜间空隙狭窄,细胞质较少。尾部外表面有由质膜向两侧突出而成的侧鳍,左右侧鳍的大小存在差异(图2-D,E)。
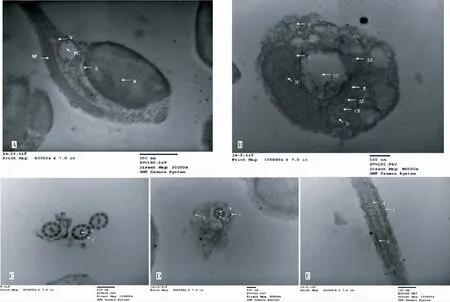
注:A为精子头部纵切,B为头部后端与颈部前端的横切,C为尾部末端横切,D为尾部中段横切,E为尾部中段纵切,N示细胞核,V示囊泡,PC示近端中心粒,BB示远端中心粒,S示袖套腔,AF示轴丝,M示线粒体,CM示中央微管,D示轴丝的外周二联微管,F示侧鳍。
Note:A is Sperm head slitting,B is the transverse of back-end of head and front end of neck, C is the transverse of tail end,D is the middle of the tail cross ,E is the middle of the tail slitter,N is nucleus, V is vesicles, PC is proximal centriole, BB is distal centrioles, S is cuff chamber, AF is axoneme, M is mitochondria, CM is the central microtubules, D is s the outer wire Tuesday microtubules, F is side fins.
图2 江鳕精子的超微结构
Fig.2 Ultrastructure of the spermatozoon ofL.lota
3 结论与讨论
3.1 江鳕精子的外部形态特点
经扫描电镜观察,江鳕精子的形态结构较为简单,由头部、颈部(中段)和尾部3部分组成。与斑点叉尾鮰、革胡子鲶、白斑红点鲑等多数硬骨鱼类精子的外部形态相似[6-8],不同之处在于江鳕精子的外形非常小且没有植入窝。有研究表明,白斑红点鲑精子的头部长24.5 μm,中段+尾部长245.0~367.5 μm,有植入窝[8];虹鳟精子的头部长21.7~34.6 μm,尾部长336.0~504.5 μm,有植入窝[9]。江鳕精子的头部长1.6 μm,尾部长16.1 μm,没有植入窝,江鳕精子的长度小于白斑红点鲑和虹鳟。江鳕精子外形小的原因:一是与江鳕卵子的卵径非常小有关,与受精的完成相适应;二是与江鳕的低温繁殖习性有关,较小的精子更能适应低温的水体环境。江鳕精子没有植入窝,是否与形态属性或繁殖特性有关,有待于进一步研究证实。
3.2 江鳕精子的超微结构特点
经透射电镜观察,江鳕精子的头部无顶体,头部有背腹之分,细胞核中染色质的电子密度呈均匀、致密分布,没有网络状间隙。从国内外已有报道来看,有些鱼类的精子有顶体,有些没有顶体。如,盲鳗、鲟鱼和肺鱼的精子有顶体[10-12],鲤鱼、黄颡鱼和哲罗鲑没有顶体[13-15]。江鳕精子没有顶体,与鲤鱼、黄颡鱼和哲罗鲑精子的超微结构一致。目前,鱼类精子顶体存在与否同鱼类受精过程的关系,有观点认为,鱼类的精子无顶体是为了适应水体环境的体外受精,顶体是鱼类进化上逐渐退化丢失的结构[16];有顶体的鱼类精子在精卵结合时会发生顶体效应、后通过受精孔入卵,而无顶体的鱼类精子则直接通过鱼卵上的卵膜孔进入卵。因此,有顶体的鱼类属于较为原始的类群[17]。
鱼类精子头部细胞核中出现电子密度较低的网络间隙,其相关研究结果不尽相同。如,白斑红点鲑、裸鲤、虹鳟精子细胞核内的染色质密集呈团状,分布较均匀,其中有相对疏松的网络状间隙,未见颗粒电子致密物质[8-9,17],哲罗鱼、细鳞鱼精子头部也有类似的网络状间隙[15,18],黄颡鱼、平鲷和索氏六须鲶鱼类精子头部细胞核中出现较大的电子密度较低区域“核泡”[14,19-20]。江鳕精子头部细胞核中染色质的电子密度呈均匀、致密分布,没有网络状间隙。表明,江鳕精子头部细胞核中没有网络间隙,是由于江鳕精子细胞核中染色质螺旋程度较低导致。与张永泉等[8]对白斑红点鲑精子头部细胞核中的网络间隙是周围染色质浓缩密集而形成“空白区域”的研究结果一致。
[1] 张俊丽.江鳕群体的形态学和遗传学研究[D].青岛:中国海洋大学,2007:1-2.
[2] 杨雨壮,殷丽洁,秦大公,等.镜泊湖江鳕的性状变异和分类地位[J].北京大学学报:自然科学版,2002,38(6):850-854.
[3] 钱 龙,范镇明,胡伯林,等.江鳕孵化条件的研究[J].淡水渔业,2006,36(5):57-58.
[4] 高晓田,肖国华,陈 力,等.江鳕胚胎发育的研究[J].淡水渔业,2011,41(6):85-90.
[5] 田永胜,姜 静,马 允,等.额尔齐斯河江鳕精子冷冻保存研究[J].农业生物技术学报,2014,22(9):1149-1156.
[6] Poirier G R,Nicholson N.Fine structure of the testicular spermatozoa from the channel catfish,Ietalurul punctatus[J].Journal of Ultrastructure Research,1980,80(1):104-110.
[7] Mansou N,Lahnsteiner F,Patzner r A.The spermatozoon of the African catfish:fine structure,modity,viability and its behaviour in seminal vesicle secretion[J].Journal of Fish Biology,2002,60(3):545-560.
[8] 张永泉,尹家胜,刘 奕,等.白斑红点鲑精子形态和超微结构的研究[J].上海海洋大学学报,2011,20(6):820-825.
[9] 谷 伟,张永泉,户 国,等.虹鳟精子的扫描和透射电镜观察[J].水产学杂志,2014,27(5):24-27.
[10] Sachiko M.Fine Structure of Spermatozoa of the Hagfish Eptatretus burger Agnatha)[J].The Biological Bulletin,1995,189:6-12.
[11] Martin N D,Wayne S K,Rosemary A W.Sperm-cell ultrastructure of North American sturgeons.Ⅲ.The lake sturgeon(AcipenserfulvescensRafinesque,1817)[J].Canadian Journal of Zoology,2000,78:438-447.
[12] 刘雪珠,杨万喜.硬骨鱼类精子超微结构及其研究前景[J].东海海洋,2002,20(3):32-37.
[13] 尤永隆,林丹军.鲤鱼精子超微结构的研究[J].动物学研究,1996,17(4):377-383.
[14] 尤永隆,林丹军.黄颡鱼精子的超微结构[J].实验生物学报,1996,29(3):235-239.
[15] 尹洪滨,尹家胜,孙中武,等.哲罗鱼精子的超微结构[J].水产学报,2008,32(1):27-31.
[16] 胡家会,张永忠,付崇罗,等.玫瑰无须鲃精子的超微结构[J].动物学报,2005,51(5):892-897.
[17] 梁 健,李长忠,史建全,等.青海湖裸鲤精子形态和超微结构的研究[J].上海海洋大学学报,2013,22(1):42-46.
[18] 张旭晨,王所安.细鳞鱼精巢超微结构和精子发生[J].动物学报,1992,38(4):355-358.
[19] 刘雪珠,杨万喜.平鲷精子的超显微结构[J].东海海洋,2004,22(4):43-48.
[20] 尹洪滨,孙中武,刘玉堂,等.索氏六须鲶精子的超微结构[J].水产学报,2000,24(4):302-305.
(责任编辑: 冯 卫)
Observation of Morphous and Ultrastructure of the spermatozoon ofLotalota
LI Shengzhong1, CHENG Xianyou2, DONG Yafei1, ZHOU Guizhen1, ZHANG Juanli1, ZHANG Yujiao1
(1.CollegeofAnimalScience,XinjiangAgricultureUniversity,Urumqi,Xinjiang830052; 2.XinjiangFisheriesResearchInstitute,Urumqi,Xinjiang830000,China)
The morphous and ultrastructural organization ofL.lotaspermatozoon was observed by scanning and transmission electron microscopes to provide the reference for enhancing the sperm motility and fertilizing rate of artificial breeding aboutL.lota. Results: The spermatozoon with no acrosome consists of the head,the neck and the tail. The head of the spermatozoon is oval shape and 1.6±0.3 μm long,the front of the sperm neck is wide,the rear of the sperm neck is narrow,the length of the sperm neck is (0.6±0.2)μm,the sperm tail is thin,long and (16.1±4.3) μm long,there is no implantation fossa in the spermatozoon. The sperm head can be divided into the back and the abdomen,the back has little cytoplasm,the abdomen consists of the nucleus mainly,the nucleus without netlike gaps and acrosome consists of electron dense chromatin materials. The sperm neck consists of centriolar complex and sleeve,the proximal centriole,which is made up of nine triplets of peripheral microtubules without central microtubules,is perpendicular to the distal centriole. The core structure of the sperm tail is axoneme, which is made up of nine peripheral duplex microtubules and a pair of central microtubules,whose structure is the typical model of“9 + 2”. The plasma membrane of the sperm tail is prominent symmetrically up and down to form two lateral fins with different sizes.
Lotalota; spermatozoon; morphous; ultrastructure
2015-11-20; 2016-02-19修回
科技部国家科技支撑计划项目“淡水养殖品种选育及规模化繁育技术研究与示范”(2012BAD26B00); 新疆大学生创新创业训练计划项目“江鳕精子显微及超微结构研究”(201510758069)
李胜忠(1964-),男,副教授,硕士,从事水产动物增养殖与繁殖生理学研究。E-mail:xndlishengzhong@sina.cn
1001-3601(2016)05-0211-0093-04
S965.199
A

