埃兹蛋白在小鼠围着床期子宫中的表达与意义
谢帆,刘雪丽,肖卓妮,谢青贞*
(1.武汉大学人民医院生殖医学中心,武汉 430060;2.武汉大学第一临床学院,武汉 430060)
·实验研究·
埃兹蛋白在小鼠围着床期子宫中的表达与意义
谢帆1,刘雪丽2,肖卓妮1,谢青贞1*
(1.武汉大学人民医院生殖医学中心,武汉430060;2.武汉大学第一临床学院,武汉430060)
【摘要】目的探讨埃兹蛋白(Ezrin)在小鼠围着床期子宫中的表达与意义。方法以昆明小鼠为实验对象,分别建立小鼠早孕及人工诱导蜕膜化模型,采用逆转录聚合酶链式反应(RT-PCR)法检测小鼠早期妊娠子中Ezrin mRNA水平,免疫组织化学(IHC)SP法检测小鼠早期妊娠子宫中Ezrin的定位。结果(1)妊娠第1~4天(妊娠第1天记为D1)小鼠子宫Ezrin的表达:RT-PCR结果显示,在D 1~4的小鼠子宫均可检测到Ezrin mRNA表达,随着妊娠天数的增加其表达量逐渐增高(P<0.05),以D4更为显著(P<0.01);IHC 结果显示,D 1~4小鼠子宫内膜的腔上皮与腺上皮均可检测到Ezrin蛋白的表达;IHC半定量分析结果显示,随着妊娠天数的增加Ezrin的蛋白水平逐渐增强(P<0.05),以D4更为显著(P<0.01)。(2)D 5胚胎着床位点小鼠子宫Ezrin的表达:RT-PCR结果显示,在D5子宫着床位点的Ezrin mRNA表达量显著高于非着床位点(P<0.01);IHC 结果显示,Ezrin在D5着床位点的免疫染色主要位于着床处下方的基质中,在非着床点仅在腔上皮和基质中有较弱的免疫染色;半定量分析结果显示,着床点小鼠子宫Ezrin的蛋白水平较非着床点高(P<0.05)。(3)Ezrin在小鼠子宫蜕膜化过程的表达:D8和人工诱导蜕膜化组(蜕膜瘤)小鼠子宫Ezrin mRNA表达量显著高于人工诱导蜕膜化对照组(分别为P<0.01和P<0.05);D8小鼠子宫Ezrin mRNA表达量高于蜕膜瘤组(P<0.05);D8和蜕膜瘤组小鼠子宫Ezrin的免疫染色均位于整个蜕膜区,人工诱导蜕膜化对照组小鼠子宫的Ezrin免疫染色位于腺上皮和腔上皮,基质中未见Ezrin的免疫染色;IHC半定量结果显示,D8和蜕膜瘤组小鼠子宫Ezrin的蛋白水平较人工诱导蜕膜化对照组高(P<0.05),D8小鼠子宫Ezrin的蛋白水平较蜕膜瘤组高(P<0.05)。结论Ezrin在小鼠妊娠早期子宫的表达具有时间和空间差异性,可能参与小鼠胚胎着床及蜕膜化过程;激活的胚泡可能促进小鼠Ezrin的表达。
【关键词】埃兹蛋白;小鼠;子宫内膜;胚胎着床
(JReprodMed2016,25(1):50-55)
胚胎着床是哺乳动物生殖过程中的重要步骤之一,是决定妊娠成功与否的关键[1],但胚胎着床的确切机制尚不明确。研究表明,胚胎着床主要依赖于卵巢雌激素和孕激素,细胞因子、黏附分子、生长因子和酶类等也发挥重要调节作用[2]。对于胚胎着床机制的研究有助于提高人工辅助生育技术的妊娠率,并对探索抗着床避孕新途径提供线索。
埃兹蛋白(Ezrin)是埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)蛋白家族成员之一,是一种重要的连接细胞膜和细胞骨架之间的膜细胞骨架连接蛋白。近年来研究表明Ezrin通过调节黏附分子和信号转导等途径,参与细胞与细胞、细胞与基质之间的相互作用,在稳定细胞形态、辅助细胞运动等多项活动中发挥着重要作用,从而在肿瘤浸润和转移过程中扮演重要角色[3-4]。近年的研究表明,Ezrin与妊娠的建立和维持关系密切,因此Ezrin在生殖领域中的研究备受关注。Matsumoto等[5]的研究提示ERM蛋白和相关黏附分子引起的细胞结构改变对于成功的胚胎着床是必需的。本文采用免疫组织化学法(IHC)及逆转录聚合酶链式反应(RT-PCR)方法,研究Ezrin在小鼠围着床期子宫中的表达及意义。
材料与方法
一、实验材料
实验动物:实验用性成熟的SPF级昆明种小白鼠(购自武汉大学医学院实验动物中心),8~12周龄,体重25~30克。饲养于人工控制条件下,室温22℃,光照周期为14 h光照(06:00~20:00),10 h黑暗;自由取食和饮水。
二、动物模型及取材
1. 早期妊娠:下午3:00~4:00将自然发情的成年雌鼠与雄鼠以1∶1的比例合笼,第2天早晨检查雌鼠是否有阴道栓,有阴道栓的雌鼠判定为交配成功,见栓当日为妊娠第1天(D1)。于每天上午9:00取材妊娠第1~8天的小鼠子宫。妊娠第2~3天时,用生理盐水冲洗输卵管,胚胎分别为2~8细胞期表示妊娠正常;第4天时,用生理盐水冲洗一侧子宫角,胚胎为囊胚表示妊娠正常;妊娠第5天上午9:00,通过尾静脉注射0.1 ml 的1%芝加哥蓝(Sigma,美国),着床位点因血管通透性增加会变为蓝色,分别收集着床位点及位于着床位点之间的非着床位点组织材料。妊娠第6~8天,肉眼观测是否发生蜕膜化确定着床位点。
2. 人工诱导蜕膜化:给健康雄性小鼠进行输精管结扎手术,手术后恢复至少两周。将结扎后的雄鼠与正常雌鼠以1∶1的比例合笼。第2天早晨检查小鼠阴道栓,见栓当日记为假孕第1天。假孕第4天上午于一侧子宫角注射10 μl芝麻油(Sigma,美国),人工诱导蜕膜化,另一侧子宫角作为对照组。假孕第8天处死雌鼠,分别留取人工诱导蜕膜化的子宫角及对照侧子宫角。
三、实验方法
1. 标本的收集及检测方法:采用颈椎脱臼法处死相应模型和各时期的小鼠,迅速取出子宫,剔除子宫系膜,切成小段。将材料分成两部分:一部分经液氮速冻后保存于-70℃冰箱中,用于RNA和蛋白的提取;另一部分用4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,制备成切片行免疫组化。每组各取3只小鼠。
2. RT-PCR法检测Ezrin mRNA表达:取相应模型小鼠子宫组织约100 mg提取总RNA,紫外分光光度计测定A260/A280范围在1.7~2.0之间。以RNA为模板,逆转录获取cDNA。
以NCBI上的小鼠Ezrin基因序列设计Ezrin引物(上游:5’-AGAGTACACGGCCAAGATCG-3’;下游:5’-TGTAGCCCATAGGCTCTGCT-3’。扩增片段长度233 bp)。以β-actin为内参照(上游引物:5’-CACGATGGAGGGGCCGGACTCATC-3’;下游引物:5’-TAAAGACCTCTATGCCAACACAGT-3’。扩增片段长度240 bp)。PCR反应条件为94℃ 1 min,1个循环;90℃ 30 s,60℃ 30 s,68℃ 10 min,25个循环;72℃ 10 min,4℃ 4 min,1个循环。
PCR产物经琼脂糖凝胶电泳,通过凝胶成像分析系统(美国Perkin Elmer Geliance 200型)摄像、测量并分析条带的灰度值,以目的基因灰度值/内参照基因灰度值的比值作为目的基因mRNA的相对表达量。实验重复3次,取平均值。
3.IHC检测Ezrin蛋白表达:应用免疫组化SP法试剂盒(武汉谷歌生物)检测,操作严格按照说明书进行。兔抗小鼠Ezrin单克隆抗体购于美国Thermo公司,用PBS代替一抗做阴性对照。阳性反应为棕黄色颗粒,阴性反应为不着色;阴性对照切片无特异性着色。
光学显微镜下观察Ezrin的定位和染色强度,采用image-proplus 6分析软件对染色进行半定量分析。在400倍高倍视野下,在每张切片相同区域随机选择5个完整的不重复的视野测定光密度,得出其平均值;每组样本观察5张切片,再求出每组平均值。
四、统计学处理
用SPSS13.0软件进行统计学分析。计量资料以平均数±标准差(±s)表示,组间比较采用t检验和方差分析;P<0.05表示差异有统计学意义。
结果
一、D1~4妊娠小鼠子宫Ezrin的表达
IHC 结果显示,D1~4妊娠小鼠子宫内膜的腔上皮与腺上皮均可检测到Ezrin蛋白的表达;IHC半定量分析结果显示,随着妊娠天数的增加,Ezrin的蛋白水平逐渐增强,与妊娠D1比较,D2、D3小鼠子宫Ezrin的蛋白表达水平显著增高(P<0.05),D4的蛋白水平更进一步增高(P<0.01)(图1A、B);RT-PCR结果显示,在D1~4的小鼠子宫均可检测到Ezrin mRNA的表达,随着妊娠天数的增加其表达逐渐增高,与D1比较,妊娠D2、D3小鼠子宫Ezrin mRNA表达显著增高(P<0.05),D4的表达更进一步增高(P<0.01)(图1C、D)。
二、D5妊娠小鼠子宫Ezrin的表达
IHC结果显示,Ezrin在D5着床位点的免疫染色主要位于着床处下方的基质中,在非着床点仅在腔上皮和基质中有较弱的免疫染色(图2A);IHC半定量分析结果显示,着床点小鼠子宫Ezrin蛋白水平较非着床点高,差异有统计学意义(P<0.05)(图2B);RT-PCR结果显示,在D5小鼠子宫着床位点的Ezrin mRNA水平显著高于非着床位点(P<0.01)(图2C、D)。
三、Ezrin在小鼠子宫蜕膜化过程的表达
IHC结果显示,D8和人工蜕膜化(蜕膜瘤)组小鼠子宫Ezrin免疫染色均位于整个蜕膜区,人工诱导蜕膜化对照组小鼠子宫的的Ezrin免疫染色位于腺上皮和腔上皮,基质中未见Ezrin的免疫染色(图3A)。
IHC半定量结果显示,D8和蜕膜瘤组小鼠子宫Ezrin蛋白水平较人工诱导蜕膜化对照组高,各组之间的差异均有统计学意义(P<0.05);D8小鼠子宫Ezrin的蛋白水平较蜕膜瘤组高,差异有统计学意义(P<0.05)(图3B)。
RT-PCR结果显示,D8的小鼠子宫Ezrin mRNA水平显著高于人工诱导蜕膜化对照组(P<0.01),蜕膜瘤组小鼠子宫Ezrin mRNA水平也显著高于人工诱导蜕膜化对照组(P<0.05);D8小鼠子宫Ezrin mRNA水平显著高于蜕膜瘤组(P<0.05)(图3C、D)

A和B分别为妊娠第1~4天(D1~4)小鼠子宫Ezrin免疫组化染色及灰度扫描结果;C和D分别为妊娠第1~4天(D1~4)小鼠子宫 Ezrin的RT-PCR产物电泳及半定量结果。M:分子量标准;le:腔上皮;ge:腺上皮。与D1比较,*P<0.05,#P<0.01;与D2比较,※P<0.05;与D3比较,△P<0.05图1 妊娠第1~4天小鼠子宫Ezrin的表达
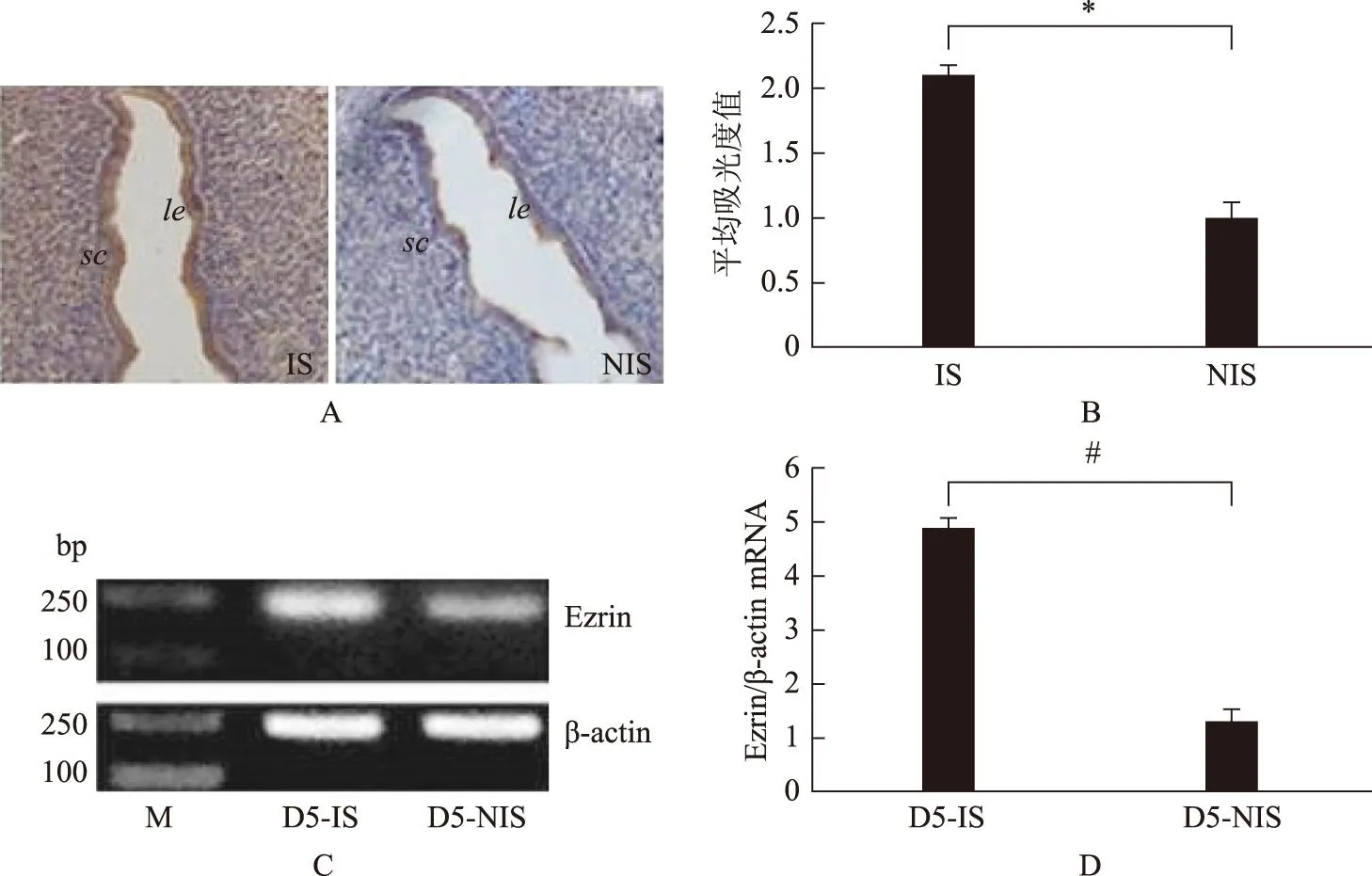
A和B分别为妊娠第5天小鼠子宫着床点(IS)和非着床点(NIS)Ezrin免疫组化染色及灰度扫描结果;C和D分别为妊娠第5天小鼠子宫着床点(D5-IS)和非着床点(D5-NIS)Ezrin的RT-PCR产物电泳及半定量结果。M:分子量标准;le:腔上皮;sc:基质细胞。相互比较,*P<0.05,#P<0.01图2 妊娠第5天小鼠子宫Ezrin的表达

A和B分别为人工诱导蜕膜化组(deciduoma)、妊娠第8天(D8)和人工蜕膜化对照组(Control)小鼠子宫Ezrin免疫组化染色及灰度扫描结果;C和D分别为人工诱导蜕膜化组(Dec)、妊娠第8天(D8)和人工蜕膜化对照组(C)小鼠子宫Ezrin的RT-PCR产物电泳及半定量结果。M:分子量标准;em:胚胎;le:腔上皮;ge:腺上皮;dc:蜕膜细胞。相互比较,*P<0.05;#P<0.01图3 Ezrin在小鼠子宫蜕膜化过程中的表达
讨论
胚胎着床是指处于活性状态的胚泡和处于接受态的子宫之间按一定的时空顺序分泌相关蛋白或局部因子从而达到相互识别、相互融合,最后导致胚胎滋养层与子宫内膜建立紧密联系的过程。该过程分为三个阶段:定位、黏附及侵入。胚胎在植入过程中,通过活性胚泡和子宫内膜之间的内分泌、旁分泌等作用,首先脱去透明带,孵化出胚泡,并定位在子宫内膜着床点;滋养外胚层在黏附分子及其受体的作用下,黏附于子宫内膜腔上皮组织并逐渐穿透上皮层和基底膜,最后侵入子宫基质细胞层[6]。
在卵巢分泌的类固醇激素的调控下基质细胞增殖分化为蜕膜细胞的过程称为蜕膜化。在啮齿动物中,蜕膜化过程也可以通过注射人工刺激物的方式进行诱导,例如向假孕子宫中注射芝麻油或对子宫进行机械性搔刮等[7]。人工诱导的蜕膜与正常妊娠蜕膜在形态上有一定差异,但差异十分细微,多用于研究蜕膜化的实验模型[8]。
Ezrin是连接细胞膜和细胞骨架之间的膜细胞骨架连接蛋白[9]。Ezrin通过氨基端伸向细胞膜直接或间接与细胞膜蛋白如细胞黏附分子CD44和CD43、细胞间黏附分子ICAM-1和ICAM-2、原癌基因c-Met、上皮细胞钙粘蛋白E-Cadherin等结合,调节细胞间及细胞与基质间的黏附[10];通过羧基端伸向细胞浆与F-肌动蛋白等细胞骨架相连接,在稳定细胞形态、辅助细胞运动等多项活动中发挥重要作用[11-13]。与Ezrin共表达的E-cadherin、ICAM-1/ICAM-2及整合素(integrin)等多种黏附分子已经在小鼠胚胎着床的研究中被证实有明确的意义。研究表明,在小鼠中,整合素在子宫内膜和胚胎的时空表达与植入窗的开放同步,是小鼠子宫接受态的标志[14]。由于人围着床期子宫内膜表达E-cadherin[15],胚胎在胚泡期也表达E-cadherin[16],这表明E-cadherin可能在人胚胎着床过程中起重要作用。与ICAM-1/ICAM-2同属于免疫球蛋白超家族的Basigin也可能在胚胎着床中发挥重要作用,Basigin基因敲除小鼠有多种生殖缺陷,如雌性小鼠不育、卵母细胞受精率低,且胚胎很难在野生型母鼠子宫中着床,绝大多数突变体胚胎在围着床期死亡[17]。Lecce等[18]研究表明,在大鼠胚胎植入过程中,Ezrin可以通过细胞骨架调节肌动蛋白骨架的重组,从而上调子宫内膜容受性,促进囊胚与子宫内膜上皮细胞的黏附。
上述研究表明,Ezrin可能在胚胎着床中起重要作用。本实验结果中,妊娠第1~4天,Ezrin表达于小鼠子宫内膜的腔上皮与腺上皮中,表达逐渐增强,Ezrin的转录水平也逐渐增高,在妊娠第4天Ezrin在腔上皮与腺上皮表达量最高,妊娠第4天是胚胎在子宫腔定位和粘附的时期,提示Ezrin可能与早孕期着床过程中的胚胎粘附有关。免疫染色及RT-PCR检测表明Ezrin在小鼠妊娠第5天子宫胚胎着床处下方的基质中高表达,说明Ezrin可能参与胚胎的着床。
在囊胚植入过程中,子宫内膜上皮细胞是与囊胚滋养细胞紧密接触的第一层细胞,该过程涉及到大量细胞骨架的重组及子宫内膜细胞顶端黏附分子的增加,最关键的是顶端骨架蛋白的明显改变,包括丝状细胞骨架终末网在胚胎植入时的溶解分离。而大量肌动蛋白和膜结合蛋白在子宫内膜上皮细胞顶端重塑过程中发挥重要作用,而顶端胞膜黏附分子也重新分布从而参与到胚胎与子宫内膜的黏附过程[19-20]。本实验结果表明,Ezrin在妊娠第8天及人工蜕膜化组小鼠的整个子宫蜕膜中都可以检测到强的免疫染色信号及转录水平,妊娠第8天及人工诱导蜕膜化组Ezrin的转录及蛋白水平均显著高于人工蜕膜化对照组,因此我们推测Ezrin可能在蜕膜化过程中起着重要的作用。
正常妊娠第5天着床点小鼠子宫Ezrin的转录及蛋白水平均高于非着床点,妊娠第8天小鼠子宫Ezrin的转录及蛋白水平较人工蜕膜化小鼠组高。以上结果均表明激活的胚泡可能诱导Ezrin在小鼠子宫中的表达,但具体机制不明,需要进一步研究。
【参考文献】
[1]Simón C,Martín JC,Pellicer A. Paracrine regulators of implantation[J]. Baillieres Best Pract Res Clin Obstet Gynaecol,2000,14:815-826.
[2]魏丽坤,张雷,王蔼明. 子宫内膜容受性的形态学和分子生物学相关标志[J].生殖医学杂志,2008,17:74-78.
[3]Auvinen E,Carpen O,Korpela T,et al. Altered expression of ezrin,E-Cadherin and β-Catenin in cervical neoplasia[J]. Neoplasma,2013,60:56-61.
[4]Fehon RG,McClatchey AI,Bretscher A. Organizing the cell cortex: the role of ERM proteins[J]. Nat Rev Mol Cell Biol,2010,11:276-287.
[5]Matsumoto H,Daikoku T,Wang H,et al. Differential expression of ezrin/radixin/moesin (ERM) and ERM-associated adhesion molecules in the blastocyst and uterus suggests their functions during implantation[J]. Biol Reprod,2004,70:729-736.
[6]Makrigiannakis A,Minas V. Mechanisms of implantation[J/OL]. Reprod Biomed Online,2007,14:102-109.
[7]Cha J,Sun X,Dey SK. Mechanisms of implantation: strategies for successful pregnancy[J]. Nat Med,2012,18:1754-1767.
[8]Bany BM,Cross JC. Post-implantation mouse conceptuses produce paracrine signals that regulate the uterine endometrium undergoing decidualization[J]. Dev Biol,2006,294:445-456.
[9]Bretscher A. Characterization and ultrastructural role of the major components of the intestinal microvillus cytoskeleton[J]. Cold Spring Harb Symp Quant Biol,1982,46 Pt 2:871-879.
[10]Smith WJ,Nassar N,Bretscher A,et a1. Structure of the active N-terminal domain of Ezrin. Conformational and mobility changes identify keystone interactions[J]. J Biol Chem,2003,278:4949-4956.
[11]Martin TA,Harrison G,Mansel RE,et al. The role of the CD44/ezrin complex in cancer metastasis[J]. Crit Rev Oncol Hematol,2003,46:165-186.
[12]Polesello C,Payre F. Small is beautiful:what flies tell us abput ERM protein function in development[J]. Trends Cell Biol,2004,14:294-302.
[13]Bruce B,Khanna G,Ren L,et al. Expression of the cytoskeleton linker protein ezrin in human cancers[J]. Clin Exp Metastasis,2007,24: 69-78.
[14]Illera MJ,Cullinan E,Gui Y,et al. Blockade of the alpha(v)beta(3) integrin adversely affects implantation in the mouse[J]. Biol Reprod,2000,62:1285-1290.
[15]Dawood MY,Lau M,Khan-Dawood FS. E-cadherin and its messenger ribonucleic acid in periimplantation phase human endometrium in normal and clomiphene-treated cycles[J]. Am J Obstet Gynecol,1998,178:996-1001.
[16]Bloor DJ,Metcalfe AD,Rutherford A,et al. Expression of cell adhesion molecules during human preimplantation embryo development[J]. Mol Hum Reprod,2002,8:237-245.
[17]Igakura T,Kadomatsu K,Kaname T,et al. A null mutation in basigin,an immunoglobulin superfamily member,indicates its important roles in peri-implantation development and spermatogenesis[J]. Dev Biol,1998,194:152-165.
[18]Lecce L,Lindsay LA,Murphy CR. Ezine and EBP50 redistribute apically in rat uterine epithelial cells at the time of implantation and in response to cell contact [J].Cell Tissue Res,2011,343:445-453
[19]Murphy CR. The cytoskeleton of uterine epithelial cells: a new player in uterine receptivity and the plasma membrane transformation[J]. Hum Reprod Update,1995,1:567-580.
[20]Terry V,Shaw TJ,Shorey CD,et al. Actin-binding proteins undergo major alterations during the plasma membrane transformation in uterine epithalial cells[J].Anat Rec,1996,246: 71-77.
[编辑:陆彩玲]
Expression of ezrin in mouse uterus during peri-implantation
XIEFan1,LIUXue-li2,XIAOZhuo-ni1,XIEQing-zhen1*
1.CenterforReproductiveMedicine,RenminHospitalofWuhanUniversity,Wuhan430060
2.TheFirstClinicalCollegeofWuhanUniversity,Wuhan430060
【Abstract】
Objective: To investigate the expression of ezrin in mouse uterus during peri-implantation.
Methods: Immunohistochemistry and reverse transcription polymerase chain reaction (RT-PCR) were adopted to detect the localization and expression of ezrin in mouse uterus in early pregnancy and artificial induced decidualization models.
Results: (1) Expression of ezrin in mouse uterus on day 1 to 4 (day 1=vaginal plug) of pregnancy: RT-PCR results showed that the expression of ezrin mRNA was significantly increased along with pregnancy days gradually (P<0.05),which was prominent on day 4 of pregnancy (P<0.01). Immunohistochemistry localized ezrin protein to luminal epithelium and glandular epithelium in endometrium,and the signal of ezrin protein was also significantly enhanced along with pregnancy days gradually (P<0.05),which reached the highest on day 4 of pregnancy by semi-quantitative analysis (P<0.01);(2) Expression of ezrin in implanted sites on day 5 of pregnancy: RT-PCR results showed that ezrin mRNA was up-regulated in implantation sites on day 5 of pregnancy compared with inter-implantation sites (P<0.01). Immunohistochemistry results showed that ezrin protein was localized in subluminal stroma surrounding implanted embryo in implantation sites,while it was weakly detected in luminal epithelium and glandular epithelium in inter-implantation sites. The expression of ezrin protein in implantation sites on day 5 of pregnancy was higher than that of in inter-implantation sites (P<0.05) by semi-quantitative analysis;(3) Expression of ezrin during decidualization: Ezrin mRNA were significantly higher expressed in implantation sites on day 8 of pregnancy or deciduoma in artificially induced decidualization when compared with the control group of artificially induced decidualization (P<0.01 andP<0.05,respectively). In addition,the expression of ezrin mRNA was significantly higher on day 8 of pregnancy than that in deciduoma (P<0.05). The immunostaining of ezrin in deciduoma group and on day 8 of pregnancy were positively located over the whole decidua area,while ezrin was localized in glandular epithelium and luminal epithelium rather than stroma in control group. Semi-quantitative analysis showed that the optical density value of immunostaining on day 8 of pregnancy or in deciduoma group was significantly higher than that in control group(P<0.05),and the value on day 8 of pregnancy was significantly higher than that in deciduoma group (P<0.05).
Conclusions: Ezrin was spatiotemporally expressed in mouse uterus during early pregnancy and may be involved in embryo implantation and decidualization. Ezrin expression in mouse uterus is induced by the activated blastocyst.
Key words:Ezrin;Mouse;Endometrium;Embryo implantation
【作者简介】谢帆,女,湖北人,硕士,生殖内分泌专业.(*通讯作者)
【收稿日期】2015-06-05;【修回日期】2015-08-11
DOI:10.3969/j.issn.1004-3845.2016.1.010

