miRNA-34a对人结肠癌细胞HCT116增殖及侵袭转移的影响
庄 彪 闵志均 王廷峰 张 鹏 倪 熊 瞿惠龙 丁育明
miRNA-34a对人结肠癌细胞HCT116增殖及侵袭转移的影响
庄彪闵志均王廷峰张鹏倪熊瞿惠龙丁育明
【摘要】目的研究微小RNA-34a(microRNA-34a,miR-34a)在人结肠癌细胞株HCT116中的过表达对细胞增殖和侵袭的影响及其机制。方法设计合成并构建携带绿色荧光蛋白 (GFP)的miR-34a真核表达载体,脂质体法稳定转染HCT116细胞。通过Realtime PCR验证转染后miR-34a的表达变化。MTT法检测转染前后HCT116细胞增殖能力变化,Transwell法检测转染前后HCT116细胞侵袭能力改变,western blot检测目的蛋白的表达。结果miR-34a转染HCT116细胞后其表达量增加到(7.32±1.34)倍,而HCT116细胞增殖能力也受到显著抑制,下降到(0.49±0.10);Bcl-2蛋白受到miR-34a表达的抑制,而BAX的表达则受到miR-34a表达的增强;HCT116细胞侵袭能力在miR-34a过表达后显著增强,相应的MMP-2和MMP-9表达也出现显著增强。阴性对照组与空白对照组比较无显著性差异。结论miR-34a的过表达能够抑制人结肠癌细胞HCT116的增殖及侵袭转移,与调控Bcl-2/BAX和MMP-2和-9蛋白的表达密切相关。
【关键词】人结肠癌细胞;miRNA-34a;增殖;侵袭
(ThePracticalJournalofCancer,2016,31:179~182)
结肠癌(cancer of colon)作为中国最常见的消化道肿瘤之一,其发病率占胃肠道肿瘤的第3位。流行病学调查研究显示,中国的结肠癌发病率呈逐年上升趋势,与社会环境、生活方式和遗传等因素密切相关。深入探究结肠癌的病因和机制,对结肠癌的早期诊断、临床治疗及预后均有显著意义。微小 RNA(microRNA,miRNA)是一类在进化上结构高度保守的内源性非编码RNA,近年来大量研究早已证实,miRNA在多种恶性肿瘤的病理进程中起到了极为重要的调控作用[1]。其中MicroRNA-34a(miR-34a)能够作为抑癌基因p53的效应分子从而抑制多种癌细胞的增殖[2],但对于miR-34a在结肠癌中的作用和机制研究仍相对空白,本研究通过构建 miR-34a表达载体并转染人结肠癌细胞HCT116,研究miRNA-34a的表达在结肠癌中的增殖及侵袭转移的作用,并探讨其作用机制。
1材料与方法
1.1 细胞株与主要试剂
人结肠癌细胞株HCT116购自中国科学院细胞库,高糖DMEM培养基、胎牛血清、青霉素和链霉素等细胞培养试剂购自GIBCO公司,miRNA提取试剂盒购自QIAGEN公司,Real-time PCR Taqman 试剂购自Takara公司,MTT试剂购自Sigma公司,miR-34a真核表达载体(GAUGUUCUAUUGAAGAGUGUUUG)和阴性对照miR-34a-none control (NC:GGACACGAAATCTATGCGCGTG)及携带GFP荧光蛋白表达的重组质粒由上海吉玛基因公司设计并合成,转染试剂 lipofectmin2000 购自 Invitrogen公司,Western blot相关试剂(上样缓冲液,蛋白marker,电泳液和转膜液,显色液)购自碧云天公司,第一抗体和第二抗体购自Cell signalling Technology公司,其他常用试剂购自Sigma公司。
1.2 实验方案
1.2.1细胞培养人结肠癌细胞株HCT116培养于含10%胎牛血清、1 000 U/ml青链霉素的高糖DMEM培养基,放置于37 ℃,5% CO2的恒温细胞培养箱内,每2~3天更换培养液,待细胞融合>80%后使用胰蛋白酶消化细胞,种板培养或传代。
1.2.2miR-34a转染HCT116细胞消化重悬后,使用DMEM完全培养基稀释到105个/ml,将2 ml细胞种到6孔板中,置于37 ℃、5% CO2的恒温细胞培养箱内24 h后,待细胞融合>50%后更换无血清培养基,进行转染。提前按照试剂说明书制备转染溶液,在500 μl DMEM 中加入 5 μg 质粒混匀,室温孵育 5 min;在DMEM中再加入 10 μl 脂质体 lipofectmin 2000 混匀,室温孵育 5 min;将上述2种稀释液混匀,室温孵育 20 min。将混合物加入6 孔板中,混匀后继续培养,转染后12 h后更换DMEM完全培养液,置于37 ℃、5% CO2的恒温细胞培养箱内培养用于后续实验。
1.2.3miR-34a表达检测培养HCT116细胞使用QIAGEN公司miRNA提取试剂盒提取总miRMA后,使用TaqMan MicroRNA 逆转录试剂盒将上述提取的miRNA 逆转录成 cDNA,反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min;以 TaqMan MicroRNA 检测试剂盒对上述制备得到的cDNA进行 real-time PCR 反应,反应条件:95 ℃ 10 min,95 ℃ 15 s 及 60 ℃ 1 min,共 40个循环。PCR 完成后,在罗氏LC480软件上分析基因的扩增情况,得到相应的 Ct 值。以 U6为内参来校正PCR 模板的拷贝数,每组设3个复孔,基因相对表达量采用 2-ΔΔCt方法计算。
1.2.4Western blotmiR-34a转染组、阴性对照组和空白对照组的HCT116 细胞在培养24 h后,去除培养基,加入预冷的PBS洗涤细胞,加入10 μl的RIPA裂解液,10 min后提取总蛋白,BCA法蛋白定量蛋白浓度,各组取50 μg蛋白进行10%SDS-PAGE电泳。电泳结束后转膜到PVDF膜,用5% milk-TBS将膜封闭1 h,加入相应的第一抗体,静置于4 ℃过夜。次日使用TBST漂洗,辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,DAB显影拍照。
1.2.5MTT 检测细胞的增殖miR-34a转染组、阴性对照组和空白对照组的HCT116 细胞以105/ml 密度接种于 96孔板中,加入200 μl DMEM完全培养液,转染后置于 37 ℃、5% CO2孵箱中分别培养 24、36、 48 h和72 h后,去除培养液,加入10 μl/每孔的MTT 后在37 ℃细胞培养箱内继续孵育1 h 后,观察到明显的颜色变化后再用酶标仪读取每孔的吸光度值,计算细胞增殖抑制率。
1.2.6Transwell肿瘤细胞侵袭实验检测细胞侵袭能力miR-34a转染组、阴性对照组和空白对照组的HCT116 细胞分别接种于6孔板中。本研究使用8 μm孔径的Corning小室检测HCT116细胞的侵袭能力。单层Matrigel胶提前包被小室滤膜,在上室孔中加入转染组、阴性对照组和空白对照组的HCT116 细胞(105个),在下室中加入DMEM完全培养基,静置于37 ℃培养箱内培养24 h后。去除培养基,使用4%多聚甲醛固定,苏木精染色,置于显微镜下随机选取5个视野进行细胞计数。细胞侵袭率/%=(穿透细胞数/空白对照组穿透细胞数)×100% 。
1.3 统计学分析
数据分析应用Graphpad Prism 5.0统计软件完成,数据采用MEAN±SEM 表达,组间比较采用单因素方差分析(one-way ANOVA),P<0.05或P<0.01表示差异具有统计学意义。
2结果
2.1 miR-34a转染HCT116细胞上调miR-34a的表达
在miR-34a表达质粒转染HCT116细胞24 h后,荧光检测结果可见,miR-34a转染的HCT116细胞中可见携带GFP绿色荧光蛋白,表明转染成功。提取细胞总miRNA进行Reltime PCR验证,结果显示,转染后的HCT116细胞的miR-34a表达水平增加了(7.32±1.34)倍(与空白对照组相比,P<0.001),而阴性对照组与空白对照组的miR-34a表达水平比较无显著性差异,其中阴性对照组为(0.99±0.01),空白对照组为(1.00±0.03)(图1)。因此可以明确,miR-34a表达质粒转染HCT116细胞后能够显著上调miR-34a的表达。
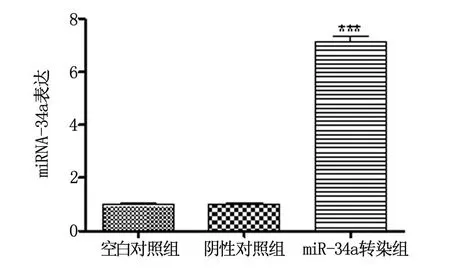
图1 Realtime PCR检测HCT116细胞中miR-34a表达
2.2 miR-34a 转染抑制HCT116细胞的增殖
对转染miR-34a后的HCT116细胞增殖能力进行检测。MTT检测结果显示,miR-34a过表达的HCT116细胞的增殖能力受到显著抑制,下降到(0.49±0.10)(与空白对照组相比,P<0.001),而阴性对照组与空白对照组miR-34a表达水平比较无显著性差异,其中阴性对照组为(1.00±0.08),空白对照组为(0.99±0.06)(图2),表明miR-34a与HCT116细胞的增殖能力密切相关。
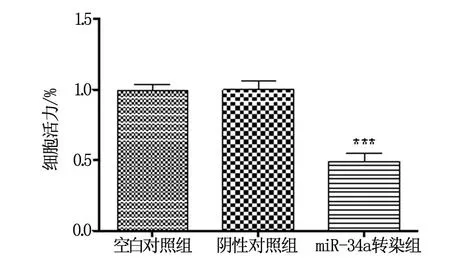
图2 MTT法检测结果
2.3 miR-34a转染对Bcl-2和BAX蛋白表达的影响
Bcl-2和BAX蛋白是细胞凋亡分子机制研究的重要靶分子。Western blot结果显示,与空白对照组及阴性对照组相比,miR-34a转染组的Bcl-2条带灰度明显降低,而BAX条带灰度则显著增强,但空白对照组和阴性对照组相比无显著差异(图3),表明miR-34a可能通过调控Bcl-2和BAX蛋白表达而抑制HCT116细胞的增殖。

图3 Western blot检测结果
2.4 miR-34a转染对HCT116侵袭能力的影响
Transwell检测结果显示,miR-34a过表达的HCT116细胞的侵袭能力受到显著抑制,下降到(62.67±8.23)%(与空白对照组相比,P<0.001),而阴性对照组与空白对照组miR-34a表达比较无显著性差异,其中阴性对照组为(93.32±10.20)%,空白对照组为(100.50±8.13)%(图4),表明miR-34a可能参与了HCT116细胞的侵袭过程。
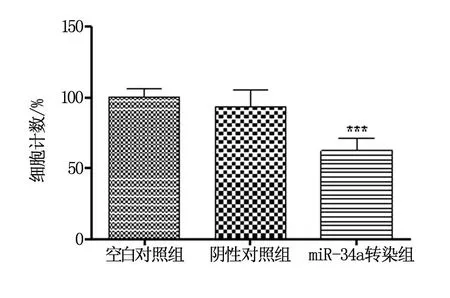
图4 Transwell法检测结果
2.5 miR-34a转染对MMP-2和MMP-9蛋白表达的影响
基质金属蛋白酶(matrix metalloproteinases,MMPs)的活性与结肠癌细胞的侵袭转移能力密切相关。Western blot结果显示,与空白对照组及阴性对照组相比,miR-34a转染组的MMP-2和MMP-9的条带灰度明显降低,其中MMP-9的条带灰度减弱更为明显,但空白对照组与阴性对照组相比,MMP-2和MMP-9无显著差异(图5),表明miR-34a可能通过调控MMP-2和MMP-9的蛋白表达而抑制HCT116细胞的侵袭转移。

图5 Western blot检测结果
3讨论
结肠癌是我国常见的消化道恶性肿瘤,全球每年新发病例多达800万人,具有浸润性生长、恶性程度高和复发率高的特点,而其病因和机制尚未得到明确的认识,给治疗带来了极大的困难[3]。进一步研究揭示结肠癌发病的分子机制和药物靶点,具有重要的社会和经济价值。
MicroRNA是1种近年逐渐明确的内源性非编码的单链小分子RNA,其结构在进化上高度保守,能够通过与目标基因的转录mRNA的3’-UTR端特异性配对结合而发生结构改变,从而促进目标基因mRNA的降解或抑制其翻译转录,从而达到调控靶蛋白表达的作用[4]。近年的大量研究表明,存在多种不同功能的miRNA位于肿瘤相关基因组的染色体区域,并能通过与目的基因的相互作用而对肿瘤细胞的恶性生物学行为产生不同的调控作用,尤其是与癌细胞的增殖和侵袭转移密切相关[5-6]。miRNA 的功能学研究为多种肿瘤,包括结肠癌的诊断和治疗提供了新的研究思路和方向,并且通过应用miRNA的表达载体或相应的反义miRNA 来提高或降低特定miRNA 的表达,从而达到抑制癌细胞生长转移的作用已取得了一定的研究成果[7]。已有研究明确,在结肠癌患者的病变组织中能够检测到多种miRNA出现差异性表达,例如Wang P等的研究显示,miRNA-21靶向调控Cdc25a的表达而对结肠癌细胞的增殖和周期产生抑制作用[8],而miRNA-143和-145在结肠癌细胞增殖和化疗敏感性等方面的作用已经相对明确,成为具有潜在的诊断和治疗价值的靶点[9]。早有研究显示,miR-34a能够促进胶质瘤细胞的凋亡,阻滞细胞周期于G1期而抑制其增殖,同时也能抑制其侵袭转移能力[10],此外miR-34a在前列腺癌、肝癌和肺癌等多种肿瘤中展示出多种不同机制的调控作用,而被认为是具有重要价值的肿瘤抑制因子[11-13],但是miR-34a 在结肠癌中的作用研究目前尚相对较少。
为了探讨miR-34a的表达在结肠癌中的作用,本研究根据microRNA作用原理设计合成了miR-34a的真核表达载体并转染HCT116细胞,采用real-time PCR 检测结果明确了转染细胞后miR-34a表达显著上升,在此基础上我们发现,miR-34a的过表达抑制了HCT116细胞的增殖和侵袭转移。上述结果表明,miR-34a在HCT116细胞中起到抑制肿瘤相关基因的作用,提示miR-34a可作为结肠癌基因治疗的潜在靶点,这与其他的研究结果一致[14]。一些研究也发现,部分miRNA具有调控部分与癌细胞增殖和侵袭转移相关的靶点蛋白,例如miRNA-146b能够通过靶向调控MMPs的表达而抑制胶质瘤细胞的侵袭能力[15]。因此我们进一步研究了与细胞增殖和转移密切相关的蛋白表达,而与前面的研究结果相一致的,Bcl-2表达被抑制而BAX表达出现上调,癌细胞转移相关的MMP-2和MMP-9的表达受到抑制,提示miR-34a通过调控Bcl-2/BAX和MMP-2和-9蛋白的表达而降低了结肠癌细胞的增殖和侵袭转移的能力。
综上所述,本研究证实miR-34a的过表达能够抑制人结肠癌HCT116细胞的增殖和侵袭转移,这一作用可能是通过调控Bcl-2/BAX和MMP-2和-9蛋白的表达相关,初步揭示了miR-34a在结肠癌的治疗和诊断中的潜在价值,为后续的深入研究提供理论和实验基础。
参考文献
[1]Watanabe T,Itabashi M,Shimada Y,et al.Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2010 for the treatment of colorectal cancer〔J〕.Int J Clin Oncol,2012,17(1):1-29.
[2]Raver-Shapira N,Marciano E,Meiri E,et al.Transcriptional activation of miR-34a contributes to p53-mediated apoptosis〔J〕.Mol cell,2007,26(5):731-743.
[3]Böckelman C,Engelmann BE,Kaprio T,et al.Risk of recurrence in patients with colon cancer stage Ⅱ and Ⅲ:A systematic review and meta-analysis of recent literature〔J〕.Acta Oncol,2015,54(1):5-16.
[4]Iorio MV,Croce CM.MicroRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review〔J〕.EMBO Mol Med,2012,4(3):143-159.
[5]Rokavec M,Öner MG,Li H,et al.IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis〔J〕.J Clin Invest,2014,124(4):1853-1867.
[6]Calin GA,Croce CM.MicroRNA-cancer connection:the beginning of a new tale〔J〕.Cancer Res,2006,66(15):7390-7394.
[7]Pereira DM,Rodrigues PM,Borralho PM,et al.Delivering the promise of miRNA cancer therapeutics〔J〕.Drug Discov Today,2013,18(5):282-289.
[8]Wang P,Zou F,Zhang X,et al.microRNA-21 negatively regulates Cdc25A and cell cycle progression in colon cancer cells〔J〕.Cancer Res,2009,69(20):8157-8165.
[9]Akao Y,Nakagawa Y,Naoe T.MicroRNA-143 and-145 in colon cancer〔J〕.DNA Cell Biol,2007,26(5):311-320.
[10]Guessous F,Zhang Y,Kofman A,et al.microRNA-34a is tumor suppressive in brain tumors and glioma stem cells〔J〕.Cell Cycle,2010,9(6):1031-1036.
[11]Liu C,Kelnar K,Liu B,et al.The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44〔J〕.Nat Med,2011,17(2):211-215.
[12]Li N,Fu H,Tie Y,et al.miR-34a inhibits migration and invasion by down-regulation of c-Met expression in human hepatocellular carcinoma cells〔J〕.Cancer Lett,2009,275(1):44-53.
[13]Gallardo E,Navarro A,Violas N,et al.miR-34a as a prognostic marker of relapse in surgically resected non-small-cell lung cancer〔J〕.Carcinogenesis,2009,30(11):1903-1909.
[14]Tazawa H,Tsuchiya N,Izumiya M,et al.Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells〔J〕.Proc Natl Acad Sci USA,2007,104(39):15472-15477.
[15]Xia H,Qi Y,Ng SS,et al.microRNA-146b inhibits glioma cell migration and invasion by targeting MMPs〔J〕.Brain Res,2009,1269:158-165.
(编辑:吴小红)
Effects of miRNA-34a on Cell Proliferation and Invasion in Human Colon
Cancer Cell HCT116
ZHUANGBiao,MINZhijun,WANGTingfeng,etal.ShanghaiPudongHospital,Shanghai,201300
【Abstract】ObjectiveTo investigate the effects of microRNA-34a (miR-34a) overexpression on cell proliferation and invasion in human colon cancer cell line HCT116.MethodsA portable green synthesis fluorescent protein (GFP) of miR-34a eukaryotic expression vector was designed and established to stably transfect HCT116 cells.Realtime PCR was used to verify the expression of miR-34a after expression vector transfection.MTT assay was used to determine the changes of HCT116 cell proliferation.Transwell assay was performed to measure the cell invasion ability of HCT116 cells.ResultsAfter transfection of miR-34a into HCT116 cells,the expression of miR-34a increased by(7.32±1.34) folds and cell proliferation ability was significantly inhibited,which was reduced to(0.49±0.10) compared with the control group.Bcl-2 protein expression was inhibited by miR-34a transfection,but the expression of BAX was enhanced by miR-34a transfection.The invasion of HCT116 cells was also significantly increased by miR-34a transfection,which was accompanied by MMP-2 and MMP-9 up-regulation.There was no significant difference in the negative control group and the control group.ConclusionOverexpression of miR-34a can inhibit the proliferation and invasion in human colon cancer cells HCT116,and it is closely correlated with the regulation of Bcl-2/BAX and the expression of MMP-2 and-9 proteins.
【Key words】Human colon cancer cells;miRNA-34a;Proliferation;Invasion
(收稿日期2015-03-23修回日期 2015-11-20)
中图分类号:R735.3+5
文献标识码:A
文章编号:1001-5930(2016)02-0179-04
DOI:10.3969/j.issn.1001-5930.2016.02.002
通讯作者:庄彪
基金项目:上海市浦东新区卫生和计划生育委员会科技发展专项基金(编号:PW2014A-28)
作者单位:201300上海市浦东医院

