dTDP-L-鼠李糖生物合成路径的电喷雾多级串联质谱法表征
许莹莹,董晨影,周大炜,2,3
(1.南开大学泰达生物技术研究院,天津 300457;2.天津市微生物功能基因组学重点实验室,天津 300457;
3.南开大学分子微生物学与技术教育部重点实验室,天津 300457)
dTDP-L-鼠李糖生物合成路径的电喷雾多级串联质谱法表征
许莹莹1,董晨影1,周大炜1,2,3
(1.南开大学泰达生物技术研究院,天津300457;2.天津市微生物功能基因组学重点实验室,天津300457;
3.南开大学分子微生物学与技术教育部重点实验室,天津300457)
摘要:本研究以2’-脱氧胸苷-5’-二磷酸-L-鼠李糖(dTDP-L-Rha)生物合成路径涉及的系列酶促反应产物为研究对象,建立了电喷雾碰撞诱导解离串联质谱(CID-ESI-MSspan)对罕见单糖生物合成路径的表征方法。该方法首先通过ESI-MS技术分析2’-脱氧胸苷-5’-二磷酸-D-葡萄糖-4,6-脱氢酶(RmlB)、2’-脱氧胸苷-5’-二磷酸-4-酮-6-脱氧-葡萄糖-3,5异构酶(RmlC)和2’-脱氧胸苷-5’-二磷酸-4-酮-鼠李糖还原酶(RmlD)酶活产物的形成,随后应用CID-ESI-MSspan技术对酶促反应终产物L-鼠李糖(dTDP-L-Rha)的结构进行表征。结果表明:dTDP-L-Rha 的生物合成始于2’-脱氧胸苷-5’-二磷酸-D-葡萄糖(dTDP-D-Glc),依次涉及RmlB、RmlC 和RmlD 三个酶的参与。这与传统的高效液相色谱法(HPLC)监测、纯化制备,核磁共振(NMR)及ESI-MS结构表征的分析结果一致。该方法简单、灵敏、快速,适用于重要罕见单糖生物合成路径的表征。
关键词:罕见单糖;dTDP-L-鼠李糖;生物合成路径;电喷雾串联质谱(ESI-MS/MS)
doi:10.7538/zpxb.youxian.2015.0045
网络出版时间:2015-09-09;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20150909.1515.012.html
在植物、真菌和细菌次生代谢物结构中发现的罕见单糖是自然界一类重要的碳水化合物,具有抗癌、抗病毒、抗真菌和抗菌活性。这些次生代谢物分子的糖部分通常发生不同程度的脱氧化,进而参与药物靶点的分子识别。大量的结构和功能研究表明,罕见单糖对其母体化合物的生物活性必不可少[1]。罕见单糖(各种活化核苷二磷酸(dNDP)-脱氧己糖)的生物合成路径重点涉及核苷二磷酸(dNDP)-己糖上C-2、C-3、C-4和C-6 羟基的脱氧,异构化,氨基化,甲酰基化,乙酰基化和甲基化转化。近年来,一些研究结果已清楚地表明,为数众多的罕见单糖仅存在于特殊种类的细菌中,而且,细菌表面酯寡糖化学结构中含有罕见单糖的O-抗原更容易逃避宿主细胞的免疫识别[2]。例如,L-鼠李糖(dTDP-L-Rha)生物合成路径的破坏在严重影响其生存的同时,也大大减弱了毒性,但该生物合成路径至今仍未在人类中发现[3]。在细菌,尤其是病原菌的形成和进化过程中,罕见单糖起着非常关键的作用。为确定涉及病原菌致病机理的关键靶点,需要更好地理解上述罕见单糖的生物合成路径。
dTDP-L-Rha的生物合成路径示于图1,目前该路径的表征方法有高效液相色谱(HPLC)法和光谱法[4-6]等,但这些方法普遍存在样品用量大、耗时长、实验程序繁琐等缺点。特别是在酶活反应体系较复杂(多酶偶联反应或含多种辅因子等)的情况下,需要分析化学领域的专业人员探索适宜的分离条件。
近年来,电喷雾电离(ESI)离子化方式的发展和成熟,特别是碰撞诱导解离(CID)技术的应用以及多级串联质谱技术的发展为糖精细结构的解析提供了技术平台[7-8]。因此,结合已知的罕见单糖生物合成途径的专业知识,可以完成罕见单糖合成酶酶活的监测和生物合成路径的表征工作。本研究以高效液相色谱法和核磁共振(NMR)技术已证明的生物合成途径的罕见单糖dTDP-L-Rha为研究模型,尝试通过电喷雾离子阱质谱(ESI-IT-MS)技术分析2’-脱氧胸苷-5’-二磷酸-D-葡萄糖4, 6-脱氢酶(dTDP-D-glucose 4,6-dehydratase, RmlB)、2’-脱氧胸苷-4-酮-6-脱氧-葡萄糖-3,5异构酶(dTDP-4-keto-6-deoxy-glucose-3,5 epimerase, RmlC)、2’-脱氧胸苷-4-酮-鼠李糖还原酶(dTDP-4-keto-rhamnose reductase,RmlD) 酶活产物的形成;并在应用电喷雾碰撞诱导解离串联质谱(CID-ESI-MSn)技术对酶促反应终产物dTDP-L-Rha结构进行表征的基础上,建立简单、高效、灵敏和准确的罕见单糖生物合成路径表征方法,以期为研究病原菌中罕见单糖生物合成涉及的酶奠定基础。
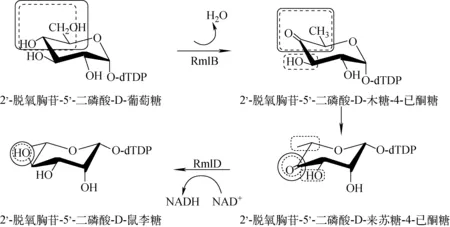
图1 dTDP-L-Rha的生物合成路径Fig.1 Biosynthesis pathway of dTDP-L-Rha
1实验部分
1.1仪器与试剂
Finnigan LCQ Advantage MAX电喷雾离子阱质谱仪:美国Thermo Electron公司产品。
脱氧胸苷二磷酸葡萄糖(dTDP-Glc):美国Sigma-Aldrich公司产品;大肠杆菌O7中RmlB、RmlC和RmlD基因的克隆,含相应重组质粒的细菌培养,以及上述3个表达产物的纯化制备等按文献[6]方法进行;甲醇、乙腈:均为色谱纯,美国Fisher公司产品;水为二次重蒸水。
1.2主要材料
1.2.1RmlB酶活反应40 μL酶活反应体系的组成:将3 mmol/L dTDP-D-Glc,5 mmol/L MgCl2,0.26 μmol/L RmlB和50 mmol/L磷酸盐缓冲液(pH 7.4)在37 ℃温育1 h,反应结束后,在沸水浴中加热3 min,以12 000 r/min离心5 min。取上清液,加入1 mL二次重蒸水,混匀后过再生的Envi-Carb柱,用2 mL冷二次重蒸水缓慢洗脱杂质,然后以1 mL已预热的50 ℃乙腈-水溶液(1∶1,V/V)洗脱酶促反应产物。经Envi-Carb柱前处理的产物混合物直接用于电喷雾离子化-离子阱多级质谱分析。
1.2.2RmlB、RmlC和RmlD三酶偶联反应40 μL三酶(RmlB、RmlC 和RmlD)偶联酶促反应体系的组成:将3 mmol/L dTDP-D-Glc,5 mmol/L MgCl2,4 mmol/L烟酰胺腺嘌呤二核苷酸(NADH),0.26 μmol/L RmlB,0.32 μmol/L RmlC,0.48 μmol/L RmlD和50 mmol/L磷酸盐缓冲液(pH 7.4)在37 ℃温育2 h,其他步骤同1.2.1节。
1.3ESI-MS条件
流动注射泵进样,进样量0.2 mL/min,负离子检测模式,喷雾电压-4.5 kV,壳气(N2)流速35个单位,金属毛细管温度220 ℃,碰撞气为氮气,辅助气体为氦气,碰撞能量20~35 eV。
2结果与讨论
2.1负离子模式下,RmlB酶活性的ESI-CID-MS/MS分析
负离子模式下,RmlB酶促反应产物的ESI-CID-MS谱图示于图2。由图2可见,以m/z545.1 [M-H]-为前体离子,可以观察到4个源于磷酸二酯键部分碎裂的MS2产物离子,分别为m/z321.0 [dTMP-H]-,m/z382.9 [dTDP-H2O-H]-,m/z222.9 [M-dTMP-H]-、m/z303.0 [M-dT-H]-,以及源于糖苷键断裂的产物离子m/z400.9 [dTDP-H]-。
在图2中,特征碎片离子m/z401、383和321分别对应核苷分子离子[TDP-H]-以及该离子失去水分子和磷酸基得到的碎片离子,这与已发表的dTDP数据一致[9-10]。同时,实验验证了初始受体底物的TDP基团并没有受到酶活反应的影响;从2个特征碎片离子m/z223 [M-dTMP-H]-和m/z303 [M-dT-H]-的存在,可以推断糖环上发生了脱水反应。
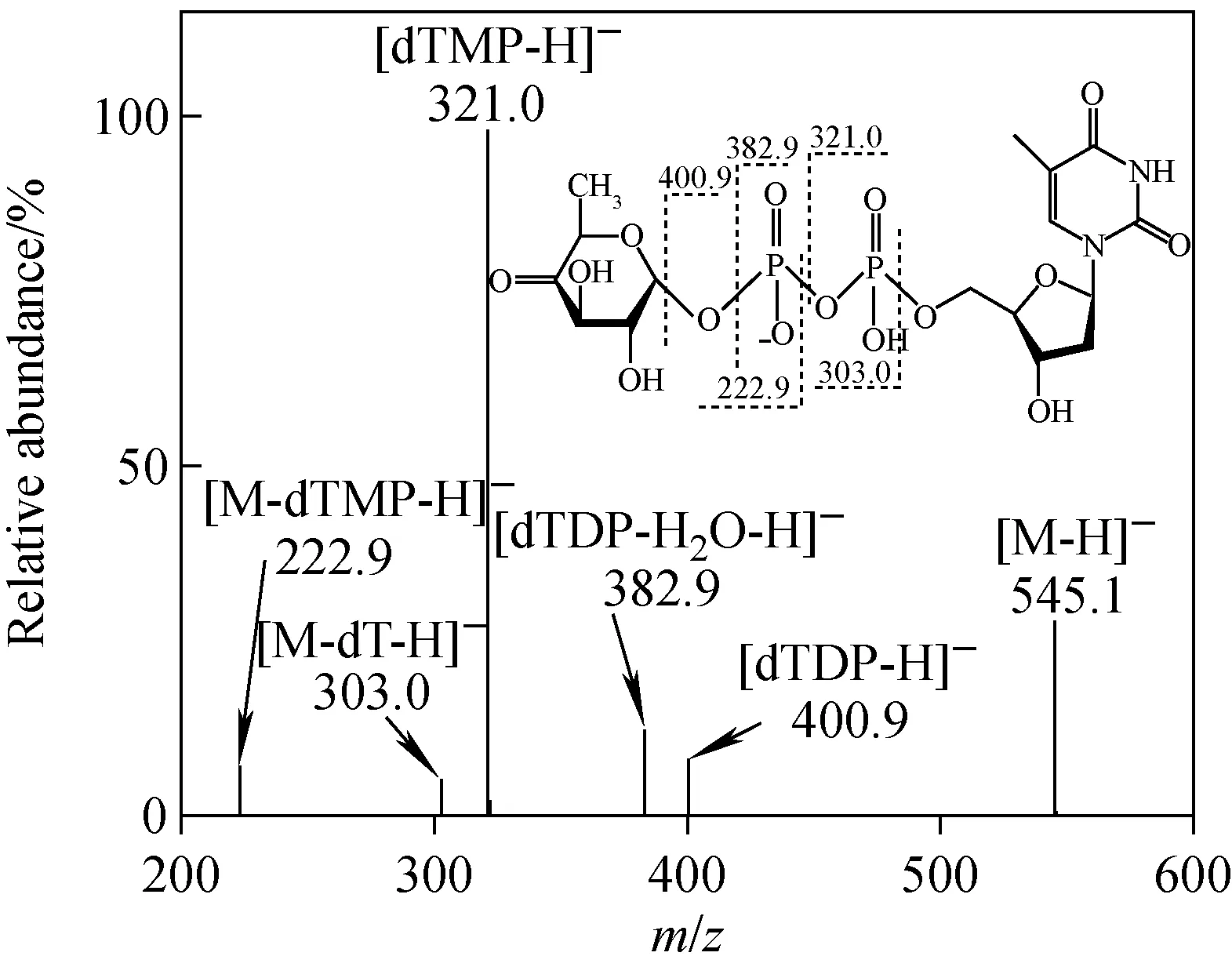
注:MS2m/z 545.1→图2 RmlB催化反应产物的ESI-CID-MS谱图Fig.2 ESI-CID-MS spectrum of RmlB product
2.2负离子模式下,RmlB,RmlC和RmlD三酶偶联反应产物的ESI-CID-MS/MS分析
负离子模式下,三酶酶促偶联反应产物的ESI-CID-MS谱图示于图3。从图3可见,以m/z547.1 [M-H]-为前体离子,可以观察到4个源于磷酸二酯键部分碎裂的MS2产物离子,分别为m/z321.0 [dTMP-H]-,m/z382.9 [dTDP-H2O-H]-,m/z225.1 [M-dTMP-H]-、m/z305.0 [M-dT-H]-,以及源于糖苷键断裂的产物离子m/z400.9 [dTDP-H]-和脱水碎片离子m/z529.1。
在图3中,特征碎片离子m/z401、383和321分别对应核苷分子离子[TDP-H]-以及该离子失去水分子和磷酸基得到的碎片离子,这与已发表的dTDP数据一致[7-8]。同时,实验验证了初始受体底物的TDP基团并没有受到酶活反应的影响;从2个特征碎片离子m/z225 [M-dTMP-H]-和m/z305 [M-dT-H]-的存在,可以推断4-酮-Rha的糖环上发生了氢化还原反应。
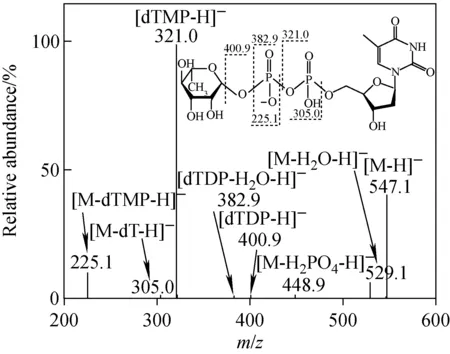
注:MS2m/z 547.1→图3 三酶酶促偶联反应产物的ESI-CID-MS谱图Fig.3 ESI-CID-MS spectrumof three-enzyme tandem reaction product
2.3RmlD酶活产物化学结构的ESI-MSn法表征
负离子模式下,RmlD酶活产物的质谱图示于图4。从图4a可见,以m/z225.1为前体离子,碎片离子m/z78.86 [PO3]-源于磷酸与戊糖之间糖苷键的断裂;碎片离子m/z180.9([0,4X]-,[M-dTMP-C2H4O-H]-)、m/z151.0([0,3X]-,[M-dTMP-C3H6O2-H]-)和m/z120.9([0,2X]-,[M-dTMP-C4H8O3-H]-)源于4-酮-Rha开环。其裂解途径与Wolucka等[10-11]对葡萄糖、半乳糖及甘露糖等-1-磷酸衍生物质谱碎裂规律的研究结果一致。
从图4b可见,以m/z321.0为前体离子,碎片离子m/z195.0 [dTMP-dT-H]-和m/z125.1 [dT-H]-源于脱氧胸腺嘧啶与戊糖之间糖苷键的断裂;碎片离子m/z96.8[H2PO4]-源于磷酸与戊糖之间糖苷键的断裂;碎片离子m/z176.9源于m/z195.0脱掉一分子水。
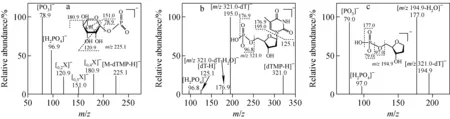
注:a.MS3m/z 547.1→ 225.1 →;b.MS3m/z 547.1→ 321.0 →;c.MS4m/z 547.1→321.0→194.9→图4 dTDP-L-Rha的ESI-CID-MSn谱图Fig.4 ESI-CID-MSnspectrum of dTDP-L-Rha
从图4c可见,以m/z194.9为前体离子,碎片离子m/z177.0源于m/z194.9脱掉一分子水;碎片离子m/z97.0源于磷酸与戊糖之间糖苷键的断裂;碎片离子m/z79.0源于m/z97.0脱掉一分子水。
在RmlD酶活产物的三级质谱图中(图3a),碎片离子m/z151.0 [0,3X]-源于RmlD酶活产物鼠李糖糖环上C0-C3键的跨环断裂,排除了氢化还原反应发生在4-酮-Rha糖环2-位和3-位的可能;碎片离子m/z180.9 [0,4X]-源于RmlD酶活产物4-酮-Rha糖环上C0-C4键的跨环断裂,排除了氢化还原反应发生在4-酮-Rha糖环6-位的可能,因此可确认RmlB具有dTDP-Glc糖环上C-6脱水活性。综上,可以推断4-酮-Rha糖环4-位发生了氢化还原反应。
通过质量数分析,发现RmlB和RmlD产物ESI-CID-MS的碎片离子主要源于糖苷键和磷酸二酯键的断裂,提供的核苷糖骨架信息可证实糖环上发生了脱水和氢化还原反应。负离子模式下,从RmlD酶活产物三级谱图可观察到的,以及可提供重要区域选择性信息的跨环断裂碎片离子表明:dTDP-Glc糖环的6-位和4-位分别发生了脱水和氢化还原反应。
3结论
负离子模式下,RmlB、RmlC和RmlD酶促反应混合物的MS2、MS3和MS4谱图表明:dTDP-L-Rha的生物合成路径涉及C-6脱水(RmlB)和C-4氢化还原反应(RmlC、RmlD),该结果与文献[6]的分析结果一致。本研究建立了简单、灵敏、快速的罕见单糖生物合成路径表征方法,对O-抗原生物合成路径中细菌罕见单糖合成酶功能的高通量准确鉴定具有普遍适用性,也将对细菌O抗原合成机理的探索,以及利用实验探索O抗原在细菌生存和致病性中所扮演的角色奠定基础。
参考文献:
[1]KREN V, MARTINKOVA L. Glycosides in medicine: “The role of glycosidic residue in biological activity”[J]. Current Medicinal Chemmistry, 2001, 8(11): 1 303-1 328.
[2]BENGOECHEA J A, NAIDENSKI H, SKURNIK M. Lipopolysaccharide O antigen status of Yersinia enterocolitica O:8 is essential for virulence and absence of O antigen affects the expression of other Yersinia virulence factors[J]. Molecular Microbiology, 2004, 52(2): 451-469.
[3]GIRAUD M F, NAISMITH J H. The rhamnose pathway[J]. Current Opinion in Structural Biology, 2000, 10(6): 687-696.
[4]KANG Y B, YANG Y H, LEE K W, et al. Preparativesynthesis of dTDP-L-rhamnosethroughcombined enzymaticpathways[J].Biotechnology and Bioengineering, 2006, 93(1): 21-27.
[5]PARAJULI N, LEE DS, LEE H C, et al. Cloning, expression and characterization of glucose-1-phosphate thymidylyltransferase (strmlA) from Thermus caldophilu[J]. Biotechnology Letters, 2004, 26(5): 437-442.
[6]GRANINGER M, NIDETZKYV B, HEINRICHS D E, et al. Characterization of dTDP-4-dehydrorhamnose 3,5-epimerase and dTDP-4-dehydrorhamnose reductase, required for dTDP-L-rhamnose biosynthesis in Salmonella enterica serovar typhimurium LT2[J]. Journal of Biological Chemistry, 1999, 274(35): 25 069-25 077.
[7]周大炜,胡波,刘斌,等. 大肠杆菌O152中wfgD基因编码的β-1,3-葡萄糖基转移酶产物结构的质谱表征[J]. 分析化学,2010,38(2):225-228.
ZHOU D W, HU B, LIU B, et al. Structure elucidation of product of beta-1,3-glucosyltransferase Encoded by wfgD gene in escherichia coli O152 using mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2010, 38(2): 225-228(in Chinese).
[8]ZAIA J. Mass spectrometry of oligosaccharides[J]. Mass Spectrometry Reviews, 2004, 23(3): 161-227.
[9]SOO E C, AUBRY A J, LOGAN S M, et al. Selective detection and identification of sugar nucleotides by CE-electrospray-MS and its application to bacterial metabolomics[J]. Analytical Chemistry, 2004, 76(3): 619-626.
[10]WOLUCKA B A, RUSH J S, WAECHTER C J, et al. An electrospray-ionization tandem mass spectrometry method for determination of the anomeric configuration of glycosyl 1-phosphate derivatives[J]. Analytical Biochemistry, 1998, 255(2): 244-251.
[11]DOMON B, COSTELLO C D. A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugats[J]. Glycoconjugate Journal, 1988, 5(4): 397-409.
Characterization of Biosynthetic Pathway of the dTDP-L-Rha
by Electrospray Ionization Tandem Mass Spectrometry
XU Ying-ying1, DONG Chen-ying1, ZHOU Da-wei1,2,3
(1.TEDAInstituteofBiologicalSciencesandBiotechnology,NankaiUniversity,Tianjin300457,China;
2.EngineeringandResearchCenterforMicrobialFunctionalGenomicsandDetectionTechnology,
Tianjin300457,China;3.KeyLaboratoryofMolecularMicrobiologyandTechnology,
NankaiUniversity,Tianjin300457,China)
Abstract:Considering the importance of carbohydrate moieties on infectivity and host mimicry, there is a need to better understand the biosynthetic pathways of these unusual sugars in order to identify key targets involved in bacterial pathogenesis. Since theinvitrobiochemical characterization of the biosynthetic pathway of unusual sugars is currently hindered by the demand for more accurate, sensitive, and rapid analytical methods for characterizing unusual sugar structures, information about the structure and biosynthesis pathway of these compounds is fragmentary. Mass spectrometry is a rapid, sensitive, and accurate approach for the direct monitoring of enzyme-catalyzed reactions that does not require a chromophore or radiolabeling and thus provides aviable alternative to existing analytical techniques. The objective of this study is to demonstrate the use of electrospray ionization-tandem mass spectrometry (ESI-MS/MS) as a powerful technique for the characterization of enzymatic products in the biosynthetic pathway of deoxythymidine 5’-diphosphate-D-rhamnose (dTDP-L-Rha) inE.coliO7. The dTDP-d-glucose 4,6-dehydratase (RmlB), dTDP-4-keto-6-deoxy-glucose-3,5 epimerase (RmlC), and dTDP-4-keto-rhamnose reductase (RmlD) catalyzed reactions were directly monitored by ESI-MS, followed by detailed structural characterization of the final enzymatic products using ESI-MS/MS in the negative-ion mode after minimal cleanup. The biosynthetic pathway of dTDP-L-Rha, beginning from dTDP-L-Rha in three reaction steps catalyzed by RmlB, RmlC, and RmlD, was characterized by ESI-MS/MS. The results obtained were in good agreement with that of traditional high-performance liquid chromatography (HPLC) monitoring and preparation, as well as NMR and ESI-MS structural characterization. Collectively, these data demonstrate that a CID-ESI-MSspanbased platform is applicable to the facile characterization of the biosynthetic pathway of important unusual dTNP-sugar in the O-chain and offers significant advantages over current methods in terms of speed, sensitivity, reproducibility, automation and reagent costs.
Key words:unusual sugar; dTDP-L-Rha; biosynthetic pathway; electrospray ionization-tandem mass spectrometry (ESI-MS/MS)
通信作者:周大炜(1966—),女(汉族),吉林人,副研究员,从事微生物功能基因组学研究。E-mail: daweizhou@nankai.edu.cn
作者简介:许莹莹(1990—),女(汉族),山东人,硕士研究生,微生物专业。E-mail: xuyingying320@qq.com
基金项目:南开大学引进人才科研启动资金(J02006)资助
收稿日期:2015-03-18;修回日期:2015-04-22
中图分类号:O657.63
文献标志码:A
文章编号:1004-2997(2016)01-0017-06

