基于UPLC-Q-TOF MS分析加工炮制对玄参化学成分的影响
王静哲,刘 震,马立满,李 军,尚明英,刘广学,徐 风,蔡少青
(北京大学药学院,北京 100191)
基于UPLC-Q-TOF MS分析加工炮制对玄参化学成分的影响
王静哲,刘震,马立满,李军,尚明英,刘广学,徐风,蔡少青
(北京大学药学院,北京100191)
摘要:为了全面阐明玄参加工工艺对其化学成分的影响,采用UPLC-Q-TOF MS技术对烘干玄参和传统加工玄参的化学成分进行分析比较,并运用主成分分析法(PCA)和正交偏最小二乘辨别分析法(OPLS-DA)进行数据统计,寻找差异性成分,同时依据一级质谱精确质荷比和二级质谱碎片信息进行成分解析。结果表明:与烘干玄参相比,传统加工玄参中共有26种成分的含量变化显著,实验鉴定出了其中的15种成分,包括9种环烯醚萜类化合物和6种苯丙素类化合物;含量降低的成分有桃叶珊瑚苷、6-O-甲基梓醇、哈巴俄苷、8-O-香豆酰基哈巴俄苷、8-O-阿魏酰基哈巴俄苷、阿格托苷、异阿格托苷、安格洛苷 C和scrophuloside B1,其中scrophuloside B1为玄参中首次发现的成分;含量增加的成分有哈巴苷、哈巴俄苷同分异构体、6″-O-α-D-半乳糖哈巴俄苷、6-O-α-D-半乳糖哈巴俄苷、斩龙剑苷A和肉桂酸。本工作对研究玄参加工炮制机制有重要意义,同时可为阐明玄参药效的物质基础提供依据。
关键词:玄参;加工炮制;UPLC-Q-TOF MS;主成分分析法(PCA);正交偏最小二乘辨别分析法(OPLS-DA)
doi:10.7538/zpxb.youxian.2015.0042
网络出版时间:2015-09-09;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20150909.1515.008.html
玄参为常用中药,是玄参科植物浙玄参(ScrophularianingpoensisHemsl)的干燥根,主产地为浙江省[1],是“浙八味”之一,具有滋阴凉血、泻火解毒的传统功效[2]。玄参的水浸液、醇提液和煎剂均有降血压作用[3],据文献报道,玄参主要含有环烯醚萜苷、苯丙素苷、苯乙醇苷类及多糖等化学成分[4-5]。其中,环烯醚萜类成分哈巴俄苷能使阴虚小鼠抑制的免疫功能恢复[6],苯丙素类成分有明显的抗炎作用[7],多糖类成分具有抗疲劳的作用[8]。
传统加工炮制玄参的方法为“发汗”法,即将新鲜玄参晒或烘至半干,堆放3~6天,反复数次至干燥[2]。方学敏等[9]运用紫外检测法研究玄参炮制前后多糖含量的变化,发现炮制后玄参中的多糖成分含量下降。本课题组[10-11]曾运用HPLC-DAD法研究玄参不同加工品中哈巴俄苷和肉桂酸的含量,发现玄参鲜材切片烘干品中哈巴俄苷含量高于传统加工品,肉桂酸含量低于传统加工品;运用HPLC-UV波长转换法测定了玄参药材及饮片中哈巴苷与哈巴俄苷的含量,发现玄参经炮制后可使哈巴俄苷含量下降,而使哈巴苷含量升高。迄今对玄参加工炮制的研究报道主要集中在哈巴俄苷、哈巴苷和肉桂酸等少数化学成分在炮制前后含量上的变化,这仅是对几个特定的化合物进行研究,而对于化学成分复杂的中药而言,所得到的信息不够全面,不能很好地阐明传统加工对玄参化学成分的影响。因此,本工作拟采用UPLC-Q-TOF MS技术,结合主成分分析法(principal component analysis,PCA)和正交偏最小二乘判别分析法(orthogonal partiallest squared discriminant analysis,OPLS-DA),对烘干玄参和传统加工玄参的化学成分进行系统的研究,试图阐明玄参经“发汗”法炮制后化学成分的变化情况。
1实验部分
1.1仪器与试剂
Xevo G2 UPLC-Q-TOF MS色谱-质谱联用仪:美国Waters公司产品,配有Masslynx4.1质谱工作站;DHG-9000系列烘干机:上海市一恒科学仪器有限公司产品;KQ500DE型超声仪:昆山市超声仪器有限公司产品;冷冻干燥机:金西盟(北京)仪器有限公司产品;Milli-Q超纯水制备仪:美国Millipore公司产品。
甲醇(A452-4):色谱纯,美国Fisher公司产品;甲酸(zk3004):色谱纯,美国ROE公司产品;乙腈(134491):质谱纯,美国Fisher公司产品;实验用水为Milli-Q超纯水;新鲜玄参药材:于2013年12月23日购于浙江省磐安县玄参种植基地,经尚明英副教授鉴定为玄参科植物浙玄参ScrophularianingpoensisHemsl的根。
1.2样品的制备
传统加工玄参:将采购的新鲜玄参的一部分委托当地药农用传统“发汗法”干燥得传统加工玄参。烘干玄参:将新鲜玄参的另一部分运到本实验室切片(厚度约2 mm)后,于50 ℃烘干(约22.5 h)得烘干玄参。
1.3供试品溶液的制备
分别精密称取1.0 g传统加工玄参和烘干玄参粉末(过40目筛),置于具塞锥形瓶中,加入20 mL 50%甲醇,密闭,于25 ℃超声提取30 min,然后过0.22 μm微孔滤膜,即得供试品溶液。
1.4实验条件
1.4.1色谱条件色谱柱:Acquity BEH C18柱(100 mm×2.1 mm×1.7 μm);柱温40 ℃;流动相:A为0.1%甲酸-水溶液,B为乙腈;梯度洗脱;洗脱程序为:0~1.6 min、3%~20%B,1.6~2.96 min、20%~30%B,2.96~3.8 min、30%~47%B,3.8~4.5 min、47%~50%B,4.5~4.9 min、50%~60%B,4.9~5.2 min、60%~70%B,5.2~5.7 min、70%~90%B,5.7~6.0 min、90%~100%B,6.0~8.9 min、100%B;流速0.4 mL/min;进样量0.5 μL。
1.4.2质谱条件采用ESI离子源,负离子模式下采集数据;数据采集范围m/z100~1 200;毛细管电压2 000 V;锥孔电压40 V;离子源温度110 ℃;脱溶剂气温度500 ℃;雾化气(N2)流速50 L/h;脱溶剂气(N2)流速800 L/h;碰撞能量(CE)15~40 V;质量校正质荷比m/z554.261 5。
1.5方法学考察
1.5.1稳定性实验精密吸取同一供试品溶液,分别于0、1、3、5、7、9 h进样检测,各主要色谱峰的相对保留时间RSD值均小于0.16%,相对峰面积RSD值均小于3.25%。实验结果表明,供试品溶液在9 h内稳定。
1.5.2精密度实验精密吸取同一供试品溶液,连续进样6 次,各主要色谱峰的相对保留时间RSD 值均小于0.21%,相对峰面积RSD值均小于3.20%,这表明仪器精密度良好。
1.5.3重复性实验精密称取1 g同一份样品,按1.3节方法制备供试品溶液6份,各主要色谱峰的相对保留时间RSD值均小于0.16%,相对峰面积RSD值均小于2.98%,表明该方法重复性良好。
1.6样品测定及数据分析
分别取烘干玄参及传统加工玄参粉末制备的供试品溶液各6份,用UPLC-Q-TOF MS仪器分析(所有供试品均在2014年9月完成制备和检测)。所得到的质谱数据经Masslynx 4.1软件处理后,将数据导入SIMCA-P 13.0.3 demo版统计软件,进行主成分分析和正交偏最小二乘辨别分析。
2结果与讨论
2.1传统加工玄参与烘干玄参的性状差异
传统加工玄参为个子药材,直径1~3 cm,长度6~20 cm,表面呈深棕色,质坚实,断面色漆黑,木质部韧皮部纹理均不可见。烘干玄参为饮片,厚2 mm左右,宽1~3 cm,表面棕色,质脆,断面乳白色,木质部韧皮部纹理可见。
2.2烘干玄参和传统加工玄参样品中化学成分的UPLC-Q-TOF MS检测结果
本研究对烘干玄参和传统加工玄参样品进行了液相色谱-质谱分析,它们在负离子模式下的基峰强度离子流图(BPI)示于图1。由图1可知,烘干玄参和传统加工玄参的主要色谱峰峰形和保留时间基本一致,但部分色谱峰的相对峰面积值变化较大。

图1 负离子模式下,烘干玄参(a)和传统加工玄参(b)的BPI图Fig.1 BPI of dried (a) and processed (b) Scrophulariae Radix by UPLC-Q-TOF MS in negative ions mode
2.3UPLC-Q-TOF MS数据的PCA分析
在负离子模式下,烘干玄参和传统加工玄参样品的UPLC-Q-TOF MS数据PCA分析的得分图示于图2。每个点代表一个样品,横、纵坐标分别为第一、第二主成分得分。可以看出,烘干玄参和传统加工玄参样品在第一主成分得分上有明显差异,即分别聚向横轴的相反方向,表明二者UPLC/Q-TOF-MS数据的差异特征明显。

图2 负离子模式下,烘干玄参和传统加工玄参样品的PCA得分图Fig.2 Score plots of PCA for dried and processedScrophulariae Radix in negative ions mode

图3 负离子模式下,烘干玄参和传统加工玄参样品的OPLS-DA差异成分的S-plot曲线Fig.3 S-plots curve of OPLS-DA for dried andprocessed Scrophulariae Radix in negative ions mode
2.4UPLC-Q-TOF MS数据的OPLS-DA分析
在负离子模式下,烘干玄参和传统加工玄参样品的UPLC-Q-TOF MS数据OPLS-DA分析的S-plot图示于图3。图中每个点代表一个变量,即位于某个保留时间的某个质荷比的信号。横坐标代表变量的贡献度(协方差),纵坐标代表变量的相关性(可信度),在-1~1之间取值。烘干玄参与传统加工玄参之间差异显著的分子离子峰分布在S曲线的两端,S曲线的右上角代表了烘干玄参与传统加工玄参相比含量较高的化合物的分子离子峰,S曲线的左下角代表了传统加工玄参与烘干玄参相比含量较高的化合物的分子离子峰,越靠近S曲线两端的点,所代表的分子离子峰对两组样品间的差异贡献越大。
通过对照两组玄参UPLC/Q-TOF的BPI谱图,并结合OPLS-DA模型的VIP 参数,可寻找烘干玄参和传统加工玄参间的差异性化学成分。通过比较传统加工玄参与烘干玄参,本实验共发现26种化学成分的含量具有显著性差异。将26种化学成分在烘干玄参中的峰面积与传统加工玄参中各自峰面积的比值作为量化指标,能够反映出26种差异性化学成分在两种玄参间的量变趋势及幅度,详情列于表1。
2.5烘干玄参与传统加工玄参差异性成分的鉴定
依据化合物质谱裂解规律并参考文献数据对炮制前后发生量变的成分进行结构解析,共鉴定出15种化合物的结构,其中包括9种环烯醚萜类化合物和6种苯丙素及其苷类成分。但仍有11种化合物(峰2、5、6、14、17~19、22、25、26)的结构未见文献报道,本实验尚不能对其进行鉴别,其结构的确认还有待于进一步研究。
26种含量差异的化学成分中,传统加工玄参中含量高于烘干玄参的成分有7种,鉴定出了其中的6种,包括4种环烯醚萜类,分别为哈巴苷(1.24倍)、哈巴俄苷同分异构体(1.35倍)、6″-O-α-D-半乳糖哈巴俄苷(2.58倍)和6-O-α-D-半乳糖哈巴俄苷(1.88倍);2种苯丙素类,分别为肉桂酸(4.06倍)和斩龙剑苷 A(3.98倍)。传统加工玄参中含量低于烘干玄参的成分有19种,鉴定出了其中的9种,包括5种环烯醚萜类,分别为桃叶珊瑚苷(0.27倍)、6-O-甲基梓醇(0.21倍)、哈巴俄苷(0.53倍)、8-O-香豆酰基哈巴俄苷(0.78倍)和8-O-阿魏酰基哈巴俄苷(0.50倍);4种苯丙素苷类,分别为阿格托苷(0.16倍)、异阿格托苷(0.19倍)、安格洛苷 C(0.93倍)和scrophuloside B1(0.28倍)。
表1传统加工玄参中26种化学成分相对烘干玄参的变化情况(n=6)及差异性化学成分的鉴定
Table 1Changes of 26 chemical constituents in processedScrophulariaeRadixcomparing
with dried samples (n=6) and identification of the difference chemical constituents

峰号tR/min选择离子分子式误差/10-6碎片离子峰面积比含量对比化合物鉴定11.293391.1239[M+HCOO]-C15H22O9-0.3345.1190,83.0658,165.0554,139.04000.27低**桃叶珊瑚苷[12]21.400509.1510[M-H]-C18H30O150.8383.1206,323.0947,253.0836,195.0509,0.09低**—183.0664,179.0567,161.045731.507409.1342[M+HCOO]-C15H24O10-1.0363.1295,201.0753,183.0648,164.0704,139.03861.24高**哈巴苷[12]41.741421.1332[M+HCOO]-C16H24O10-3.3375.1288,213.0757,195.0652,183.0657,151.03940.21低**6-O-甲基梓醇[12]51.876405.1382[M-H]-C17H26O11-3.7183.0640,179.0566,165.05580.23低**—62.459841.2621[M+HCOO]-C33H48O220.8795.2554,647.2062,341.1105,249.1328,179.05543.91高**—72.772623.1971[M-H]-C29H36O15-0.8461.1637,315.1052,179.0332,161.02290.16低**阿格托苷[12]82.815769.2552[M-H]-C35H46O19-0.4593.2094,193.0518,175.0394,163.0386,0.28低**scrophulosideB1[13]145.0300,135.044792.950623.1976[M-H]-C29H36O150461.1641,315.0991,179.0316,161.02330.19低**异阿格托苷[14]103.000517.1553[M+HCOO]-C21H28O12-0.8471.1487,323.0976,161.0283,147.04393.98高**斩龙剑苷A[12,15]113.213783.2706[M-H]-C36H48O19-0.8607.2245,461.1671,193.0496,175.0390,0.93低*安格洛苷C[12]167.0705,149.0443123.291637.2135[M-H]-C30H38O150.5193.0478,175.0401,161.0238,146.95980.29低**—133.313509.1643[M-H]-C24H30O12-3.1329.1005,285.0816,183.0638,163.0385,0.78低**8-O-香豆酰基哈巴俄苷[12,16]161.0231,146.9598

续表1
注:“—”表示未鉴定;“*”表示p<0.05;“**”表示p<0.01
scrophuloside B1(化合物8)为玄参中首次发现,在玄参的同属植物Scrophularianodosa中发现过该化合物。高分辨质谱给出的化合物8的准分子离子峰为m/z769.254 7[M-H]-,推测其分子式为C35H46O19;高分辨质谱给出的化合物11的准分子离子峰为m/z783.271 3[M-H]-,推测其分子式为C36H48O19,二者相差14 u(CH2)。根据二级质谱中碎片离子及文献数据推测化合物11为angoroside C[11]。化合物8的二级质谱中出现了与化合物11相同的阿魏酸离子碎片m/z193.047 9[ferulic acid-H]-,还出现了鼠李糖离子碎片m/z163.038 6[rhamnose-H]-;化合物11出现中性丢失176 u的碎片离子m/z607.224 5[M-H-feruloyl]-,及进一步丢失鼠李糖基(146 u)的碎片离子m/z461.167 1,因此判断化合物8和11有着相似的结构片段。在化合物8中可见3,4-二羟基苯乙醇的碎片离子m/z135.044 7[C8H10O3-H-H2O]-,化合物11中却可见3-羟基-4-甲氧基苯乙醇的碎片离子m/z167.070 5[C9H12O3-H]-和m/z149.044 3[C9H12O3-H-H2O]-,3,4-二羟基苯乙醇和3-羟基-4-甲氧基苯乙醇在结构上相差CH2,与二者分子质量相差14 u相符,因此推测化合物8为化合物11的同系物scrophuloside B1[13],二者的结构式示于图4。

图4 Scrophuloside B1和angoroside C的结构式Fig.4 Structural formula of scrophuloside B1and angoroside C
传统加工玄参中化学成分的含量(峰面积值)有些高于烘干玄参中的含量,有些则低于烘干玄参中的含量,推测是某些成分在炮制过程中发生了化学反应,转化成了其他的成分。例如,在实验过程中发现,传统加工玄参中哈巴俄苷含量低于烘干玄参中的含量,而哈巴苷和肉桂酸含量高于烘干玄参中的含量,据此推测哈巴俄苷在炮制过程中水解生成哈巴苷和肉桂酸,反应途径示于图5,这与本课题组前期的研究结果相一致[11]。
传统加工玄参中8-O-香豆酰基哈巴苷与8-O-阿魏酰基哈巴苷含量也低于烘干玄参中含量,二者与哈巴俄苷结构类似,因此推测二者在炮制过程中发生了与哈巴俄苷类似的反应,分别水解脱掉香豆酸与阿魏酸生成哈巴苷,这一反应可使哈巴苷含量升高。
传统加工炮制玄参中6″-O-α-D-半乳糖哈巴俄苷和6-O-α-D-半乳糖哈巴俄苷含量高于烘干玄参中的含量,它们的结构均为在哈巴俄苷上结合了一分子半乳糖,因此推测玄参在加工炮制过程中哈巴俄苷可能与半乳糖发生结合反应。同时发现哈巴俄苷的同分异构体含量也增加,推测加工炮制可能使部分哈巴俄苷转化为同分异构体,以上这两种反应均可导致哈巴俄苷含量下降。
传统加工玄参中斩龙剑苷A含量高于烘干玄参中含量,斩龙剑苷 A的结构为肉桂酸结合一分子蔗糖,因此推测玄参在加工炮制过程中肉桂酸与蔗糖发生了结合反应。
传统加工玄参中环烯醚萜苷桃叶珊瑚苷和6-O-甲基梓醇与苯丙素苷阿格托苷、异阿格托苷、scrophuloside B1和安格洛苷 C含量低于烘干玄参中含量,推测这些化合物在加工炮制过程中可能发生了苷键水解反应。
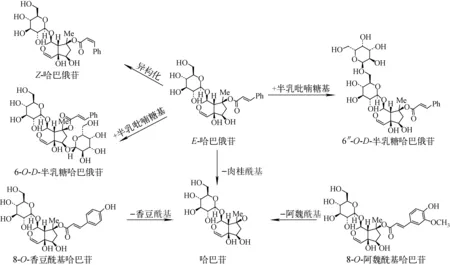
图5 玄参炮制过程中哈巴俄苷和哈巴苷的变化Fig.5 Changes of harpagoside and harpagide during the processing of Scrophulariae Radix
3结论
本实验采用UPLC-Q-TOF MS技术对烘干玄参及传统加工玄参中的化学成分进行快速分析,并用SIMCA-P 13.0.3软件进行主成分分析和正交偏最小二乘判别分析,发现玄参炮制前后有26种化学成分含量具有显著差异。其中,传统加工玄参中含量高于烘干玄参的成分有7种,低于烘干玄参的成分有19种,且这些化合物含量变化幅度不等,这些炮制后发生量变的成分可能与玄参的传统功效密切相关。依据质谱裂解规律并参考文献数据,对炮制前后发生量变的化合物进行结构解析,共鉴定了15个化合物的结构,除哈巴苷、肉桂酸、哈巴俄苷、阿格托苷和安格洛苷C外[10-11,22],其余10个化合物为首次发现的差异性成分,化合物scrophuloside B1为玄参中首次报道的化学成分。
本实验应用UPLC-Q-TOF MS技术和多元统计学方法研究加工炮制对玄参化学成分的影响,该方法能够直观准确地反映玄参炮制前后化学成分的变化情况,对进一步研究玄参加工炮制机制具有重要意义,同时也为玄参药效物质基础的阐明提供了重要依据。
参考文献:
[1]肖培根. 新编中药志[M]. 北京:化学工业出版社,2002:366.
[2]国家药典委员会. 中国药典[M]. 2010版. 北京:中国医药科技出版社,2010:108-109.
[3]姜守刚,蒋建勤,祖元刚. 玄参的化学成分研究[J]. 植物研究,2008,28(2):254-256.
JIANG Shougang, JIANG Jianqin, ZU Yuan-gang. Chemical components from the root ofScrophularianingpoensis[J]. Bulletin of Botanical Research, 2008, 28(2): 254-256(in Chinese).
[4]李医明,蒋山好,高文远,等. 玄参中的苯丙素苷类成分[J]. 中草药,1999,30(7):487-489.
LI Yiming, JIANG Shanhao, GAO Wenyuan, et al. Phenylpropanoid glycosides of ningpo figwort (Scrophularianingponesis)[J]. Chinese Traditional and Herbal Drugs, 1999, 30(7): 487-489(in Chinese).
[5]胡瑛瑛,黄真. 玄参的化学成分及药理作用研究进展[J]. 浙江中医药大学学报,2008,32(2):268-270.
HU Yingying, HUANG Zhen. Advances in research of chemical constituents and pharmacological effects ofScrophulariaNingpoensisHemsl[J]. Journal of Zhejiang College of Traditional Chinese Medicine, 2008, 32(2): 268-270(in Chinese).
[6]王建华,谢丽华,钱瑞琴,等. 玄参中哈巴苷和哈巴俄苷滋阴作用的药理研究[C]. 全国中药研究与开发学术研讨会论文集,2001:47.
[7]李医明,曾华武,贺祥,等. 玄参中环烯醚萜甙和苯丙素甙对LTB4产生及血小板聚集的影响[J]. 第二军医大学学报,1999,20(5):301-303.
LI Yiming, ZENG Huawu, HE Xiang, et al. Iridoid and phenylpropanoid glycosides ofScrophularianingpoensisinhibit the formation of LTB4 and platelet aggregation[J]. Academic Journal Second Millitary Medical University, 1999, 20(5): 301-303(in Chinese).
[8]王珲,陈平,张丽萍,等. 玄参多糖成分抗疲劳活性的研究[J]. 武汉植物学研究,2009,27(1):118-120.
WANG Hui, CHEN Ping, ZHANG Liping, et al. Study on the antifatigue function of polysaccharides fromScrophularianingpoensisHemsl[J]. Journal of Wuhan Botanical Research, 2009, 27(1): 118-120(in Chinese).
[9]方学敏,曹岗,蔡银燕. 玄参炮制前后多糖含量的变化研究[J]. 中华中医药学刊,2012,30(5):986-987.
FANG Xuemin, CAO Gang, CAI Yinyan.Studies on the change of the content of polysaccharides in crude and processedScrophulariaeRadix[J]. Chinese Archivesof Traditional Chinese Medicine, 2012, 30(5): 986-987(in Chinese).
[10]王建华,谢丽华,刘洪宇,等. 玄参不同加工品中哈巴俄苷与肉桂酸的HPLC含量测定[J]. 中国药学杂志,2000,35(6):375-378.
WANG Jianhua, XIE Lihua, LIU Hongyu, et al. HPLC determination of harpagoside and cinnamic acid in Xuanshen after processed in different methods[J]. Chinese Pharmaceutical Journal, 2000, 35(6): 375-378(in Chinese).
[11]白云娥,袁鹏飞,王庆辉. HPLC-UV波长转换法测定玄参药材及饮片中哈巴苷与哈巴俄苷的含量[J]. 中国中药杂志,2011,36(19):2 697-2 702.
BAI Yun’e, YUAN Pengfei, WANG Qinghui, et al. Determination of harpagide and harpagosideinScrophulariaeRadixby HPLC-UV[J]. China Journal of Chinese Materia Medica, 2011, 36(19): 2 697-2 702(in Chinese).
[12]WU Q, YUAN Q, LIU E H, et al. Fragmentation study of iridoid glycosides and phenylpropanoid glycosides inRadixScrophulariaeby rapid resolution liquid chromatography with diode-array detection and electrospray ionization time-of-flight mass spectrometry[J]. Biomedical Chromatography, 2010, 24(8): 808-819.
[13]TOSHIO M, AI M.Acylatediridoid and phenylethanoidglycosides from the aerial parts ofScrophularianodosa[J]. Journal of Natural Products, 1999, 62(8): 1 079-1 084.
[14]HAN L F, MAVIS B Y, LIU E W, et al. Structural characterisation and identification of phenylethanoidglycosides fromCistanchesdeserticolaY.C. Ma by UHPLC/ESI-QTOF-MS/MS[J]. Phytochemical Analysis, 2012, 23(6): 668-676.
[15]LI Y M, JIANG S H, GAO W Y, et al. Phenylpropanoid glycosides fromScrophularianingpoensis[J]. Phytochemistry, 2000, 54(8): 923-925.
[16]NIU Z R, WANG R F, SHANG M Y, et al. A new iridoid glycoside fromScrophularianingpoensis[J]. Natural Product Research, 2009, 23(13): 1 181-1 188.
[17]CHEN B, WANG N L, HUANG J H, et al. Iridoid and phenylpropanoid glycosides fromSchrophularianingpoensisHemsl[J]. Asian Journal of Traditional Medicines, 2007, 2(3): 118-123.
[18]CHEN B, LIU Y, LIU H W, et al.Iridoid and aromatic glycosides fromScrophularianingpoensisHemsl and their inhibition of [Ca2+] increase induced by KCl[J]. Chemistry & Biodiversity, 2008, 5(9): 1 723-1 735.
[19]SO R K, LEE K Y, KOO KA, et al. Four new neuroprotectiveiridoid glycosides fromScrophulariabuergerianaroots[J]. Journal of Natural Products, 2002, 65(11): 1 692-1 699.
[20]LI Y M, JIANG S H, GAO W Y, et al. Iridoid glycosides fromScrophularianingpoensis[J].Phytochemistry, 1998, 50(1): 101-104.
[21]CHEN L, WANG D, WU J, et al. Identification of multiple constituents in the traditional Chinese medicine formula GuiZhiFuLing-Wan by HPLC DAD MS/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(2): 267-275.
[22]CAO G, CONG X D,CAI H, et al. Simultaneous quantitation of eight active components in crude and processedRadixScrophulariaeextracts by high performanceliquid chromatography with diode array detector[J]. Chinese Journal of Natural Medicines, 2012, 10(3): 213-217.
Changes of Chemical Constituents inScrophulariaeRadix
During Processing Based on UPLC-Q-TOF MS
WANG Jing-zhe, LIU Zhen, MA Li-man, LI Jun, SHANG Ming-ying,
LIU Guang-xue, XU Feng, CAI Shao-qing
(SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
Abstract:In order to clarify the influence of the traditional processing on the chemical constitution ofScrophulariaeRadix, the UPLC-Q-TOF MS method was used to analyze the dried and processedScrophulariaeRadix. Data were processed by principal component analysis (PCA) and orthogonal partial least squared discriminant analysis (OPLS-DA) to find the difference between dried and processedScrophulariaeRadix. The accuratem/zvalues of Q-TOF MS and Q-TOF MS/MS fragments were applied to constitution identification. The results show that a total of 26 constituents have significant differences between dried and processedScrophulariaeRadix. Fifteen constituents are identified, including 9 iridoid glycosidesand 6 phenylpropanoid glycosides. Compared with the driedScrophulariaeRadix, the contents of aucubin, 6-O-methylcatapol, harpagoside, 8-O-cumaroylharpagide, 8-O-feruloylharpagide, acteoside, isoacteoside, angoroside C and scrophuloside B1in processedScrophulariaeRadixwereare decreasing. The contents of harpagide, harp agoside isomer, 6″-O-α-D-galactopyranosylharp agoside, 6-O-α-D-galactopyranosylharp agoside, sibirioside A and cinnamic acid are increasing. InScrophulariaeRadix, scrophuloside B1is detected for the first time. The UPLC/Q-TOF-MS method proves to have a high sensitivity and the result isaccurate and reliable. The method could fully reflect the changes of multiple chemical constituents in the course of processing and lay a good foundation for the further study of processing mechanism of traditional Chinese medicine.
Key words:ScrophulariaeRadix; processing; UPLC-Q-TOF MS; PCA; OPLS-DA
通信作者:尚明英(1963—),女(汉族),山东临沂人,副教授,从事生药质量控制及有效成分研究。E-mail: myshang@bjmu.edu.cn
作者简介:王静哲(1988—),女(汉族),河北石家庄人,硕士研究生,生药学专业。E-mail: wjingzhe2012@163.com
基金项目:国家自然科学基金项目(81274074)资助
收稿日期:2015-01-26;修回日期:2015-04-07
中图分类号:O657.63
文献标志码:A
文章编号:1004-2997(2016)01-0001-09

