人肺腺癌SPC-A1荷瘤裸鼠中RNAi靶向沉默FAK的作用*
叶 璐,母 丹,付 波,王 敏,杨 莉,邓洪新
(1.核工业416医院肿瘤科,成都610051;2.四川大学华西医院生物治疗国家重点实验室/2011计划“生物治疗协同创新中心”,成都610041)
·应用基础研究·
人肺腺癌SPC-A1荷瘤裸鼠中RNAi靶向沉默FAK的作用*
叶 璐1,母 丹1,付 波1,王 敏1,杨 莉1,邓洪新2△
(1.核工业416医院肿瘤科,成都610051;2.四川大学华西医院生物治疗国家重点实验室/2011计划“生物治疗协同创新中心”,成都610041)
目的:通过用脂质体包裹靶向局部粘着斑激酶(focal adhesion kinase,FAK)基因的短发夹RNA(short hairpin RNA,shRNA)质粒(shRNA-FAK),探讨该方法对荷瘤裸鼠中人肺腺癌SPC-A1的抑制效果。方法:用脂质体包裹shRNA-FAK,并通过尾静脉注射治疗荷瘤裸鼠,通过肿瘤生长曲线和重量,肿瘤组织形态学,肿瘤中的FAK蛋白表达情况、CD31、VEGF、PCNA和TUNEL检测,分析该方法对荷瘤裸鼠中人肺腺癌SPC-A1的抑制效果。结果:荷瘤裸鼠经过脂质体shRNA-FAK治疗后,肿瘤生长速度明显缓于对照组(P<0.05),肿瘤重量明显低于对照组(P<0.05)。肿瘤组织的免疫组化、western blot和TUNEL检测显示与对照组相比,治疗组FAK蛋白表达降低(P<0.05)、血管生成和细胞增殖均减少(P<0.05)、凋亡细胞增加(P<0.05),荷瘤裸鼠主要脏器形态学正常。结论:FAK特异性的小干扰RNA(small interfering RNA,siRNA)能够在体内阻断FAK蛋白的表达,使组织内FAK蛋白的表达相应地减少,并进一步诱导肿瘤细胞的凋亡,最终导致肿瘤的生长速度减缓。
RNA干扰;局部粘着斑激酶;凋亡;SPC-A1
肺癌目前仍是全球恶性肿瘤发病率和病死率第一的肿瘤[1]。其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)占87.05%[2],约80%NSCLC患者被确诊时为晚期,目前以化疗为主的治疗方案中位生存期不超过1年,多种化疗方案并未提高疗效[3]。肿瘤细胞的侵袭生长必须黏附于细胞外基质,进而影响细胞的黏附、运动与迁移。局部粘着斑激酶(focal adhesion kinase,FAK)介导的信号转导系统是依赖于蛋白酪氨酸激酶(protein tyrosine kinase,PTK)活性的细胞外基质信号转导中最为重要的细胞信号转导途径之一[4]。因此在理论上使FAK低表达或不表达就有可能干扰细胞外基质对侵袭性生长的调控,进而达到抑制肿瘤生长的目的。
1 材料与方法
1.1 材料
shRNA表达载体购自pGenesil(武汉GeneSil生物技术有限公司)。ShRNA-FAK根据已公布的FAK siRNA序列[5]设计目标mRNA序列5′-AACCACCTGGGCCAGTATTAT-3′(图1),ShRNA-HK序列是一个与任何人类和小鼠基因没有同源性的序列(5′-GACTTCATAAGGCG CATGC-3′),用于对照。大肠杆菌(Amersham Pharmacia Biothech)。SPC-A1细胞株[ATCC(American Type Culture Collection)]。裸鼠(BALB/cA-nu):4~6周龄,18只(中国科学院上海实验动物中心)。用于体内动物实验的DOTAP-Chol阳离子脂质体的制备参考文献[6]并略有改动。将阳离子脂质成份DOTAP与中性成分胆固醇(Chol)按1∶1的摩尔比进行混合,并将混合物用HPLC级的氯仿进行溶解,置于旋转蒸发仪上40℃下旋蒸1小时后成膜,真空干燥过夜。利用超声将所形成的膜打碎,然后高压均质,将样品取出后溶解于5%的葡萄糖溶液中,然后在55℃水浴条件下震荡1小时,将混合物转到试管中,并通过220nm聚碳酸酯膜挤压5~6次,最后将混合物溶解在适量的5%的葡萄糖溶液中,得到浓度为5mg/ml的DOTAP-Chol阳离子脂质体混悬液,储藏在4℃备用。质粒小量快速提取试制盒[道普生物科技(北京)有限公司]。无内毒素质粒提取试剂盒EndoFree plasmid Giga Kit(Qiagen)。细胞凋亡检测试剂盒DeadEnd Fluorometric TUNEL System(Promega公司)。蛋白质定量试剂(BIO-RAD)。DAB显色试剂盒(北京中杉金桥生物技术有限公司)。Western blotting化学发光检测试剂盒(PIERCE公司)。蛋白酶抑制剂cocktail(Sigma)。兔抗人FAK单克隆抗体IgG2b(Sigma)。小鼠抗人GAPDH单克隆抗体(Sigma)。辣根过氧化物酶HRP标记的羊抗兔IgG(H+L)(北京中山生物公司)。
1.2 实验主要方法
1.2.1 细胞培养及荷瘤模型的建立 人肺腺癌SPC-A1细胞株使用RPMI-1640培养基培养,收集对数生长期的SPC-A1细胞,用无血清、无抗生素的RPMI-1640培养液洗涤、计数。无菌条件下将2×106个细胞皮下接种于小鼠肋腹侧。待肿瘤体积达70~100 mm3时,将小鼠随机分为3组(6只/组)进行治疗。葡萄糖组(GS组):每只小鼠尾静脉注射(5%葡萄糖溶液100μL/次),每周3次,共10次。脂质体空载质粒组(HK组):每只小鼠尾静脉注射100μL/次:5μg空载质粒,脂质体15μg溶于5%葡萄糖溶液中并充分混匀,总体系100μL,给药时间同上。脂质体shRNA-FAK组(shRNA-FAK组):每只小鼠尾静脉注射100μL/次:5μg质粒,脂质体15μg溶于5%葡萄糖溶液中并充分混匀,总体系100μL,给药时间同上。从开始治疗起每3天用游标卡尺测量肿瘤的长径(L)和短径(D),计算肿瘤体积:肿瘤体积V(mm3)=0.52×L ×D2。治疗结束后第3天,处死裸鼠。取小鼠的心、肝、脾、肾固定于福尔马林溶液中,取各组小鼠的肿瘤组织进行称重。并计算抑瘤率,抑瘤率=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%。
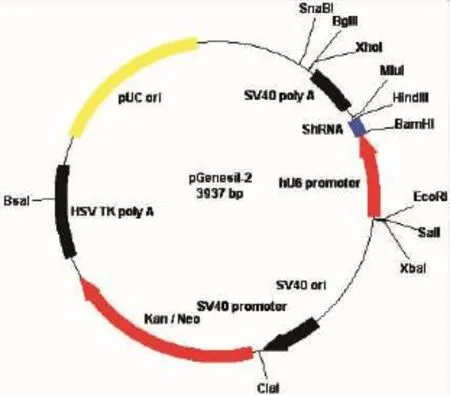
图1 质粒pGenesil-shRNA质粒图谱Figure 1 Plasmid pGenesil-shRNA plasmid map
1.2.2 肿瘤组织及裸鼠主要脏器形态学观察 肿瘤组织及裸鼠心、肝、脾、肾用10%的中性福尔马林固定,石蜡包埋、切片机切片,厚度为3~5μm。Mayer氏苏木素及伊红染色,中性树胶封片,显微镜(×200)下观察并照相。
1.2.3 Western-blot 提取总蛋白进行FAK蛋白表达情况的检测。组织在液氮中加入蛋白酶抑制剂cocktail 10μg/mL,RIPA裂解液(1mL per 107cells/100mm dish/150cm2flask,单位细胞量使用的裂解液),研磨组织至粉末状。以15 000rpm于4℃离心10min,将上清液转入新的EP管中,用蛋白质定量试剂对各样品的总蛋白进行定量,即以牛血清白蛋白(BSA)为标准,采用BIO-RAD公司蛋白质定量试剂(protein assay)比色测定蛋白质的含量,根据公式C(mg/mL)=1.45×A280-0.74×A260计算蛋白质的浓度,蛋白样品置于-80℃保存。取各组的总蛋白50μg用Tricine-PAGE分离,以100V、50min转移至聚偏二氟乙烯(PVDF)膜。室温下将PVDF膜在含有5%脱脂奶粉的TBS中使用摇床封闭1~2h。TBS室温下漂洗PVDF膜10min×2次,TBST室温下漂洗10min。将PVDF膜在含有兔抗人FAK单克隆抗体的TBST(1∶500)中于室温孵育1~2h,或者于4℃孵育过夜。同时使用小鼠抗人GAPDH单克隆抗体(1∶5 000)孵育作为对照。TBS室温下漂洗PVDF膜10min×2次,TBST室温下漂洗10min。HRP标记的山羊抗兔IgG(H+L)(用于FAK),山羊抗小鼠IgG(H+L)(用于GAPDH),在TBST中稀释(1∶10 000),再与PVDF膜于室温下在摇床上孵育1~2h。TBST室温下漂洗PVDF膜5min×3次。将两种化学发光底物等体积混合,于暗室中进行适时曝光;在X光医用冲洗机上显影,Quantity One软件进行数据分析,以FAK/GAPDH的IOD比值作为FAK的蛋白相对表达量。
1.2.4 肿瘤组织免疫组化、抗血管生成和细胞增殖 将石蜡切片置于65℃孵箱中加热2h,随后二甲苯脱蜡15min×2次;再先后用100%、95%、80%、70%酒精浸泡各2min;无菌去离子水洗涤5min×2次。用3%过氧化氢处理(室温)切片25min以阻断内源性过氧化氢酶的作用;PBS室温下漂洗组织切片5min×2次;将切片置于0.01M柠檬酸缓冲液(pH6.0)中,煮沸后高压加热10min进行抗原修复(FAK)或枸橼酸缓冲液(pH6.0)高压加热10min修复(CD31或PCNA);自然冷却至室温,无菌去离子水洗片5min×2次;以3%的与第二抗体同源血清处理切片,室温或37℃20min,之后用滤纸吸去多余血清;滤纸吸去血清后直接滴加FAK蛋白免疫前的兔血清或兔抗人FAK抗血清(1∶1 000),或小鼠抗人CD31和PCNA一抗(1∶500),置湿盒内于37℃孵育30min,然后4℃冰箱过夜;PBS室温下漂洗组织切片5min×2次;滴加生物素标记的山羊抗兔第二抗体(1∶200,以PBS稀释)50μL,置湿盒内于37℃孵育40min;PBS室温下漂洗组织切片5min×2次;酶标链亲和素复合物(1∶200,以PBS稀释)50μL,置湿盒内于37℃孵育40min;PBS室温下漂洗组织切片5min× 2次;滤纸吸去切片周围液体,滴加新鲜配制DAB工作液[0.01M PBS 1mL中加入DAB贮存液(25mg/ mL)20μL、3%过氧化氢10μL]显色,镜下观察,适时终止显色,流水充分冲洗;苏木素复染,室温4min,流水充分冲洗后用1%盐酸酒精(80%酒精99ml中加入浓盐酸1ml)分色30s左右,流水冲洗返蓝15min;脱水、透明,用中性树胶封片,光镜下观察并照相。
1.2.5 TUNEL检测 肿瘤组织的细胞凋亡采用Promega公司的DeadEnd Fluorometric TUNEL(TdT-mediated dUTP Nick-End Labeling,原位末端脱氧核苷酸转移酶标记法)System检测,参照试剂盒提供的方法进行。在荧光显微镜下全面观察每一张切片,随机选择3个高倍(×400)视野,每个视野内计数红色荧光细胞和绿色荧光细胞的数量,计算出肿瘤组织细胞的凋亡指数(凋亡指数=凋亡细胞数/总细胞数×100%)。
1.3 统计学方法
实验数据应用SPSS 20.0软件,各组间比较采用单因素方差分析(ANOVA),计量采用t检验;检验水平为α=0.05。
2 结 果
2.1 shRNA-FAK治疗后对荷瘤小鼠瘤重和肿瘤体积的影响
治疗第20d,以颈椎脱臼法处死裸鼠。取各组裸鼠的肿瘤组织进行称重并计算体积。结果发现shRNA-FAK能明显抑制肿瘤生长,到治疗终止时肿瘤的生长在治疗组(shRNA-FAK组)和阴性对照组(HK组)之间差异有统计学意义(P<0.05),而空白组(GS组)与阴性对照组(HK组)之间差异没有统计学意义(图2、图3),表明了实验中所采用的靶向shRNA-FAK能有效抑制体内肿瘤细胞的生长。治疗组(shRNA-FAK组)抑瘤率为56.50%,与阴性对照组(HK组)比较,差异有统计学意义(P<0.05)(表1)。
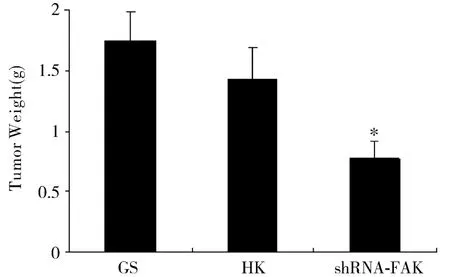
图2 各组的肿瘤重量Figure 2 Tumor weight of dissected lung cancer xenograft from each treatment groups

图3 各组的肿瘤生长曲线Figure 3 The tumor growth curves by groups

表1 各组裸鼠瘤重及抑瘤率比较Table 1 Tumor weight and tumor inhibition rate
2.2 肿瘤模型中的RNA干扰效果
经western blot分析,GS组、HK组和shRNAFAK组的相对FAK蛋白质表达量分别为78.36% ±1.67%,79.94%±8.90%和38.37%±1.85%。HK组相对于GS组,未见FAK蛋白含量下调,而在shRNA-FAK组中,FAK蛋白含量明显下调,与GS组相比差异有统计学意义(P<0.05)(图4);肿瘤组织FAK免疫组织化学分析显示,HK组相对于GS组,未见FAK蛋白含量下调,而在shRNA-FAK组中,FAK蛋白含量明显下调(图5A)。GS组与阴性对照组(HK组)的肿瘤细胞形态完整,没有出现明显的坏死区域。shRNA-FAK治疗组的肿瘤组织内部可以见到较为明显的免疫细胞浸润甚至细胞核固缩现象,而各对照组则很少有免疫细胞浸润(图5B)。肿瘤组织TUNEL染色显示shRNA-FAK治疗组中阳性染色细胞(凋亡细胞)明显增加,GS组和HK组未见明显的凋亡细胞(图5C1),差异有统计学意义(P<0.05)(图5C2)。在shRNA-FAK组中,肿瘤组织血管明显减少,而在GS组和HK组中,未见肿瘤组织血管减少(图5D1),差异有统计学意义(P<0.05)(图5D2);肿瘤组织VEGF、PCNA免疫组织化学分析显示,在GS组和HK组中,未见VEGF、PCNA蛋白含量下调(棕黄色为阳性),而在shRNA-FAK组中,VEGF、PCNA蛋白含量明显下调(图5E1、F1),差异有统计学意义(P<0.05)(图5E2、F2)。

图4 Western blot检测SPC-A1细胞中FAK蛋白表达Figure 4 FAK of SPC-A1 cells measured by Western blot analysis
2.3 不良反应观察
随着肿瘤逐渐增大,各组荷瘤鼠摄食都出现减少,活动迟缓,体重减轻,精神变差。后期出现肿瘤恶病质表现。治疗结束后颈椎脱臼法处死小鼠,取出心、肝、脾、肺、肾等主要脏器进行常规H&E染色,显微镜下观察各组织器官的细胞形态在对照组和治疗组中均未出现明显异常的形态学差异(图6)。
3 讨 论
在这项研究中,我们通过shRNA-FAK抑制荷瘤小鼠肿瘤组织的FAK蛋白表达,诱导肺腺癌SPCA1细胞凋亡,抑制肺腺癌肿瘤的生长。结果表明,在荷瘤小鼠中,FAK蛋白的表达抑制对于控制人肺腺癌SPC-A1的生长是有效的,与对照组相比,肿瘤体积明显减小,差异具有统计学意义。因此,在该肿瘤模型中,shRNA-FAK成功地抑制了肿瘤的生长,FAK或可成为肺腺癌的有效靶点。

图5 各组肿瘤组织中蛋白表达情况与细胞凋亡分析Figure 5 Analysis of protein expression and apoptosis in tumor tissues
在许多恶性肿瘤中FAK均过表达,包括卵巢癌[7],甲状腺癌、乳腺癌[8]、结肠癌[9]、头颈部肿瘤[10]。FAK是关键的非受体激酶,FAK与一些信号及细胞骨架分子结合后磷酸化,传递来自细胞外基质(extracellular matrix,ECM)的信号或传递来自可溶性生物活性因子的信号[11]。FAK在细胞迁移、存活和增殖中起关键调节作用[12]。FAK也是细胞存活和细胞凋亡的重要介质;FAK表达水平的升高与人肿瘤细胞侵入电位高度相关[13]。当细胞受到紫外线照射,或接触到依托泊苷、过氧化氢时,FAK的过表达能使细胞免受这类应激反应的伤害。但是以前的报告表明FAK活性的抑制并不一定诱导细胞凋亡[14-15]。在体外实验中,抑制FAK活动没有影响胰腺癌细胞的增殖,也未诱导细胞凋亡[16]。细胞在体外单层培养时,FAK基因沉默不诱导细胞凋亡,而它在裸鼠中抑制肿瘤的生长,这表明,抑制FAK表达进而抑制体内肿瘤生长可能体现在失巢凋亡上:即凋亡的形成是由于FAK基因沉默导致与细胞外基质信号传导缺失的缘故。
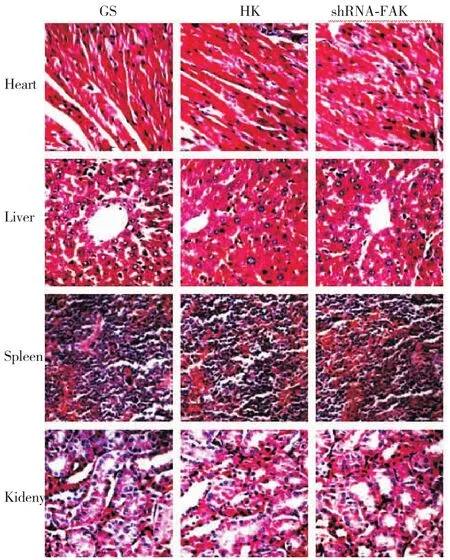
图6 各组裸鼠主要脏器(心脏、肝脏、脾脏、肾脏)H&E染色Figure 6 H&E staining of heart,liver,spleen and kidney tissues in each group,SP×200.
与siRNA[17]相比,在质粒中表达shRNA可更方便地以低成本进行扩增,并且shRNA非常稳定。本研究中,我们采用了质粒表达shRNA来特异性抑制FAK基因的功能,并在体内应用时用脂质体包裹表达质粒以延缓其在血清中的半衰期,取得了比较理想的抗肿瘤效果。病毒DNA载体表达的shRNA也已经用于对特定基因的沉默[18]。但是,病毒载体在全身给药时能激起机体的免疫反应[19],特别是可能会因为病毒基因组的插入而导致其他疾病(如白血病),使其进一步的临床应用受到限制[[20-21]。Cardoso等[22]研究发现,由转铁蛋白、脂质体和siRNA三者构成的复合体更加稳定且靶向性和安全性好;利用聚乙二醇(polyethylene glycol,PEG)修饰的免疫脂质体(pegylated immunoliposomes,PIL)包裹表达shRNA的质粒不仅增加了表达质粒在体内的稳定性,而且能靶向性地透过血脑屏障[23],使RNAi质粒能够到达肿瘤部位。总之,使用shRNA为人类进行治疗,很大程度上依赖于安全而有效的输送系统。FAK在肿瘤进展中起着关键性的作用[24],未来或将有更多的使用shRNA靶向FAK的治疗方案,比如使用特定抗体缀合载体、组织特异性基因启动子载体或细胞特异性基因启动子载体以抑制FAK激酶活性。
总之,体内实验表明,通过脂质体包裹的shRNA-FAK质粒使FAK低表达可抑制肺腺癌SPC-A1肿瘤的生长和诱导肿瘤细胞凋亡。基于shRNA的优点和对FAK现有的研究,我们认为在未来shRNA和FAK仍会是研究的热点,如何更有效地将RNAi导入哺乳动物体内,进行基因功能研究和基因治疗,值得进一步探索。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任。
利益冲突:本文全部作者均认同文章无相关利益冲突。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Fred R Hirsch.Lung cancer:current therapies and new targeted treatments[J/OL].http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)30958-8/abstract,2016-08-26.
[2] Zappa C,Mousa SA.Non-small cell lung cancer:current treatment and future advances[J].Transl Lung Cancer Res,2016,5(3):288-300.
[3] Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl JMed,2002,346(2):92-98.
[4] Cance WG,Kurenova E,Marlowe T,et al.Disrupting the scaffold to improve focal adhesion kinase-targeted cancer therapeutics[J].Sci Signal,2013,6(268):pe10.
[5] Xu LH,Owens LV,Sturge GC,et al.Attenuation of the expression of the focal adhesion kinase induces apoptosis in tumor cells[J].Cell Growth Differ,1996,7(4):413-418.
[6] Templeton NS,Lasic DD,Frederik PM,et al.Improved DNA:liposome complexes for increased systemic delivery and gene expression[J].Nat Biotechnol,1997,15(7):647-652.
[7] Hutchinson L.Ovarian cancer:FAK-new target for antiangiogenic therapy[J].Nat Rev Clin Oncol,2016,13(6):328.
[8] Isabelle Tancioni.FAK activity protects nucleostemin in facilitating breast cancer spheroid and tumor growth[J/OL].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4407832/,2015-05-28.
[9] Heffler M,Golubovskaya VM,Conroy J,et al.FAK and HAS inhibition synergistically decrease colon cancer cell viability and af-fect expression of critical genes[J].Anticancer Agents Med Chem,2013,13(4):584-594.
[10]Kornberg LJ.Focal adhesion kinase expression in oral cancers[J].Head Neck,1998,20(7):634-639.
[11]Yoon H,Dehart JP,Murphy JM,et al.Understanding the roles of FAK in cancer:inhibitors,genetic models,and new insights[J].J Histochem Cytochem,2015,63(2):114-128.
[12]Tomakidi P,Schulz S,Proksch S,et al.Focal adhesion kinase(FAK)perspectives in mechanobiology:implications for cell behaviour[J].Cell Tissue Res,2014,357(3):515-526.
[13]Sonoda Y,Matsumoto Y,Funakoshi M,et al.Anti-apoptotic role of focal adhesion kinase(FAK).Induction of inhibitor-of apoptosis proteins and apoptosis suppression by the overexpression of FAK in a human leukemic cell line,HL-60[J].J Biol Chem,2000,275(21):16309-16315.
[14]van de Water B,Houtepen F,Huigsloot M,et al.Suppression of chemically induced apoptosis but not necrosis of renal proximal tubular epithelial(LLC-PK1)cells by focal adhesion kinase(FAK).Role of FAK in maintaining focal adhesion organization after acute renal cell injury[J].JBiol Chem,2001,276(39):36183-36193.
[15]Chan PC,Lai JF,Cheng CH,et al.Suppression of ultraviolet irradiation-induced apoptosis by overexpression of focal adhesion kinase in Madin-Darby canine kidney cells[J].J Biol Chem,1999,274(38):26901-26906.
[16]Duxbury MS,Ito H,Benoit E,et al.RNA interference targeting focal adhesion kinase enhances pancreatic adenocarcinoma gemcitabine chemosensitivity[J].Biochem Biophys Res Commun,2003,311(3):786-792.
[17]黄上明,彭 波,翁志梁.应用RNA干扰技术阻断PC-3细胞中SRC-1基因表达的意义[J].肿瘤预防与治疗,2013,26(6):313-317.
[18]McCaffrey AP,Nakai H,Pandey K,et al.Inhibition of hepatitis B virus in mice by RNA interference[J].Nat Biotechnol,2003,21(6):639-644.
[19]Vorburger SA,Hunt KK.Adenoviral gene therapy[J].Oncologist,2002,7(1):46-59.
[20]Li Z,Dullmann J,Schiedlmeier B,et al.Murine leukemia induced by retroviral gene marking[J].Science,2002,296(5567):497.
[21]Marshall E.Gene therapy.Second child in French trial is found to have leukemia[J].Science,2003,299(5605):320.
[22]Cardoso AL,Simoes S,de Almeida LP,et al.siRNA delivery by a transferrin-associated lipid-based vector:a non-viral strategy to mediate gene silencing[J].J Gene Med,2007,9(3):170-183.
[23]Boado RJ.RNA interference and nonviral targeted gene therapy of experimental brain cancer[J].Neuro Rx,2005,2(1):139-150.
[24]Shanthi E,Krishna MH,Arunesh GM,et al.Focal adhesion kinase inhibitors in the treatment of metastatic cancer:a patent review[J].Expert Opin Ther Pat,2014,24(10):1077-1100.
RNA Interference Targeting Focal Adhesion K inase Inhibited the Grow th of Human Lung Adenocarcinoma SPC-A1*
Ye Lu,Mu Dan,Fu Bo,et al
(Department of Oncology,No.416 Hospital of Ministry of Nuclear Industry,Chengdu 610051,Sichuan,China)
Objective:To evaluate the inhibition effect of the plasmids encoding focal adhesion kinase(FAK)short hairpin RNA(shRNA)encapsulated in liposome on human lung adenocarcinoma SPC-A1 in nudemice bearing tumor.Methods:The nudemice bearing tumor were established and treated with shRNA-FAK encapsulated in liposome through tail vein injection.The inhibition effect of human lung adenocarcinoma SPC-A1 in nude mice was analyzed by tumor growth curve and weight,tumor histomorphology,FAK protein expression,CD31,VEGF,PCNA and TUNEL detection.Results:Tumor growth speed was significantly slower in the nudemice treated with liposomal shRNA-FAK than that in the control group(P<0.05).The tumor weight in the nudemice treated with liposomal shRNA-FAK was significantly lower than that of the control group(P<0.05).Immunohistochemistry,Western blot and TUNEL assay showed that the expression of FAK protein(P<0.05),the angiogenesis and cell proliferation decreased(P<0.05),and the apoptotic cells increased(P<0.05)in the treatment group compared with the control group,and the main organs of the nudemice bearing tumor were morphologically normal.Conclusion:FAK-specific small interfering RNA(siRNA)can suppress the expression of FAK protein in vivo,and the expression of FAK protein in the tissue is correspondingly reduced,thus induces the apoptosis of tumor cells,leading to the decelerated tumor growth.
RNA Interference;Focal Adhesion Kinase(FAK);Apoptosis;SPC-A1
R734.2;R73-35;R730.231
A
10.3969/j.issn.1674-0904.2016.06.002
2016-09-07
2016-10-31
*国家“重大新药创制”科技重大专项(编号:2009ZX09102-241)
叶 璐(1983-),女,成都人,硕士,主治医师,主要从事胸部与腹部肿瘤的临床研究与综合治疗。
△邓洪新,教授,E-mail:denghongx@scu.edu.cn

