促进Aβ 42形成不溶性聚集物的一种真菌化合物
邹永东,梁泽秋,董 瑶,陈国栋,刘国宝,郑易之
1)深圳大学生命与海洋科学学院,广东深圳 518060;2)深圳市微生物基因工程重点实验室,广东深圳 518060;
3)深圳市海洋生物资源与生态环境重点实验室,广东深圳 518060;
4)暨南大学药学院,中药及天然药物研究所,广东广州510632

Received:2015-09-22;Accepted:2015-12-07
Foundation:National Natural Science Foundation of China (81202441)
† Corresponding author:Professor Zheng Yizhi. E-mail: yzzheng@szu.edu.cn
Citation:Zou Yongdong, Liang Zeqiu, Dong Yao, et al. Promoting action of demethoxyviridin on Aβ 42 oligomers to form insoluble macromolecule aggregates[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(1): 25-32.(in Chinese)

【生物工程 / Bioengineering】
促进Aβ 42形成不溶性聚集物的一种真菌化合物
邹永东1,2,梁泽秋1,2,董瑶1,3,陈国栋4,刘国宝1,2,郑易之1,2
1)深圳大学生命与海洋科学学院,广东深圳 518060;2)深圳市微生物基因工程重点实验室,广东深圳 518060;
3)深圳市海洋生物资源与生态环境重点实验室,广东深圳 518060;
4)暨南大学药学院,中药及天然药物研究所,广东广州510632
摘要:β-类淀粉蛋白42 (amyloid-β 42, Aβ 42)聚集形成的可溶性寡聚体具有神经细胞毒性,是引起阿尔茨海默症的主要原因之一.通过浊度法、聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)和原子力显微镜(atomic force microscopy, AFM)技术,分析在真菌化合物demethoxyviridin存在情况下,Aβ 42聚集过程中荧光强度、浊度、寡聚体和聚集物的比例及颗粒表观形态等动态变化之间的对应关系.结果表明,化合物demethoxyviridin可明显促进Aβ 42小分子寡聚体形成高分子量寡聚体后,形成不溶性大分子聚集物沉淀,减少可溶性Aβ 42寡聚体比例.探讨了硫磺素T荧光法、浊度法、SDS-PAGE法和AFM法在研究Aβ 42聚集及活性化合物影响Aβ 42聚集中的互补性,认为综合应用4种方法有助于揭示活性化合物影响Aβ 42寡聚体沉淀形成的分子机理.
关键词:微生物药物学;阿尔茨海默症;β-类淀粉蛋白;Aβ 42寡聚体;Aβ 42聚集;Aβ 42大分子聚集沉淀;真菌化合物
Promoting action of demethoxyviridin on Aβ 42 oligomers
to form insoluble macromolecule aggregates
Zou Yongdong1, 2, Liang Zeqiu1, 2, Dong Yao1, 3, Chen Guodong4,
Liu Guobao1, 2, and Zheng Yizhi1,2†
神经退行性疾病阿尔茨海默症(Alzheimer’s disease, AD)已成为全球发病率和死亡率增长最快的疾病之一,其发病机制有淀粉样蛋白学说等[1-4].根据该学说,大脑中淀粉样β-类淀粉蛋白42 (amyloid-β 42, Aβ 42)聚集形成寡聚体、纤维状中间体和纤维,可引起神经突触损伤和炎症,进而导致阿尔茨海默症的发生[4-5].Aβ 42聚集形成的可溶性寡聚体是引起细胞毒性的首要原因[6-8].在体外,Aβ 42单体(monomer,M)可自发形成多种寡聚体,如二聚体(dimer,D)、三聚体(trimer)、四聚体(tetramer,T)及高分子量寡聚体(high molecular weight oligomers,H)[8-9],其中,以三聚体和四聚体为主的小分子寡聚体的细胞毒性最大[10].因此,以Aβ 42寡聚体为靶点,获得可抑制Aβ 42寡聚体形成或减少Aβ 42寡聚体比例的天然活性物质,将有助于阻止其引起神经细胞毒性,对预防与干预阿尔茨海默症具有重要意义[4,7].
目前,已发现一些天然化合物影响Aβ 42寡聚体形成,如表没食子儿茶素没食子酸酯和阿魏酸可抑制Aβ 42寡聚体形成,而姜黄素和白藜芦醇可清除Aβ 42寡聚体[7,11-13].文献[14]通过硫磺素T(thioflavine T,ThT)荧光法发现来源真菌Nodulisporium sp.的甾体类化合物demethoxyviridin在0~5 h期间可明显降低Aβ 42聚集过程中的ThT荧光强度,而其结构类似物inoterpene B未显示出明显的作用.本研究采用浊度法、聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)和原子力显微镜(atomic force microscope,AFM)技术,研究了0~48 h期间化合物demethoxyviridin影响Aβ 42聚集的动态过程,发现该化合物可显著促进溶液中Aβ 42单体、二聚体和四聚体形成高分子量寡聚体及不溶性大分子聚集物,减少可溶性寡聚体的比例.此结果不仅有助于揭示demethoxyviridin影响Aβ 42寡聚体沉淀形成的分子机理,也显示出该活性化合物在干预和预防AD应用上的潜力.
1材料与方法
1.1实验材料
Aβ 42多肽购自上海吉尔生化有限公司;二甲基亚砜(dimethyl sulphoxide,DMSO)和六氟异丙醇(1,1,1,3,3,3-hexafluoro-2-propanol,HFIP)购自美国Sigma公司.
1.2Aβ 42寡聚体的制备
用2 mL HFIP溶解1 mg Aβ 42多肽干粉,于4 ℃混匀12 h.超声波处理20 min后,取200 μL用氮气吹干,加入111 μL DMSO溶解,离心40 min,上清液即Aβ 42母液.取40 μL Aβ 42母液,加入磷酸盐缓冲溶液(phosphate buffered saline,PBS)(10 mmol/L Na2HPO3,pH=7.4)至200 μL,Aβ 42终浓度为40 μmol/L,于25 ℃静置48 h,制备Aβ 42寡聚体溶液.检测待测化合物时,在40 μL Aβ 42母液中先加入用DMSO溶解的待测化合物.
1.3ThT荧光法检测Aβ 42的聚集
ThT荧光法检测Aβ 42寡聚体溶液时,在40 μL的Aβ 42母液中先加入等摩尔的ThT溶液.采用多功能酶标仪(美国Thermo Varioskan Flash)对Aβ 42寡聚体溶液进行连续检测,设置激发光和发射光检测波长分别为444和485 nm.
1.4浊度法分析Aβ 42形成沉淀
在Aβ 42寡聚体溶液制备后的0、1、5、24和48 h时分别取样,采用紫外分光光度计(美国GE UltroSpec 2100 pro)测定每份样品在340 nm处的光密度(optical density, OD), 检测Aβ 42溶液的浊度.
1.5SDS-PAGE电泳检测Aβ 42寡聚体
在Aβ 42寡聚体溶液制备后的0、1、5、24和48 h时分别取20 μL,各加入上样缓冲液,95 ℃加热5 min后用于电泳.采用质量浓度为50 mg/mL的浓缩胶和质量浓度为150 mg/mL的分离胶进行SDS-PAGE电泳.利用Lab-image软件(美国BioRad)分析凝胶板上电泳条带的灰度百分比.
1.6AFM观察Aβ 42聚集颗粒
在Aβ 42寡聚体溶液制备后的0、5和48 h时分别取2 μL,各稀释10倍后滴于云母片上,静置5 min后纯水冲洗3遍,再干燥12 h.采用AFM(美国Bruker Multimode 8)选轻敲模式进行扫描观察,探针型号为RTESP.采用美国AEP科技公司SPIP型扫描探针图像处理软件统计云母片上颗粒高度分别为0.5~3.0 nm、3.0~8.0 nm及大于8.0 nm的Aβ 42聚集体的面积.
以上实验均重复3~5次.采用方差分析法对所得数据进行差异显著性分析.
2结果与分析
2.1ThT荧光法显示demethoxyviridin可明显影响Aβ 42的聚集
ThT荧光法常用于从化合物库或天然产物库中筛选可抑制Aβ 42聚集活性的化合物[7, 15].文献[15-16]显示,Aβ 42多肽在聚集成寡聚体和纤维过程中形成β-折叠,以此与外加ThT结合,在444 nm光激发下产生485 nm发射光,通过检测485 nm荧光强度来反映Aβ 42的聚集程度[15-16].
在前期工作中发现,真菌Nodulisporium sp.次生代谢产物demethoxyviridin在Aβ 42聚集0~5 h时,表现出明显的降低Aβ 42溶液ThT荧光强度的活性,而inoterpene B则未显示出明显活性[14].在此基础上,本研究通过ThT荧光法检测了0~48 h内demethoxyviridin和inoterpene B化合物对Aβ 42聚集的影响.将新配制的Aβ 42溶液(空白对照)加入ThT后置于酶标仪下,检测结果显示,0 h时含Aβ 42肽的溶液的ThT荧光强度为6.2,5 h时迅速上升到10.9;随后缓慢增加,48 h时达到13.4,即在5~48 h期间ThT荧光强度缓慢上升进入“平台期”.在Aβ 42溶液中加入4 μmol/L demethoxyviridin后,0~5 h期间荧光强度从4.2增至7.3;5~48 h间荧光强度趋于平稳.当demethoxyviridin浓度提高到40 μmol/L后,0~5 h期间荧光强度从4.3快速降至1.3,之后荧光强度维持稳定.在Aβ 42溶液中加入40 μmol/L inoterpene B后,0~5 h时,Aβ 42溶液的荧光强度由5.2速升至9.9,之后保持稳定,如图1.由图1可见,demethoxyviridin明显地影响Aβ 42的聚集,且其影响作用主要发生在Aβ 42聚集的0~5 h内.

图1 化合物demethoxyviridin和inoterpene B对Aβ 42溶液ThT荧光强度的影响Fig.1 Influence of demethoxyviridin and inoterpene B on ThT fluorescence of Aβ 42 solutions
2.2浊度法显示demethoxyviridin可促进Aβ 42肽快速形成不溶性沉淀
Aβ 42肽在溶液中可聚集形成不溶性沉淀[17],而溶液中的不溶性或悬浮体沉淀物质可通过浊度法进行检测[18].本研究通过浊度法检测了Aβ 42肽形成不溶性沉淀的动态过程.结果显示,含Aβ 42溶液(空白对照)在340 nm处0 h的光密度值为0.021,5 h时为0.023,48 h时为0.102,表明在0~48 h内Aβ 42沉淀物持续缓增.在Aβ 42溶液中加入40 μmol/L demethoxyviridin后,0~5 h的光密度值从0.018急增至0.258,之后继续上升,48 h时达到0.319,在聚集后期(5~48 h)沉淀物形成速度明显减慢,如图2.而在Aβ 42溶液中加入40 μmol/L inoterpene B后,0~5 h内溶液的光密度值仅由0.019升至0.026,在48 h达到0.134.上述结果表明,demethoxyviridin可在Aβ 42溶液聚集初期(0~5 h)促进Aβ 42肽快速形成不溶性沉淀.

图2 化合物demethoxyviridin和inoterpene B对Aβ 42溶液D(340)值的影响Fig.2 Influence of demethoxyviridin and inoterpene B on the oplical density at 340 nm of Aβ 42 solutions
2.3SDS-PAGE法显示demethoxyviridin可加快Aβ 42寡聚体聚集成大分子聚集物
Aβ 42肽具有高度自发聚集的特性.在体外实验中因制备条件(如缓冲液、pH值及温度)的差异,其聚集状态(如寡聚体和纤维)也表现不同[8,19-20].本研究采用PBS溶液(10 mmol/L Na2HPO3,pH=7.4)配制Aβ 42溶液(空白对照),经SDS-PAGE电泳显示,0 h时Aβ 42溶液中即出现单体、二聚体、四聚体和位于浓缩胶与分离胶交界处的高分子量寡聚体(1 Da=1 u),如图3(a).这一现象与文献[20-21]报道相似.实验结果还显示,在Aβ 42聚集后的0~48 h内溶液中的单体、二聚体和高分子量寡聚体条带未明显改变,四聚体条带浓度持续减弱;灰度扫描结果显示,四聚体条带灰度百分比从0 h的43.8%下降到5 h的33.3%及48 h的25.8%,如图3(d);值得注意的是,位于浓缩胶加样孔处的大分子聚集物(aggregate,A)逐渐加深,其灰度百分比由0 h的4.9%渐升至5 h的8.9%,48 h达16.6%,如图3(f).
将40 μmol/L的demethoxyviridin加入Aβ 42溶液中,0 h时Aβ 42的单体、二聚体、四聚体和高分子量寡聚体条带的灰度百分比与Aβ 42(空白对照)十分相似.在以后的48 h内,Aβ 42单体和二聚体条带的灰度百分比分别从0 h的21.6%和9.7%先升至5 h的22.2%和10.6%,然后降至48 h的18.3%和6.5%,如图3(b)和(c);四聚体条带的灰度百分比由0 h的47.4%快速降至5 h的16.4%及48 h的3.2%,如图3(d);高分子量寡聚体条带的灰度百分比由0 h的14.0%持续下降至5 h的8.5%及48 h的2.5%,如图3(e);与此相反,大分子聚集物条带的灰度百分比在0 h为7.4%、5 h为22.3%,48 h上升至26.8%,如图3(f).根据上述结果可认为,在0~5 h期间,demethoxyviridin可明显促进Aβ 42单体、二聚体、四聚体和高分子量寡聚体形成大分子聚集物;在后续的5~48 h期间,几种寡聚体形成大分子聚集物的速度逐渐减慢.
若将40 μmol/L inoterpene B加入Aβ 42溶液后的0~48 h,单体、几种寡聚体和大分子聚集物条带的灰度百分比与Aβ 42(空白对照)相似,如图3.
2.4AFM技术显示demethoxyviridin可促进Aβ 42形成大分子聚集物颗粒
AFM技术的优点是可直观显示Aβ 42多肽形成的各种聚集颗粒大小及形态,并通过相应的软件统计颗粒的高度和面积百分比[5,8,19].如Mastrangelo等[8]采用AFM法定义高度达1.0~3.0 nm的Aβ 42颗粒主要由单体、二聚体和四聚体组成,高度达2.0~8.0 nm的颗粒为高分子量寡聚体.本研究利用AFM观察到Aβ 42聚集形成的小颗粒(高度0.5~3.0 nm)和中等颗粒(高度3.0~8.0 nm),这与Mastrangelo定义的两种颗粒相对应;此外,在显微镜视野中还可见一些大颗粒(高度>8.0 nm),如图4(a).笔者认为大颗粒可与SDS电泳中的大分子聚集物沉淀相对应.本研究还采用SPIP软件比较了上述3种颗粒在Aβ 42溶液加入demethoxyviridin和inoterpene B后的面积百分比.
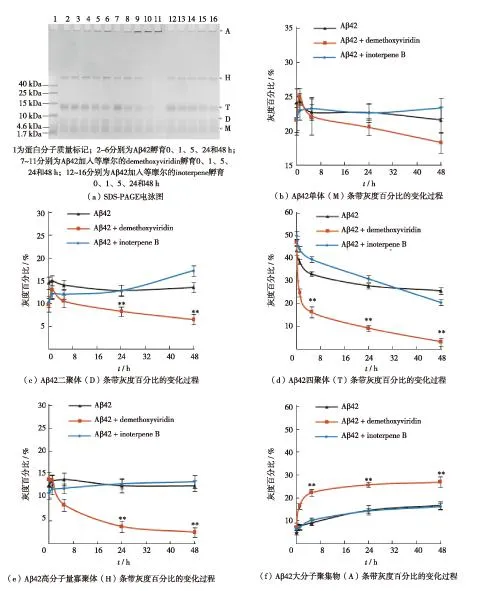
图3 化合物demethoxyviridin和inoterpene B对Aβ 42溶液中单体、二聚体、四聚体、高分子量寡聚体和大分子聚集物比例的影响Fig.3 Influence of demethoxyviridin and inoterpene B on the proportions of Aβ 42 monomers, dimmers, tetramers, high molecular weight oligomers and macromolecular aggregates

图4 化合物demethoxyviridin和inoterpene B对Aβ 42溶液中不同高度Aβ 42颗粒比例的影响Fig.4 Influence of demethoxyviridin and inoterpene B on the proportions of Aβ 42 particles with different heights
通过AFM技术可见,在0 h时Aβ 42溶液(空白对照)中存在大量小颗粒、少量中等颗粒和极少量的大颗粒;3种颗粒的面积百分比分别为88.2%、13.3%和3.5%,如图4(b).聚集后的5和48 h,小颗粒数量减少,其面积百分比急剧下降至32.7%和14.9%;中等颗粒的面积百分比均呈现先增后降的趋势,从0 h的13.3%先增加到5 h的46.2%,后又减少到48 h的41.0%;而大颗粒不仅数目增加,面积百分比在48 h时增至44.1%,如图4(b).上述结果表明,Aβ 42肽在聚集过程中先聚集形成小颗粒,再逐渐聚集成中等颗粒及大颗粒,中等颗粒可认为是聚集过程中的过渡类型.将40 μmol/L demethoxyviridin加入Aβ 42溶液,在0 h时,3种颗粒的面积百分率与单独Aβ 42溶液(空白对照)相比无显著区别;5 h时小颗粒数量明显减少,中等颗粒数目增加,同时中等颗粒面积也显著增加;随着聚集时间延长,在48 h时小颗粒与中等颗粒均显著减少,而以大颗粒居多;同时,小颗粒面积百分比从0 h的73.9%持续减至48 h的19.2%,中等颗粒面积百分比从0 h的21.9%先增至5 h的44.7%再降至48 h的7.9%,而大颗粒面积百分比从0 h的4.0%持续增加到48 h的72.9%,如图4(b).若在Aβ 42溶液加入40 μmol/L inoterpene B,Aβ 42聚集过程中3种颗粒面积百分比与Aβ 42(空白对照)相比未见明显区别.
可见,demethoxyviridin可加速Aβ 42溶液中的小颗粒形成中等颗粒及大颗粒,这一结果与前述浊度法和SDS-PAGE电泳结果相对应.
3讨论
阿尔茨海默症的发病机制与Aβ 42聚集形成的寡聚体和纤维密切相关[4-5],其中,Aβ 42寡聚体是引起神经细胞毒性的主要原因之一[6].因此,获得可抑制Aβ 42寡聚体形成或减少Aβ 42寡聚体活性的天然产物具有重要意义.文献[7]表明,一些天然化合物可抑制Aβ 42寡聚体形成或清除Aβ 42寡聚体.如表没食子儿茶素没食子酸酯可抑制较高毒性Aβ 42寡聚体的形成,产生低毒性的大分子聚集物;阿魏酸可抑制Aβ 42形成β-折叠,阻止Aβ 42单体向寡聚体的转变,并减少Aβ 42引起的SH-SY5Y细胞毒性[12];姜黄素可结合于Aβ 42多肽的N端,通过促进Aβ 42纤维形成,减少Aβ 42原纤维和寡聚体的形成,降低Aβ 42导致的神经细胞毒性作用[11].白藜芦醇是葡萄果皮产生的多酚类化合物,可将Aβ可溶性寡聚体、纤维状中间体和成熟的纤维转变为低毒的无定形大分子聚集物,降低Aβ聚集物的细胞毒性[13].本实验室从一种红树植物——水黄皮中分离出内生真菌Phomopsisocculta, 发现其发酵提取物的ME0-W-F1肽组分可在体外抑制Aβ 42聚集,降低Aβ 42引起的SH-SY5Y细胞毒性[3].前期还从真菌Nodulisporium sp.天然产物库中筛选出具有明显降低Aβ 42溶液ThT荧光强度的活性化合物demethoxyviridin[14].实验结果表明,该化合物可明显促进Aβ 42小分子寡聚体形成高分子量寡聚体,形成不溶性大分子聚集物沉淀,具有显著清除可溶性小分子Aβ 42寡聚体的活性.
在Aβ 42聚集的体外研究中,通常采用ThT荧光法筛选出可影响Aβ 42聚集的活性化合物.由于Aβ 42聚集速度相当快,研究者难以检测到Aβ 42聚集为寡聚体、大分子聚集物及Aβ 42纤维的过程,也无法揭示活性化合物对有细胞毒性的Aβ 42寡聚体形成的影响.研究者通常采用以下一种或两种方法,如圆二色谱法、SDS-PAGE、抗体杂交、透射电镜和AFM等辅助ThT荧光法研究活性化合物的作用机理[3,7,11-13],但相关报告并不多见.本研究综合分析了ThT荧光法、浊度法、SDS-PAGE和AFM法的研究结果,认为ThT荧光法是最常用的研究Aβ 42聚集的方法之一,其制备Aβ 42相对简单,在样品制备后的0~5 h内即可检出Aβ 42聚集的动态变化[14],便捷、灵敏是ThT荧光法检测Aβ 42聚集动态过程的优势;浊度法可快速反映溶液中Aβ 42聚集过程形成沉淀悬浮物的变化;SDS-PAGE电泳法可区分Aβ 42的单体、二聚体、四聚体和高分子寡聚体及大分子聚集物,并反映其比例[3,20-21];AFM法可直观地观察到Aβ 42聚集的几种不同高度的颗粒[5,8,19].与ThT法相比,后3种方法最大的优势是能够检测出Aβ 42寡聚体的动态变化,并揭示活性化合物影响Aβ 42寡聚体及沉淀形成的分子机理.
本研究采用浊度法、SDS-PAGE电泳和AFM法发现,Aβ 42溶液可缓慢形成不溶性大分子聚集物沉淀,demethoxyviridin的加入则显著加速形成不溶性沉淀.因此,推测Aβ 42溶液0~5 h内ThT荧光强度快速升高可能与聚集早期形成的大量寡聚体有关;5~48 h期间随着较多Aβ沉淀(蛋白电泳条带灰度百分比达到16.6%)的形成,ThT荧光强度缓慢上升,该现象可能是已发生聚集形成沉淀的Aβ 42与ThT的结合力及发光强度很大程度被减弱所致[15-16].而在demethoxyviridin加入Aβ 42溶液后0~5 h内ThT荧光强度急剧下降,其原因是该化合物加快了Aβ 42沉淀的形成.
通过浊度法、SDS-PAGE法和AFM法研究还发现,在0~48 h期间活性化合物demethoxyviridin可快速减少Aβ 42各种寡聚体的相对比例,显著促进Aβ 42小颗粒聚集形成大颗粒,促进其沉淀的快速形成.即使在demethoxyviridin加入Aβ 42溶液后5~48 h内,ThT荧光强度处于较低的“稳定期”,Aβ 42各种寡聚体向大分子聚集沉淀的快速转变仍存在.这反映了demethoxyviridin影响Aβ 42聚集的作用方式,也预示着它具有降低Aβ 42低聚物比例和减少细胞毒性的可能性.由此可见,在利用ThT法筛选到具有降低Aβ 42溶液ThT荧光强度的候选活性化合物后,应增加SDS-PAGE法和AFM法进行研究,这不仅有助于从理论上揭示活性化合物影响Aβ 42寡聚体沉淀形成的分子机理,也可为今后利用相关的细胞及动物模型研究活性化合物是否可降低Aβ 42寡聚体的细胞毒性提供重要依据.
Aβ 42具有高度自聚集倾向的特性,受缓冲液离子强度、pH值和温育的温度的影响,所形成的寡聚体、大分子聚集物或纤维比例有很大不同[22].同时,Aβ 42形成寡聚体和纤维的过程有多种途径[23].本研究将Aβ 42加入到25 ℃的PBS溶液(pH=7.4)中,在AFM下只观察到了大小不等的颗粒,未见到Aβ 42纤维形成.这表明在此制备条件下,单独的Aβ 42主要形成的是寡聚体而不是纤维.可见,这是一套适合于检测活性化合物对Aβ 42寡聚体影响的实验体系.
结语
阻止或减少可溶性Aβ 42寡聚体(尤其是小分子寡聚体)的形成对于干预和预防阿尔茨海默症具有重要意义.本研究比较了ThT荧法法、浊度法、SDS-PAGE法和AFM法4种方法在研究Aβ 42形成寡聚体及活性化合物影响Aβ 42寡聚体形成的互补性,证明了demethoxyviridin具有显著的清除可溶性小分子Aβ 42寡聚体的活性,这不仅有助于从理论上揭示活性化合物影响Aβ 42聚集物形成的分子机理,也可为今后利用细胞及动物模型研究活性化合物是否可降低Aβ 42聚集物的细胞毒性提供重要参考.

引文:邹永东,梁泽秋,董瑶,等. 促进Aβ 42形成不溶性聚集物的一种真菌化合物[J]. 深圳大学学报理工版,2016,33(1):25-32.
参考文献/ References:
[1] 倪嘉缵, 陈平, 刘琼, 等. 阿尔茨海默病的防治策略研究进展[J]. 深圳大学学报理工版, 2013, 30(4): 331-348.
Ni Jiazuan, Chen Ping, Liu Qiong, et al. Advance reseach on strategies for the prevention of Alzheimer’s disease[J]. Journal of Shenzhen University Science and Engineering, 2013, 30(4): 331-348.(in Chinese)
[2] 李冰石, 薛山, 宋国丽. 纳米粒子对amyloid-β聚集的影响的研究进展[J]. 深圳大学学报理工版, 2015, 32(6): 601-609.
Li Bingshi, Xue Shan, Song Guoli. Review of the influence of nanoparticles on aggregation of amyloid-β[J]. Journal of Shenzhen University Science and Engineering, 2015, 32(6): 601-609.(in Chinese)
[3] Wu Haiqiang, Zhang Fang, Williamson N, et al. Effects of secondary metabolite extract from Phomopsisocculta on beta-amyloid aggregation[J]. PLOS One, 2014, 9(10): e109438.
[4] Citron M. Alzheimer’s disease: strategies for disease modification[J]. Nature Reviews Drug Discovery, 2010, 9(5): 387-398.
[5] Fu Ziao, Aucoin D, Ahmed M, et al. Capping of Aβ 42 oligomers by small molecule inhibitors[J]. Biochemistry, 2014, 53(50): 7893-7903.
[6] Stefani M. Structural features and cytotoxicity of amyloid oligomers: implications in Alzheimer’s disease and other diseases with amyloid deposits[J]. Progress in Neurobiology, 2012, 99(3): 226-245.
[7] Ehrnhoefer D E, Bieschke J, Boeddrich A, et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers[J]. Nature Structural & Molecular Biology, 2008, 15(6): 558-566.
[8] Mastrangelo I A, Ahmed M, Sato T, et al. High-resolution atomic force microscopy of soluble Aβ 42 oligomers[J]. Journal of Molecular Biology, 2006, 358(1): 106-119.
[9] Kayed R, Head E, Thompson J L, et al. Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis[J]. Science, 2003, 300(5618): 486-489.
[10] Kelly B L, Ferreira A. Beta-amyloid-induced dynamin 1 degradation is mediated by N-methyl-D-aspartate receptors in hippocampal neurons[J]. Journal of Biological Chemistry, 2006, 281(38): 28079-28089.
[11] Caesar I, Jonson M, Nilsson K P R, et al. Curcumin promotes A-beta fibrillation and reduces neurotoxicity in transgenic Drosophila [J]. PLOS One, 2012, 7(2): e31424.
[12] Cui Lili, Zhang Yuan, Cao Hao, et al. Ferulic acid inhibits the transition of amyloid-beta 42 monomers to oligomers but accelerates the transition from oligomers to fibrils[J]. Journal of Alzheimer’s Disease, 2013, 37(1): 19-28.
[13] Ladiwala A R A, Lin J C, Bale S S, et al. Resveratrol selectively remodels soluble oligomers and fibrils of amyloid Abeta into off-pathway conformers[J]. Journal of Biological Chemistry, 2010, 285(31): 24228-24237.
[14] Zheng Qichang, Chen Guodong, Kong Mingzhu, et al. Nodulisporisteriods A and B, the first 3,4-seco-4-methyl-progesteroids from Nodulisporium sp.[J]. Steroids, 2013, 78(9): 896-901.
[15] Keskitalo S, Farkas M, Hanenberg M, et al. Reciprocal modulation of Aβ 42 aggregation by copper and homocysteine[J]. Frontiers in Aging Neuroscience, 2014, 6: 237.
[16] Bhattacharya A, Prajapati R, Chatterjee S, et al. Concentration-dependent reversible self-oligomerization of serum albumins through intermolecular β-sheet formation[J]. Langmuir, 2014, 30(49): 14894-14904.
[17] Han Sunho, Chang Yujin, Jung Eunsun, et al. Effective screen for amyloid beta aggregation inhibitor using amyloid beta-conjugated gold nanoparticles[J]. Journal of Nanomedicine, 2011, 6: 1-12.
[18] Fowler S B, Poon S, Muff R, et al. Rational design of aggregation-resistant bioactive peptides: reengineering human calcitonin[J]. Proceedings of the National Academy of Sciences, 2005, 102(29): 10105-10110.
[19] Takai E, Uda K, Yoshida T, et al. Cysteine inhibits the fibrillisation and cytotoxicity of amyloid-beta 40 and 42: implications for the contribution of the thiophilic interaction[J]. Physical Chemistry Chemical Physics, 2014, 16(8): 3566-3572.
[20] Poduslo J F, Howell K G, Olson N C, et al. Alzheimer’s disease amyloid β-protein mutations and deletions that define neuronal binding/internalization as early stage nonfibrillar/fibrillaraggregates and late stage fibrils[J]. Biochemistry, 2012, 51(19): 3993-4003.
[21] Poduslo J F, Howell K G. Unique molecular signatures of Alzheimer’s disease amyloid β peptide mutations and deletion during aggregate/oligomer/fibril formation[J]. Journal of Neuroscience Research, 2015, 93(3): 410-423.
[22] Jan A, Hartley D M, Lashuel H A. Preparation and characterization of toxic Abeta aggregates for structural and functional studies in Alzheimer’s disease research[J]. Nature Protocols, 2010, 5(6): 1186-1209.
[23] Necula M, Kayed R, Milton S, et al. Small molecule inhibitors of aggregation indicate that amyloid beta oligomerization and fibrillizationpathways are independent and distinct[J]. Journal of Biological Chemistry, 2007, 282(14): 10311-10324.
【中文责编:晨兮;英文责编:艾琳】
1) College of Life and Marine Science, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China
2) Shenzhen Key Laboratory of Microbial Genetic Engineering, Shenzhen 518060, Guangdong Province, P.R.China
3) Shenzhen Key Laboratory of Marine Bioresources and Ecology, Shenzhen 518060, Guangdong Province, P.R.China
4) College of Pharmacy, Institute of Traditional Chinese Medicine and Natural Products, Jinan University,
Guangzhou 510632, Guangdong Province, P.R.China
Abstract:Amyloid beta (Aβ) is crucially involved in Alzheimer’s disease, and soluble Aβ 42 oligomers are the main neurotoxic species. In this paper, the experimental methods, including standard thioflavin T (ThT) fluorescence assay, turbimetric method, sodium dodecyl sulfate-polyacrylamide gelelectrophoresis (SDS-PAGE) and atomic force microscopy (AFM), are applied to investigate the relationship among the thioflavin T fluorescence, the turbidity, the proportion and the surface shape of Aβ 42 oligomers and aggregates during the Aβ 42 aggregation procedure. The results show that the fungal compound demethoxyviridin could clearly promote soluble small molecular Aβ 42 oligomers to form insoluble macromolecular aggregate precipitates via high molecular weight oligomers. In addition, the complementarities of the ThT fluorescence assay, turbimetric method, SDS-PAGE and AFM on Aβ 42 aggregation procedure are discussed. The comprehensive application of these methods is helpful to reveal the molecular mechanism of the effect of the active compounds on the formation of Aβ 42 oligomers and their precipitation.
Key words:microbial pharmacology; Alzheimer disease; amyloid-β (Aβ); Aβ 42 oligomer; Aβ 42 aggregation; Aβ 42 macromolecular aggregate precipitate; fungal compound
作者简介:邹永东(1968—),男,深圳大学高级实验师.研究方向:植物生物技术及天然产物应用. E-mail:zouyd@szu.edu.cn
基金项目:国家自然科学基金资助项目(81202441)
中图分类号:R 93
文献标志码:A
doi:10.3724/SP.J.1249.2016.01025

