膀胱浆细胞样尿路上皮癌的临床病理分析
余慧萍 付 尧 陈洁宇 史 炯 王景美⋆
膀胱浆细胞样尿路上皮癌的临床病理分析
余慧萍 付 尧 陈洁宇 史 炯 王景美⋆
目的 探讨膀胱浆细胞样变异型尿路上皮癌(PUC)的临床和病理特征。方法 回顾分析12例PUC病例的临床资料、组织学形态和免疫组织化学表型,并进行随访观察。结果 12例患者男女比例为3:1,发病年龄47~89岁。肿瘤细胞胞浆嗜酸性或透亮,核偏位或居中,核大深染,可见小核仁,细胞间粘附性较差,间质疏松或粘液样;约75%的病例可查见部分不等的高级别尿路上皮癌细胞。免疫组化标记显示尿路上皮标记物CK7、P63、CK20阳性,淋巴造血肿瘤标记物LCA、CD38、CD3、CD20阴性,但CD138可阳性表达。结论 PUC是尿路上皮癌的一种罕见变异型,组织形态易与浆细胞肿瘤混淆,且具有较差的预后;全面观察组织学形态,寻找高级别尿路上皮癌细胞,免疫组化染色显示尿路上皮标记物阳性、淋巴造血肿瘤标记物阴性有助于确诊;CD138不宜作为鉴别诊断标记物。
浆细胞样 尿路上皮癌 免疫组织化学
膀胱癌是最常见的癌症之一,位居世界肿瘤的第7位。在组织学上,尿路上皮癌占膀胱癌的>90%,并且有巢状变异型、微囊变异型、淋巴上皮瘤样癌、浆细胞样变异型等多种变异型,其中浆细胞样变异型尿路上皮癌(Plasmacytoid urothelial carcinoma,PUC)[1]较为罕见,且组织学形态与浆细胞肿瘤相似,较易误诊,尤其在活检小标本中常出现。作者在此回顾分析一组病例,探讨其组织学表现及临床病例特征,以期提高对该类肿瘤的认识。
1 临床资料
1.1 一般资料 收集南京大学医学院附属鼓楼医院病理科2009年1月至2015年12月诊断为膀胱PUC的12例病例。所有病例的PUC成分均占肿瘤成分的>50%。其中4例为根治标本,其余8例为活检标本。所有病例均有存档石蜡包埋肿瘤组织蜡块。所有病例临床资料来源于存档病历。随访采用电话联系。
1.2 形态观察 标本经10% 福尔马林溶液固定,常规石蜡包埋,4μm切片,HE染色,在光镜下观察。观察项目包括:肿瘤发生部位、肿瘤大体形态、肿瘤浸润深度、肿瘤细胞形态、核分裂像数量、肿瘤间质及背景观察等。
1.3 免疫组织化学染色 采用全自动免疫组织化学仪(BenchMarkXT,美国Roche公司),EnVision 两步法染色,第一抗体包括CK、CK7、CK20、P63、CD38、CD138、E-cadherin,CD20、CD3、LCA、HMB45、S100、Desmin、Ki67(均购自DAKO公司),以各抗体已知的阳性切片做阳性对照,以PBS代替一抗作阴性对照。具体操作步骤参考试剂盒说明书和全自动免疫组织化学仪标准操作流程。染色结果半定量判读:若阳性部位在细胞质或细胞膜,以出现黄色颗粒且染色强度高于背景非特异性着色者为阳性细胞;综合考虑染色强度和阳性细胞数:无染色(0),<60%肿瘤细胞弱到中等染色(1+),<60%肿瘤细胞强染色或≥60%肿瘤细胞弱到中等染色(2+),≥60%肿瘤细胞强染色(3+)。P63阳性部位在细胞核,计数阳性细胞数量,无染色为(0),≤30%为(1+),31%~59%为(2+),≥60%为(3+)。Ki67阳性部位在细胞核,记录阳性细胞百分比。
2 结果
2.1 临床资料 12例患者中男9例,女3例;发病年龄47~89岁,平均年龄67.8岁;其中11例均有无痛血尿病史,1例为体检发现膀胱肿块;其中4例为肿瘤根治标本,其余8例为膀胱镜活检标本。
2.2 病理学表现 (1)肉眼所见:肿瘤可分布于膀胱壁各部位,以右侧壁多见(7/12);绝大多数病例(11/12)为菜花状或结节样、息肉样肿块,1例为弥漫浸润性肿块。肿块最大径1.2~4.5cm,平均2.7cm。(2)镜下组织学特征:肿瘤细胞小至中等大小,细胞圆形或卵圆形,胞浆透亮或嗜酸性,胞浆量可多可少,核偏位或中位,核大深染,可呈浆细胞样、印戒细胞样或淋巴细胞样,细胞具有轻-中度异型性,可见小核仁,核分裂像可见(1~8个/10HPF);肿瘤细胞片状排列,细胞间粘附性较差;9例标本内均可查见高级别尿路上皮癌细胞(约占肿瘤成分的5%~40%);间质疏松或粘液样,肿瘤背景大多(11/12)可见散在淋巴细胞浸润,部分病例可见淋巴滤泡形成;部分病例(4/12)见合体样多核细胞形成(图1~3)。在根治标本中常可见脉管及神经侵犯(3/4);部分病例(2/4)残留输尿管切缘和/或尿道切缘尿路上皮的异型增生;部分病例(2/4)查见淋巴结转移。(3)免疫组化:所有病例均表达上皮标记物CK、CK7;大部分病例表达CK20(10/12)、P63(9/12)、CD138(11/12),表达强度不等;E-cadherin的表达减弱(4/12为弱-中等强度表达)或缺失(8/12);Ki67的表达强度为10%~80%,平均35.4%。所有标本均不表达LCA、CD38、CD20、CD3、Desmin、HMB45、S100。
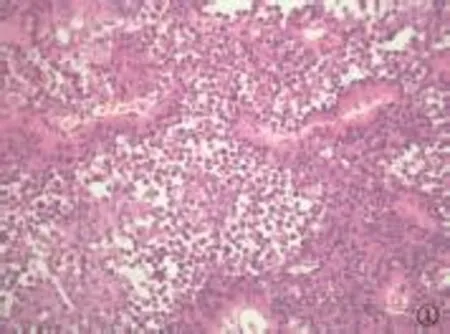
图1 肿瘤细胞弥散,缺乏粘附性,核偏位,并可见高级别尿路上皮癌细胞(HE,400×)
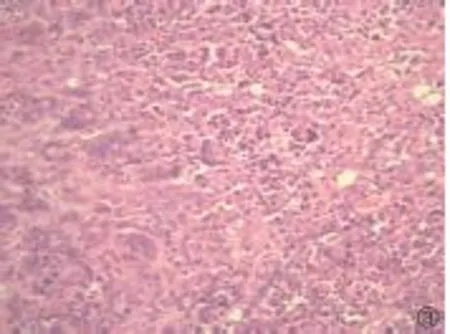
图2 间质内可见淋巴细胞浸润(HE,400×)
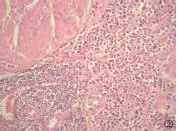
图3 可见多核巨细胞成分(HE,400×)
2.3 随访 12例患者,其中4例患者死亡,存活时间2~34个月,其余8例存活,最长存活时间78个月。
3 讨论
PUC既往称为淋巴瘤样和浆细胞样变异型[2],在2016年第四版WHO肿瘤分类《泌尿系统及男性生殖器官肿瘤病理学和遗传学》中更名为浆细胞样变异型[1]。由于其肿瘤细胞形态呈浆细胞样或淋巴细胞样,且可较好地表达常用浆细胞肿瘤标记物CD138,容易和浆细胞肿瘤混淆,因此对此类变异型需要有一个较为全面和清晰的认知。
膀胱PUC好发于男性,Dayyani 等[3]报道31例PUC中有83.3%为男性;张伟等[4]报道的16例PUC中有15例为男性,多见于中老年人,大多表现为无痛性肉眼血尿。本资料中男女比例为3∶1,发病年龄47~89岁,绝大多数(11/12)有无痛肉眼血尿史,与既往报道相符。
肿瘤大体形态多种多样,可显示为菜花样、息肉样或浸润性生长等,部分病例可伴有溃疡形成;肿块可发生于膀胱壁各部位,在资料中,发生于右侧壁最为常见。
镜下观察显示肿瘤细胞呈浆细胞样、印戒细胞样或淋巴细胞样,细胞片状排列,细胞间粘附性较差,组织学形态类似于浆细胞肿瘤、淋巴瘤及其他低粘附性肿瘤。但多数标本内尚可查见多少不等的高级别尿路上皮癌细胞,因此仔细观察肿瘤形态,尤其是在浆细胞样区域边缘与正常上皮交界处查见异型尿路上皮成分有助于PUC的诊断。免疫组化染色显示尿路上皮标记阳性、CD38阴性均有助于提示尿路上皮来源,而非浆细胞肿瘤。本组研究中所有病例的浆细胞样成分均表达尿路上皮标记CK7,大多数病例表达CK20、P63,所有病例显示淋巴造血肿瘤标记LCA、CD38、CD3、CD20阴性,这些均有助于提示尿路上皮来源[5]。另外,浆细胞肿瘤常用标记物CD138也可以在PUC中阳性表达,此常导致误诊。本组12例样本中即有11例表达CD138阳性。多项研究[6-8]显示CD138实质上为一种粘附分子,并非浆细胞肿瘤的特异性标记物。因此在PUC和浆细胞肿瘤的鉴别诊断中,标记CD38比CD138更有意义。
另外,PUC尚需与以下肿瘤鉴别:(1)恶性黑色素瘤:恶性黑色素瘤细胞也可呈浆细胞样,可散在分布,尤其当缺乏黑色素时易与本病混淆[9]。但恶性黑色素瘤细胞常具有嗜酸性大核仁,免疫组化染色表达HMB45、Melan- A、S- 100阳性,尿路上皮标记阴性。(2)横纹肌肉瘤:膀胱横纹肌肉瘤最常见于儿童,大部分瘤细胞较小,可见胞质丰富、嗜酸性的细胞[10-11],形态上与PUC有类似之处。但PUC多见于中老年人,细胞小至中等大小,免疫组化显示PUC肿瘤细胞MyoDl和Myogenin阴性,尿路上皮标志物阳性。(3)转移性肿瘤:转移性恶性肿瘤常有相关病史,以胃癌和乳腺癌相对较为常见,肿瘤细胞也可弥散分布,可出现核偏位的细胞,与PUC形态类似。仔细观察肿瘤组织,寻找与正常上皮移行处是否存在异型尿路上皮有助于诊断。PUC病例常可查见典型尿路上皮癌细胞,且免疫组化显示为尿路上皮标记阳性。PUC患者具有较差的预后,这可能与PUC具有较高的侵袭性、播散性和较高的阳性切缘发生率有关。
Ricardo-Gonzalez等[12]对15例PUC患者的研究发现,33%的患者在膀胱切除后出现腹腔内转移。转移部位包括直肠前间隙、卵巢和阴道、卵巢和输卵管、肠壁浆膜、大网膜及肠壁浆膜(各1例);并且20%出现后续的浆膜面转移。因此需要认识到PUC可能会出现包括浆膜面在内的腹腔内播散,并确保恰当的术中分期和术后随访。
Kaimaklioti等[13]对510例接受膀胱癌根治的患者进行回顾分析显示,30例患者有阳性输尿管切缘。其中非变异型患者的阳性输尿管切缘出现率为3.7%(17/457),而PUC患者为32.0%(8/25),且有5例出现沿着浆膜下和血管外膜侵袭的特点。在本组研究的4例根治标本中也查见有2例残留输尿管切缘和/或尿道切缘尿路上皮异型增生。提示外科医生和病理科医生都需要警惕外科手术切缘情况。
PUC具有较强的转移潜能,Kaimaklioti等[13]还发现阳性淋巴结在PUC患者中出现的比例比非变异型患者明显高,分别为72%和18.6%。在本资料中的4例根治标本中也有2例出现淋巴结转移,分别为11/18枚和7/14枚,且均为N2。另外有研究还发现即使是浅表的肿瘤也可能具有显著的转移能力。Peck等[14]曾报道1例膀胱浅表PUC,肿瘤累及黏膜下层,胸骨切开活检显示为尿路上皮癌转移灶。因此膀胱PUC具有较高的转移发生率,淋巴结的仔细清扫、查找和术后复查对于PUC患者具有重要意义。
由于PUC具有较高的侵袭性和转移潜能,因此对患者的预后也有较明显的影响。Keck等[15]回顾分析了205例进展性膀胱癌患者,发现PUC患者的整体生存率为(27.4个月),明显低于非变异型患者(62.6个月)(P=0.013),提示此类患者具有较差的临床结局。PUC的播散和转移可能与E-Cadherin表达缺失相关。E-Cadherin是一种细胞粘附分子,其正常表达具有抑制肿瘤扩散作用。在本资料中,钙粘附蛋白E-Cadherin的表达也出现减弱(4/12)或缺失(8/12),与既往研究相符。CDH1杂合性缺失可能导致膀胱尿路上皮癌中E-cadherin细胞膜表达缺失;而SNAI1(20q 13.1)、CCND1(11q13.3)的丢失可能是浆细胞样变异型尿路上皮癌侵袭性生物学行为的共同机制。
综上所述,由于膀胱PUC相对较为少见,且组织学形态与浆细胞瘤有相似之处,尤其是在以该肿瘤成分为主时可能会造成误诊。对于此类病例,首先需要全面仔细观察肿瘤形态及组成成分,与周围上皮的延续情况,查找是否存在高级别尿路上皮癌细胞。免疫组化标记显示尿路上皮标记物CK7、P63、CK20阳性,淋巴造血系统肿瘤标记LCA、CD38、CD3、CD20阴性有助于PUC的诊断;浆细胞肿瘤常用标记物CD138可在多数PUC中阳性表达,不宜作为鉴别诊断标记物,需要谨慎诊断误区。此类肿瘤具有较高的侵袭性、播散性和局部复发率,提示外科医生和病理科医生都需要警惕外科手术切缘情况,并注意淋巴结的清扫和查找,确保恰当的临床、病理分期和术后随访。
[1] Moch H,Humphrey PA,Ulbright TM et al.WHO classification of tumours of the urinary system and male genital organs.2016:80-98.
[2] Eble JN,Sauter G,Epstein JI,et al.世界卫生组织肿瘤分类:泌尿系统及男性生殖器官肿瘤病理学和遗传学.冯晓莉,何群,陆敏,等,译.北京:人民卫生出版社,2006:96-110.
[3] Dayyani F, Czerniak BA, Sircar K, et al.Plasmacytoid urothelial carcinoma, a chemosensitive cancer with poor prognosis, and peritoneal carcinomatosis.J Urol,2013,189(5):1656-1661.
[4] 张伟,蒋艳霞,刘燕,等.膀胱浆细胞样尿路上皮癌16例临床病理特征和预后分析.中华病理学杂志,2013,42(7):433-437.
[5] Rubin BP,Skarin AT,Pisick E,et al.Use of cytokeratins 7 and 20 in determining the origin of metastatic carcinoma of unknown primary,with special emphasis on lung cancer.Eur J Cancer Prev, 2001,10(1):77-82.
[6] Szatmári T, Ötvös R, Hjerpe A, et al. Syndecan-1 in Cancer: Implications for Cell Signaling,Differentiation, and Prognostication.Dis Markers, 2015,27(10):2054-2067.
[7] Raspollini MR, Sardi I, Giunti L, et al. Plasmacytoid urothelial carcinoma of the urinary bladder: clinicopathologic, immunohistochemical, ultrastructural, and molecular analysis of a case series. Hum Pathol, 2011,42(8):1149-1158.
[8] Rawstron AC. Immunophenotyping of plasma cells.Curr Protoc Cytom,2006,6(16):23.
[9] Khan M, O'Kane D, Du Plessis J. Primary malignant melanoma of the urinary bladder and ureter.Can J Urol,2016,23(1):8171-8175.
[10] Chen KW, Wu FM, Lee VK. et al. Embryonal rhabdomyosarcoma of the adult urinary bladder: a rare case report of misclassification as inflammatory myofibroblastic tumor. Case Rep Surg, 2015, 2015(1):1-4.
[11] 刘丽丽,陈云新,叶新青,等.横纹肌肉瘤临床病理及分子遗传学特征研究.中国矫形外科杂志,2014, 22(17):1542-1546.
[12] Ricardo-Gonzalez RR,Nguyen M,Gokden N,et al.Plasmacytoid carcinoma of the bladder: a urothelial carcinoma variant with a predilection for intraperitoneal spread.Urol,2012,187(3):852-855.
[13] Kaimakliotis HZ, Monn MF,Cheng L,et al.Plasmacytoid bladder cancer: variant histology with aggressive behavior and a new mode of invasion along fascial planes.Urology,2014,83(5):1112-1116.
[14] Peck JR, Hitchcock CL, Maguire S, et al. Isolated cardiac metastasis from plasmacytoid urothelial carcinoma of the bladder.Exp Hematol Oncol, 2012,1(1):16.
[15] Keck B,Wach S,Stoehr R,et al.Plasmacytoid variant of bladder cancer defines patients with poor prognosis if treated with cystectomy and adjuvant cisplatin-based chemotherapy. BMC Cancer, 2013,13(3):71.
Objective To study the clinicopathologic features of plasmacytoid urothelial carcinoma(PUC) of the urinary bladder. Methods The clinical and pathologic findings of 12 cases of PUC were retrospectively reviewed.Immuhistochemical study was carried out. The follow-up data were analyzed. Results There were altogether 9 males and 3 females. The age of patients ranged from 47 years to 89 years. These tumors were characterized by the presence of single discohesive malignant cells in a loose or myxoid stroma. The tumour cells have clear or eosinophilic cytoplasm and central or eccentrically placed enlarged,hyperchromatic nuclei with small nucleoli. A component of high-grade urothelial carcinoma was present in about 75% of cases. Immuhistochemical study showed that the tumor cells in most of cases were strongly positive for CK7、P63、CK20. Immunohistochemical stains for lymphoid markers(eg. LCA、CD38、CD3、CD20) have consistently been reported as negative,but the tumours are positive for CD138. Conclusions PUC is a rare variant of urothelial carcinoma with poor prognosis. Its morphology was similar to plasma cell tumor. A component of high-grade urothelial carcinoma is present in many cases.Immunohistochemical staining showed that the urinary tract epithelial markers are positive. Immunohistochemical stains for lymphoid markers are negative,but CD138 should not be used for differential diagnosis.
Plasmacytoid Urothelial carcinoma Immuhistochemistry
210008 南京大学医学院附属鼓楼医院病理科
*通信作者

