以铂类为基础的新辅助化疗疗效与胃癌临床病理特征及泛素特异性蛋白酶39的相关性研究
程海东,莎仁高娃,陈 凛
·论著·
以铂类为基础的新辅助化疗疗效与胃癌临床病理特征及泛素特异性蛋白酶39的相关性研究
程海东,莎仁高娃,陈 凛
【摘要】背景胃癌新辅助化疗是胃癌综合治疗的重要内容,取得了很好的结果,但是仍然有部分患者在治疗期间疾病进展,失去治疗机会。寻找能够预测新辅助化疗疗效的指标是今后研究的热点。目的探讨以铂类为基础的新辅助化疗疗效与胃癌临床病理特征及泛素特异性蛋白酶39(USP39)的相关性。方法选取2012—2013年在中国人民解放军总医院进行以铂类为基础的新辅助化疗的胃癌患者44例为研究对象,采用以铂类为基础的新辅助化疗SOX方案进行治疗,根据治疗效果分为有效组和无效组。收集患者的临床病理资料,采用免疫组织化学及Western blotting法检测USP39的表达。结果44例患者采用以铂类为基础的新辅助化疗SOX方案,其中有效组23例,无效组21例。有效组与无效组患者性别、年龄、病程、血红蛋白、中性粒细胞分数(N)、淋巴细胞分数(L)、血清清蛋白水平及肿瘤部位、肿瘤大小、分化程度、术前化疗疗程比较,差异均无统计学意义(P>0.05)。无效组患者N/L≥3及USP39阳性率高于有效组(P<0.05)。结论以铂类为基础的新辅助化疗治疗胃癌,有效组患者的N/L、USP39低于无效组,N/L、USP39有可能成为预测胃癌以铂类为基础的新辅助化疗疗效的有效分子。
胃癌是严重威胁我国人民身体健康的恶性肿瘤,高致残率、致死率和低生存率是本病的最大特点[1]。目前,胃癌的治疗主要是以手术治疗为主的综合治疗,但是效果并不理想。5年生存率仍是30%左右[2]。为提高胃癌的疗效,应积极寻找新的治疗方案。新辅助化疗是胃癌治疗的热点研究,取得了肯定的效果[3-4]。但是在临床实践中,部分患者在接受新辅助化疗的过程中病情非但没有改善,反而出现进展[5]。所以,寻找高效敏感预测化疗疗效的临床病理指标或分子生物指标来个体化指导胃癌的治疗,是今后的研究重点。泛素水解酶属半胱氨酸蛋白酶家族,其作用是将泛素与蛋白底物分离开,以此来调控泛素化过程。泛素则是一种存在大多数真核细胞的小蛋白,主要作用是标记需要分解的蛋白质,通过泛素化复合链式反应,使其水解泛素水解酶能够作用各级的泛素化复合式链式反应的不同位点,影响生物体内的泛素化,对蛋白质的降解起促进或抑制作用[6]。泛素特异性蛋白酶39(USP39)是新近发现的泛素水解酶,该基因可能与RNA剪切有关,并对保证有丝分裂纺锤体的完整性起关键作用。有报道称,USP39基因的高表达可以影响乳腺癌、肝癌及甲状腺癌等的恶性生物学行为[7-10]。此外,一些临床病理指标在一定程度上可以预测化疗疗效[11]。为了寻找有效预测胃癌新辅助化疗疗效的指标,进行此项研究。
1资料与方法
1.1临床资料选取2012—2013年中国人民解放军总医院进行以铂类为基础的新辅助化疗的胃癌患者44例为研究对象,其中男31例,女13例;年龄21~74岁,平均年龄(56.7±11.3)岁;病程2~12个月,平均病程(5.1±2.2)个月;无心脑血管、呼吸系统严重合并症及梗阻、出血、营养不良等并发症。纳入标准:(1)患者均完成以铂类为基础的新辅助化疗及手术治疗,治疗前病例资料完整;(2)患者均经病理确诊,治疗前病理组织蜡块或术后冷冻病理组织保存良好。排除标准:(1)患者对于铂类化疗药物治疗有过敏反应;(2)患者有未能控制的心力衰竭、肝脏或肾脏疾病;(3)患者有难以控制的细菌、病毒、真菌感染;(4)患者有精神异常等器质性疾病。取44例患者肿瘤病灶癌组织及距离癌组织2 cm远的正常组织。
1.2治疗术前以铂类为基础的新辅助化疗:患者均严格按照SOX方案进行。SOX方案:替吉奥胶囊(S-1) 100~120 mg/d,第1~14天,口服;注射用奥沙利铂130 mg/m2,第1天,静脉滴注,每3周重复1次。如果患者血液学毒副作用达到Ⅲ级或Ⅳ级或非血液毒副作用达Ⅱ级、Ⅲ级或Ⅳ级,调整S-1剂量由120 mg/d减为 100 mg/d,100 mg/d减为80 mg/d,80 mg/d减为60 mg/d,或由于毒副作用而停止给药。随后的剂量根据结果进行调整。注射用奥沙利铂剂量调整如下:由 130 mg/m2调整为100 mg/m2或 85 mg/m2。化疗疗程均为4个疗程。患者完成最后一次化疗休息至少4周进行术前评估,按照日本胃癌规约[12]完成D2手术。
本研究创新点:
胃癌新辅助化疗是目前胃癌综合治疗的临床研究热点,疗效预判是新辅助化疗的难点。寻找能够预测新辅助化疗疗效的指标是本研究的目的。中性粒细胞分数(N)/淋巴细胞分数(L)可以在一定程度上反映人体炎症和免疫状态;泛素特异性蛋白酶39(USP39)可促进肿瘤的增殖、转移、侵袭,抑制其凋亡。本研究通过收集进行以铂类为基础的新辅助化疗胃癌患者的临床病理资料,采用免疫组织化学及Western blotting法检测USP39的表达,探讨N/L、USP39的表达与以铂类为基础的胃癌新辅助化疗疗效的相关性,结果显示,无效组患者N/L≥3及USP39阳性率高于有效组,为今后胃癌综合治疗提供了理论依据。
1.3病理学疗效评价[13]0级:无肿瘤消退;1a级:存活肿瘤细胞占肿瘤区2/3及以上;1b级:存活肿瘤细胞占肿瘤区1/3及以上,但小于2/3;2 级:存活肿瘤细胞占肿瘤区小于1/3;3 级:无存活肿瘤细胞,建议追加切片检查证实结果。其中0级和1级评为无效组,2级和3级评为有效组。
1.4临床病理特征记录患者的性别、年龄、病程、化疗前血生化相关指标〔血红蛋白、中性粒细胞分数(N)、淋巴细胞分数(L)、N/L、血清清蛋白〕及肿瘤部位、肿瘤大小、分化程度、术前化疗疗程。
1.5N/L以N/L=3为临界值,主要参考文献[14-16]。
1.6免疫组织化学法采用LSAB法将术前组织石蜡标本以5 μm厚切片烤干,于二甲苯液中脱蜡,于不同浓度的乙醇溶液中脱水,于3%过氧化氢(H2O2)溶液中消除内源性过氧化物酶的活性,乙二胺四乙酸(EDTA)(pH值=8.0)修复液常规修复,玻片封闭,孵育盒中抗体孵育,抗原暴露,加入山羊血清,依次滴加一抗(anti-USP39,Abcom,工作浓度为1∶100)、二抗、三抗,DBA显色,苏木素复染,烘干封固〔磷酸盐缓冲液(PBS)代替一抗、二抗作为阴性对照〕。
1.7免疫组织化学法结果判定USP39根据染色强度及着色细胞数进行判断:细胞染色强度分为4级,无着色为1级计0分,浅黄色为2级计1分,棕黄色为3级计2分,棕褐色为4级计3分;分别在高倍光镜下随机观察5个不同的视野,根据阳性细胞占细胞总数的百分比分为5个等级:<5%为0级,5%~25%为1级,26%~50%为2级,51%~75%为3级,>75%为4级,分别计为0、1、2、3、4分。采用二者得分乘积判定结果,积分≥2分为USP39阳性,<2分为USP39阴性。
1.8Western blotting法取适量术后冰冻组织匀浆,用RAPI细胞裂解液裂解细胞制备蛋白,Bradford比色法定量。按每孔30 μg蛋白上样,10%十二烷基硫酸钠+聚丙烯酰胺凝胶(SDS+PAGE)在120 V电压下分离,30 V电压将凝胶上的蛋白湿转至硝酸纤维素膜上。5%脱脂奶粉将膜封闭2 h后,加入一抗(USP39,工作浓度为1∶1 000)和小鼠抗人 GAPDH(稀释度为1∶2 000)。4 ℃孵育过夜,TBS-T充分漂洗后加入辣根过氧化物酶标记的二抗,孵育1 h,ECL试剂盒显色,胶片曝光,图像扫描。重复3次。

2结果
2.1有效组与无效组患者临床病理特征比较44例患者采用以铂类为基础的新辅助化疗SOX方案,其中有效组23例,无效组21例。有效组与无效组患者性别、年龄、病程、血红蛋白、N、L、血清清蛋白水平及肿瘤部位、肿瘤大小、分化程度、术前化疗疗程比较,差异均无统计学意义(P>0.05)。无效组患者N/L≥3及USP39阳性率高于有效组,差异有统计学意义(P<0.05,见表1)。
2.2免疫组织化学法结果USP39在肿瘤细胞胞核染色,呈深黄色、棕褐色或棕色颗粒,无效组癌组织中USP39的表达较有效组增加,正常胃黏膜组织中不染色(见图1,本文图1、2彩图见网站www.chinagp.net电子期刊相应文章附见)。
2.3Western blotting法结果以GAPDH为内参,无效组术后癌组织中USP39表达较有效组高(见图2)。
3讨论
随着对胃癌发生、发展机制的深入认识,新药研发、新辅助化疗成为胃癌临床研究的热点[17]。随着欧美、日本等国家多中心临床研究数据的发表,可以肯定的是,胃癌的新辅助化疗疗效得到了很好的效果[18]。新辅助化疗可以降低胃癌肿瘤分期、提高肿瘤根治性切除率,亦可以延长患者的生存期和无疾病进展期,改善患者生存质量[19]。但是,不可否认的是,胃癌是异质性较大的肿瘤,同样的治疗方案可能得到不一样的结局。部分患者新辅助化疗无效,疾病进展失去最佳的根治性手术机会,这是新辅助化疗研究过程中不可回避的现实问题。为此,寻找能够预测新辅助化疗疗效的临床病理、分子生物学指标成为研究重点。

表1 有效组与无效组患者临床病理特征比较
注:N=中性粒细胞分数,L=淋巴细胞分数,USP39=泛素特异性蛋白酶39;a为t值

注:USP39=泛素特异性蛋白酶39
图1免疫组织化学法检测胃癌患者癌组织及正常胃黏膜组织中USP39表达(苏木素-伊红染色)
Figure 1USP39 expression in the gastric cancer tissue and normal gastric mucosa tissue using immunohistochemical method
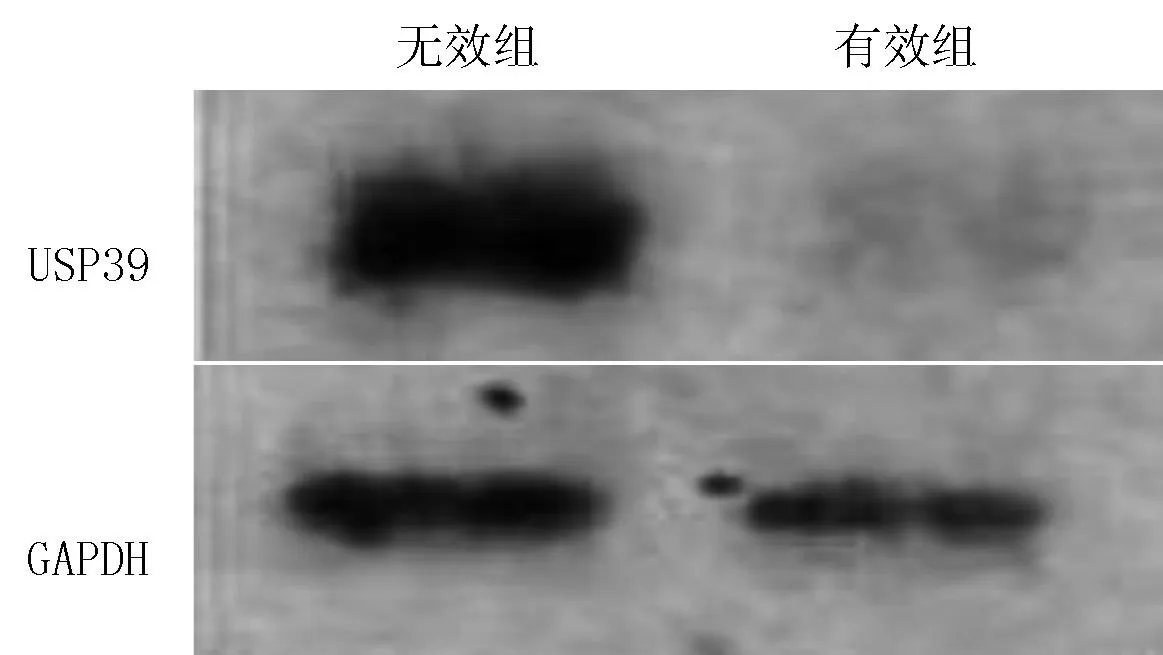
图2 Western blotting法检测术后癌组织中USP39表达
Figure 2USP39 expression of cancer tissue after surgery measured by Western blotting method
近年来,关于炎症与肿瘤的发生的关系引起了学者的注意。有文献报道,由肿瘤介导的炎性反应可以促进肿瘤的转移,此过程可能通过上调炎性递质和细胞因子从而促进肿瘤增殖、肿瘤血管生成、抑制肿瘤凋亡[20]。有研究显示,N/L作为炎症免疫指标,可以作为肿瘤患者生存预后的独立预测因子[14-15],并且与肿瘤化疗疗效显著相关[21]。本研究以N/L=3为临界值,有效组N/L≥3的发生率较无效组降低。N/L作为肿瘤患者预后和化疗疗效预测因子可能与以下因素相关:首先,淋巴细胞是宿主抵御肿瘤细胞的关键,其可有力打击和消除新生肿瘤细胞,肿瘤细胞周围环境中众多的淋巴细胞可以抑制肿瘤的进展,淋巴细胞分数与肿瘤患者预后相关已经得到验证[22]。另外,有研究显示,中性粒细胞可以通过促进肿瘤血管生成和抑制淋巴细胞的活性导致肿瘤的生长和转移[23-24]。有学者探讨其他临床病理指标和肿瘤生物标志物与肿瘤化疗疗效的相关性,证实肿瘤分化程度、肿瘤大小和Lin28等基因与其相关[25]。本研究结果显示,以铂类为基础的新辅助化疗治疗胃癌患者有效组USP39阳性率低于无效组。USP39可以促进乳腺癌、肝癌等肿瘤的增殖、侵袭、转移等恶性生物学行为,亦可以导致肿瘤对药物的耐受性,USP39可能与肿瘤干性的维持和多药耐药有关[3-6],但具体机制仍不清楚。
本研究仍存有不足之处。首先,由于本研究样本量较小并且属于回顾性研究,不能很好的代表新辅助化疗群体,亦不能排除既往服药史对N/L影响等混杂因素,所以有必要设计一个多中心、大样本的前瞻性研究进一步进行验证。另外,USP39在肿瘤中的作用机制仍然不清楚,有待后续的深入研究。
总之,化疗前外周血N/L以及癌组织中USP39的表达在一定程度上可以预测以铂类为基础的新辅助化疗的疗效,随着今后进一步的研究和验证,可为胃癌的综合治疗提供坚实的理论基础。
作者贡献:程海东进行试验设计和实施、资料搜集整理、撰写论文、成文并对文章负责;莎仁高娃进行试验实施、评估、资料收集;陈凛进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2]Allemani C,Weir HK,Carreira H,et al.Global surveillance of cancer survival 1995-2009:analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J].Lancet,2015,385(9972):977-1010.
[3]Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.
[4]Ychou M,Boige V,Pignon JP,et al.Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma:an FNCLCC and FFCD multicenter phase Ⅲ trial[J].J Clin Oncol,2011,29(13):1715-1721.
[5]Cohen DJ,Leichman L.Controversies in the treatment of local and locally advanced gastric and esophageal cancers[J].J Clin Oncol,2015,33(16):1754-1759.
[6]Khaminets A,Behl C,Dikic I.Ubiquitin-dependent and independent signals in aelective autophagy[J].Trends Cell Biol,2015.[Epub ahead of print]
[7]An Y,Yang S,Guo K,et al.Reduced USP39 expression inhibits malignant proliferation of medullary thyroid carcinoma in vitro[J].World J Surg Oncol,2015,13(1):255.
[8]Yuan X,Sun X,Shi X,et al.USP39 promotes the growth of human hepatocellular carcinoma in vitro and in vivo[J].Oncol Rep,2015,34(2):823-832.
[9]Pan Z,Pan H,Zhang J,et al.Lentivirus mediated silencing of ubiquitin specific peptidase 39 inhibits cell proliferation of human hepatocellular carcinoma cells in vitro[J].Biol Res,2015,48:18.
[10]Wang H,Ji X,Liu X,et al.Lentivirus-mediated inhibition of USP39 suppresses the growth of breast cancer cells in vitro[J].Oncol Rep,2013,30(6):2871-2877.
[11]Wang LB,Teng RY,Jiang ZN,et al.Clinicopathologic variables predicting tumor response to neoadjuvant chemotherapy in patients with locally advanced gastric cancer[J].J Surg Oncol,2012,105(3):293-296.
[12]Nakajima T.Gastric cancer treatment guidelines in Japan[J].Gastric Cancer,2002,5(1):1-5.
[13]Becker K,Mueller JD,Schulmacher C,et al.Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy[J].Cancer,2003,98(7):1521-1530.
[14]Jung MR,Park YK,Jeong O,et al.Elevated preoperative neutrophil to lymphocyte ratio predicts poor survival following resection in late stage gastric cancer[J].J Surg Oncol,2011,104(5):504-510.
[15]Shimada H,Takiguchi N,Kainuma O,et al.High preoperative neutrophil-lymphocyte ratio predicts poor survival in patients with gastric cancer[J].Gastric Cancer,2010,13(3):170-176.
[16]Cho IR,Park JC,Park CH,et al.Pre-treatment neutrophil to lymphocyte ratio as a prognostic marker to predict chemotherapeutic response and survival outcomes in metastatic advanced gastric cancer[J].Gastric Cancer,2014,17(4):703-710.
[17]Yoshikawa T,Tsuburaya A,Morita S,et al.A comparison of multimodality treatment:two or four courses of paclitaxel plus cisplatin or S-1 plus cisplatin followed by surgery for locally advanced gastric cancer,a randomized Phase Ⅱ trial (COMPASS)[J].Jpn J Clin Oncol,2010,40(4):369-372.
[18]Lu JY,Xiao Y,Qiu HZ,et al.Clinical outcome of neoadjuvant chemoradiation therapy with oxaliplatin and capecitabine or 5-fluorouracil for locally advanced rectal cancer[J].J Surg Oncol,2013,108(4):213-219.
[19]Basi A,Sohrabkhani S,Zamani F,et al.Comparing efficacy of preoperative neo-adjuvant chemotherapy and surgery versus surgery alone in patients with resectable gastroesophageal cancer[J].Int J Hematol Oncol Stem Cell Res,2013,7(4):24-28.
[20]Balkwill F,Mantovani A.Inflammation and cancer:back to Virchow?[J].Lancet,2001,357(9255):539-545.
[21]Chua W,Charles KA,Baracos VE,et al.Neutrophil/lymphocyte ratio predicts chemotherapy outcomes in patients with advanced colorectal cancer[J].Br J Cancer,2011,104(8):1288-1295.
[22]Martinet L,Garrido I,Filleron T,et al.Human solid tumors contain high endothelial venules:association with T- and B-lymphocyte infiltration and favorable prognosis in breast cancer[J].Cancer Res,2011,71(17):5678-5687.
[23]Di Carlo E,Forni G,Musiani P.Neutrophils in the antitumoral immune response[J].Chem Immunol Allergy,2003,83:182-203.
[24]Shamamian P,Schwartz JD,Pocock BJ,et al.Activation of progelatinase A (MMP-2) by neutrophil elastase,cathepsin G,and proteinase-3:a role for inflammatory cells in tumor invasion and angiogenesis[J].J Cell Physiol,2001,189(2):197-206.
[25]Teng RY,Zhou JC,Jiang ZN,et al.The relationship between Lin28 and the chemotherapy response of gastric cancer[J].Onco Targets Ther,2013,6:1341-1345.
(本文编辑:陈素芳)
【关键词】胃肿瘤;泛素特异性蛋白酶39;中性粒细胞;淋巴细胞;治疗结果
程海东,莎仁高娃,陈凛.以铂类为基础的新辅助化疗疗效与胃癌临床病理特征及泛素特异性蛋白酶39的相关性研究[J].中国全科医学,2016,19(3):277-281.[www.chinagp.net]
Cheng HD,Sha RGW,Chen L.Correlation analysis of the efficacy of neoadjuvant chemotherapy based on platinum and the clinicopathologic features of gastric carcinoma and USP39[J].Chinese General Practice,2016,19(3):277-281.
Correlation Analysis of the Efficacy of Neoadjuvant Chemotherapy Based on Platinum and the Clinicopathologic Features of Gastric Carcinoma and USP39CHENGHai-dong,SHARen-gao-wa,CHENLin.MedicalCenter,TsinghuaUniversity,Beijing100084,China
【Abstract】BackgroundNeoadjuvant chemotherapy is a crucial part of the comprehensive treatment of gastric carcinoma,and it has favorable efficacy.However,there are also some patients who undergo disease progression during the therapy and lose the opportunity for treatment.Finding the indexes that predict the efficacy of neoadjuvant chemotherapy is a hot topic in the future research.ObjectiveTo explore the correlation between the efficacy of neoadjuvant chemotherapy based on platinum and clinicopathologic features as well as the expression of USP39.MethodsA total of 44 patients with gastric cancer who were administrated with neoadjuvant chemotherapy based on platinum in Chinese PLA General Hospital from 2012 to 2013,and neoadjuvant chemotherapy of SOX scheme based on platinum was employed.The patients were divided into effective group and ineffective group according to therapeutic effects.The clinical clinicopathological data,paraffin embedded tissues and fresh frozen cancerous tissues were collected,and USP39 was detected using immunohistochemistry and Western blotting.ResultsNeoadjuvant chemotherapy of SOX scheme based on platinum was undertaken on the 44 patients,among which 23 were of effective group and 21 were of ineffective group.The two groups were not significantly different in gender,age,course of disease hemoglobin,neutrophils score (N),lymphocyte score (L),serum albumin level,tumor site,tumor size,differentiated degree and preoperative chemotherapy treatment course(P>0.05).The ineffective group was higher than effective group in the number of patients with N/L≥3 and the positive rate of USP39 (P<0.05).ConclusionAfter neoadjuvant chemotherapy based on platinum,the effective group is higher than ineffective group in the levels of N/L and USP39.N/L and USP39 may become effective predictors for the efficacy of neoadjuvant chemotherapy based on platinum.
【Key words】Stomach neoplasms;Ubiquitin-specific protease 39;Neutrophil;Lymphocytes;Treatment outcome
(收稿日期:2015-05-16;修回日期:2015-11-03)
【中图分类号】R 735.2
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.03.007
通信作者:陈凛,100853 北京市,中国人民解放军总医院;E-mail:chenlinjfj@sina.com
基金项目:国家自然科学基金资助项目(81272698);国家高技术研究发展计划(863计划)(2012AA02A504)
作者单位:100084 北京市,清华大学医学中心(程海东);内蒙古医科大学基础医学院分子病理实验室(莎仁高娃);中国人民解放军总医院(陈凛)

