食源性钙结合多肽的研究进展
孙殿钦,吕晨艳
(首都医科大学公共卫生学院,北京 100069)
食源性钙结合多肽的研究进展
孙殿钦,吕晨艳*
(首都医科大学公共卫生学院,北京 100069)
钙是维持人体生命活动所必需的常量元素。然而,我国居民膳食中钙的摄入量仅为推荐摄入量的一半,传统补钙制剂存在生物利用率低等缺点,因此开发安全高效的补钙制剂势在必行。食源性钙结合多肽因其天然性更为安全可靠,越来越成为研究的热点。本文对常见的食源性钙结合多肽及其分离纯化、鉴定方法进行综述,以寻找食源性钙结合多肽的新路径,以期为食源性钙结合多肽的制备和开发提供参考。
钙,营养制剂,分离纯化,多肽,食源性
流行病学调查表明,在中国大陆,骨质疏松的患病率在6.6%~19.3%之间[1]。随着我国人口老龄化程度加深,骨质疏松症带来的社会负担也愈来愈沉重。骨质疏松症重在预防,充足的钙吸收是骨骼发育良好的重要条件。然而,2015年国家卫生计生委发布的《中国居民营养与慢性病状况报告(2015)》指出:我国人群中钙、铁等营养素缺乏的问题依然存在[2]。因此,缺钙仍然是我国居民中普遍存在的问题。
目前,市场上钙制剂主要分为无机钙、有机酸钙制剂和氨基酸螯合钙制剂等,然而这些钙制剂都存在一定的缺陷,如无机钙制剂易刺激胃肠道且生物效价低,有机酸钙溶解度大易流失且成本高,氨基酸螯合钙存在潜在的安全问题,长期服用可能会引起人体的负氮平衡[3-4]。因此,开发一类安全高效的补钙制剂是目前亟待解决的问题。近年来,随着研究的深入,从食品中提取出的一些生物活性肽和蛋白质已引起研究者的普遍关注。食源性钙结合多肽是一类具有钙结合特性的活性肽,其可通过酶解食品中的蛋白质得到,可应用于功能食品以补充人体钙质。此外,有毒性评价实验表明活性肽为实际无毒类物质[5],安全可靠。
1 常见的食源性钙结合多肽
1.1 酪蛋白磷酸肽(casein phosphopeptides,CPPs)
CPPs是牛乳酪蛋白经酶水解得到的生物活性多肽。CPPs分布于β,αs1,αs2酪蛋白的不同区域,不同的酶作用于酪蛋白则生成不同的CPPs,CPPs的相对分子质量和磷酸解离常数也不同。然而,这些CPPs都含有一段特殊序列即-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-,构成一个酸性区域(图1)[6]。这个酸性区域是金属离子尤其是Ca2+结合的主要区域,也是其发挥生物活性必不可少的部分。在小肠后段pH为7~8的条件下,酸性区域中的磷酸基团参与构成的β折叠带有高密度负电荷,CPPs以离子键与Ca2+结合形成可溶物,从而有效阻止磷酸钙沉淀的形成。据报道,pH为7.40时,每摩尔CPP可以结合(2.44±0.01) mol Ca2+[7]。

图1 酪蛋白中磷酸化多肽的氨基酸序列[6]Fig.1 Amino acid sequence of the casein derived phosphopeptides[6]
大量的体内体外实验证明CPPs具有促进钙吸收的功效[8],但是,目前CPPs促进钙吸收的机制仍不清楚。一些研究学者认为CPPs主要是与钙结合成可溶性复合物,从而促进钙在小肠下段通过细胞旁途径被动扩散吸收[9]。此外,也有研究表明CPPs可以作用于细胞膜上的离子通道而影响钙离子的转运[10]。然而,在体内实验中,Teucher等人通过15位成年人参与的随机交叉实验得出:在排除CPPs-Ca提供的钙源影响后,CPPs对人体钙的吸收并无帮助[11]。这可能是由于CPPs来源、剂量、制备纯化工艺的差异,体内一些螯合剂,如草酸、单宁酸对钙吸收的影响以及实验对象体质健康情况的不同造成的。例如,CPPs对全麦粥中钙的吸收没有促进作用可能是因为食物中植酸的影响[12]。同时,CPPs与Ca的比例以及CPPs磷酸丝氨酸残基的数量和位置也会影响CPPs促进钙吸收的效果[13-14]。由此可见,CPPs对钙吸收的促进作用会受到多种因素的影响,只有进一步阐明其作用机理,才能充分利用CPPs促进钙吸收的功效。
此外,CPPs对铁、锌等矿物元素的吸收利用也有促进作用,这也是其优于其他补钙制剂的特性之一[15]。最重要的是,CPPs通过了毒理学评价,被认为是可以安全食用的实际无毒物质[16]。因此,CPPs作为补钙制剂在食品领域拥有广阔的发展前景。
1.2 卵黄高磷蛋白磷酸肽(phosvitin phosphopeptides,PPPs)
卵黄高磷蛋白(Phosvitin,PV)是禽类卵黄中一类磷酸化糖蛋白,是已知蛋白中磷酸化程度最高的蛋白质。PV的氨基酸序列如图2所示,PV中大约55%的氨基酸为丝氨酸,其中近80%的丝氨酸被磷酸化[17]。磷酸化丝氨酸以成串形式存在,最多串联可达14个,形成的多聚磷酸化丝氨酸区域即为卵黄高磷蛋白的核心(图2)。Ishikawa等研究发现PV使鸡蛋中Fe、Ca、Mg等金属离子的生物利用度明显降低,这可能是由金属离子与PV结合形成不溶物而引起的[18]。然而,研究发现其酶解产物卵黄高磷蛋白磷酸肽(PPPs)有促进金属离子吸收的作用[19]。PPPs的分子大小会影响其与Ca2+结合的能力,相比CPPs,分子质量为1~3 ku的PPPs结合钙的能力更强[20]。由此可见,PPPs作为补钙制剂有很大的开发潜力。然而,PPPs在体内外的吸收情况及其安全性还有待进一步研究。

图2 卵黄高磷蛋白一级结构示意图[21]Fig.2 Schematic of phosvitin primary structure[21]
1.3 大豆肽(soybean protein hydrolysates,SPHs)
除了磷酸化的丝氨酸残基可以与钙结合外,蛋白质或多肽也可以通过谷氨酸、天冬氨酸残基的羧酸基团结合钙而发挥促进钙吸收的作用[22]。占大豆蛋白质组成34%的11S大豆球蛋白(Glycinin)含有大量谷氨酸和天冬氨酸(图3)。前期研究表明,SPHs具有结合钙形成可溶复合物的能力,SPHs相对分子质量越大可以结合的钙越多[23]。此外,在Caco-2细胞模型上,SPHs-Ca复合物可以促进钙的吸收[23]。在大鼠模型上,SPHs也可以促进钙在大鼠肠道中的吸收[24]。与此同时,研究还发现SPHs-Ca复合物对快速生长的大鼠的骨质积累有着积极影响[25]。
目前,Lv等人利用固定金属离子亲和色谱法(immobilized metal ion affinity chromatography,IMAC)证明SPHs的钙结合能力与氨基酸组成有关:在SPHs与钙结合时谷氨酸、谷氨酰胺、赖氨酸和脯氨酸可能扮演了重要角色[26]。并且,Liu等人的研究表明大豆肽的聚合对其钙结合能力也有重要影响[27]。然而,SPHs-Ca复合物在人体的吸收机制还不清楚,有待深入研究。
1.4 其他
我国蕴藏着丰富的渔业资源,连续十几年水产品总量位居世界第一。然而我国水产加工比例仍然较低,无法直接食用的鱼卵、鱼鳞、鱼骨等被废弃,造成资源的极大浪费。前期学者对水产品的加工进行了大量的研究,其中便有研究者从水产品中分离纯化出钙离子结合肽,为天然肽钙制剂的制备提供了更多的选择,表1进行了部分列举。并且,研究人员通过大鼠实验证实来自罗非鱼鱼鳞、长尾鳕骨干、鲤鱼卵的蛋白水解产物都具有和CPPs相当的促钙吸收的能力[28-30],具备开发成补钙制剂的潜能。
最近,研究人员还在乳清蛋白、牛血清蛋白和大麦的蛋白水解产物中分离提取到了钙结合多肽[31-33]。然而,它们对生物体钙吸收的影响还有待进一步的研究。除此之外,研究人员还从植物中分离纯化了天然高钙结合蛋白:石榴种子III型几丁质酶和水溶性葡萄籽11S球蛋白[34-35],这拓宽了天然植源性补钙剂的来源,为不同饮食习惯的人提供了更多的选择。
2 食源性钙结合多肽的分离纯化
蛋白水解酶和酶解条件的选择是影响活性肽生理功能和产率的重要因素。

表1 来源于水产品的钙结合多肽
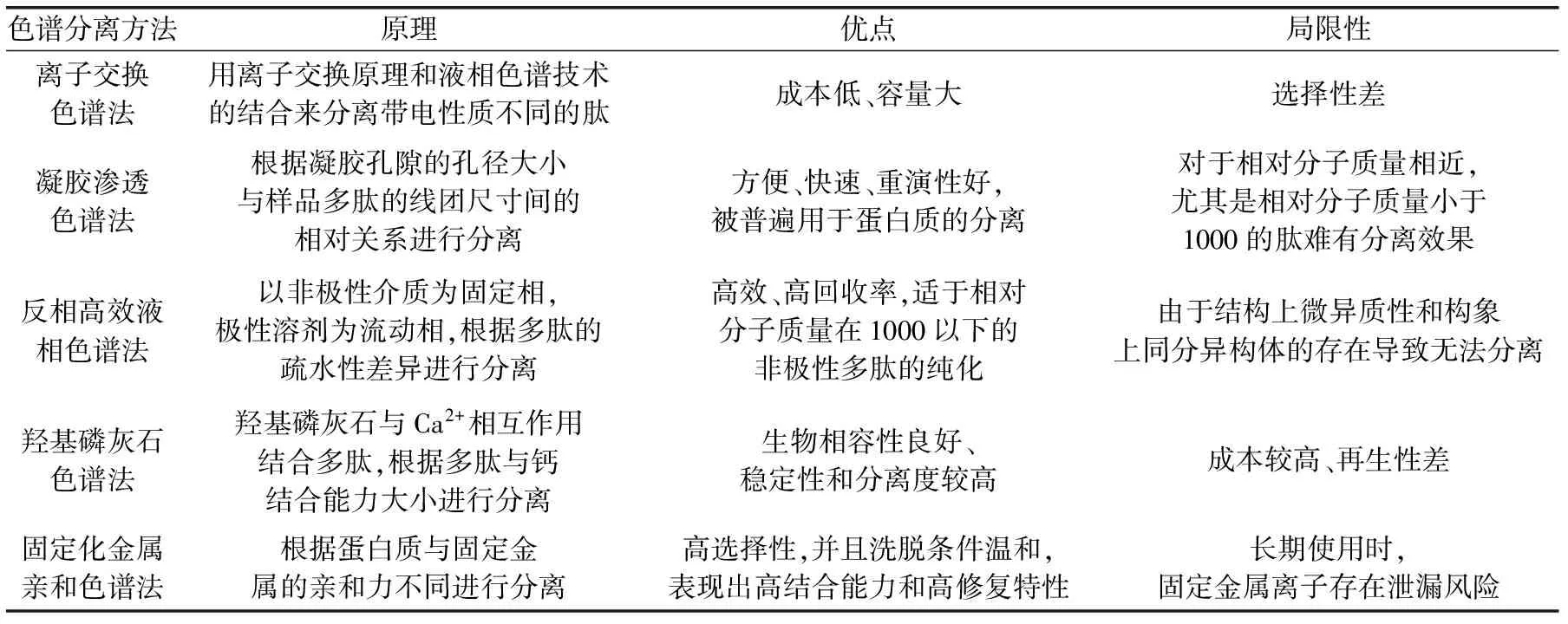
表2 食源性钙结合多肽分离纯化常用色谱及其特点
目前,在筛选蛋白水解酶时,主要通过利用不同性质的水解酶进行酶解,跟踪测定水解度以及目标活性,最终确定所用酶。但此法存在一定的盲目性,需要花费大量时间,不适用于大规模筛选食源性蛋白质和所需酶。一些研究者利用生物信息学技术对蛋白水解酶的筛选进行了优化,如彭等利用模拟酶切软件peptidecutter,对已知序列的酪蛋白进行模拟酶切并建立酶解肽库,以生成的寡肽数量为指标初步选出适用酶,节约了成本和时间[41]。Raus等利用模拟酶切软件protein cutter对蛋白质进行酶切,并对所获得的肽段相对分子质量、等电点、氨基酸组成以及疏水性进行了分析[42]。这提示模拟酶切数据库在活性肽来源蛋白质的筛选和食源性钙结合多肽的酶解优化中可发挥更大作用。
从水解产物中得到钙结合多肽需要通过一系列的色谱分离方法进行纯化。这些色谱分离方法主要包括固定化金属亲和色谱法(immobilized metal ion affinity chromatography,IMAC)、凝胶渗透色谱法(gel permeation chromatography,GPC)、离子交换色谱法(ion exchange chromatography,IEC)、反相高效液相色谱法(reversed-phase high performance liquid chromatography,RP-HPLC)和羟基磷灰石色谱法(hydroxyapatite affinity,HA),这些方法的原理、优点和局限性如表2所示。
实际应用中,单一的分离方法很难达到预期分离效果,往往需要充分利用样品分子的各种理化特性,通过多种不同的色谱分离机制,在每一个分离维度上都尽量达到较好的分离效果,从而有效降低样品的复杂程度。如Chen等人联用HA、GPC以及RP-HPLC从罗非鱼鱼鳞蛋白的水解产物中提取到较纯的钙结合多肽[29]。由于目标多肽是具有钙结合特性的活性肽,研究人员多选用IMAC和HA作为色谱分离的第一步[26,37,40],同时,IMAC和HA都是温和、非变性的色谱分离方法。Zhang等运用磁性硫酸软骨素钠取代IMAC的固体基质部分,得到与传统提纯方法相比更高纯度的PPPs,并且避免了有机溶剂的使用[43]。而IEC和GPC作为传统可靠的色谱分离方法,在食源性钙结合多肽的分离纯化中被广泛运用,其往往被用于IMAC和HA之后,依据带电性质和相对分子质量大小对样本进行分离[44]。
近年来,液相色谱-串联质谱以及基质辅助激光解吸电离飞行时间质谱也开始逐渐应用到食源性钙结合多肽的结构鉴定,并辅以质谱数据解析软件protein pilot极大的提高了结构鉴定效率[26,29]。该技术将高效液相色谱的强分离性能与质谱的强定性优势相结合,适用于复杂食源性蛋白酶解产物的分离和鉴定。Sabine L等验证了液相色谱-串联质谱联用技术分离复杂样品中较小相对分子质量多肽的可行性[45]。Ren等也运用液相色谱-串联质谱联用和质谱多反应监测技术高效鉴定出卵黄高磷蛋白酶解产物中32个含十个以上磷酸基团的钙结合多肽[46]。
由于食源性蛋白酶解产物组分复杂,而且相对分子质量相近或带电性质相似的肽段难以进行分离纯化,给后续的结构鉴定带来了巨大的难题。现有方法存在工作量大,纯化过程会影响活性肽的性能等缺点。因此,食源性钙结合多肽的高效纯化与结构鉴定是获得高活性目标肽的研究瓶颈之一。
3 食源性钙结合多肽的鉴定
食源性钙结合多肽的鉴定方法主要是酶解、超滤、多维色谱、串联质谱等,过程复杂,并且存在一定的盲目性。近年来随着生物信息学的发展,其研究工具在多个领域逐渐被广泛地运用。在生物活性肽领域,研究者们借鉴定量构效关系(quantitative structure activity relationship,QSAR)、模拟酶切软件和肽数据库等生物信息学工具进行了有益的探索[47]。邹等人运用模拟酶切软件对菜籽蛋白进行酶切后得到样品肽集,通过QSAR模型预测肽的IC50值进行初筛,结合NANO-Q-TOF质谱技术寻找出6条目标多肽,并将目标多肽与血管紧张素转化酶的Zn2+活性中心进行水合分子对接,筛选出一条未报道过的高活性血管紧张素转化酶抑制肽[48]。这为食源性钙结合多肽的开发提供了新思路:研究者可运用计算机模拟酶切软件得到肽集,结合分子对接以及QSAR模型对多肽活性进行预测和筛选,并通过质谱技术对水解液中的多肽进行鉴定,寻找筛选出的目标多肽。这一方法将大大提高筛选食源性钙结合多肽的效率,降低技术成本。
到目前为止,虽已有大量食源性钙结合多肽的序列被阐明,但食源性钙结合多肽没有固定结构,其QSAR模型仍未建立。目前认为,钙结合多肽的钙结合位点主要有磷酸基团-钙和羧基-钙两种模式。磷酸基团-钙结合模式的代表肽为酪蛋白磷酸肽和卵黄高磷蛋白磷酸肽,磷酸丝氨酸残基占二者氨基酸组成的较大比重。当对CPPs和PPPs进行脱磷处理,其结合钙活性基本丧失,充分说明磷酸丝氨酸残基在肽钙结合中发挥的重要作用[49]。大豆肽是羧基-钙结合模型的代表肽,11S大豆球蛋白(Glycinin)含有大量谷氨酸和天冬氨酸。Bao认为谷氨酸和天冬氨酸的羧基是大豆肽与钙的结合位点[50],而Lv的研究表明,在SPHs与钙结合时谷氨酸、谷氨酰胺、赖氨酸和脯氨酸可能扮演了重要角色[26]。除氨基酸组成外,多肽相对分子质量的大小也会影响其钙结合能力[20]。然而,到目前为止,关于钙结合多肽的构效关系还没有公认的结论,有待进一步研究。
4 展望
近年来,关于食源性钙结合肽的研究有了较大进展。越来越多食源性钙结合多肽被发现,这为阐明其构效关系奠定了基础,也预示着钙结合多肽在营养食品领域拥有广阔的发展前景。然而,食源性钙结合多肽作为补钙制剂推广仍面临诸多挑战。目前,虽已在动物身上进行多次实验以验证食源性钙结合多肽的补钙效果[24-25,28-30],其对人体钙吸收的影响仍缺乏大规模的临床证据。此外,生物信息学技术的发展为高效寻找高活性食源性钙结合多肽开辟一条新途径,也为食源性钙结合多肽的纯化和鉴定提供工具支持。因此,开展临床实验以验证食源性钙结合多肽补钙效果,借鉴先进工具以推动钙结合多肽构效关系的阐明和工业化生产,是未来研究发展的方向。
[1]Wang Y,Tao Y X,Hyman M E,et al. Osteoporosis in china[J]. Osteoporosis International,2009,20(10):1651-1662.
[2]中华人民共和国国家卫生和计划生育委员会. 中国居民营养与慢性病状况报告(2015年)[R]. 北京:中华人民共和国国务院新闻办公室,2015.
[3]薛荣涛,李翠芹,何腊平. 复合氨基酸螯合钙的研究进展[J]. 食品工业科技,2014,35(21):390-394.
[4]蒋金来,王令充,吴皓,等. 钙制剂研究进展[J]. 食品工业科技,2012,33(11):379-382,387.
[5]陈锦瑶,张立实. 生物活性肽的安全性评价研究进展[J]. 毒理学杂志,2013(2):142-146.
[6]Bouhallab S D,Bougl D. Biopeptides of milk:Caseinophosphopeptides and mineral bioavailability[J]. Reproduction Nutrition Development,2004,44(5):493-498.
[7]Mekmene O,Gaucheron F. Determination of calcium-binding constants of caseins,phosphoserine,citrate and pyrophosphate:A modelling approach using free calcium measurement[J]. Food Chemistry,2011,127(2):676-682.
[8]Perego S,Del F E,De Luca P,et al. Calcium bioaccessibility and uptake by human intestinal like cells followinginvitrodigestion of casein phosphopeptide-calcium aggregates[J]. Food & Function,2015,6(6):1796-1807.
[9]Ryuichiro S,Masanori S,Hiromi G,et al. Characterization of phosphopeptide derived from bovineβ-casein:An inhibitor to intra-intestinal precipitation of calcium phosphate[J]. Biochimicaet Biophysica Acta,1991,1077(3):413-415.
[10]Silvia P,Stefania C,Amelia F,et al. Casein phosphopeptides modulate proliferation and apoptosis in HT-29 cell line through their interaction with voltage-operated L-type calcium channels[J]. Journal of Nutritional Biochemistry,2012,23(7):808-816.
[11]Teucher B,Majsak-Newman G,Dainty J R,et al. Calcium absorption is not increased by caseinophosphopeptides[J]. American Journal of Clinical Nutrition,2006,84(1):162-166.
[12]Marvin M H,Brittmarie S,Michael F J,et al. Casein phosphopeptides improve zinc and calcium absorption from rice-based but not from whole-grain infant cereal.[J]. Journal of Pediatric Gastroenterology and Nutrition,1997,24(1):56-62.
[13]Hong Z,Lijuan P,Saisai Z,et al. Effects of molecular structure on the calcium-binding properties of phosphopeptides[J]. European Food Research and Technology,2012,235(5):811-816.
[14]Daniela E,Salvatore C,Giulio T. Effect of the ratio of casein phosphopeptides to calcium(w/w)on passive calcium transport in the distal small intestine of rats[J]. Nutrition,2002,18(9):743-746.
[15]Divya P,A J L. Preparation of caseinophosphopeptides and assessing their efficacy in enhancing the bioaccessibility of iron and zinc[J]. Journal of Food Science and Technology-Mysore,2015,52(11):7493-7499.
[16]谢玮,宫学诗. 酪蛋白磷酸肽的毒性研究[J]. 预防医学文献信息,2003,9(5):573-574.
[17]Bm B,Adv S,Jam V,et al. Amino-acid-sequence of phosvitin derived from the nucleotide-sequence of part of the chicken vitellogenin gene[J]. Biochemistry,1984,23(19):4275-4279.
[18]Satoshi I,Shigeru T,Keizo A,et al. Egg yolk protein and egg yolk phosvitin inhibit calcium,magnesium,and iron absorptions in rats[J]. Journal of Food Science,2007,72(6):S412.
[19]王飞,刘静波,林松毅,等. 卵黄高磷蛋白磷酸肽-钙对受试小鼠钙表观吸收率的影响[J]. 食品科学,2008,29(12):654-657.
[20]Jiang B,Mine Y. Phosphopeptides derived from hen egg yolk phosvitin:Effect of molecular size on the calcium-binding properties[J]. Biosci Biotechnol Biochem,2001,65(5):1187-1190.
[21]Anton M,Castellani O,Guérin-Dubiard C.Phosvitin[M].Berlin,Heidelberg:Springer Berlin Heidelberg,2007:17-24.
[22]Charoenphun N,Cheirsilp B,Sirinupong N,et al. Calcium-binding peptides derived from tilapia(Oreochromis niloticus)protein hydrolysate[J]. European Food Research and Technology,2013,236(1):57-63.
[23]Lv Y,Bao X L,Yang B C,et al. Effect of soluble soybean protein Hydrolysate-Calcium complexes on calcium uptake by caco-2 cells[J]. Journal of Food Science,2008,73(7):H168-H173.
[24]Kumagai H,Koizumi A,Suda A,et al. Enhanced calcium absorption in the small intestine by a phytate-removed deamidated soybean globulin preparation[J]. Bioscience,biotechnology,and biochemistry,2004,68(7):1598-1600.
[25]Lv Y,Liu H,Ren J,et al. The positive effect of soybean protein hydrolysates—calcium complexes on bone mass of rapidly growing rats[J]. Food & Function,2013,4(8):1245-1251.
[26]Lv Y,Bao X L,Liu H,et al. Purification and characterization of caclium-binding soybean protein hydrolysates by Ca2+/Fe3+immobilized metal affinity chromatography(IMAC)[J]. Food Chemistry,2013,141(3):1645-1650.
[27]Liu H,Lv Y,Xu J T,et al. Soybean peptide aggregates improved calcium binding capacity[J]. LWT-Food Science and Technology,2016,67:174-180.
[28]Jung W,Lee B,Kim S. Fish-bone peptide increases calcium solubility and bioavailability in ovariectomised rats[J]. British Journal of Nutrition,2006,95(1):124.
[29]Chen D,Mu X,Huang H,et al. Isolation of a calcium-binding peptide from tilapia scale protein hydrolysate and its calcium bioavailability in rats[J]. Journal of Functional Foods,2014,6:575-584.
[30]黄海,李八方,刘尊英,等. 鱼卵肽钙复合物对大鼠体内促钙吸收作用的研究[J]. 食品工业科技,2014,35(3):331-335.
[31]Huang S L,Zhao L N,Cai X X,et al. Purification and characterisation of a glutamic acid-containing peptide with calcium-binding capacity from whey protein hydrolysate[J]. Journal of Dairy Research,2015,82(1):29-35.
[32]Jihye L,Dongwon C,Kyungbin S. Isolation of Calcium-Binding Peptides from Barley Protein Hydrolysates[J]. 2012,19(3):438-442.
[33]Dongwon C,Jihye L,Hohyun C,et al. Isolation of a calcium-binding peptide from bovine serum protein hydrolysates[J]. Food Science and Biotechnology,2012,21(6):1663-1667.
[34]吕晨艳,赵广华. 葡萄籽中水溶性钙结合蛋白的分离和鉴定[J]. 农业工程学报,2015(2):319-323.
[35]Yang H X,Zhang T,Masuda T,et al. Chitinase III in pomegranate seeds(Punica granatum Linn.):A high-capacity calcium-binding protein in amyloplasts[J]. The Plant Journal,2011,68(5):765-776.
[36]Huang G,Ren L,Jiang J. Purification of a histidine-containing peptide with calcium binding activity from shrimp processing byproducts hydrolysate[J]. European Food Research and Technology,2011,232(2):281-287.
[37]Jung W,Karawita R,Heo S,et al. Recovery of a novel Ca-binding peptide from Alaska Pollack(Theragra chalcogramma)backbone by pepsinolytic hydrolysis[J]. Process Biochemistry,2006,41(9):2097-2100.
[38]Jung W,Kim S. Calcium-binding peptide derived from pepsinolytic hydrolysates of hoki(Johnius belengerii)frame[J]. European Food Research and Technology,2007,224(6):763-767.
[39]Guo L,Harnedy P A,O Keeffe M B,et al. Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J]. Food Chemistry,2015,173:536-542.
[40]Huang H,Li B F,Liu Z Y,et al. Purification of a novel oligophosphopeptide with high calcium binding activity from carp egg hydrolysate[J]. Food Science and Technology Research,2014,20(4):799-807.
[41]彭莉娟,王伟,张赛赛,等. 基于模拟酶切的酪蛋白定向酶解探究[J]. 食品工业科技,2012,33(3):214-216.
[43]Zhang J,Sun J,Liu Y T,et al. Separation and purification of phosvitin phosphopeptides using immobilized metal affinity nanoparticles[J]. Journal of Chromatography B,2012,893-894:121-126.
[44]Guo L D,Harnedy P A,Li B F,et al. Food protein-derived chelating peptides:Biofunctional ingredients for dietary mineral bioavailability enhancement[J]. Trends in Food Science & Technology,2014,37(2):92-105.
[45]Lahrichi S L,Affolter M,Zolezzi I S,et al. Food Peptidomics:Large scale analysis of small bioactive peptides—a pilot study[J]. Journal of Proteomics,2013,88:83-91.
[46]Ren J D,Li Q Y,Offengenden M,et al. Preparation and characterization of phosphopeptides from egg yolk phosvitin[J]. Journal of Functional Foods,2015,18:190-197.
[47]于志鹏,薛如阳,赵文竹,等. 肽组学在食源性活性肽研究中应用的进展[J]. 食品工业科技,2016(4):382-385.
[48]邹平,何国庆,吴建平. 基于生物信息学,qsar及分子对接的菜籽ace抑制肽筛选[J]. 食品工业科技,2014(17):71-74.
[49]West D W. Structure and function of the phosphorylated residues of casein[J]. Journal of Dairy Research,1986,53(2):333-352.
[50]Bao X L,Lv Y,Yang B C,et al. A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J]. Journal of Food Science,2008,73(3):C117-C121.
Research progress of calcium-binding peptides from foodstuffs
SUN Dian-qin,LV Chen-yan*
(School of Public Health,Capital Medical University,Beijing 100069,China)
Calcium is an essential element of the human body,and plays a significant role in health. However,the dietary intake of calcium in China is only half of the recommended intakes. Considering the low bioavailability of traditional calcium supplements,developing the safe and efficient calcium supplements is imperative. Calcium-binding peptides from foodstuffs are safer and more reliable,which have caused the extensive concern of researchers. In this review,several typical calcium-binding peptides from foodstuffs,and methods of purification,identification and structural analysis had been summarized,which would provide reference for the application of calcium-binding peptides in functional food.
calcium;supplement;isolation and purification;peptide;from foodstuffs
2016-07-08
孙殿钦(1996-),男,本科生,研究方向:食品营养,E-mail:mr_sped@126.com。
*通讯作者:吕晨艳(1988-),女,博士,讲师,研究方向:食品营养,E-mail:lvchenyan1010@163.com。
首都医科大学优秀青年教师国内交流项目。
TS201.4
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

