单核细胞趋化蛋白-1 A-2518G基因多态性与2型糖尿病及葡萄糖耐量异常的关系▲
陈 冰 王美宁 何海宁 黄勇奇 蒋杰球 唐智清 刘巧玲
(1 广西医科大学附属南宁市第一人民医院内科,南宁市 530022,E-mail:bbc12306@hotmail.com;2 南方电网公司医务所;3 广西医科大学生化教研室;4 广西医科大学第一附属医院检验科,南宁市 530022)
论著·临床研究
单核细胞趋化蛋白-1 A-2518G基因多态性与2型糖尿病及葡萄糖耐量异常的关系▲
陈 冰1王美宁1何海宁2黄勇奇3蒋杰球4唐智清1刘巧玲1
(1 广西医科大学附属南宁市第一人民医院内科,南宁市 530022,E-mail:bbc12306@hotmail.com;2 南方电网公司医务所;3 广西医科大学生化教研室;4 广西医科大学第一附属医院检验科,南宁市 530022)
目的 探讨单核细胞趋化蛋白-1(MCP-1)A-2518G基因多态性与葡萄糖耐量异常(IGT)、新发2型糖尿病(T2DM)的关系。方法 对111例健康人(NC组)、82例IGT患者(IGT组)及76例新发T2DM患者(T2DM组)采用聚合酶链反应-限制性片段长度多态性技术,观察MCP-1A-2518G基因多态性,分析其与IGT和T2DM的关系。结果 IGT、T2DM组与NC组的MCP-1等位基因和基因频率比较差异无统计学意义(P>0.05),logistic回归分析结果显示,腰臀比、胰岛素抵抗指数、MCP-1 AA是IGT及新发T2DM发病的独立危险因素(P<0.05)。结论 MCP-1 A-2518G基因多态性可能参与IGT及新发T2DM的发病机制,AA基因携带增加人群IGT及新发T2DM的患病风险。
2型糖尿病;葡萄糖耐量异常;单核细胞趋化蛋白-1;胰岛素抵抗;基因多态性
糖耐量异常(impaired glucose tolerance,IGT),也称为糖尿病前期,是介于正常血糖和2型糖尿病(type 2 diabetes mellitus,T2DM)的中间血糖状态,与T2DM一样是以胰岛素抵抗及胰岛素分泌异常为特征的慢性代谢性疾病[1]。胰岛素抵抗是IGT及T2DM发病的重要环节,也是代谢综合征的基础障碍。肥胖是导致胰岛素抵抗的重要因素。研究发现肥胖及T2DM患者循环血中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1)等水平升高,体重减轻可以降低这些免疫介质的水平[2-3]。鼠动物模型研究发现鼠脂肪组织MCP-1表达增高,MCP-1通过减少脂质堆积、蛋白酪氨酸磷酸化、葡萄糖转运蛋白4表达及胰岛素刺激的葡萄糖摄取等多方面影响脂肪细胞的代谢[4]。在人体的研究发现,IGT及T2DM患者血浆MCP-1水平升高[3,5],这些研究表明脂肪组织细胞浸润与肥胖相关的胰岛素抵抗有关。
不同的遗传背景在趋化因子中的表达是造成个体之间炎症严重程度差异的主要原因。人MCP-1的转录在5′未翻译区内受两个不同区域的调控。其远端含有两个核转录因子-kB(nuclear factor-kB,NF-kB)结合区,是独立于细胞因子调节所必需的,而近端区域含有一个GC盒,主要是为了调节组织特异表达。在-2518位置一个常见的A→G的基因变异在远端调节区调控MCP-1表达[5]。已有研究报告该基因变异与T2DM、胰岛素抵抗[5]、心血管疾病[6]相关。本研究存在探讨MCP-1 A-2518G基因多态性与IGT、T2DM的关系。
1 资料与方法
1.1 研究对象 抽取2006年7月及2013年5~8月在我院体检的健康人群111例为正常对照组(NC组),其中男62例,女49例,年龄33~62(47.31±6.94)岁,均无糖尿病、心血管疾病,无其他内分泌及代谢系统疾病,无感染、无糖尿病家族史。选取同期IGT患者(IGT组)82例,其中男48例,女34例,年龄42~65(52.15±5.12)岁,新发T2DM患者(T2DM组)76例,其中男36例,女40例,年龄46~66(54.67±4.29)岁,IGT及T2DM组符合1999年世界卫生组织糖尿病诊断标准[7]。T2DM患者均为首次诊断患者,彼此间无亲缘关系,T2DM组及IGT组无明显的慢性肝脏疾病及其他内分泌代谢系统疾病,无其他炎症疾病,无糖尿病酮症,排除使用胰岛素、糖皮质激素类药物的患者。
1.2 研究方法
1.2.1 临床及生化检查:受试者均空腹过夜,次日晨采集前臂肘静脉血测定空腹血糖(fasting plasma glucose,FPG)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、胰岛素(insnlin,Ins)浓度。所有受试者行75 g葡萄糖耐量试验,服糖后2 h再取血测血糖。采用日立7600全自动生化分析仪测定,血浆Ins浓度采用放射免疫法测定。胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=[FBG(mmol/L)×Ins(mU/L)]/22.5。测量受试者的身高和体重,计算体重指数(body mass index,BMI):体重(kg)/[身高(m)]2。同时测量收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),测量腰围、臀围以计算腰臀比(waist/hip ratio,WHR)。
1.2.2 MCP-1基因型检测:基因变异的鉴定使用聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)方法分析。(1)引物的序列[5],上游引物为5′-CCG AGA TGT TCC CAG CAC AG-3′,下游引物为5′-CTG CTT TGC TTG TGC CTC TT-3′(北京三博远志生物公司合成)。(2)DNA提取:所有受试者均空腹过夜,次日晨采集前臂静脉血2 ml,加入乙二铵四乙酸二钠抗凝,用全血基因组DNA小量快速提取试剂盒(北京三博远志生物公司)提取DNA,提取方法按照试剂盒中的说明进行。(3)扩增:PCR体系:25 μl PCR反应体系中,基因组DNA(200 ng) 1 μl,脱氧核苷三磷酸(dNTP)1 μl,DNA聚合酶0.25 μl,10×PCR缓冲液3 μl,MgCl21 μl,双蒸水17.75 μl,上下游引物各0.5 μl。PCR反应条件:95℃预变性2 min,95℃变性45 s,52℃退火30 s,72℃延伸 45 s,共35个循环,最后72℃进一步延伸5 s。(4)酶切:20 μl体系:双蒸水7 μl,10×缓冲液2 μl,Pvu Ⅱ(美国Fergmentas)1 μl,PCR产物10 μl。加样后离心,置37℃温箱中酶切3 h,取出后立即-20℃保存。(5)电泳:取酶切产物10 μl进行1.7%琼脂糖凝胶电泳(Agarose,上海根生生物公司Biowest原装),琼脂糖凝胶中包括终浓度为0.5 mg/L溴化乙啶(用于染色)。在水平电泳槽中,70 V电泳约30 min,以DNA片段长度标准物(100 bp梯标记)为参考,紫外灯下观察结果。
1.3 统计学分析 采用统计软件SPSS 17.0进行统计分析。计量资料以(x±s)表示,两组间比较采用成组t检验,三组间比较采用方差分析,非正态分布或方差不齐时采用秩和检验;影响因素的分析采用logistic回归分析。遗传平衡吻合度检验群体基因型频率分布是否符合Hardy-Weinberg平衡定律。以P<0.05为差异有统计学意义。
2 结 果
2.1 MCP-1 A-2518G基因型的等位基因频率分布比较 本研究对IGT和T2DM组及NC组进行Hardy-Weinberg平衡吻合度检验,NC组χ2=2.673,P=0.080,IGT组χ2=5.101,P=0.126,DM组χ2=1.495,P=0.104,总体人群χ2=4.147,P=0.110,符合Hardy-Weinberg平衡定律,表示样本来自遗传平衡的总体,具有群体代表性。NC组AA、AG、GG基因频率分别为27%、39%、34%,A、G等位基因频率分别为48%、52%。IGT及T2DM组AA、AG、GG基因频率分别为30%、42%、28%,A、G等位基因频率分别为51%、49%。两组基因型及等位基因的构成差异无统计学意义(P>0.05),见表1。

表1 NC组与IGT及T2DM组MCP-1 A-2518G基因型和等位基因频率分布(n,%)
2.2 NC、IGT及T2DM三组间临床指标比较 IGT及T2DM组年龄较NC组大(P<0.05),提示IGT及T2DM发病与年龄可能有关。IGT组及T2DM组的FPG、餐后2 h血糖、糖化血红蛋白高于NC组(P<0.05)。与NC组比较,IGT及T2DM组有较高的BMI、WHR、TC、TG、LDL-C、SBP及HOMA-IR水平(P<0.05),而3组的DBP、HDL-C的比较差异无统计学意义(P>0.05),见表2。
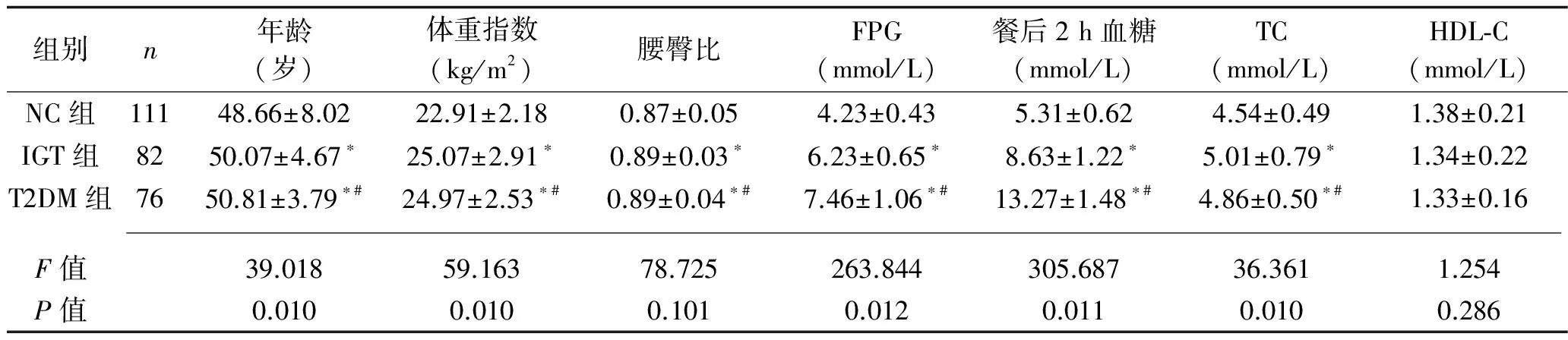
表2 NC、IGT及T2DM三组临床指标的比较(x±s)

续表2
注:与对照组比较,*P<0.05,与IGT组比较,#P<0.05。
2.3 logistic分析 进一步分别以IGT或T2DM作为因变量Y,将性别、年龄、BMI、WHR、FPG、餐后2 h血糖、TC、HDL-C、TG、LDL-C、SBP、DBP、HOMA-IR、糖化血红蛋白、MCP-1各基因型作为自变量X,进行logistics回归分析,只有WHR、HOMA-IR、MCP-1 AA基因型分别进入IGT及T2DM的回归方程,说明三者是IGT及T2DM发病的独立危险因素(P<0.05),见表3。
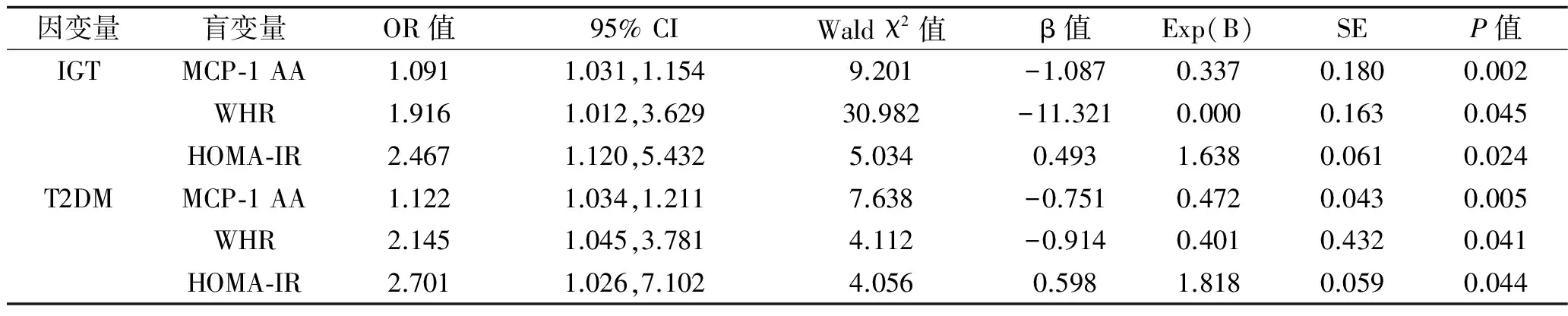
表3 Logistic多因素分析
3 讨 论
越来越多的证据表明系统慢性炎症反应与胰岛素抵抗的免疫不平衡有关[8],而趋化因子在此环节中起重要作用。MCP-1作为一种重要的前炎症细胞因子,它在体内可引起单核/巨噬细胞、嗜碱性粒细胞、淋巴细胞等的激活和聚集,参与机体炎症反应及免疫调节等多种机能活动。研究发现,MCP-1参与调节脂肪组织功能、抑制脂肪细胞胰岛素刺激的葡萄糖摄取[4]及促进肥胖患者脂肪组织巨噬细胞堆积[8]。高血糖可以加速单核细胞及血管内皮细胞产生MCP-1[9-10]。
本研究发现在NC组中G等位基因频率高于A等位基因频率,这与其他学者的研究结果[11-12]相似。后者发现MCP-1 -2518G等位基因为亚洲人、墨西哥人、韩国人及中国人常见频率,与高加索人群以A等位基因为常见频率[5]正好相反,这反映了不同种族之间基因变异的不同,这种基因变异的不同可能影响疾病的进程以及患者对感染或药物治疗的反应。而在IGT及新发T2DM组的A等位基因频率高于对照组,但两组间差异无统计学意义(P>0.05),这与Zietz等[13]的研究结果相似,后者发现糖尿病患者AA基因携带频率高于对照组,但两组之间差异也无统计学意义(P>0.05),而与Simeoni等[5]的结果有异,提示该基因多态性存在种族异质性。进一步logistic分析提示MCP-1-2518 AA携带、WHR及HOMA-IR是IGT及T2DM的独立危险因素,说明MCP-1 A-2518G基因多态性参与IGT及T2DM发病机制。近年来,炎症在T2DM发病机制中的作用备受关注,而MCP-1基因远端调控区A2518G多态性与胰岛素抵抗和T2DM的关系也逐渐受到重视。Simeoni等[5]通过对803例胰岛素抵抗者、635例T2DM患者及1869例健康对照人群MCP-1的A2518G等位基因多态性分析发现,血浆MCP-1水平升高与胰岛素抵抗及糖尿病相关,结果与我们既往的研究结果相似[14];而且MCP-1 AA基因携带的糖尿病患者MCP-1的血浆水平升高[5]。有学者研究发现在饮食诱导的肥胖大鼠中MCP-1 mRNA的表达是正常大鼠的7.2倍,而且血浆MCP-1水平也明显升高,并与体重呈正相关[15]。Tateya等[16]的研究结果显示,循环MCP-1水平急性升高可以诱导胰岛素抵抗,当MCP-1及其受体CCR2的信号被抑制时,胰岛素抵抗得以改善,提示循环MCP-1水平升高可以独立于脂肪组织炎症而足以诱导系统的胰岛素抵抗。高血糖可以通过激活转录因子NF-kB[17]而刺激MCP-1的表达[18]以及氧化应激活性氧簇的生成[19]。然而,最近的研究表明,棕榈酸,但非油酸或高血糖,是通过激活胰腺的β细胞和非β细胞的NF-kB诱导趋化因子和细胞因子的表达(包括CCL2),从而化学性地诱导内质网应激引起细胞因子的表达[20]。因此,MCP-1参与葡萄糖代谢调节的机制尚不明确。
MCP-1 基因变异调节MCP-1基因转录的机制不清。基因远端调节区含有两个NF-kB结合部位负责MCP-1表达的细胞诱导。-2518 A→G基因变异可能影响这个区域的转录活性,因此是影响MCP-1产物在个体之间不同的原因[5]。有学者认为MCP-1促进巨噬细胞在脂肪组织堆积,TNF-α在脂肪组织刺激MCP-1表达及MCP-1介导的胰岛素活性拮抗物产生,G等位基因可能阻止这种病原的恶性循环[5]。
本研究具有探讨性,需要在不同人群、不同种族的大量前瞻性研究进一步证实。如果亚临床炎症确实是胰岛素抵抗的另一面,而MCP-1参与了胰岛素抵抗、IGT和T2DM的发病机制,那么阻止MCP-1的分泌或抑制MCP-1的影响将成为治疗胰岛素抵抗、IGT及T2DM有用的新途径。
[1] American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2014,37(Suppl 1):S81-S90.
[2] Christiansen T,Richelsen B,Bruun JM.Monocyte chemoattractant protein-1 is produced in isolated adipocytes,associated with adiposity and reduced after weight loss in morbid obese subjects[J].Int J Obes,2005,29(1):146-150.
[3] Piemonti L,Calori G,Mercalli A,et al.Fasting plasma leptin,tumor necrosis factor-alpha receptor 2,and monocyte chemoattracting protein 1 concentration in a population of glucose-tolerant and glucose-intolerant women: impact on cardiovascular mortality[J].Diabetes Care,2003,26(10):2 883-2 889.
[4] Sartipy P,Loskutoff DJ.Monocyte chemoattractant protein 1 in obesity and insulin resistance[J].Proc Natl Acad Sci U S A,2003,100(12):7 265-7 270.
[5] Simeoni E,Hoffmann MM,Winkelmann BR,et al.Association between the A-2518G polymorphism in the monocyte chemoattractant protein-1 gene and insulin resistance and Type 2 diabetes mellitus[J].Diabetologia,2004,47(9):1 574-1 580.
[6] De Lemos JA,Morrow DA,Blazing MA,et al.Serial measurement of monocyte chemoattractant protein-1 after acute coronary syndromes:results from the A to Z trial[J].J Am Coll Cardiol,2007,50(22):2 117-2 124.
5) 当装配出错时,由于流水线的运转会使得该发动机流向下一个工位。因此需要使用挡块来阻止问题发动机流向下一个工位,由于流水线是滚筒型的,每个滚筒之间有间隙,因此采用气缸作为挡块,在滚筒之间安装气缸,气缸伸出不会与流水线发生干涉,同时也可以很好阻挡问题发动机流向下一个工位。
[7] Gabir MM,Hanson RL,Dabelea D,et al.The 1997 American Diabetes Association and 1999 World Health Organization criteria for hyperglycemia in the diagnosis and prediction of diabetes[J].Diabetes Care,2000,23(8):1 108-1 112.
[8] Weisberg SP,Hunter D,Huber R,et al.CCR2 modulates inflammatory and metabolic effects of high-fat feeding[J].J Clin Invest,2006,116(1):115-124.
[9] Shanmugam N,Reddy MA,Guha M,et al.High glucose-induced expression of proinflammatory cytokine and chemokine genes in monocytic cells[J].Diabetes,2003,52(5):1 256-1 2764.
[10]Takaishi H,Taniguchi T,Takahashi A,et al.High glucose accelerates MCP-1 production via p38 MAPK in vascular endothelial cells[J].Biochem Biophys Res Commun,2003,305(1):122-128.
[11]Ye DQ,Hu YS,Li XP,et al.The correlation between monocyte chemoattractant protein-1 and the arthritis of systemic lupus erythematosus among Chinese[J].Arch Dermatol Res,2005,296(8):366-371.
[12]Moon JY,Jeong L,Lee S,et al.Association of polymorphisms in monocyte chemoattractant protein-1 promoter with diabetic kidney failure in Korean patients with type 2 diabetes mellitus[J].J Korean Med Sci,2007,22(5):810-814.
[13]Zietz B,Buchler C,Herfarth H,et al.Caucasian patients with type 2 diabetes mellitus have elevated levels of monocyte chemoattractant protein-1 that are not influenced by the -2518 A→G promoter polymorphism[J].Diabetes Obes Metab,2005,7(5):570-578.
[15]Takahashi K,Mizuarai S,Araki H,et al.Adiposity elevates plasma MCP-1 levels leading to the increased CD11b-positive monocytes in mice[J].J Biol Chem,2003,278(47):46 654-46 660.
[16]Tateya S,Tamori Y,Kawaguchi TA,et al.An increase in the circulating concentration of monocyte chemoattractant protein-1 elicits systemic insulin resistance irrespective of adipose tissue inflammation in mice[J].Endocrinology,2010,151(3):971-979.
[17]Satriano J,Schlondorff D.Activation and attenuation of transcription factor NF-kB in mouse glomerular mesangial cells in response to tumor necrosis factor-alpha,immunoglobulin G,and adenosine 3′:5′-cyclic monophosphate.Evidence for involvement of reactive oxygen species[J].J Clin Invest,1994(94):1 629-1 636.
[18]Ihm CG,Park JK,Hong SP,et al.A high glucose concentration stimulates the expression of monocytes chemotactic protein-1 in human mesangial cells[J].Nephron,1998,79(1):33-37.
[19]Ha H,Yoon SJ,Kim MH.High glucose can induce lipid peroxidation in the isolated rat glomeruli[J].Kidney Int,1994(46):1 620-1 626.
[20]Igoillo-Esteve M,Marselli L,Cunha DA,et al.Palmitate induces a pro-inflammatory response in human pancreatic islets that mimics CCL2 expression by beta cells in type 2 diabetes[J].Diabetologia,2010,53(7):1 395-1 405.
Relationship of polymorphism of monocyte chemoattractant protein-1 A-2518G gene with type 2 diabetes mellitus and impaired glucose tolerance
CHENBing1,WANGMei-ning1,HEHai-ning2,HUANGYong-qi3,JIANGJie-qiu4,TANGZhi-qing1,LIUQiao-ling1
(1DepartmentofInternalMedicine,theFirstPeople′sHospitalofNanningAffiliatedtoGuangxiMedicalUniversity,Nanning530022,China; 2GuangxiSouthernPowerGridCompanyInfirmary,Nanning530022,China;3DepartmentofBiochemistry,GuangxiMedicalUniversity,Nanning530022,China;4DepartmentofClinicLaboratory,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530022,China)
Objective To explore the relationship of polymorphism of monocyte chemoattractant protein-1(MCP-1)A-2518G gene with impaired glucose tolerance(IGT) and new-onset type 2 diabetes mellitus(T2DM).Methods A total of 111 healthy individual(NC group),82 patients with IGT(IGT group) and 76 patients with new-onset T2DM(T2DM group) were enrolled.The polymorphism of MCP-1 A-2518G gene was observed using a polymorphism chain reaction(PCR) and restriction fragment length polymorphism technology,and its relationship with IGT and T2DM was analyzed.Results There were no significant differences in alleles or genotype frequencies of MCP-1 gene among NC group,IGT group and T2DM group(P>0.05).The result of logistic regression analysis showed that waist/hip ratio,insulin resistance index and MCP-1 AA were the independent risk factors for IGT and new-onset T2DM(P<0.05).Conclusion MCP-1 A-2518G polymorphism may be involved in the pathogenesis of IGT and new-onset T2DM.AA gene carriers may increase the morbidity risk of IGT and new-onset T2DM.
Type 2 diabetes mellitus,Impaired glucose tolerance,Monocyte chemoattractant protein-1,Insulin resistance,Gene polymorphism
广西自然科学基金(桂科自0640198)
陈冰(1965~),女,博士,主任医师,研究方向:体外诱导人胚胎干细胞向胰岛细胞分化,糖尿病慢性病并发症的发生机制和防治。
R 587.1
A
0253-4304(2016)04-0471-05
10.11675/j.issn.0253-4304.2016.04.07
2015-12-18
2016-03-12)

