痛安注射液的化学成分研究(Ⅰ)*
尚 婵,李海波,李孟璇,苏真真,孟兆青,黄文哲,王振中,丁 岗,杨中林,萧 伟**
(1.中国药科大学中药学院 南京 211198;2.江苏康缘药业股份有限公司 连云港 222001;3.中药制药过程新技术国家重点实验室 连云港 222001)
痛安注射液的化学成分研究(Ⅰ)*
尚 婵1,李海波2,李孟璇2,苏真真2,孟兆青2,黄文哲2,王振中2,丁 岗2,杨中林2,萧 伟2**
(1.中国药科大学中药学院 南京 211198;2.江苏康缘药业股份有限公司 连云港 222001;3.中药制药过程新技术国家重点实验室 连云港 222001)
目的:研究痛安注射液中的抗炎活性成分。方法:采用LPS诱导的RAW 264.7巨噬细胞炎症模型检测化合物对PGE2抑制活性,综合应用HP-20大孔吸附树脂、硅胶柱色谱、ODS柱色谱、Sephadex LH-20柱色谱、制备及半制备HPLC等色谱方法对活性部位进行分离和纯化,根据化合物的光谱数据和理化性质鉴定化合物的结构。结果:痛安注射液中经HP-20大孔吸附树脂,95%乙醇洗脱部位为抗PGE2释放活性部位,从中分离得到17个化合物,分别鉴定为丁香脂素(1)、N-反式阿魏酰酪胺(2)、白屈菜红碱(3)、青藤碱(4)、黄连碱(5)、血根碱(6)、白屈菜碱(7)、木兰花碱(8)、别隐品碱(9)、原阿片碱(10)、杜鹃素(11)、二氢血根碱(12)、Heptadec-(9Z)-enoic acid(13)、绿原酸(14)、隐绿原酸(15)、3,5-O-二咖啡酰奎宁酸(16)、4,5-O-二咖啡酰奎宁酸(17);通过PGE2抑制活性检测,6个化合物对PGE2具有很好的抑制作用。结论:化合物1-17均为首次从痛安注射液中分离得到,化合物2、5、9、10、11、12对PGE2具有很好的抑制作用。
痛安注射液黄酮生物碱有机酸苯丙素PGE2
痛安注射液由青风藤、白屈菜、汉桃叶三味常用中药材精制而成,主要用于放化疗或非放化疗的肺癌、肝癌、胃癌等肿瘤属血瘀引发的癌性中度疼痛[1]。其临床癌痛缓解总有效率达98.04%[2]。本课题组前期对痛安注射液进行了PGE2抑制活性检测,结果显示:经HP-20大孔树脂95%乙醇洗脱部位对PGE2有很好的抑制活性。在此基础上,本研究对活性部位(95%乙醇洗脱部位TA-4)进行了系统的化学成分研究,从中分离得到了17个化合物,分别鉴定为(1)、N-反式阿魏酰酪胺(2)、白屈菜红碱(3)、青藤碱(4)、黄连碱(5)、血根碱(6)、白屈菜碱(7)、木兰花碱(8)、别隐品碱(9)、原阿片碱(10)、杜鹃素(11)、二氢血根碱(12)、Heptadec-(9Z)-enoic acid(13)、绿原酸(14)、隐绿原酸(15)、3,5-O-二咖啡酰奎宁酸(16)、4,5-O-二咖啡酰奎宁酸(17)。上述化合物均为首次从痛安注射液中分离得到,通过17个化合物的PGE2抑制活性检测,结果显示:化合物2、5、9、10、11、12对PGE2具有很好的抑制作用。
1 实验材料
高效液相色谱仪Agilent1200(美国安捷伦科技有限公司),BruckerAVANCE400 型核磁共振仪(瑞士Brucker公司),Finnigan LCQ Advantage MAX 质谱仪(Thermo Fisher Scientific),R502B型旋转蒸发仪(上海申生科技有限公司),SHZ-IIIB循环水真空泵(临海市谭氏真空设备有限公司),Agilent 1260制备型高效液相色谱(美国安捷伦科技有限公司),分析高效液相色谱柱为 C18柱(250 mm×4.6 mm,5 μm,ZORBAXExtend-C18美国安捷伦科技有限公司),制备高效液相色谱柱为C18柱(250 mm×20 mm,5 μm,YMC-PACKODS-A,YMC)。
硅胶薄层色谱板(青岛海洋化工厂分厂),制备薄层硅胶板和柱色谱硅胶(100-200、200-300目,青岛海洋化工厂分厂),HP-20 大孔树脂(日本Mitsubishi-Chemical公司),Sephadex LH-20填料(瑞典Amersham Biosciences公司),反相ODS柱色谱填料(40 μm,日本YMC公司),色谱甲醇和乙腈(美国Tedia试剂公司),小鼠巨噬细胞系(RAW264.7,中国中医科学院),Thermo Scientific BB15型CO2细胞培养箱(美国Thermo Electron公司),Nikon TS100型倒置显微镜ZW-A型微量振荡器(常州国华仪器有限公司),PGE2ELISA kit(瑞士Enzo Life Sciences公司,批号:06241415D),0.25% Trypsin-EDTA(美国Gibco公司,批号:1697785),DMSO(上海晶纯生化科技股份有限公司,批号:40399),脂多糖(南京大治生物科技有限公司),FBS(美国GEMINI公司,批号:A79E00G),DMEM/ HIGH GLUCOSE(美国Thermo scientific公司,批号:NAH1441)。其余所用试剂均为分析纯,购自广东光华科技股份有限公司、国药集团化学试剂有限公司。痛安注射液(江苏康缘药业股份有限公司,批号140601)。
2 提取分离
取痛安注射液成品浓缩液1246g,用适量水溶解后经HP-20 大孔树脂吸附,用乙醇-水(水、 50%、70% 及95%乙醇)梯度洗脱,得到水洗脱部位TA-1(603.88 g),50%乙醇洗脱部位TA-2(145.97 g),70%乙醇洗脱部位TA-3(58.27 g),95%乙醇洗脱部位TA-4(67.01 g)。取TA-4(65 g)进行硅胶柱色谱分离, 氯仿-甲醇(100:0、98:2、 95:5、 92:8、90:10、85:15、80:20、70:30、50:50、30:70、0:100)梯度洗脱共得到12个组分Fr. 1-12。Fr. 1(0.6 g)经Sephadex LH-20 柱色谱及反相 HPLC 分离,得到化合物1(4.72 mg),2(2.21 mg),12(3.12 mg),Fr. 2(1.68 g)经反相 HPLC 分离,得到化合物3(5.53 mg),5(3.78 mg),6(2.23 mg),8(2.10 mg),9(6.25 mg),11(2.78 mg),14(3.75 mg),Fr. 4(29 g)经反复硅胶、 ODS及反相 HPLC 分离,得到化合物13(8.43 mg),7(1.36 g)、4(5.88 mg)、10(100.73 mg)、15(3.28 mg)、16(2.33 mg)、17(6.10 mg)、18(4.7 mg)。
3 结构鉴定
化 合 物1:白 色 针 状 结 晶;ESI-MS m/z: 441[M+Na]+,1H-NMR(400 MHz,CD3OD)δ: 6.59(4H,s,H-2′,H-2″,H-6′,H-6″),5.51 (4H,brs,4′-OH,4″-OH),4.75(2H,brd,J = 4.5 Hz,H-2,H-6),4.29(2H,dd,J = 6.57Hz,J = 7.04 Hz,H-4,H-8),3.89(2H,dd,J = 3.8Hz,J = 9.2 Hz,H-4,H-8),3.10(12H,s,4×OCH3),3.10(2H,m,H-1,H-5);13C-NMR (100 MHz,CD3OD)δ:147.38(C-3),147.38(C-5),134.53(C-1),132.33(C-4),102.93(C-2),102.93(C-6),86.3(C-7),72.03(C-9),56.61(C-3-OCH3),56.61(C-5-OCH3),54.58(C-8)。以上数据与文献报道一致[3],故鉴定化合物1为丁香脂素。
化合物2:无色油状;ESI-MS m/z: 314[M+H]+,1H-NMR(400 MHz, CD3OD)δ:7.42(1H,d,J=15.45 Hz,H-7),7.08(1H,d,J=1.64Hz,H-2),7.03(2H,d,J=8.28Hz,H-2′,H-6′),7.01(1H,dd,J=8.45Hz,J=1.5Hz,H-6),6.77(1H,d,J=8.83Hz,H-5),6.70(2H,d,J=8.71Hz,H-3′,H-5′),6.39(1H,d,J=15.98Hz,H-8),3.84(3H,s,3-OCH3),3.45(2H,t,J=7.24Hz,H-8′),2.74(2H,t,J=7.48Hz,H-7′);13C-NMR(100 MHz,CD3OD)δ:169.17(C-9),156.93(C-4′),149.84(C-4),149.27(C-3),142.04(C-7),131.27(C-1′),130.74(C-2′,C-6′),128.23(C-1),123.22(C-6),118.68(C-8),116.44(C-5),116.25(C-3′,C-5′),111.46(C-2),56.34(C-3-OCH3),42.55(C-8′),35.8(C-7′)。以上数据与文献报道一致[4],故鉴定化合物2为N-反式阿魏酰酪胺。
化合物3:淡黄色粉末;ESI-MS m/z:348[M]+,1H-NMR(400 MHz, DMSO-d6)δ: 10.09(2H,s,H-6),8.85(1H,d,J=8.83Hz,H-10),8.79(1H,d,J=8.26 Hz,H-11),8.46(1H,s,H-4),8.27(1H,d,J=8.86Hz,H-9),8.27(1H,d,J=8.86 Hz,H-12),7.82(1H,s,H-1),6.35(2H,d,-OCH2O-),4.97(3H,s,8-OCH3),4.20(3H,s,7-OCH3),4.15(3H,s,N-CH3);13C-NMR(100 MHz,DMSO-d6)δ:152.68(C-6),151.26(C-4),149.89(C-2),149.01(C-3),148.98(C-8),146.35(C-7),127.98(C-12),127.98(C-10a),126.55(C-10b),124.78(C-6a),120.88(C-4a),118.75(C-10),117.22(C-11),105.31(C-1),103.28(C-4b),102.78(C-2,3-OCH2O-),101.25(C-9),61.98(C-7-OCH3),58.58(C-8-OCH3),51.15(C-N-OCH3)。以上数据与文献报道一致[5],故鉴定化合物3为白屈菜红碱。
化合物4 :白色针晶;ESI-MS m/z:330[M+H]+,1H-NMR(400 MHz,CDCl3)δ:10.74(1H,s,OH),6.74(1H,d,J=8.46Hz,H-2),6. 62(1H,d,J=8.18 Hz,H-1),5.35(1H,s,br,W1/2 =2.0 Hz,H-8),4. 35(1H,d,J=15.12Hz,5-He),3.85(3H,s,2-OCH3),3.51(3H,s,7-OCH3),3.15(1H,m,H-9),3.05(1H,m,H-14),3.01(1H,m,10-He),2.77(1H,dd,J=5.15,17.28Hz,10-Ha),2.57(1H,d,J=15.28Hz,5-Ha),2.42(1H,m,16-He),2.33(3H,s,NH3),2.12(1H,m,16-Ha),1.93(2H,m,H-15);13C-NMR(100 MHz,CDCl3)δ:192.27(C-6),153.12(C-7),146.26(C-3),145.18(C-4),125.47(C-11),120.56(C-12),118.98(C-1),110.72(C-8),110.26(C-2),58.71(C-9),56.39(C-3-OCH3),55.28(C-7-OCH3),48.5(C-16),47.49(C-5),42.25(C-14),39.05(C-13),33.53(C-15),24.83(C-10)。以上数据与文献报道一致[6,7],故鉴定化合物4为青藤碱。
化 合 物5:黄 色 棱 晶;ESI-MS m/z:320[M]+,1H-NMR(400 MHz,DMSO-d6)δ:9.95(1H,s,H-8),8.96(1H,s,H-13),8.03(1H,d,J=7.66 Hz,H-11),7.82(1H,d,J= 8.43 Hz,H-12),7.79(1H,s,H-1),7.08 (1H,s,H-4),6.53(2H,brs,-OCH2O-),6.17(2H,brs,-OCH2O-),4.88(2H,dd,J =6.2,6.0 Hz,H-6),3.20(2H,dd,J= 6.2,6.0 Hz,H-5);13C-NMR(100 MHz,DMSO-d6)δ:149.78(C-3),147.06(C-2),144.55(C-8),147.70(C-10),143.84(C-9),136.84(C-13a),132.33(C-12a),130.56(C-4a),121.73(C-13),121.04(C-11,12),120.98(C-8a),111.64(C-13b),108.42(C-4),105.3(C-1),104.47(-OCH2O-),102.08(-OCH2O-),55.08(C-6),26.25(C-5)。以上数据与文献报道一致[8],故鉴定化合物 5为黄连碱。
化合物6:橙红色针晶;ESI-MS m/z:332[M]+,1H-NMR(400 MHz,DMSO-d6)δ:8.79(1H,d, J=9.6 Hz,H-11),8.64(1H,d,J=8.63 Hz,H-12),8.30(1H,s,H-4),8.27(1H,d,J=8.2Hz,H-10),7.95(1H,s,H-1),7.77(1H,d,J=8.2Hz,H-9),6.61(1H,s,-OCH2O-),6.35(2H,s,-OCH2O-),6.11(1H,s,-OCH2O-),5.45(1H,s,H-6),4.92(3H,s,N-CH3);13C-NMR(100 MHz,DMSO-d6)δ:150.4(C-3),149.19(C-2),147.97(C-8),146.72(C-7),131.93(C-12a),131.75(C-4a),131.75(C-4b),127.62(C-10a),126.13(C-12),120.74(C-10b),120.38(C-11),119.34(C-10),117.8(C-6a),109.94(C-9),106.2(C-1),105.36(-OCH2O-),105.36(-OCH2O-),104.71(C-4),103.24(C-6),52.56(N-CH3)。以上数据与文献报道一致[9],故鉴定化合物 6为血根碱。
化合物7:白色结晶;ESI-MS m/z:354[M+H]+,1H-NMR(400 MHz,CDCl3)δ: 6.86(1H,d,J=7.28Hz,H-9),6.78(1H,d,J=8.0Hz,H-10),6.77(1H,s,H-4),6.69(1H,s,H-1),6.00(1H,d,J=1.27Hz,-OCH2O-),5.98(1H,d,J=1.27Hz,-OCH2O-),5.95(1H,d,J=1.70Hz,-OCH2O-),5.93(1H,d,J=1.31Hz,-OCH2O-),4.21(1H,brs,W1/2=7.9Hz,H-11),4.08(1H,d,J=15.85Hz,H-6a),3.63(1H,brs,H-14),3.49(1H,d,J=15.72Hz,H-6),3.12(1H,d,J=17.5Hz,H-12a),3.11(1H,dd,J=17.5,4.3Hz,H-12b),3.05(1H,t,J=2.25Hz,H-13),2.30(3H,s,N-CH3);13C-NMR(100 MHz,CDCl3)δ:149.8(C-8),147.12(C-3),147.01(C-2),144.48(C-7),132.41(C-10a),129.65(C-4a),127.08(C-12b),121.91(C-10),118.35(C-6a),113.08(C-4),110.25(C-9),108.42(C-1),102.77(C-7,8-OCH2O-),102.55(C-2,3-OCH2O-),74.23(C-11),64.11(C-14),54.47(C-6),42.7(N-CH3),42.1(C-12a)。以上数据与文献报道一致[10],故鉴定化合物 7为白屈菜碱。
化合物8:淡黄色粉末;ESI-MS m/z:342[M]+,1H-NMR(400 MHz,CD3OD)δ: 6.65(1H,d,J=8.22Hz,H-8),6.45(1H,s,H-3),6.43(1H,d,J=4.38Hz,H-9),4.92(2H,d,J=5.76Hz,H-6α),3.82(3H,s,10-OCH3),3.74(3H,s,2-OCH3),3.56(1H,m,H-5β),3.41(1H,m,H-5α),3.22(3H,s,N-CH3-β),3.13(1H,m,H-4β),3.13(1H,m,H-7β),2.89(1H,m,H-4α)3.13(1H,m,H-7β),3.75(3H,s,N-CH3-α),2.55(1H,m,H-7α);13C-NMR(100 MHz,CD3OD)δ:153.21(C-2),151.85(C-10),150.88(C-1),149.83(C-11),126.12(C-7a),123.71(C-11a),123.58(C-1a),121.11(C-1b),117.18(C-8),115.93(C-3a),110.65(C-9),109.51(C-3),71.13(C-6α),62.38(C-5α),56.42(N-CH3-β),56.09(N-CH3-α),54(C-10-OCH3),43.64(C-2-OCH3),31.7(C-7α),24.71(C-4α)。以上数据与文献报道一致[11],故鉴定化合物 8为木兰花碱。
化 合 物9:白 色 块 状 结 晶;ESI-MS m/z: 370[M+H]+,1H-NMR(400 MHz,CD3OD)δ: 6.94(1H,s,H-1),6.91(1H,d,J=8.22Hz,H-11),6.79(1H,d,J=8.66Hz,H-12),6.62(1H,s,H-4),5.93(2H,s,-OCH2O-), 3.84(3H,s,10-OCH3),3.76(3H,s,9-OCH3),3.29(2H,s,H-8),2.49(2H,dd,H-5),2.49(2H,s,H-13),2.48(2H,dd,H-6),1.54(3H,s,N-CH3);13C-NMR(100 MHz,CD3OD)δ:192.89(C-14),161.12(C-9),146.98(C-10),144.21(C-2),147.12(C-3),135.79(C-14a),129.77(C-12a),128.78(C-8a),127.6(C-12),110.5(C-11),110.12(C-4),109.22(C-4a),107.98(C-1),100.82(C-2,3-OCH2O-),56.77(C-6),50.12(C-8),60.39(C-9-OCH3),55.5(C-10-OCH3),46.8(C-13),39.98(N-OCH3),30.79(C-5)。以上数据与文献报道一致[5],故鉴定化合物9为别隐品碱。
化合物10:白色粉末;ESI-MS m/z:354[M+H]+,1H-NMR(400 MHz,CDCl3)δ:6.90(1H,s,H-1),6.70(1H,s,H-4),6.67(1H,d,J = 7.9 Hz,H-11),6.64(1H,d,J=7.9 Hz,H-12),5.95(2H,s-OCH2O-),5.92 (2H,s,-OCH2O-),3.78(2H,brs,H-13),3.57(2H,brs,H-8),2.89(2H,m,H-5),2.53(2H,m,H-6),1.92(3H,s,N-CH3);13C-NMR(100 MHz,CDCl3)δ:194.9(C-14),148.16(C-3),146.47(C-2),146.15 (C-9),146.04(C-10),136.27(C-4a),132.89(C-14a),129.11(C-12a),125.22(C-12),118.02(C-8a),110.62(C-4),108.3(C-1),106.89(C-11),101.35(-OCH2O-),101(-OCH2O-),57.95(C-6),50.99(C-8),46.61(C-13),41.46(-NCH3),31.92(C-5)。以上数据与文献报道一致[9],故鉴定化合物10为原阿片碱。
化合物11:白色粉末;ESI-MS m/z:299 [MH]-,1H-NMR(400 MHz,CD3OD)δ: 7.33(2H,d,J=8.21 Hz,H-2′,6′),6.84(2H,d,J=8.21 Hz,H-3′,5′),5.30(1H,dd,J= 12.28,3.23 Hz,H-2),3.08(1H,dd,J=16.8,12.8 Hz,H-3a),2.72(1H,dd,J=17.2,2.8 Hz,H-3b),2.00(3H,s,6-CH3),1.99(3H,s,8-CH3);13C-NMR(100 MHz,CD3OD)δ:198.53(C-4),164.26(C-9),160.42(C-5),159.46(C-7),158.98(C-4′),131.68(C-1′),128.96(C-2′,6′),116.46(C-3′,5′),104.91(C-6),104.21(C-10),103.39(C-8),80.19(C-2),44.24(C-3),8.3(6-CH3),7.56(8-CH3)。以上数据与文献报道一致[12],故鉴定化合物11为杜鹃素。
化 合 物12:无 色 针 状 结 晶;ESI-MS m/z: 334[M+H]+,1H-NMR(400 MHz,CDCl3)δ:7.77(1H,d,J=8.66Hz,H-11),7.56(1H,s,H-4),7.53(1H,d,J=9.38Hz,H-12),7.40(1H,d,J=8.27 Hz,H-10),7.30(1H,s,H-1),6.95(1H,d,J=8.3 Hz,H-9),6.13(2H,s,-OCH2O-2,3),6.09(2H,s,-OCH2O-7,8),4.12(2H,s,H-6),2.50(3H,s,N-CH3);13C-NMR(100 MHz,CDCl3)δ:148.00(C-2),147.35(C-3),146.99(C-8),144.37(C-7),141.96(C-4b),130.52(C-12a),128.73(C-10a),126.46(C-4a),125.81(C-10b),124.03(C-12),120.36(C-11),116.38(C-10),112.90(C-6a),107.35(C-9),104.31(C-1),101.43(-OCH2O-7,8),101.30(-OCH2O-2,3),99.83(C-4),47.97(C-6),41.37(N-Me)。以上数据与文献报道一致[13],故鉴定化合物12为二氢血根碱。
化合物13:白色粉末;ESI-MS m/z: 269[M+H]+,1H-NMR(400 MHz,CDCl3)δ: 5.35(2H,d,J= 4.57,11.1Hz,H-9,H-10),2.22(2H,d,J=8.4 Hz,H-2),2.01(4H,m,J=5.56 Hz,H-8,H-11),1.63(2H,m,J=6.9 Hz,H-3),1.31-1.26(18H,brm,9×CH2),0.88(3H,t,J=6.78 Hz,H-18);13C-NMR(63 MHz,CDCl3)δ:175.39(C-1),129.94(C-9),129.90(C-10),35.94(C-2),31.92(C-15),29.79,29.61,29.56,29.54,29.49,29.33,27.23(C-8,C-11),25.55(C-3),22.7(C-16),14.12(C-17)。以上数据与文献报道一致[14],故鉴定化合物13为Heptadec-(9Z)-enoic acid。
化合物14:白色无定形粉末;ESI-MS m/z:377[M+Na]+,353 [M-H]-,1H-NMR(400 MHz,CD3OD)δ:7.60(1H,d,J=15.88Hz,H-β),7.14(1H,d,J=2.1Hz,H-2′),6.96(1H,dd,J=8.35,2.10 Hz,H-6′),6.78(1H,d,J=8.5 Hz,H-5′),6.36(1H,d,J= 15.79 Hz,H-α),5.26(1H,dd,J=9.1,8.6,4.1 Hz,H-5),4.20(1H,brs,H-3),3.76(1H,dd,J=8.23,3.21Hz, H-4),2.19(2H,m,H-2),1.99(2H,m,H-6)。以上数据与文献报道一致[15],故鉴定化合物14为绿原酸。
化合物15:白色无定形粉末;ESI-MS m/z: 377[M+Na]+,353 [M-H]-,1H-NMR(400 MHz,CD3OD)δ:7.64(1H,d,J=15.85 Hz,H-β),7.28(1H,d,J=1.85 Hz,H-2′),6.96(1H,dd,J=8.21,1.79Hz,H-6′),6.82 (1H,d,J=8.21 Hz,H-5′),6.40(1H,d,J=15.88 Hz,H-α),4.79(1H,dd,J=11.91,3.0 Hz,H-4),4.29(1H,m,H-3),4.29(1H,m,H-5),2.25(2H,m,H-2),1.98(2H,m,H-6)。以上数据与文献报道一致[16],故鉴定化合为15为隐绿原酸。
化合物16:淡黄色无定形粉末;ESI-MS m/ z: 539[M+Na]+,515 [M-H]-,1 H-NMR(400 MHz,CD3OD)δ:7.66(1H,d,J=15.78Hz,H-3′),7.57(1H,d,J=15.78Hz,H-3″),7.17(2H,br,d,J=2.02Hz,H-5′,5″),6.87(2H,d,J=8.15Hz,H-8′,8″),6.78(2H,d,J=8.15,1.9 Hz,H-9′,9″),6.34(1H,d,J=15.85 Hz,H-2′),6.25(1H,d,J=15.85 Hz,H-2″),5.43 (2H,m,H-3,5),3.66(1H,dd,J=6.52,3.2 Hz,H-4),2.29(2H,m,H-2),2.08(2H,m,H-6)。以上数据与文献报道一致[17],故鉴定化合物16 为 3,5-O-二咖啡酰奎宁酸。
化合物17:淡黄色无定形粉末;ESI-MS m/ z: 539[M+Na]+,515 [M-H]-,1H-NMR(400 MHz,CD3OD)δ: 7.58(1H,d,J=15.85Hz,H-3′),7.49(1H,d,J=15.85Hz,H-3″),6.99(2H,d,J=2.0Hz,H-5′,5″),6.94(1H,dd,J=8.15,2.0 Hz,H-9′),6.93(1H,dd,J = 8.2,2.0Hz,H-9″),6.79(1H,d,J=8.19 Hz,H-8″),6.75(1H,d,J=8.2 Hz,H-8′),6.20(1H,d,J =15.85Hz,H-2′),6.08(1H,d,J=15.85 Hz,H-2″),5.53 (1H,m,H-5),5.09(1H,dd,J=8.7,2.0Hz,H-4),4.37(1H,d,J=6.5,3.1Hz,H-3),2.37-2.10(2H,m,H-6),2.34-2.10(2H,m,H-2)。以上数据与文献报道一致[18],故鉴定化合物17 为4,5-O-二咖啡酰奎宁酸。
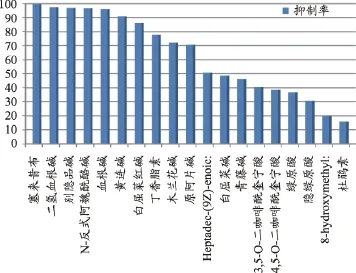
图1 各化合物的抑制率/%
4 化合物对PGE2抑制作用的研究
脂多糖(Lipopolysaccharide,LPS)为革兰氏阴性菌细胞壁的主要组成成分,机体受到感染时,LPS作用于细胞膜受体诱导炎症因子前列腺素E2(Prostaglandins E2,PGE2)、NO、TNF-α等的释放,其中PGE2是参与炎症、疼痛等多种生理病理机制过程的活性物质[19]。研究采用LPS诱导的RAW 264.7巨噬细胞炎症模型检测化合物对PGE2抑制活性,化合物的最高测试浓度均为100 nmol·L-1。
实验设空白对照组、溶剂对照组、模型组和样品组4组,阳性药塞来昔布(3 300 nmol·L-1)做对照。取对数期的RAW264.7细胞,用0.25%胰酶消化,用培养基稀释细胞密度为1×105个/mL,每孔400 μL均匀接种于24孔板中,置37℃,5%CO2培养箱中培养24 h形成细胞单层。弃培养液,给药组分别加入稀释后的化合物,每组3复孔。空白对照组加入无血清的培养基,溶剂对照组加入含0.1%DMSO的无血清培养基。培养箱中孵育1 h后,模型组和给药组每孔加入终浓度为1 μg·mL-1LPS,置培养箱中培养18 h。收集细胞上清,按Elisa试剂盒说明书检测PGE2含量。抑制率的计算公式如下:
抑制率=(模型组PGE2的平均含量-样品组PGE2的平均含量)/(模型组PGE2的平均含量-溶剂组PGE2的平均含量)×100%
各化合物的抑制率见图1,由图可见,化合物二氢血根碱、别隐品碱、N-反式阿魏酰酪胺、血根碱、黄连碱、白屈菜红碱、丁香脂素、木兰花碱、原阿片碱、对PGE2的抑制作用较好,Heptadec-(9Z)-enoic acid、白屈菜碱、青藤碱、3,5-O-二咖啡酰奎宁酸、4,5-O-二咖啡酰奎宁酸、绿原酸、隐绿原酸对PGE2有一定的抑制作用。
5 讨论
本研究采用现代化学与药理学相结合的方法对痛安注射液进行了系统的化学成分分析,综合应用各种色谱分离手段分离鉴定了17个化合物,所有化合物均为首次从痛安注射液中分离得到,并采用LPS诱导的RAW 264.7巨噬细胞炎症模型对所分离到的17化合物进行了PGE2抑制活性检测。结果显示,生物碱类化合物对PGE2有较好的抑制活性,该类化合物可能是痛安注射液镇痛抗炎的主要药效物质。这在一定程度上揭示了该产品发挥抗炎镇痛作用的物质基础,为探讨生物碱类成分对复方药效的贡献提供了依据。本研究也为后期痛安注射液指纹图谱的指认以及建立与功效相关联的质量控制方法奠定了一定的基础,同时也为抗炎镇痛相关新药研发和相关有效成分发现奠定了基础。
1 杨绪芳,王秀海,柏伟荣,等.痛安注射液配液过程中除杂工艺优化研究.中国中药杂志,2015,40(16):3200-3203.
2 关洁珊,景娇,林丽珠,等.痛安注射液对中度癌性疼痛的治疗作用.广州中医药大学学报,2013,30(1):12-15.
3 包保全,乌雅罕,陈建平,等. 蒙药材细叶铁线莲化学成分研究.世界科学技术-中医药现代化,2015,17(9):1929-1933.
4 Meerungrueang W, Panichayupakaanant P.A New Antibacterial Tetrahydronaphthalene Lignanamide, Foveolatamide, from the Stems of Ficus foveolata.Nat Prod Commun, 2016, 11(1):91-94.
5 卿志星,徐玉琴,杨鹏,等. 博落回果荚中生物碱的研究.中药材,2016,39(2):312-314.
6 程维明.青风藤化学成分及青藤碱大鼠体内代谢研究.长春:沈阳药科大学博士学位论文,2005.
7 班小红,黄筑艳,李焱,等.青风藤化学成分的研究.时珍国医国药,2008,19(8):1831-1832.
8 杨鑫宝,刘扬子,杨秀伟,等.盤安延胡索的化学成分研究.中草药,2013,44(16):2200-2207.
9 於佳佳.黄紫堇生物碱成分的研究.长春:吉林大学硕士学位论文,2014.
10 赵强,索有瑞,王延璞,等. 野生药用植物红茂草生物碱化学成分的研究. 天水师范学院学报,2015,35(2):43-45.
11 李雪改,杨立国,陈丽霞,等. 黄连水提液化学成分的分离与鉴定.沈阳药科大学学报,2012,29(3):193-226.
12 李干鹏,罗阳,李尚秀,等.小叶杜鹃花的化学成分研究.中草药,2014,45(12):1668-1672.
13 邹惠亮,李红玉,余绍福,等.博落回的生物碱成分及细胞毒性活性研究.中国中药杂志,2015,40(3):458-462.
14 Ji Young Choi, Eun Hyang Choi, Hee Wook Jung, 等.Melanogenesis Inhibitory Compounds from Saussureae Radix. Arch Pharm Res, 2008, 31(3):294-299.
15 罗咏婧,李会军,李萍,等. 毛花柱忍冬花蕾化学成分研究. 林产化学与工业, 2010,30(1):73-76.
16 宋亚玲,王雪晶,赵祎武,等. 金银花中抗补体活性酚酸类成分的研究. 中国中药杂志,2015,40(2):269-274.
17 刘波,谢亮亮,王英锋. 杏香兔耳风化学成分研究. 首都师范大学学报:自然科学版,2007,28(6):36-37.
18 Zhu X F, Hang H X, Lo R. Three di-O-caffeoylquinic acid derivatives from the heads of Cynara scolymus L.. Nat Prod Res, 2009, 23(6):527-532.
19 常秀娟,范麒如,王红梅,等. 热毒宁拆方对RAW264.7细胞炎症相关因子表达的影响. 世界科学技术-中医药现代化,2016,18(2):286-290.
Chemical Constituents from Tong An Injection (I)
Shang Chan1, Li Haibo2, Li Mengxuan2, Su Zhenzhen2, Meng Zhaoqing2, Huang Wenzhe2, Wang Zhenzhong2, Ding Gang2, Yang Zhonglin2, Xiao Wei2
(1. China Pharmaceutical University, Nanjing 211198, China; 2. Jiangsu Kanion Parmaceutical Co. Ltd., Lianyungang 222001, China; 3. State Key Laboratory of New-Tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China)
This study aimed at investigating the antiviral constituents from the active fractions of Tong-An (TA) injection. In this study, the active constituents of TA injection were screened by LPS-induced PGE2productionmode to detect the contents of PGE2. The chemical constituents were isolated by HP-20 macroporous resin, silica gel column chromatography, ODS column chromatography, Sephadex LH-20 column chromatography and preparative and semi-preparative HPLC. The structures were identified by spectral data and physicochemical property. As a result, the 95% ethanol eluate of TA injection on the macroporous adsorption resin column was proved to be the active fraction of TA injection. Seventeen compounds were isolated from TA injection and identified as syringaresinol (1), N-Trans-Feruloyltyramine (2), chelerythrine (3), sinomenine (4),coptisine (5), sanguinarine (6), chelidoniny (7), magnoflorine (8), allocryptopine (9), protopine (10), farrerol (11), dihydrosanguinarine (12), heptadec-(9Z)-enoic acid (13), chlorogenic acid (14), cryptochlorogenin acid (15), 3,5-di-O-caffeoylquinic acid (16) and 4,5-di-O-caffeoylquinic acid (17). PGE2inhibitory activities of these compounds were determined, among which six compounds presented inhibitory activities against PGE2. It was concluded that all the isolated compounds from TA injection were firstly reported with the favorable inhibitory activities of compounds 2, 5, 9, 10, 11, 12 against PGE2.
Tong-An injection, flavonoids, alkaloid, organic acids, phenylpropanoids, prostaglandin E2
10.11842/wst.2016.12.016
R284.1
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-30
修回日期:2016-10-19
* 江苏省自然科学基金委青年基金项目(BK20140441):基于活性成分追踪分离及快速检识分析新策略的中药复方药效物质基础研究,负责人:李海波。
** 通讯作者:萧伟,本刊编委,研究员级高级工程师,博士,主要研究方向:中药新药的研究与开发。

