丙胺类离子液体的合成及其脱硫性能
刘 超,王建英,程刘备,姜海超,胡永琪
(河北科技大学 化学与制药工程学院,河北 石家庄 050018)
废气处理
丙胺类离子液体的合成及其脱硫性能
刘 超,王建英,程刘备,姜海超,胡永琪
(河北科技大学 化学与制药工程学院,河北 石家庄 050018)
以廉价的正丙胺及苯酚、乳酸、四氮唑乙酸为原料,采用一步法合成了3种丙胺类离子液体(丙胺乳酸盐([PA]L)、丙胺苯酚盐([PA][PHE])、丙胺四氮唑乙酸盐([PA][TAA])),并将其用于SO2的吸收。测定了3种离子液体的主要理化指标,系统考察了其脱硫性能,并对SO2的吸收机理进行了探讨。实验结果表明:3种离子液体均具有较高的热稳定性;25 ℃下,[PA][TAA]的密度和表面张力均较高,而[PA][PHE]的黏度远小于[PA]L和[PA][TAA],仅为66 mPa·s;3种离子液体的脱硫能力均较高,且吸收速率快,30 ℃下吸收平衡时SO2与[PA][PHE],[PA]L,[PA][TAA]的摩尔比分别为0.570,0.806,0.904;3种离子液体的解吸较容易,对SO2的吸收具有高选择性,且循环使用性能较好;丙胺类离子液体对SO2同时存在物理吸收和化学吸收作用。
离子液体;脱硫;黏度;丙胺;吸收;解吸
随着以能源消耗为主的重工业的迅猛发展,我国连续多年的SO2排放总量位居世界第一。目前工业采用的烟气脱硫治理技术基本是酸碱中和反应及氧化还原反应。市场占有率高的传统石灰/石灰石法或碱液吸收法可满足环保要求,但硫资源不能回收利用,给吸收后的废弃物处理带来新的困难[1]。
近年来,离子液体作为环境友好吸收剂,在气体吸收分离领域引起广泛关注。离子液体几乎没有挥发性,用于烟气脱硫有以下优点[2]:一方面,离子液体不会因为自身的挥发带来损失或引起二次污染;另一方面,净化后的烟气以及解吸得到的SO2气体中也不会含有吸收液组分,能够有效回收宝贵的硫资源;此外,离子液体的可设计性使其更具应用潜力,通过调控阴阳离子的组成可合成综合性能更好的材料。
脱硫功能化离子液体新材料的研究主要集中于含有氨基功能基团的胍类、咪唑类、醇胺类等[3-13]。胍类离子液体具有较高的热稳定性和化学稳定性,但具有脱硫成本高、黏度大等缺点;醇胺类离子液体吸收SO2机理为弱的化学键结合,对低浓度SO2的吸收效果较好,但该类离子液体同时对烟气中的CO2有一定吸收作用,吸收选择性不佳;咪唑类离子液体容易解吸,但吸收量较小。因此,设计合成一种成本低、黏度低且脱硫性能好的离子液体具有重要的实际意义。
本工作以廉价的正丙胺及苯酚、乳酸、四氮唑乙酸为原料,采用一步法合成了3种丙胺类离子液体,并将其用于SO2的吸收。
1 实验部分
1.1 试剂和仪器
正丙胺、苯酚、乳酸、四氮唑乙酸、无水乙醇:分析纯。
DF-101S型集热式恒温加热磁力搅拌器:巩义市予华仪器有限公司;DZ-1A型真空干燥箱:天津泰斯特仪器有限公司;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂;SO2钢瓶、N2钢瓶、CO2钢瓶:北氧特种气体研究所;FTS135型傅里叶变换红外光谱仪:美国伯乐公司;MDY-2型电子密度仪:上海民仪电子有限公司;DCAT11EC型表面张力仪:德国Dataphysics公司;1834型石油毛细管黏度计:浙江椒江玻璃仪器厂;AVANCE500MHz型核磁共振仪:瑞士布鲁克公司;Q600型差热-热重联用热分仪:美国TA公司。
1.2 离子液体的合成
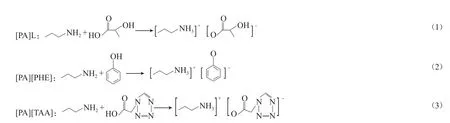
[14],通过一步中和反应合成离子液体:将盛有200 mL无水乙醇的500 mL三口烧瓶置于0 ℃的恒温水浴锅中,开启磁力搅拌;将正丙胺(0.29 mol)和乳酸(0.20 mol)依次加入三口瓶中,反应17 h;将反应后的混合物于65 ℃下旋转蒸发2 h,除去过量的丙胺和溶剂乙醇;将旋蒸后得到深褐色液体置于80 ℃真空干燥箱中干燥24 h,即得丙胺乳酸盐([PA]L),收率为87.4%。分别用苯酚和四氮唑乙酸替换乳酸,得到褐色的丙胺苯酚盐([PA][PHE])和土黄色的丙胺四氮唑乙酸盐([PA][TAA]),收率分别为95.6%和99.7%。反应方程见式(1)~(3)。
1.3 离子液体的脱硫性能评价
1.3.1 离子液体对SO2的吸收
吸收实验流程见图1。由图1可见,气体从SO2钢瓶流出后,经质量流量计通入吸收/解吸装置,与离子液体充分接触后排出,经漏斗通入尾气吸收装置(盛有NaOH溶液的烧杯)。吸收/解吸装置的外管直径为19 mm,内管直径由上到下从8 mm逐渐减至2 mm。实验时,将一定量的离子液体置于吸收/解吸装置中,然后于一定温度下通入SO2气体,每10 min称重一次,直至质量恒定。以SO2与离子液体的摩尔比(n(SO2)∶n(IL))来表征离子液体对SO2的吸收量;以吸收平衡时SO2与离子液体的摩尔比(ne(SO2)∶ne(IL))来表征离子液体的脱硫能力。

图1 吸收实验流程
1.3.2 离子液体的解吸和循环使用
将SO2钢瓶换为N2钢瓶。将吸收饱和的离子液体于一定温度下用N2吹扫的方式进行解吸,每10 min称重一次,直至质量恒定。重复吸收/解吸实验,共循环7次。以解吸的SO2与离子液体的摩尔比(∆n(SO2)∶n(IL))来表征SO2的解吸量。
1.3.3 离子液体对SO2和CO2的吸收选择性
将SO2钢瓶换为CO2钢瓶,按1.3.1节步骤进行CO2吸收实验。以吸收平衡时SO2与CO2的摩尔比(ne(SO2)∶ne(CO2))来表征离子液体对SO2的吸收选择性。
1.4 分析方法
采用分析天平直接称重吸收/解吸装置,测定吸收/解吸的SO2或CO2质量,计算气体与离子液体的摩尔比。
采用TG,FTIR,NMR技术对离子液体进行表征。分别采用电子密度仪、石油毛细管黏度计、表面张力仪测定离子液体的密度、黏度、表面张力。
2 结果与讨论
2.1 离子液体的理化性质
2.1.1 热稳定性
3种离子液体的TG曲线图见图2。由图2可见:[PA][PHE]在118 ℃时逐渐分解;[PA]L的热稳定性高于[PA][PHE],210 ℃开始分解;[PA][TAA]的分解温度为300 ℃。3种离子液体均具有较高的热稳定性,其高低顺序为:[PA][TAA]>[PA]L>[PA][PHE]。
2.1.2 物性
离子液体的物性研究将为工业应用提供重要的基础数据。在常温(25 ℃)下,3种离子液体的物性见表1。由表1可见:与其他两种离子液体相比,[PA][TAA]的密度和表面张力都较高,而[PA][PHE]的密度和表面张力均最小;[PA][PHE]的黏度远小于[PA]L和[PA][TAA],同时也远小于文献[15]报道的4种咪唑类/醇胺类离子液体。

图2 3种离子液体的TG曲线图
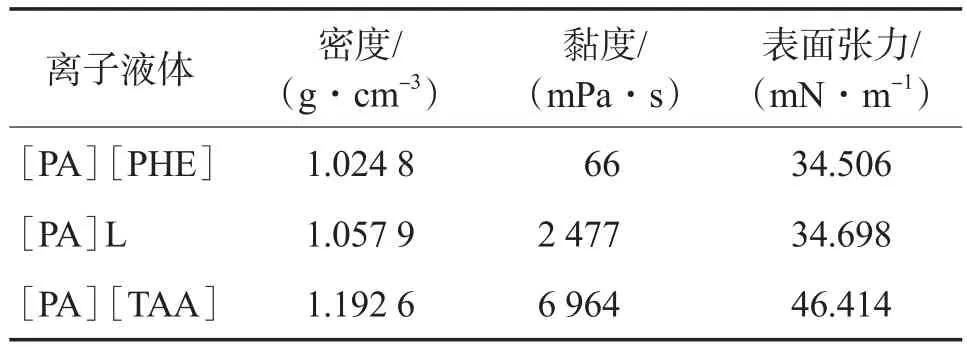
表1 3种离子液体的物性
2.2 离子液体的脱硫性能
2.2.1 温度对离子液体脱硫能力的影响
温度对离子液体脱硫能力的影响见表2。由表2可见,随温度的升高,胺类离子液体对SO2的吸收能力逐渐降低。这是由于:从吉布斯自由能的变化角度来看,对气体的吸收是熵变小于零的过程,温度越低,自由能变就越小,吸收越倾向于自发进行;从分子间作用力来看,SO2与脱硫剂间靠范德瓦耳斯力和较弱的化学键相结合,并不牢固,温度升高时,SO2分子在脱硫剂上的附着力减小,解吸趋势增强[16-17]。由表2还可见,在实验范围内3种离子液体对SO2的吸收能力均较强,30 ℃时[PA][TAA]的ne(SO2)∶ne(IL)最高,为0.904。与文献[16]和[18]报道的几种胍类和咪唑类离子液体相比,3种丙胺类离子液体的脱硫能力要远优于它们。其中,[PA][PHE]因黏度低而更具工业应用价值。
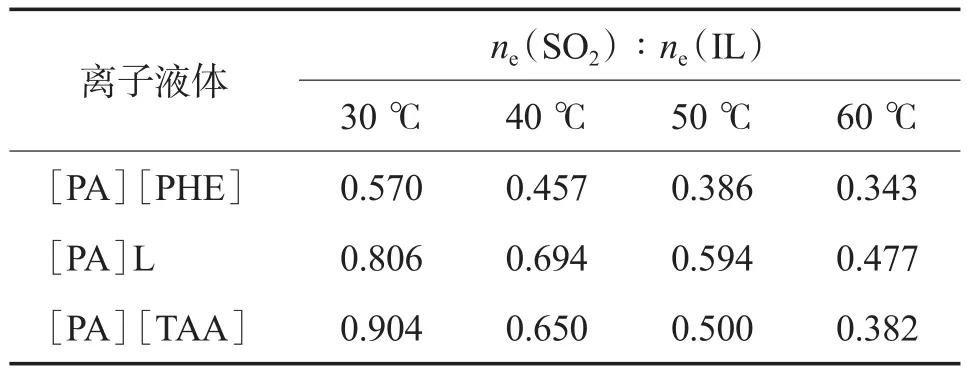
表2 温度对离子液体脱硫能力的影响
2.2.2 脱硫速率
离子液体的工业应用要求脱硫速率快。30 ℃下,3种离子液体的SO2吸收量随吸收时间的变化见图3。由图3可见:75 min时,3种离子液体对SO2的吸收量均已达到吸收平衡时的85%以上,吸收速率快;3种离子液体中,[PA][PHE]的吸收速率最快,75 min时已基本达吸收平衡,而[PA]L和[PA][TAA]分别需要90 min和120 min。
2.2.3 SO2的解吸
温度对离子液体解吸SO2的影响见表3。由表3可见:吸收SO2饱和的[PA][PHE]在100 ℃下就能基本解吸完全;而对于[PA]L和[PA][TAA],则需在110 ℃下才能完全解析。上述结果表明,丙胺类离子液体间的范德瓦耳斯力与化学键较易被破坏,解吸较容易,有利于工业化应用。

图3 3种离子液体的SO2吸收量随吸收时间的变化
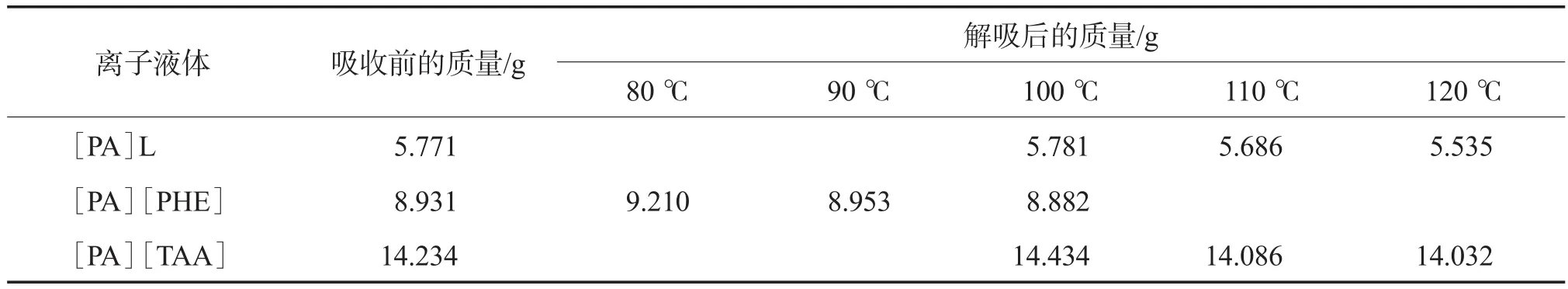
表3 温度对离子液体解吸SO2的影响
解吸速率关系到离子液体再生的能耗问题,对其工业应用具有重要实际意义。相应温度下([PA][PHE]在100 ℃下、[PA]L和[PA][TAA]在110 ℃下),3种离子液体的SO2解吸量随解吸时间的变化见图4。由图4可见:随解吸时间的延长,∆n(SO2)∶n(IL)趋于平缓,解吸完全;30 min时,离子液体的解吸率均达90%以上,解吸速率很快。
2.2.4 离子液体对SO2和CO2的吸收选择性
30 ℃时,离子液体对SO2和CO2的吸收选择性见表4。由表4可见,3种离子液体的选择性大小顺序为[PA]L>[PA][PHE]>[PA][TAA],且对CO2的吸收能力均远低于文献[14]报道的3种胍类离子液体。与胍类离子液体相比,丙胺类离子液体用于烟气脱硫在选择性方面更具优势,对SO2的吸收具有高选择性。

图4 3种离子液体的SO2解吸量随解吸时间的变化

表4 离子液体对SO2和CO2的吸收选择性
2.2.5 离子液体的循环使用性能
3种离子液体的循环使用性能见图5。由图5可见:循环使用6次,ne(SO2)∶ne(IL)略有减小,[PA][PHE],[PA]L,[PA][TAA]分别减少0.131,0.135,0.159;3种离子液体均保持了较高的脱硫能力。对循环使用后的离子液体进行了NMR表征,发现离子液体结构无变化。上述结果表明,3种丙胺类离子液体的循环使用性能较好。
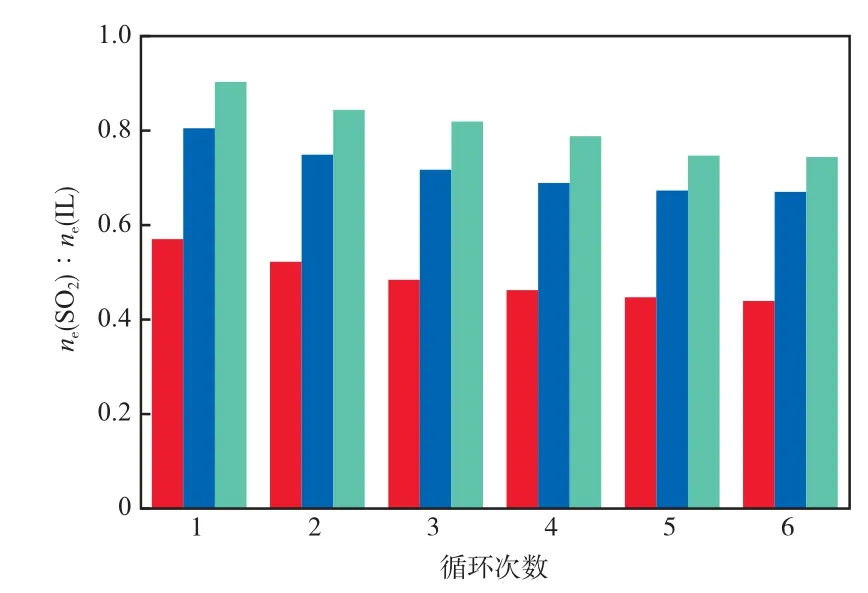
图5 3种离子液体的循环使用性能
2.3 脱硫机理的探讨
离子液体的脱硫过程中普遍存在物理吸收,物理吸收主要靠阳离子上的π电子和SO2分子之间的范德瓦耳斯力;而部分离子液体(如胍类离子液体[19])的脱硫过程中也存在化学吸收,化学吸收主要靠氨基与SO2形成化学键。3种离子液体吸收SO2前后的FTIR谱图见图6。由图6可见:与吸收前相比,吸收SO2后的离子液体分别于954 cm-1和1 412 cm-1附近新出现了S—O—H键和S=O键的特征吸收峰,这表明3种丙胺类离子液体对SO2均存在化学吸收。化学吸收方程式见式(4)。

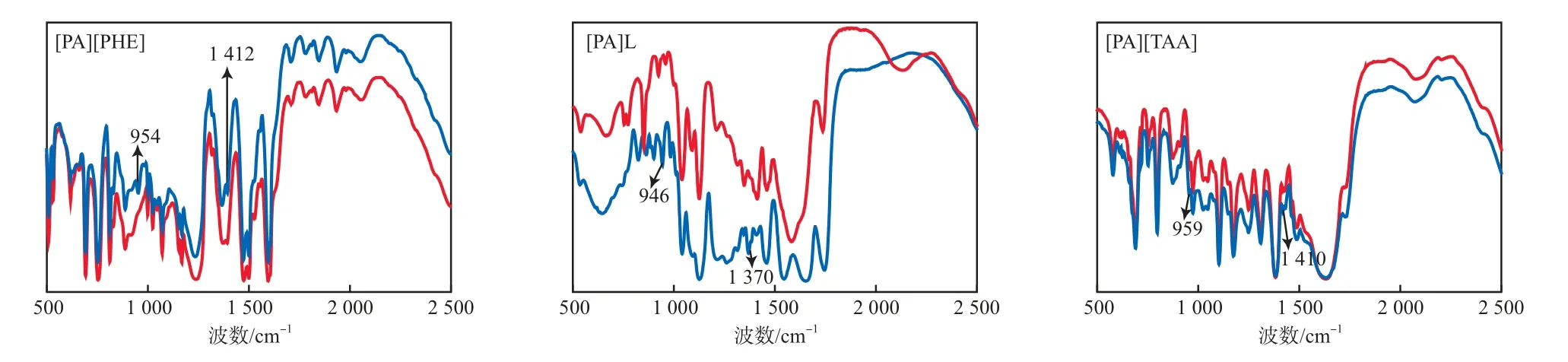
图6 3种离子液体吸收SO2前后的FTIR谱图
3 结论
a)以正丙胺和苯酚、乳酸、四氮唑乙酸为原料,采用一步法合成了[PA][PHE],[PA]L,[PA][TAA]3种离子液体。
b)3种离子液体均具有较高的热稳定性;25 ℃下,[PA][TAA]的密度和表面张力均较高,而[PA][PHE]的黏度远小于[PA]L和[PA][TAA],仅为66 mPa·s。
c)3种离子液体的脱硫能力均较高,且吸收速率快;30 ℃下吸收平衡时,SO2与[PA][PHE],[PA]L,[PA][TAA]的摩尔比分别为0.570,0.806,0.904。
d)3种离子液体的解吸较容易,对SO2的吸收具有高选择性,且循环使用性能较好。
e)丙胺类离子液体对SO2同时存在物理吸收和化学吸收作用。
参 考 文 献
[1] 李长海,汪颖军,孙丽丽. 烟道气脱硫技术研究进展[J]. 西部煤化工,2007(2):63 - 68.
[2] 张星辰. 离子液体:从理论基础到研究进展[M]. 北京:化学工业出版社,2009:45.
[3] Wu Weize,Han Buxing,Gao Haixiang,et al. Desulfurization of fl ue gas:SO2absorption by an ionic liquid[J]. Angew Chem Int Ed,2004,43(18):2415 - 2417.
[4] Rasmussen S B,Huang J,Riisager A,et al. Flue gas cleaning with alternative processes and reaction media [J]. ECS Trans,2007,3(35):49 - 59.
[5] Yuan Xiaoliang,Zhang Suojiang,Lu Xingmei. Hydroxyl ammonium ionic liquids: Synthesis,properties,and solubility of SO2[J]. J Chem Eng Data,2007,52(2):596 - 599.
[6] Zhai Linzhi,Zhong Qin,He Chuan,et al. Hydroxyl ammonium ionic liquids synthesized by water-bath mi-crowave:Synthesis and desulfurization[J]. J Hazard Mater,2010,177(1/2/3):807 - 813.
[7] Hong Sung Yun,Im Jinkyu,Palgunad Jelliarko,et al. Ether-functionalized ionic liquids as highly effi cient SO2absorbents[J]. Energy Environ Sci,2011,4(5):1802 - 1806.
[8] 李娟. 咪唑类离子液体性质、制备及应用的研究进展[J]. 山东化工,2009,38(5):35 - 39.
[9] Ren Shuhang,Hou Yucui,Wu Weize,et al. Properties of ionic liquids absorbing SO2and the mechanism of the absorption[J]. J Phys Chem B,2010,114 (6):2175 - 2179.
[10] 中国石油大学(北京). 用于吸收酸性气体的含胺基离子液体及其制备方法与应用:2010102796347 [P]. 2013-05-15.
[11] 张英锋,李长江,包富山,等. 离子液体的分类、合成与应用[J]. 化学教育,2005(2):7 - 12.
[12] 陈理. 国外烟气脱硫脱硝技术开发近况[J]. 化工环保,1997,17(3):17 - 22.
[13] 邱正秋,黎建明,任艳丽,等. 烟气脱硫溶液中硫酸根的去除[J]. 化工环保,2014,34(2):133 - 136.
[14] Shang Ying,Li Hongping,Zhang Suojiang,et al. Guanidinium-based ionic liquids for sulfur dioxide sorption[J]. Chem Eng J,2011,175:324 - 329.
[15] 任楠楠. 离子液体体系密度、黏度及表面张力的测定及研究[D]. 北京:北京化工大学,2013.
[16] Huang Jun,Riisager A,Berg R W,et al. Tuning ionic liquids for high gas solubility and reversible gas sorption[J]. J Mol Catal A:Chem,2008,279 (2):170 - 176.
[17] Zhang Luhong,Zhang Zijian,Sun Yongli,et al. Ether-functionalized ionic liquids with low viscosity for effi cient SO2capture [J]. Ind Eng Chem Res,2013,52(46):16335 - 16340.
[18] Ren Shuhang,Hou Yucui,Tian Shidong,et al. Deactivation and regeneration of an ionic liquid during desulfurization of simulated fl ue gas[J]. Ind Eng Chem Res,2012,51(8):3425 - 3429.
[19] Wang Congmin,Cui Guokai,Luo Xiaoyan,et al. Highly effi cient and reversible SO2capture by tunable azole-based ionic liquids through multiple-site chemical absorption [J]. J Am Chem Soc,2011,133:11916 - 11919.
(编辑 魏京华)
Preparation of propylamine-based ionic liquids and their desulfurization properties
Liu Chao,Wang Jianying,Cheng Liubei,Jiang Haichao,Hu Yongqi
(School of Chemical and Pharmaceutical Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
The 3 kinds of propylamino-based ionic liquids including[propylamine][lactate]([PA]L),[propylamine][phenol]([PA][PHE]),[propylamine][1H-tetrazole-1-acetic acid]([PA][TAA])were one-step synthesized for SO2absorption using cheap propylamine,phenol,lactic acid,1H-tetrazole-1-acetic acid as raw materials. Their physical and chemical indexes were determined,their desulfurization properties were investigated and the mechanism of SO2absorption was discussed. The experimental results show that:These 3 kinds of ionic liquid exhibit good thermal stability;At the temperature of 25 ℃,the density and surface tension of [PA][TAA] are higher than those of others,while the viscosity of [PA][PHE] is 66 mPa·s,far lower than that of[PA]L and[PA][TAA];The desulfurization capabilities of the 3 ionic liquids are great,and the absorption rates of them are fast;When the absorption is in equilibrium at 30℃,the mole ratio of SO2to [PA][PHE],[PA]L,[PA][TAA] are 0.570,0.806,0.904 respectively;The 3 ionic liquids can desorb SO2easily,and show good selectivity and reusability for SO2absorption;The chemical absorption and physical absorption of propylamino-based ionic liquids to SO2are both existing.
ionic liquid;desulfurization;viscosity;propylamine;absorption;desorption
O647.32
A
1006-1878(2016)01-0078-06
10.3969/j.issn.1006-1878.2016.01.016
2015 - 08 - 10;
2015 - 10 - 28。
刘超(1989—),男,河北省唐山市人,硕士生,电话 15226553228,电邮 1004503081@qq.com。联系人:王建英,电话 13230428480,电邮 jenneywjy@126.com。
国家自然科学基金项目(21206030)。

