高效液相色谱/四级杆飞行时间质谱法筛选产溶血磷脂酸芽胞杆菌
郑雪芳,陈 峥,刘 波,朱育菁,史 怀
(福建省农业科学院农业生物资源研究所,福建 福州 350003)
高效液相色谱/四级杆飞行时间质谱法筛选产溶血磷脂酸芽胞杆菌
郑雪芳,陈 峥,刘 波*,朱育菁,史 怀
(福建省农业科学院农业生物资源研究所,福建 福州 350003)
溶血磷脂酸(lysophosphatidic acid,LPA)是一种重要细胞外信号递质和细胞内第二信使。本研究采用高效液相色谱/四级杆飞行时间质谱(HPLC-QTOF-MS)技术对34株不同种类芽胞杆菌的代谢物进行测定。结果表明,供试的菌株中只有1株枯草芽胞杆菌BacillussubtilisFJAT-8784的代谢物中检测出产溶血磷脂酸,与Metlin代谢物质谱数据库中溶血磷脂酸的匹配得分达96.73,该化合物的质子化分子离子[M+H]+质荷比为439.281 9,质量数为438.275 8,推断出其分子式可能为C21H43O7P,其相对含量占发酵上清液总代谢物的1.32%。
芽胞杆菌;溶血磷脂酸;高效液相色谱/四级杆飞行时间质谱
溶血磷脂酸(lysophosphatidic acid,LPA),化学结构:1-酰基-2-羟基-3-磷酸甘油(1-acyl-2-hydroxy-sn-glycerol-3-phosphate),CAS:944265-88-7。LPA是溶血磷脂的活性成分之一,为一种重要细胞内第二信使,对细胞的生长、增殖、分化及细胞内信息传递产生多种影响,在维持机体正常的生理功能,参与各种病理过程的发生发展均有着重要的作用[1]。美国罗德岛大学(university of Rhode Island)的研究人员发现LPA通过干扰病原菌生物膜的形成,可千倍增强抗生素效果,使得一些较老的β-内酰胺类抗生素能再次使用,而且可降低抗生素的使用剂量[2]。Zhang等[3]研究了LPA抗乳房癌的特性,Schleicher等[4]研究了LPA抗辐射敏化作用,Nikitopoulou等[5]研究了LPA治疗关节炎作用。
关于溶血磷脂酸来源主要采用化学合成和酶法合成,Jiang等[6]研究了PLA的选择性合成。陈家华等[7]研究了溶血磷脂酸(LPA)的化学合成方法,通过合成重要中间体2-O-苄基甘油,接着先进行脂肪酰化,然后用氯代磷酸二苯酯作为磷酰化试剂进行磷酰化,最后用PtO2/H2这一还原方法将苄基和苯基同时还原去保护,得到了目标分子——酰基LPA,与此同时,利用相似的方法,醚键LPA也被成功地合成。关于微生物产生LPA研究报道较少,Hara等[8]报道了枯草芽胞杆菌甘油醛3-磷酸(sn-glycerol-3-phosphate (G3P))代谢过程发现LPA的产生,Lu 等[9]发现了肺炎链球菌Streptococcuspneumoniae细胞膜磷脂合成过程产生LPA。
高效液相色谱/四级杆飞行时间质谱(HPLC-QTOF-MS)联用技术是20世纪70年代发展起来的一门综合性分析技术,具有高分离能力、高灵敏度、应用范围广和极强的专属性等特点[10]。本研究利用HPLC-QTOF-MS法对福建省农业科学院农业生物资源研究所保存的不同种类及地理来源的芽胞杆菌进行溶血磷脂酸(LPA)普筛,筛选出具产生LPA的芽胞杆菌,为具有活性芽胞杆菌代谢物的进一步开发应用奠定基础。
1 材料与方法
1.1 试验材料
供试的34株不同种类的芽胞杆菌由福建省农业科学院农业生物资源研究所保存(表1)。芽胞杆菌的固体培养基为LB,购买自上海生工。发酵培养基为胰蛋白胨大豆肉汤培养基(TSB),购买自美国BD公司。试验试剂:色谱纯乙腈购买自美国JT Baker公司;色谱纯乙酸铵(CNW)购买自上海安谱科学仪器有限公司。试验仪器:液相四级杆飞行时间质谱联用仪Agilent 1260/6520为美国安捷伦科技公司生产。

表1 供试芽胞杆菌菌株Table 1 Bacillus strains used

(续上表)
1.2 试验方法
发酵液制备: 供试芽胞杆菌在LB培养基上活化,30℃培养24 h后,转接至20 mL LB种子培养基中,30℃、180 r·min-1振荡培养12 h,为种子液。取种子液按1%接种量接入TSB液体培养基中,30℃、180 r·min-1振荡培养48 h。将发酵液密封,4℃冰箱中备用。样品制备:取50 mL 芽胞杆菌发酵液,8 000 r·min-1离心15 min,取上清液,过0.22 μm微孔滤膜后,转置GC小瓶,4℃冰箱保存备用。
HPLC条件:色谱柱为Agilent ZORBAX Extend C18(2.1 mm× 50 mm, 1.8 Micron),柱温35℃,进样量为2 μL。流动相:A液为10 mmol·L-1的乙酸, B液为乙腈;流速为0.2 mL·min-1;梯度洗脱程序:0~3 min为90% B和10% A,3~25 min为50% B和50% A,25~35 min为90% B和10% A。QTOF-MS运行条件:正离子模式,干燥气温度为300℃,干燥气流速为5 L·min-1,雾化器压力为30 psig,毛细管电压为3 500 V,裂解电压为175 V,Skimmer为65.0 V,质量范围:150~1 000 m·z-1。
2 结果与分析
2.1 产溶血磷脂酸芽胞杆菌的筛选
利用HPLC-QTOF-MS技术检测到供试的34个不同种类芽胞杆菌中只有1株产溶血磷脂酸,为枯草芽胞杆菌FJAT-8784,其他菌株暂无检出该成分。菌株FJAT-8784的溶血磷脂酸与Metlin代谢物质数据库检索到的溶血磷脂酸匹配得分为96.73。枯草芽胞杆菌FJAT-8784胞外代谢物中溶血磷脂酸相对含量占其发酵上清液总代谢物的1.32%。
2.2 芽胞杆菌来源的溶血磷脂酸成分分析
采用HPLC-QTOF-MS技术对34株不同种类芽胞杆菌发酵上清液中的代谢物进行测定后,利用Mass Hunter软件,对原始数据进行分子特征提取,然后将它们在Metlin代谢物质谱数据库中进行检索比对而获得各代谢物的信息。结果表明,从枯草芽胞杆菌FJAT-8784的发酵上清液中检测出溶血磷脂酸(LPA),色谱图显示其特征峰的保留时间为25.90 min,离子响应度为5.90×105(图1)。FJAT-8784中LPA的扫描质谱图(图2)和分子特征提取质谱图(图3)提供了相应同位素峰的相对丰度和同位素峰的间距。
采用正离子模式电离,正离子模式下产生 [M+H]+、[M+Na]+、[M+NH4]+、[M+K]+等,根据表2化合物鉴定结果显示,化合物的质子化分子离子[M+H]+质荷比为439.281 9,因而该成分质量数为438.275 8,进而推断出其分子式可能为C21H43O7P,该化合物名称为溶血磷脂酸(LPA),其分子结构见图4。
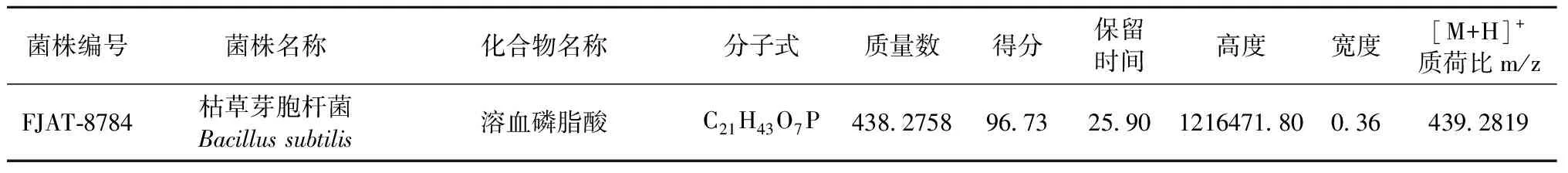
表2 化合物鉴定结果Table 2 Identification of related compound
3 讨论与结论
LPA主要来源于血小板,具有生长激素样效应,在各项细胞效应中起重要的信号转导作用[11]。LPA主要功能有以下几点:(1)促进细胞有丝分裂。Dunlop等[12]在人胰岛细胞上发现LPA能激活细胞周期蛋白依赖性激酶(CDK4),促进其与四环素D1(cycline D1)形成复合物,使细胞从G1期转入S期;(2)抗细胞淍亡。Murph等[13]首次报道LPA与Gi偶联受体结合,可以抑制胱门蛋白酶(caspases)的活性,上调细胞凋亡相关基因Bcl-2的表达,使致癌基因与抑癌基因比例失调,肿瘤细胞淍亡数目下降;(3)影响神经细胞形态。张兆辉等[14]证明LPA具有明显的剂量信赖性的神经毒性作用,可诱导细胞内合成活性氧(ROS)形成而发生氧化应激导致神经元凋亡。
关于细菌产溶血磷脂酸的研究报道较少,Hiraoka等[15]报道枯草芽胞杆菌RB14能产LPA。Hara 等[8]研究枯草芽胞杆菌甘油醛3-磷酸(sn-glycerol-3-phosphate (G3P)酰化过程,发现了LPA的产生。Lu等[9]发现了肺炎链球菌Streptococcuspneumoniae代谢过程合成LPA。有关芽胞杆菌产LPA的研究报道较少。芽胞杆菌种类多、数量大、能产生多种生物活性物质,已在工农业、医药卫生、环保等领域得到广泛应用[16]。因此,从芽胞杆菌中寻找LPA产物,为开发新型天然的LPA制剂提供很好的条件。本研究在芽胞杆菌产溶血磷脂酸菌株筛选中,使用了HPLC-MS联用技术,相较于传统研究方法,具有高通量、高灵敏度、高分辨率及强大的定性分析能力,适用于大量样品的研究。本研究充分发挥技术优势,实现对产溶血磷脂酸芽胞杆菌菌株的快速筛选,结果表明在供试的34种芽胞杆菌,包括枯黄芽胞杆菌、地衣芽胞杆菌、解淀粉芽胞杆菌等,只有1株枯草芽胞杆菌FJAT-8784能产次生代谢物LPA,这也印证了Hiraoka等的研究,本研究的LPA色谱图显示其特征峰的保留时间为25.90 min,离子响应度为5.90×105,与Metlin代谢物质数据库的溶血磷脂酸匹配得分较高,为96.73,分子式为C21H43O7P,相对含量较高,为1.32%。产溶血磷脂酸枯草芽胞杆菌筛选,使得利用芽胞杆菌作为生物反应器生产LPA成为可能,拓展了LPA来源途径,为生物活性物质LPA的利用奠定基础,有关芽胞杆菌产溶血磷脂酸的代谢机理和应用范围有待进一步研究。
[1]何兰杰. 溶血磷脂酸——一种具有多种生物学功能的磷脂信号分子[J]. 细胞生物学杂志, 2000, 22(3): 121-126.
[2]KROGFELT K A, UTLEY M, KRIVAN H C, et al. Specific phospholipids enhance the activity of β-lactamantibiotics againstPseudomonasaeruginosa[J]. Journal of Antimicrobial Chemotherapy, 2000, 46: 377-384.
[3]ZHANG H L, XU X Y, GAJEWIAK J, et al. Dual activity lysophosphatidic acid receptor Pan-Antagonist/Autotaxininhibitor reduces breast cancer cell migration in vitro and causes tumor regression in vivo [J]. Cancer Research, 2009, 69: 5441.
[4]SCHLEICHER S M, THOTALAL D K. Autotaxin and LPA receptors represent potential molecular targets for the radiosensitization of murine glioma through effects on tumor vasculature [J]. PLoS ONE, 2011, 6(7): e22182.
[5]NIKITOPOULOU I, KAFFE E, SEVASTOU I, et al. A metabolically-stabilized phosphonate analog of lysophosphatidic acid attenuates collagen-induced arthritis [J]. PLoS ONE, 2013, 8(7): e70941.
[6]JIANG G, XU Y, FUJIWARAY, et al. Alpha-substituted phosphonate analogues of lysophosphatidic acid (LPA) selectively inhibit production and action of LPA [J]. ChemMedChem, 2007, 2(5): 679-690.
[7]陈家华, 张延东. 酯键溶血磷脂酸和醚键溶血磷脂酸的全合成[J]. 北京大学学报:自然科学版, 2003, 39(2): 151-157.
[8]HARA Y, SEKI M, MATSUOKA S, et al. Involvement of PlsX and the acyl-phosphate dependent sn-glycerol-3-phosphate acyltransferase PlsY in the initial stage of glycerolipid synthesis inBacillussubtilis[J]. Genes Genet Syst, 2008, 83(6):433-442.
[9]LUY J, ZHANG Y M, GRIMES K D, et al. Acyl-phosphates initiate membrane phospholipid synthesis in gram-positive pathogens [J]. Molecular Cell, 2006, 23: 765-772.
[10]孟兆玲, 齐元英, 柳仁民. 高效液相色谱-质谱联用技术的应用进展[J]. 化学分析计量, 2006, 15(6):99-102.
[11]TANGKIJVANICH P, MELTON A C, SANTISKULVONG C. Rho and p38 MAP kinase signaling pathways mediate LPA-stimulated hepatic myofibroblast migration [J]. Journal of Biomedical Science, 2003,(10): 352-358.
[12]DUNLOP M, MUGGLI E, CLARK E. Association of cyclin-dependent kinase-4 and cyclin D1 in neonatal cells after mitogenic stimulation by lysophosphatidic acid [J]. BiochemBiophys Res Commun, 1996, 218: 132-136.
[13]MURPH M, MILLS G B. Targeting the lipids LPA and SIP and their signaling pathways to inhibit tumour progression [J]. Expert Reviews in Molecular Medicine, 2007,(9): 1-18.
[14]张兆辉, 卫涛涛, 余绍祖, 等. 溶血磷脂酸损伤小脑颗粒神经元并诱导细胞凋亡[J]. 卒中与神经疾病, 2004, 11(6): 321-324.
[15]HIRAOKA H, ASAKA O, ANO T, et al. Characteristics ofBacillussubtilisRB14, coproducer of peptide antibiotics iturin A and surfactin [J]. Journal of General and Applied Microbiology, 1992, 38(6): 635-640.
[16]SANAHUJA G, BANAKAR R, TWYMAN RM, et al.Bacillusthuringiensis: a century of research, development and commercial applications [J]. Plant Biotechnology Journal,2011, 9:283-300.
(责任编辑:林海清)
Screening Lysophosphatidic-acid-producingBacillusUsing HPLC and Quadrupole Time-of-flight Mass Spectrometry
ZHENG Xue-fang, CHEN Zheng, LIU Bo*, ZHU Yu-jing, SHI Huai
(AgriculturalBio-ResourcesInstitute,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350003,China)
Lysophosphatidic acid (LPA) is an important extracellular signal transmitter and intracellular secondary messenger. Metabolites in the supernatants of liquid culture media for 34 strains ofBacilluswere determined by using HPLC and quadrupole time-of-flight mass spectrometry. It was found that the onlyB.subtilisstrain that produced LPA was FJAT-8784. The obtained LPA showed a matching score of 96.73 according to the Metlin database. It had a molecular weight of 438.2758, and a mass to charge ratio of 439.2819. Consequently, the chemical formula for the isolated LPA was assumed to be C21H43O7P. In the supernatant, the total metabolites contained approximately 1.32% LPA.
Bacillus; lysophosphatidic acid; HPLC/quadrupole time-of-flight mass spectrometry
2016-05-23初稿;2016-09-08修改稿
郑雪芳(1977-),女,博士,副研究员,主要从事植物病害生物防治的研究(E-mail:zhengxuefangfz@163.com) *通讯作者:刘波(1957-),男,博士,研究员,主要从事微生物生物技术及农业生物药物研究(E-mail:Fzliubo@163.com)
国家自然科学基金(31370059);福建省自然科学基金项目(2015J01103);福建省科技计划项目——省属公益类科研院所基本科研专项(2014R1018-8)
Q 545
:A
:1008-0384(2016)11-1252-05
郑雪芳,陈峥,刘波,等.高效液相色谱/四级杆飞行时间质谱法筛选产溶血磷脂酸芽胞杆菌[J].福建农业学报,2016,31(11):1252-1256.
ZHENG X-F,CHEN Z,LIU B,et al.Screening Lysophosphatidic-acid-producingBacillusUsing HPLC and Quadrupole Time-of-flight Mass Spectrometry[J].FujianJournalofAgriculturalSciences,2016,31(11):1252-1256.

