高温胁迫下皱纹盘鲍不同养殖群体心率变化比较
林思恒1, 2, 3, 4, 吴富村1, 3, 4, 张国范1, 3, 4
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京100049; 3. 海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266071; 4. 中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071)
高温胁迫下皱纹盘鲍不同养殖群体心率变化比较
林思恒1, 2, 3, 4, 吴富村1, 3, 4, 张国范1, 3, 4
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京100049; 3. 海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266071; 4. 中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071)
高温是海水贝类度夏死亡的环境诱因之一。本研究应用一种非损伤性的心率检测方法, 检测两个皱纹盘鲍养殖群体在高温胁迫条件下心率等生理指标的变化, 尝试以心率变化指标比较这两个群体高温耐受能力。由于高温胁迫下皱纹盘鲍的心率随温度变化的关系符合阿伦尼乌斯(Arrhenius)公式, 且心率随温度上升呈先上升后下降趋势, 该研究通过计算两者直线拟合拐点即阿伦尼乌斯拐点温度(ABT, Arrhenius break temperatures)指标, 用以指示皱纹盘鲍温度耐受程度。以此法对皱纹盘鲍两个群体(高温耐性, 对照)各17个个体进行了测定分析, 结果表明: 两个群体间的ABT存在显著差异, 高温耐性组的皱纹盘鲍的ABT显著高于对照组(P<0.05); 个体ABT指标的高低与测定个体的壳高呈正相关(P<0.05)。本研究首次将探讨了高温胁迫下皱纹盘鲍心率变化规律, 并以ABT为指标分析比较了两个皱纹盘鲍养殖群体间高温耐受能力, 结果对研究皱纹盘鲍和其它贝类温度胁迫下生理响应及抗逆选育具一定借鉴意义。
皱纹盘鲍(Haliotis discus hannai); 心率测定; 高温胁迫; ABT
鲍养殖产业随着杂交技术的产业化应用及浅海养殖技术等的革新, 年产量已超过100000 t。近年来,皱纹盘鲍(Haliotis discus hannai)已经成为福建海区的主要养殖鲍物种, 且福建的养殖鲍产量约占全国总产量85%。然而皱纹盘鲍作为北方自然分布的物种, 在转移到南方海区的养殖过程中, 尤其是近年来遭遇了度夏死亡的问题, 每年的度夏死亡造成了皱纹盘鲍养殖产业的巨大损失[1-2]。
夏季大规模死亡一直是困扰经济贝类的主要问题之一, 虽然根本原因尚未有定论, 但学界普遍认为是环境因素[3-4]、贝类生物的生理状态[5-6]和病原微生物的富集[7-9]等交互作用引起的。高温是导致海水贝类夏季死亡的重要原因, 目前海水贝类高温胁迫的生理响应及适应机制已成为研究热点, 已有许多研究针对贝类动物高温耐受能力进行初步研究, 如对近江牡蛎的致死温度[10]、高温下虾夷扇贝存活率[11]以及皱纹盘鲍幼苗高温存活率的研究[12]。然而这些研究都是采用对贝类动物进行高温胁迫, 逐渐升高处理温度, 当出现死亡时, 记录致死温度的方法, 其表型记录仅为生存与否(二分类数据), 且存在温度测定不够准确的问题。开发新型的测皱纹盘鲍个体的高温耐受能力的检测方法及表型评价方法将有效解决这一问题。
心率的测定是一种重要的反映生物代谢水平变化的方法。衡量高温胁迫时皱纹盘鲍的心率变化可以用于评估皱纹盘鲍对高温的耐受能力。早在1990年, 无脊椎动物心率就能通过红外线信号的方法被稳定测定[13], 阿伦尼乌斯拐点温度(Arrhenius break temperatures, ABT)指标最早在1996年被用于表现潮间带瓷蟹的高温耐受程度[14]。根据阿伦尼乌斯方程,心率与温度两者之间存在线性关系。通常动物体的心率会先随着温度上升而上升, 表现了代谢速率的加快; 当温度超过了动物体的承受范围时, 心率会随着温度上升而下降, 意味着机体受到了影响。这两个阶段过程中心脏活动急剧下降的温度被称为ABT指标, 可以用于量化机体的高温耐受程度。该方法具有非损伤性、进行原位测定的优点, 而且得到的指标可以精准量化, 已经用于滨螺、帽贝和贻贝等动物的心率测定[15-16]。本研究首次探讨了高温胁迫下皱纹盘鲍心率变化规律, 并以ABT指标分析比较了两个皱纹盘鲍养殖群体间高温耐受能力。本文对鲍等温度胁迫下生理响应及抗逆选育等研究等具一定借鉴意义。
1 材料与方法
1.1 材料
本研究选取来自宁德海区(26°69′N, 119°72′E)和青岛海区(36°25′N, 120°69′E)的两个皱纹盘鲍养殖群体(均为一龄个体)。其中宁德海区的皱纹盘鲍群体对度夏存活性状经三代选育, 且一直在南方海区饲养,具有相对较强的温度耐受性。而青岛海区皱纹盘鲍群体作为对照, 未经度夏存活性状选育, 假定其不具备高温耐受性, 称为对照群体。两个皱纹盘鲍群体分别从海区运至实验室后, 在实验养殖池内暂养两周, 期间每日更换海水, 常规方法投喂至实验开始。之后分别从两个群体内挑选17个个体进行心率测定。实验于2014年12月至2015年2月进行, 该阶段实验室养殖池海水温度为10~12℃。
1.2 方法
1.2.1 心率测定方法
心率测定采用一种非损伤性的方法[17-18], 将红外传感器用蓝丁胶(Blu-Tack, Bostik Ltd, UK)固定在鲍鱼心脏对应的壳表面[19]。心跳产生的光电流信号经放大器(AMP 03, Heartbeat monitor, Newshift, Portugal)放大过滤处理后, 被记录并展示在简易示波器软件(Powerlab 8/30, AD Instruments, Germany)上, 利用内置软件(LabChart Version 8.0)可以计算出每分钟心率(bpm)。
1.2.2 升温设备
开始测定时将待测定的皱纹盘鲍个体与设备连接完好后, 放入设定为15℃的控温循环水浴锅内(鲍鱼实际放置在水浴锅内的装有海水的圆形玻璃槽(25 cm× 25 cm×20 cm)内, 所测温度均为海水温度, 下同)。当个体心率信号稳定后, 开始升高水浴温度, 每次增加0.5℃。每增加一次温度后至海水温度也上升0.5℃后, 维持2 min后再继续升温, 直至皱纹盘鲍腹足从玻璃槽壁脱离。实验过程中通过温度测定仪严格记录温度(Fluke 54II, Fluke, WA, USA)。结合持续收集的心跳信号, 可以得出升温过程中每个温度对应的心率, 通过计算求得每个个体的ABT(℃)。
1.2.3 不同群体皱纹盘鲍个体心率测定
随机选取高温耐性和对照组的皱纹盘鲍群体一龄个体各17个, 进行心率测定, 升温区间为15~35℃,持续时间不超过2 h, 并对每个实验个体进行生长性状测定, 包括壳长(mm)、壳高(mm)、壳宽(mm)和体湿质量(g)。
1.3 数据处理
用示波器Powerlab内置软件LabChart分析不同时间点的心率数据, 选取升温过程中温度稳定阶段期间的心率作为该温度对应心率。根据阿伦尼乌斯方程
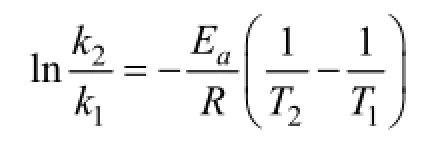
式中, k为每分钟周期数(bpm); T为绝对温度(K); Ea为活化能与R为前因子均在该公式中被认为常数。
对温度与心率进行变换后, 利用Excel 2013和SPSS20.0 (IBM SPSS Inc., Chicago, IL, USA)对数据进行作图与分析。使用Excel的线性回归分析功能对每个皱纹盘鲍个体心率值上升与下降阶段进行直线拟合, 继而求出交点温度ABT指标。利用独立样本t检验方法分析两个群体间的ABT指标显著性差异,显著性差异表示为P<0.05。为分析皱纹盘鲍体尺及个体质量性状对心率ABT指标的影响, 对不同个体的生长性状与ABT指标进行相关分析并计算Pearson相关系数分析, 显著相关表示为P<0.05。
2 结果
两个皱纹盘鲍群体17个个体均获得有效心率测定结果。图1为个体心率随温度变化示意图, 可以看出不同温度下心率周期的明显差异。图2为高温耐性和对照群体中的各一个个体心率变化曲线的直线拟合, 通过该直线拟合获得该个体的ABT指标。表1为34个个体心率测定结果与生长性状测定结果(部分个体因死亡未记录)。计算获得两个群体的平均ABT指标, 高温耐性群体为(28.18±0.45)℃; 对照群体为(27.75±0.56)℃。经t检验, 两个群体的ABT存在显著性差异, 高温耐性组皱纹盘鲍的ABT显著高于对照组, P为0.019。分析检测个体的生长性状与ABT的关系, 发现只有壳高与ABT呈显著相关, 相关系数为0.370, P为0.048。
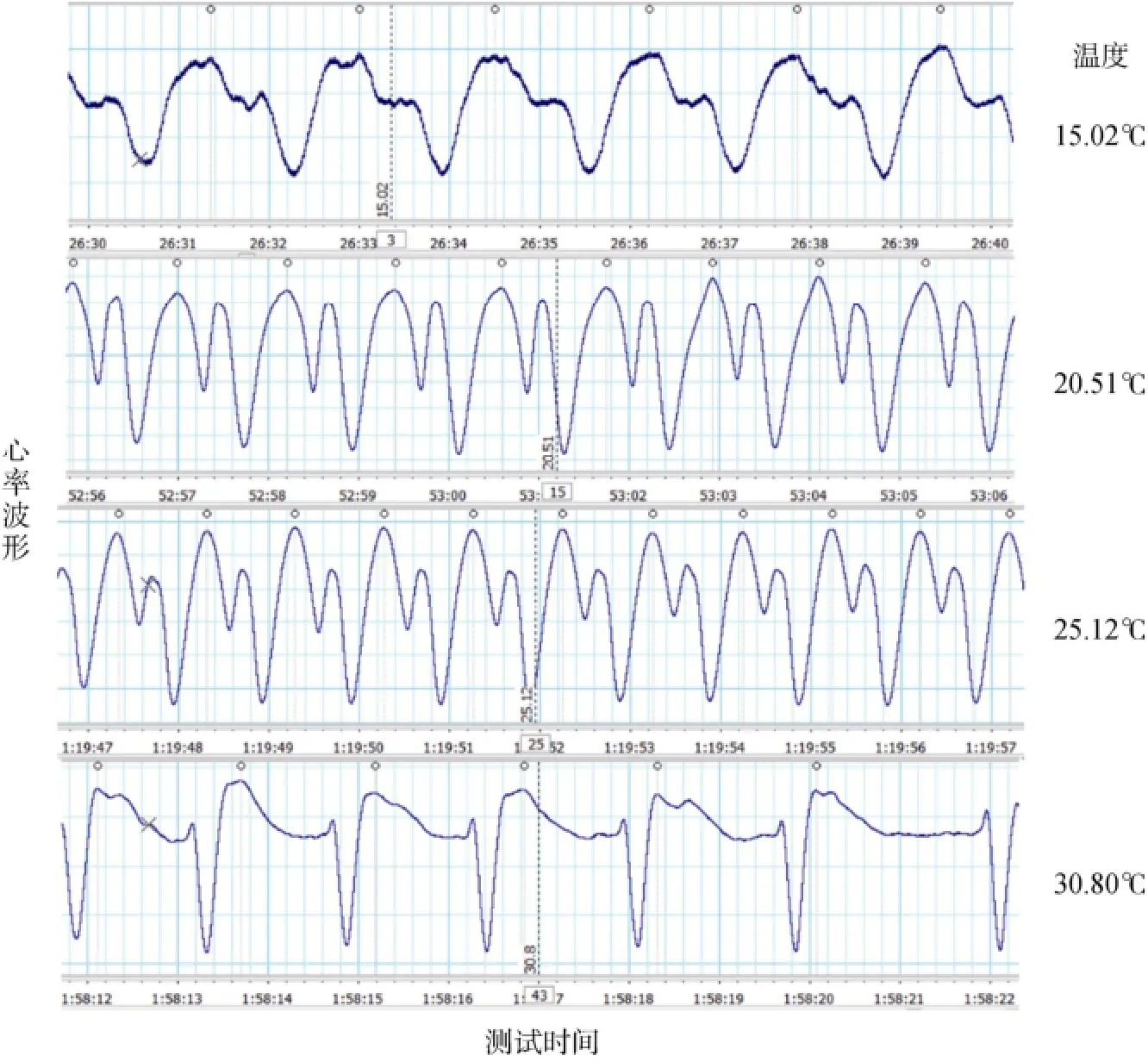
图1 心率变化示意图Fig. 1 Variation in cardiac response to thermal stress in Pacific abalone
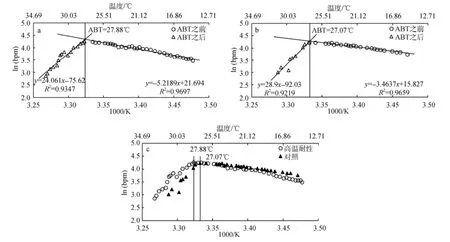
图2 ABT计算示意图Fig. 2 ABT calculation method
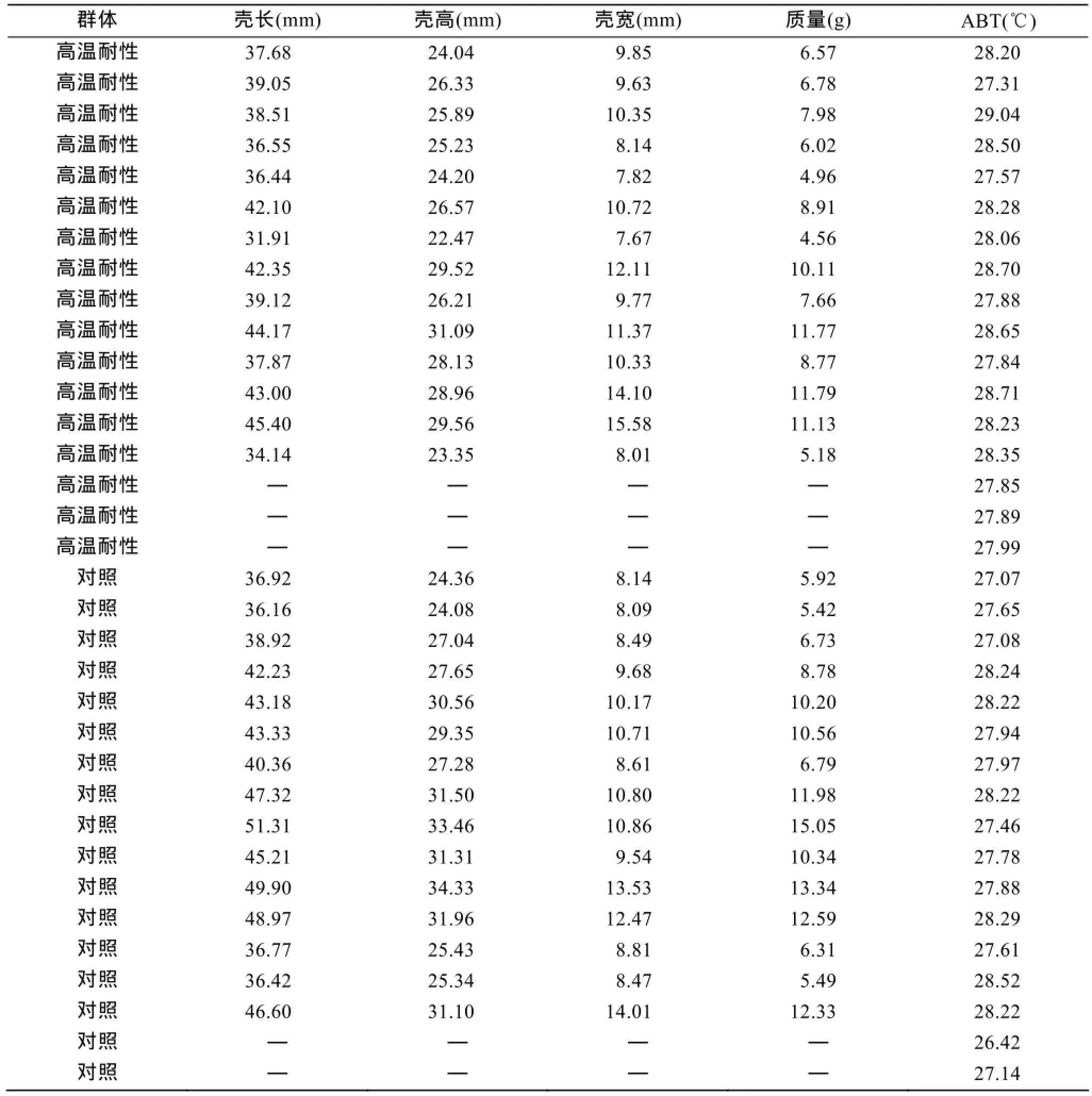
表1 高温耐性与对照群体皱纹盘鲍ABT(℃)与生长性状Tab. 1 ABT and growth traits of resistant and contrast abalones
3 讨论
3.1 皱纹盘鲍ABT指标的可行性分析
ABT指标在滨螺、帽贝和贻贝中已有广泛研究。这些贝类大多都是潮间带生物, 它们多具有广温性的特点, 有利于ABT指标的测定。以帽贝为例, 温度适宜范围从4~50℃, 且不同物种之间的差异明显,相差可达5℃以上。ABT指标对于帽贝而言, 不仅可以衡量其高温耐受程度, 更可作为一个环境监测指标反映不同种帽贝所处环境条件的差异[20]。虽然皱纹盘鲍不具备广温性, 但本实验证明了该方法在皱纹盘鲍中的可行性。首先, 两个群体的ABT指标的标准差均不高说明ABT指标的组内个体间差异不大。其次, 高温耐性组ABT显著高于对照组, 因此用于比较两个群体的高温耐受程度是科学可行的。值得注意的是一龄个体是最适合开展心率测定的,由于一龄个体体积较小(平均壳长为40 mm), 心脏对应位置壳表面积小于红外探头截面(4 mm×5 mm),可以快速稳定获得心率信号。而蓝丁胶的粘贴需要将鲍鱼壳表面擦干以增加粘贴时长, 一龄个体有利于缩短捕获心率的时间。所以一龄个体更适合进行心率测定实验。通过红外探头粘贴在鲍鱼壳表面以检测心率的方法也是皱纹盘鲍的生长指标中只有壳高与心率存在显著相关的主要原因, 壳高会直接影响到心率信号的获取。
开展心率测定的时间是影响实验的重要因素。皱纹盘鲍的最适生长温度范围是10~22℃[21], 监测皱纹盘鲍心率的起始温度必须在该温度范围内, 且起始温度越低越好。因为计算ABT指标过程中, 心率随温度上升而上升的阶段越长, 趋势线的计算越准确。所以在水温低的时候, 如11月至2月, 是进行心率测定的最佳时间。测定心率时还应注意实验时长的控制, 本实验每个个体的心率测定时间均控制在2 h以内, 毕竟是在水浴条件内进行实验, 并且还会出现超过ABT后的心率骤降现象, 作为一种非损伤性的检测方法, 实验动物的存活是也关键的考量。虽然本实验有部分个体在测定心率后出现了死亡,但相比传统的表型记录为生存与否以评估高温耐受程度的方法, 已经大幅提高了实验动物的存活率。
然而并非所有贝类生物都适用这一方法。本实验室亦用这一方法对长牡蛎(Crassostrea gigas)和虾夷扇贝(Patinopecten yessoensis)进行心率测定。结果扇贝可以得到有效结果, 而牡蛎难以得到有效的心率信号, 可能与牡蛎表面粗糙有关。
3.2 皱纹盘鲍ABT指标的实际应用
本实验选取的是两个来源清晰, 能够区分高温抗性与对照的群体进行ABT指标的测定。结果与实际相符不仅说明了方法的可行性, 也为该方法作为比较群体或家系的高温耐受程度的标准提供可能。很多品系的皱纹盘鲍经过杂交育种后, 品质得到改良[22-23], 但高温耐受能力作为存活率的关键指标却无法合理科学的量化。心率测定ABT指标的方法有效的改善这一问题, 比较多个家系间皱纹盘鲍的ABT指标就可以比较这些家系的高温耐受程度, 以此作为一种筛选手段, 亦可作为育种值, 针对高温耐性进行选育。该方法不仅快速有效, 还对实验动物具有较低致死性, 可以解决传统的胁迫致死检测法对一些珍贵的家系无法测定高温耐受能力的困扰。
目前主要养殖海区的水温监测系统已经开始使用, 结合皱纹盘鲍ABT指标的推广, 可以在海水温度迫近养殖鲍鱼耐受临界温度时及时调整养殖活动,降低皱纹盘鲍出现严重的度夏死亡的风险。
[1] 吴富村, 张国范. 皱纹盘鲍杂交幼鲍闽东内湾度夏初探[J]. 海洋科学, 2009. 33(10): 9-14. Wu Fucun, Zhang Guofan. Preliminary study on over-summering of juvenile hybrid Pacific abalone in east Fujian inner bay[J]. Marine Sciences, 2009, 33(10): 9-14.
[2] You W, Guo Q, Fan F, et al. Experimental hybridization and genetic identification of Pacific abalone Haliotis discus hannai and green abalone H. fulgens[J]. Aquaculture, 2015, 448: 243-249.
[3] Soletchnik P, Le Moine O, Faury N, et al. Summer mortality of the oyster in the Bay Marennes-Oleron: Spatial variability of environment and biology using a geographical information system (GIS)[J]. Aquatic Living Resources, 1999, 12(2): 131-143.
[4] Berthelin C, Kellner K, Mathieu M. Histological Characterization and Glucose Incorporation into Glycogen of the Pacific Oyster Crassostrea gigas Storage Cells[J]. Marine Biotechnology, 2000, 2(2): 136-145.
[5] Cheney D P, MacDonald B F, Elston R A. Summer mortality of Pacific oysters, Crassostrea gigas (Thunberg): Initial findings on multiple environmental stressors in Puget Sound, Washington, 1998[J]. Journal of Shellfish Research, 2000, 19(1): 353-359.
[6] Wang X, Wang L, Yao C, et al. Alternation of immune parameters and cellular energy allocation of Chlamys farreri under ammonia-N exposure and Vibrio anguillarum challenge[J]. Fish & Shellfish Immunology, 2012, 32(5): 741-749.
[7] Friedman C S, Estes R M, Stokes N A, et al. Herpes virus in juvenile Pacific oysters Crassostrea gigas from Tomales Bay, California, coincides with summer mortality episodes[J]. Diseases of Aquatic Organisms, 2005, 63(1): 33-41.
[8] Garnier M, Labreuche Y, Garcia C, et al. Evidence for the Involvement of Pathogenic Bacteria in Summer Mortalities of the Pacific Oyster Crassostrea gigas[J]. Microbial Ecology, 2007, 53(2): 187-196.
[9] 房沙沙, 林壮炳, 邱礽, 等. 粤东养殖区分离的2株海洋弧菌及其胞外产物对皱纹盘鲍致死毒性的初步分析[J]. 海洋科学, 2013, 37(8): 16-22. Fang Shasha, Lin Zhuangbing, Qiu Reng, et al. The pathogenicities of two Vibrio bacteria and their extracellular products in the Pacific abalone, Haliotis discus hannai farmed in East Guangdong area[J]. Marine Sciences, 2013, 37(8): 16-22.
[10] 张其中, 邱马银, 吴信忠, 等. 热休克诱导近江牡蛎对高温的耐受性[J]. 生态科学, 2005, 24(1): 35-37.Zhang Qizhong, Qiu Mayin, Wu Xinzhong, et al. Heat pretreatment induces thermotolerance in the Jinjiang oyster (Crassostrea ariakensis Gould) [J]. Ecological Science, 2005, 24(1): 35-37.
[11] 郝振林, 刘京哲, 唐雪娇, 等. 高温下3种壳色虾夷扇贝存活率、代谢率、免疫酶活力及HSP70表达的比较研究[J]. 海洋科学, 2015, 39(11). Hao Zhenlin, Liu Jingzhe, Tang Xuejiao, et al. A comparative study of survival, metabolism, immune indicators and HSP70 expression in three kinds of shell colors Japanese scallop Mizuhopecten yessoensis under high temperature stress [J]. Marine Sciences, 2015, 39(11).
[12] 贾艳丽, 王江勇, 刘广锋, 等. 高温胁迫对皱纹盘鲍幼鲍生长和成活的影响[J]. 南方水产科学, 2015(2): 96-100. Jia Yanli, Wang Jiangyong, Liu Guangfeng, et al. Effect of high temperature stress on growth and survival of juvenile Haliotis discus hannai Ino[J]. South China Fisheries Sciences, 2015(2): 96-100.
[13] Depledge M H, Andersen B B. A computer-aided physiological monitoring system for continuous, long-term recording of cardiac activity in selected invertebrates[J]. Comparative Biochemistry & Physiology Part A Physiology, 1990, 96(4): 473-477.
[14] Stillman J, Somero G. Adaptation to temperature stress and aerial exposure in congeneric species of intertidal porcelain crabs (genus Petrolisthes): correlation of physiology, biochemistry and morphology with vertical distribution[J]. Journal of Experimental Biology, 1996, 199(Pt8): 1845-1855.
[15] Marshall D J, Dong Y W, McQuaid C D, et al. Thermal adaptation in the intertidal snail Echinolittorina malaccana contradicts current theory by revealing the crucial roles of resting metabolism[J]. Journal of Experimental Biology, 2011, 214(Pt 21): 3649-3657.
[16] Dong Y-w, Williams G A. Variations in cardiac performance and heat shock protein expression to thermal stress in two differently zoned limpets on a tropical rocky shore[J]. Marine Biology, 2011, 158(6): 1223-1231.
[17] Chelazzi G, Williams G A, Gray D R. Field and laboratory measurement of heart rate in a tropical limpet, Cellana grata[J]. Journal of the Marine Biological Association of the United Kingdom, 1999, 79(4): 749-751.
[18] Han G D, Zhang S, Marshall D J, et al. Metabolic energy sensors (AMPK and SIRT1), protein carbonylation and cardiac failure as biomarkers of thermal stress in an intertidal limpet: linking energetic allocation with environmental temperature during aerial emersion[J]. Journal of Experimental Biology, 2013, 216(Pt 17): 3273-3282.
[19] 梁羡园. 鲍鱼的解剖[J]. 生物学通报, 1959, 2: 62-68. Liang Xianyuan. Anatomy of abalone[J]. Bulletin of Biology, 1959, 2: 62-68.
[20] Prusina I, Sarà G, De Pirro M, et al. Variations in physiological responses to thermal stress in congeneric limpets in the Mediterranean Sea[J]. Journal of Experimental Marine Biology and Ecology, 2014. 456: 34-40.
[21] Hara M, Sekino M. Genetic difference between Ezo-awabi Haliotis discus hannai and Kuro-awabi H.discus discus populations: Microsatellite-based population analysis in Japanese abalone[J]. Fisheries Science, 2005. 71(4): 754-766.
[22] Liang S, Luo X, You W, et al. The role of hybridization in improving the immune response and thermal tolerance of abalone[J]. Fish & Shellfish Immunology, 2014. 39(1): 69-77.
[23] 张国范, 刘晓, 阙华勇, 等.贝类杂交及杂种优势理论和技术研究进展[J]. 海洋科学, 2004, 28(7): 54-60. Zhang Guofan, Liu Xiao, Que Huayong, et al. The theory and application of hybridization and heterosis in marine mollusks[J]. Marine Sciences, 2004, 28(7): 54-60.
Received: Feb.10, 2016
Variation in cardiac response to thermal stress in two different cultured populations of Pacific abalones
LIN Si-heng1,2,3,4, WU Fu-cun1,3,4, ZHANG Guo-fan1,3,4
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, 7 Nanhai Road, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 4. National & Local Joint Engineering Laboratory of Ecological Mariculture, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
Haliotis discus hannai; measuring heart rate; thermal stress; Arrhenius break temperatures
High water temperature is one of the most important reasons for the low summer survival rate of Pacific abalones (Haliotis discus hannai). The temperature that induces cardiac failure in abalone is known as the Arrhenius break temperature (ABT). Survival indicators of Pacific abalones can be obtained by measuring their heart rate. In this study, heart rates were measured using a non-invasive method. We then obtained ABTs as biomarkers and used them to determine the heat resistance of abalones with high accuracy and speed. Abalone heart rates rose as the temperature increased and then dropped abruptly. In this study, we measured the heart rate in 17 resistant abalones and 17 contrast abalones from two different groups. The results indicate that the ABT of the resistant abalones seemed higher (P<0.05) than that of the contrast abalones. In addition, there was a significant (P<0.05) positive correlation between abalone shell height and ABT. For the first time, we determined the heat resistance of Pacific abalones by measuring heart rate and verified the feasibility of the method.
S917.4
A
1000-3096(2016)11-0084-07
10.11759/hykx20160328003
(本文编辑: 梁德海)
2016-02-10;
2016-04-08
国家自然科学基金项目(31302184); 贝类产业技术体系项目(CARS-48); 泰山攀登计划项目
[Foundation: National Natural Science Foundation of China, No. 31302184; The Earmarked Fund for Modern Agro-industry Technology Research System (CARS-48); Taishan Scholars Climbing Program of Shandong]
林思恒(1991-), 男, 福建厦门人, 硕士研究生, 研究方向:海洋贝类遗传育种, E-mail: linsiheng@qq.com; 张国范, 通信作者,研究员, 博士研究生导师, E-mail: gfzhang@qdio.ac.cn

