肝脏上皮样血管内皮瘤的影像特点及临床诊治体会
复旦大学附属肿瘤医院中西医结合科,复旦大学上海医学院肿瘤学系,上海 200032
肝脏上皮样血管内皮瘤的影像特点及临床诊治体会
宁周雨,陈其文,朱晓燕,徐立涛,王海永,庄丽萍,张晨月,孟志强
复旦大学附属肿瘤医院中西医结合科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:肝脏上皮样血管内皮瘤(hepatic epithelioid haemangioendothelioma,HEHE)是一种极为罕见的血管源性肿瘤,临床及影像诊断很容易误诊。本研究通过总结HEHE的临床及影像特点,为今后HEHE的临床诊治提供重要参考。方法:回顾分析复旦大学附属肿瘤医院中西医结合科住院的5例经病理证实的HEHE患者的临床表现、影像特征、病理特点及临床治疗的疗效。结果:5例患者中,男性2例,女性3例,年龄范围26~65岁,平均45.6岁,2例肝内多中心发生,3例全身多组织、多中心发生。B超为等低回声,病灶内无明显血流信号。CT平扫为等低密度,MR平扫为低T1高T2信号,内密度及信号不均匀,CT/MR增强扫描时病灶呈“慢进慢出”式明显、环状强化特点。PET/CT为明显高FDG摄取,且呈延迟显像的特点。DSA造影下见肿瘤血管纤细,肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)术后病灶碘油沉积不理想。显微镜下肿瘤细胞呈上皮样分化并出现细胞质内血管腔形成,免疫组织化学法检测5例均呈CD31和CD34阳性。5例患者均存活,其中2例经TACE联合高强度聚焦超声(high intensity focused ultrasound,HIFU)和(或)射频消融(radiofrequency ablation,RFA)肿瘤局部控制效果显著。结论:HEHE具有特征性的临床表现及影像学特征,目前对于全身多组织、多中心发生的晚期患者,TACE联合HIFU和(或)RFA可能是最有效的方法。
肝肿瘤;上皮样血管内皮瘤;诊断;肝动脉化疗栓塞;高强度聚焦超声;射频消融术
上皮样血管内皮瘤(e p i t h e l i o i d hemangioendothelioma,EHE)是一种少见的血管源性肿瘤,全身多种组织均可发生,包括软组织、淋巴结、骨、肺、肝脏、胸膜、腹膜、皮肤、胃及脑。EHE发生的年龄范围广,且肿瘤发生的部位与年龄及性别有一定规律,如肝脏及肺内肿瘤在中青年女性中常见[1-3]。肝脏上皮样血管内皮瘤(hepatic epithelioid hemangioendothelioma,HEHE)被认为是一种中低度恶性肿瘤,其1年及5年生存率明显高于其他原发肝脏恶性肿瘤,目前其预后影响因素尚不清楚,国内Wang等[4]报道HEHE的3年生存率73.3%,提出年龄大于47岁、有症状及CA-199升高是重要的不良预后相关因素。为提高HEHE诊治相关特点的认识,对复旦大学附属肿瘤医院中西医结合科诊治且病理证实为HEHE的临床表现、诊断及治疗进行详细阐述。
1 资料和方法
1.1 患者资料
2012—2014年在复旦大学附属肿瘤医院就诊的5例患者,男性2例,女性3例,年龄范围26~65岁,平均45.6岁,所有病例均经复旦大学附属肿瘤医院病理科细胞学及免疫组织化学染色确诊。
1.2 影像检查方法
超声:使用美国GE公司的LOG-7,进行彩色多普勒超声检查,探头频率3.0~5.0 MHz。记录肿块部位、大小、形态、回声、包膜及彩色血流表现,肝门淋巴结有无肿大,有无门静脉及下腔静脉内瘤栓。
CT:采用德国Siemens公司的Somatom Sensation64层螺旋CT进行平扫和增强检查,管电压120 kV、管电流160 mA,扫描层厚5 mm,间隔5 mm,矩阵512×512。增强扫描时经肘静脉高压注射对比剂碘普罗胺(370 mgI/mL),注射速率3 mL/s,剂量2.0 mL/kg。
MR:肝脏采用美国GE公司的Signa HDx 1.5 T扫描仪行常规横断面、矢状面或冠状面平扫及增强扫描,层厚8 mm,层间距1 mm。SE T1WI序列:TR 356~860 ms,TE 9~12 ms;T2WI序列:TR 3 000~4 500 ms,TE 84~132 ms。增强扫描采用Gd-DTPA 0.1 mmol/kg,静脉注射后立即行SE T1WI增强扫描,扫描参数同平扫。
PET/CT:采用德国Siemens公司的Biograph® 16HR PET/CT,扫描显像剂为FDG,断层厚度3 mm,扫描前患者空腹6 h以上,静脉注射FDG后,暗室静卧45~60 min,依次行全身螺旋CT扫描和PET发射扫描,整个扫描过程30~40 min完成,图像重建后根据CT资料和核素衰变规律校正,PET及CT图像传送到工作站进行图像对位融合。
DSA:采用德国Siemens公司的Artis zee ceiling DSA造影剂,采用Seldinger穿刺技术,行股动脉穿刺插管,先行选择性腹腔动脉造影,再行肝动脉造影,对比剂每次20~25 mL,注射流率5~7 mL/s,曝光至肝内毛细血管期显示。
1.3 观察指标
5例患者的所有影像资料均由2位放射科副主任医师进行分析,同时每3个月电话随访1次,随访目的主要为获得患者生存情况、疾病进展情况及患者一般情况。
2 结 果
2.1 临床表现
1例患者为腰背部疼痛不适,3例为上腹部疼痛不适,1例为体检时发现,5例体格检查未见阳性体征。本组病例除1例CT和MR检查确定无其他肿瘤发生部位,其余4例均为PET/CT提示全身病灶分布特点。本组5个病例均为肝左、右叶多发,其中1例合并脾脏、椎体、肋骨及右侧颈部淋巴结多发,2例为合并肺内多发。仅1例有小三阳病史17年。实验室检查:所有病例三大常规、肝肾、凝血功能、乙肝五项及肿瘤标志物均未见异常。
2.2 影像表现
2.2.1 超声表现
5例肝内病灶最大径4~128 mm,病灶为低回声团块,内回声欠均匀,包膜不明显,边界欠清,形态规则,彩色超声未见明显异常血流信号或见条状稀疏血流信号。1例可见脾脏内多发类圆形结节,直径约30 mm,内部回声欠均匀,边界欠清,未见明显血流信号。
2.2.2 CT表现
5例患者均为肝内多发病灶,其中1例同时可见最大径约12.8 cm的巨大肿块,周围小结节灶,多数病灶呈类圆形,边界清楚,未见明显包膜,CT平扫时表现为等或稍低密度影,CT值为35~40 Hu;病灶中心均见片状更低密度影,3例肝内部分病灶边缘可见斑点状或蛋壳状钙化(图1A)。3例肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)术后1个月复查病灶周边可见少量灶状碘油沉积,边界不清(图1B)。骨内病灶CT显示,溶骨性破坏,椎体内不规则骨质破坏,可见粗大的骨嵴及残存粗大的骨小梁。
2.2.3 MR表现
本组4例行MR检查,呈T1WI低信号,T2WI不均匀高信号,边缘肿瘤实质信号略高,中心液化坏死区更高,实质部分呈环状分布。增强扫描时,动脉期肿瘤实质部分强化不明显,部分大病灶内可见明显强化分隔,病灶呈不完整环状强化,小病灶可见牛眼征;静脉期及延迟期实质部分强化逐渐增强,病灶边缘可见尖角状明显强化影突入病灶中心,外缘低信号晕圈较动脉期显示清晰,可见晕环征和(或)蛋壳征,少数病灶外缘周边常可见片状异常灌注区(图1C、D)。椎体病灶MRI表现:T1WI呈低信号,低于或等于肌肉,T2WI呈明显高信号。病灶呈膨胀性生长特点,类圆形,肿瘤与正常骨髓分界部分欠清,部分可见假包膜样改变,病变内可见低信号分隔。

图 1 患者的影像表现Fig. 1 The imaging findings of patients
2.2.4 PET/CT表现
2例均为两肺多发结节,成弥漫性分布,较大的直径约1.1 cm,放射性摄取略高,SUVmax为1.5,部分直径较小时(0.6 cm),未见代谢摄取增高;肝内病灶可见放射性摄取不同程度异常增高,SUVmax为3.2~9.1,内部见更低密度影,放射性稀疏、缺损(图2A)。脾脏内可见结节状低密度影,FDG摄取增高,SUVmax为4.5;全身多发骨质(左侧第2后肋,左侧第6前肋,右侧肩胛骨、T4、T8-11、L1-3,左侧髂骨翼)局部可见FDG摄取增高,SUVmax为6.6,右颈部见1枚肿大淋巴结,直径约1.0 cm,FDG摄取增高,SUVmax为4.0。
2.2.5 DSA表现
DSA显示,肝固有动脉无增粗,肝内动脉分支无明显扩张,动脉期见肝包膜下正常肝实质内不规则片状染色,肿瘤血管纤细,染色较晚,毛细血管期肿瘤染色呈“碗”状(中心未见明显肿瘤染色,病灶边缘肿瘤染色明显,图1E、F)。第1例2012年8月1日行肝肿瘤介入术,在肝固有动脉注入吡柔比星30 mg+超液化碘油5 mL,并于2012年9月26日行肝脏肿瘤介入治疗,术中于肝固有动脉注入吡柔比星60 mg+超液化碘油7 mL,术后部分病灶边缘少量碘油沉积。第4例2014年4月3日行TACE,于肝固有动脉注入奥沙利铂200 mg+吡柔比星60 mg+超液化碘油5 mL栓塞,术后1个月复查CT,病灶内仅见少量碘油沉积。第5例为1999年于南京武警总医院行TACE,具体用药不详。并于2014年2月13日行TACE,于肝固有动脉奥沙利铂200 mg+吡柔比星60 mg+超液化碘油5 mL栓塞,术后肿瘤内碘油沉积欠佳。
2.3 病理学特点
2.3.1 镜下特点
纤维硬化区为中心,周围瘤组织呈小细胞巢或细条索状排列(图2B),瘤细胞为圆形、多边形或上皮样的内皮细胞,细胞质多少不等,呈粉红色,核呈空泡状,核偏位,特征性地呈现为细胞质内血管腔,内含红细胞,可见原始血管通道及核空泡等上皮样血管内皮瘤特征性病理改变(图2C)。瘤细胞较少出现异型性,核分裂象一般不超过2个/高倍视野分裂。第4例患者病灶内核分裂象明显增加,核质比较其他明显高,部分可见血管肉瘤样变,恶性程度较其余4例高(图3A)。
2.3.2 免疫组织化学染色
CD31及CD34均呈强阳性(图2D)。
2.4 治疗及术后随访
第1例患者行2次TA C E。第2、3例患者未行任何治疗,定期电话随访。第4例患者行1次TA C E,肝右叶肿瘤(大小120 mm×70 mm×50 mm,频率1.04 MHz,焦距151 mm,平均功率200 W,治疗总时间532 s)及肝左内叶肿瘤(大小82 mm×73 mm×48 mm,频率1.04 MHz,焦距151 mm,平均功率327 W,治疗总时间475 s)各行1次海扶刀治疗。第5例患者行2次TACE,肝左叶肿瘤(41 mm×45 mm×51 mm,频率1.04 MHz,焦距151 mm,平均功率227 W,治疗总时间500 s)及肝尾状叶肿瘤(53 mm×50 mm×50 mm,频率1.04 MHz,焦距151 mm,平均功率161 W,治疗总时间709 s)各行1次海扶刀治疗,肝右叶肿瘤射频消融(radiofrequency ablation,RFA)治疗1次(肝Ⅵ段2个病灶,直径分别为15和10 mm,治疗功率60 W,治疗时间分别为314和120 s)。5例患者目前均存活,第1例患者行2次TACE和2次高强度聚焦超声(high intensity focused ultrasound,HIFU)术后疗效评价为肝内病灶进展,遂改为在复旦大学附属肿瘤医院门诊口服中药。第2、3例患者门诊复查较为稳定。第4例患者于2014年5月12日复查CT提示病灶缩小(图3B、C),无症状。第5例患者于2014年5月15日出现L2椎体压缩性骨折,已行骨水泥治疗,复查腹部MR增强提示肝内HIFU及RFA术后病灶无活性(图2E、F)。
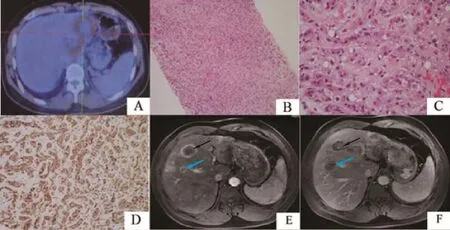
图 2 第5例患者的影像表现及病理学特点Fig. 2 The imaging findings and pathological characteristics of the fifth patients

图 3 第4例患者的病理学特点及影像表现Fig. 3 The pathological characteristics and imaging findings of the fourth patients
3 讨 论
HEHE病因不明,有学者推测可能与口服避孕药、孕激素失调、氯乙烯污染和肝移植等因素有关,与原发性肝肿瘤相比,HEHE起源于慢性肝病等相关疾病的背景尚不清楚[4],本组仅1例(20%)患者HBV感染,其发病是否与HBV相关,还需大样本的病例报道证实。在大多数情况下,病变多中心的肝和肝外受累已报道的患者达36%,本组则高达60%,笔者认为EHE多为全身多组织、多中心发生,HEHE较其它组织或器官EHE多见,而且病变往往为肝内多中心发生,笔者推测可能与肝脏内血窦异常丰富密切相关。
本组3例为肝内及肝外同时多中心发生,平均年龄42岁,女性多见。3例因右上腹部疼痛或不适就诊,实验室检查未见异常。国内Wang等[4]和张树辉等[5]报道的患者平均年龄42.5~47.0岁,女性发生率高于男性,症状出现率为51.2%(21/41),与本研究结果类似,本组CA-199均为阴性,低于Wang等[4]和张树辉等[5]的研究结果,可能与本组病例少且发现晚有关。
综合已有文献报道[6-8],本组HEHE在不同时期有结节型(表现为各自独立的结节,直径0.4~12.8 cm,多为早期表现)和弥散型(随着疾病的进展,肿瘤逐渐增大和融合,同时常伴有肝血管浸润,多数病灶分布于肝脏外周,延伸到肝包膜,为结节型的晚期表现)2种不同影像表现形式。结合本研究可以看出,本组5例患者影像学检查均提示有多个病灶逐步融合的特点,肝内呈区域分布,这是肿瘤进展的重要特征之一。
HEHE超声为等低回声改变,与病灶内实质成分细胞呈灶状或条索状分布,组织排列疏松,导致整体病灶回声较低,内多见略高回声分隔(纤维硬化区);而且病灶中心常常因合并间质黏液变、囊变和(或)坏死而出现更低回声或无回声。
CT和MR的表现亦主要与肿瘤细胞的分布特点、纤维硬化区的多少及原始血管的成熟度密切相关。本组3例(60%)CT显示,肝内多发病灶边缘蛋壳状及点簇状钙化,较张树辉等[5]和钱斌等[9]报道的出现率高,可能与本组均为晚期病例有关。纤维硬化区和肿瘤细胞排列紧密区CT密度略高、MR T2加权像信号减低。根据本研究结果,结合文献复习,提示HEHE增强扫描强化方式主要表现为动脉期病灶实质部分强化不明显或轻微强化,门静脉期及延迟期周边向中心递进强化,坏死区无强化,呈“慢进慢出”和向心性强化模式;少数为动脉期周边显著强化,静脉期及延迟期对比剂不消退,且由边缘向中央递进强化,类似于转移瘤的“牛眼征”。本组4例MR增强中大部分肝内病灶呈环状“慢进慢出”式明显强化,环常不完整,内面可见多发结节状突起,类似于“肝包膜回缩征”[9],这也体现了肿瘤各向生长的不均匀性和肿瘤整体生长的缓慢性。多数病灶外缘可见不规则低信号环,可能与瘤体生长过程中长时间压迫周围组织致邻近组织继发纤维增生形成的假包膜有关,由于其浸润性生长的特点,病灶本身无真包膜。影像上HEHE常易与肝内转移瘤、多结节肝癌及多发血管瘤混淆:肝内转移瘤多发有原发灶病史,可见“牛眼征”,但是强化程度轻,晕环完整,周围未见异常灌注区,而且转移瘤有“牛眼征”,转移瘤因病灶外缘环形水肿带,致病灶边界不清,而HEHE病灶因生长缓慢,边界清晰。多发结节肝癌常有肝炎、肝硬化背景,呈典型的“快进快出”的强化特点;肝内多发性学血管瘤多发先天性疾病,病灶边界清晰,内囊变坏死少见,边缘几乎无钙化,呈“快进慢出”的强化特点,MRT2图像上呈典型的“灯泡征”。
在HEHE疗效的影像学评估方面,CT及MR各具优势,结合本组病例笔者发现,3例行TACE术后平扫CT可明确显示肿瘤边缘环状或灶状碘油沉积,MR未能显示碘油沉积的范围和分布。但是MRI信号的改变直接反映肿瘤的组织特征,并且在疗效评价中起到更为重要的作用,在行HIFU和(或)RFA的2例患者中,可观察到术后病灶未见增强征象,而CT受部分容积效应的影响而使治疗前后病灶血供变化显示不清。
PET/CT显像对于全身病变的范围的观察、肿瘤分级和肝内病灶的鉴别诊断具有重要价值。有研究证实,HEHE及其转移灶肝外多发中心发生的HEHE均为高FDG摄取[10-12]。本组4例患者显示肿瘤周边FDG浓聚,SUVmax为3.2~9.1,1例患者延迟显像后SUVmax为3.6。Kitapci等[13]认为PET/CT的双时相对HEHE的诊断非常有价值,双时相鉴别低增生和细胞分化良好的肿瘤具有重大意义,与本组第3例的延迟显像显示一致。
DSA示肿瘤血管丰富,肿瘤血管纤细,这可能是TACE术中进行推注碘油时有一定阻力,血管铸型明显,经肝固有动脉推注碘油5~7 mL时患者疼痛症状较为明显的重要原因,遂终止手术。笔者认为HEHE肿瘤血管为低排高阻型,从而使TACE术疗效欠佳,术后发现3例患者碘油沉积有一定的差异,对照病理发现,沉积较好的第4例患者其肿瘤细胞高度异型,排列紊乱、堆积,血管腔样结构丰富,高度血管肉瘤样变,因此笔者认为恶性程度高的HEHE较分化好的HEHE碘油沉积好。
由于患者发现肿瘤多数无症状,而且往往全身多部位、多中心发生,且易误诊为转移性肿瘤,无手术治疗指征。对于病理确诊后的患者,肝切除和肝移植是治疗HEHE的首选治疗,化疗、放疗,激素治疗、TACE、经皮酒精注射、中药甚至无任何治疗的随访等常常适合无手术适应症的患者,本组5例均无外科手术指征。第2、3例仅为门诊随访并口服中药,疾病仍缓慢进展。TACE是转移性肝癌的常用治疗方法,但是本组第1例行2次TACE术后,疾病仍进行性进展,患者遂放弃介入治疗改门诊口服中药,术后一直门诊随访,肝内病灶缓慢进展。本组第4和第5例患者单纯TACE术后1个月复查CT示肝内病灶碘油沉积不良,病灶未见缩小,因此笔者认为单纯TACE术对延缓HEHE进展无明显临床价值。Grenader等[14]研究报道,脂质体阿霉素的低剂量化疗维持是一种有效的治疗方式,且未见明显心脏毒性,笔者大胆猜测在行TACE术时改用脂质体阿霉素作为灌注化疗药物可能取得临床疗效。
HIFU将超声波汇聚于靶区组织,引起靶区瞬态温升(大于65 ℃)和空化效应,使靶区组织凝固性坏死。HIFU通过热效应、机械效应、空化效应及靶组织内血管毁损等的综合效应,能够切断肿瘤的血供,造成组织缺血缺氧,间接导致肿瘤组织死亡[15]。本研究对第4例患者肝左、右叶交界处巨块肿瘤行2次HIFU治疗,对第5例患者采用肝左叶及尾状叶肿瘤各行1次HIFU治疗后,肿瘤体积缩小和(或)肿瘤血供明显减少,取得良好的局部控制效果。
RFA是通过射频发生器产生高频交流电流,通过射频电极针置入体内,产生回路,引起局部组织离子振动从而摩擦产热,热能通过传导至邻近组织中,发生不可逆性蛋白变性、细胞膜脂质层溶解和凝固性坏死等改变,具有疗效确切、并发症少和可重复操作等优点,对于直径小于3 cm的肝癌,其5年生存率与肝手术切除大致相仿[16],对于本组第5例患者肝右叶直径小于3 cm病灶选择进行RFA,术后复查MR增强,病灶强化,达到完全消融。
HEHE为中低度恶性肿瘤,其预后明显好于血管肉瘤和肝细胞癌,Mehrabi等[17]报道的肝移植(101例)、肝切除(22例)、放化疗(60例)和院外随访监测(70例)的5年生存率分别为54.5%、75%、30%和4.5%[17]。本组第5例长期带瘤生存15年,近期出现肝外转移灶的进展,目前患者KPS为90分,其余4例且均无症状存活。目前肝切除是可切除的肝内病变患者的首选治疗,肝外存在多发病灶是否是手术治疗禁忌证仍有争论[18-20],本组采用TACE联合HIFU和(或) RFA等微创治疗手段取得良好的局部及全身控制效果,因此认为TACE联合HIFU和(或)RFA是治疗不可切除的HEHE首选治疗。
[1]LEENARDOU P, SEMELKA R C, MAATROPASQUA M, et a1. 1ipithelioid hemangioendothelioma of the liver: MR imaging findings [J]. MagnReson Imaging, 2002, 20(1): 631-633.
[2]MEHRABI A, ARIANEB A, KASHFI H, et al. Primary malignant hepatic epithelioid hemangioendothelioma: a comprehensive review of the literature with emphasis oil the surgical therapy [J]. Cancer, 2006, 107(1): 2108-2121.
[3]GALVAO F H, BAKONYI·NETO A, MACHADO M A, et a1. Interferon alpha 2B and liver resection to treat mutifocal hepatic epithelioid hemangioendothelioma: a relevant approach to avoid liver transplantation [J]. Transplant, 2005, 37(2): 4354-4358.
[4]WANG L R, ZHOU J M, ZHAO Y M, et al. Experience with primary hepatic epithelioid hemangioendothelioma: retrospective study of 33 patients [J]. World J Surg, 2012, 36(2): 2677-2683.
[5]张树辉, 丛文铭, 吴孟超. 肝上皮样血管内皮瘤的临床病理特点(附8例报告及文献复习) [J]. 中华肝胆外科杂志, 2013, 9(6): 326-330.
[6]李 玲, 唐光健, 唐萍萍, 等. 弥漫型肝脏上皮样血管内皮细胞瘤一例 [J]. 中华放射学杂志, 2010, 44(1): 443-444.
[7]周 易, 林 江, 曾蒙苏, 等. 五例肝脏上皮样血管内皮瘤的影像表现与病理对照分析 [J]. 中华放射学杂志, 2008, 42(4): 432-434.
[8]LYBUM I D, TORREGGIANI W C, HARRIS A C, et a1. Hepatic epithelioid hemangioendotheliom: sonographic, CT, and MR imaging appearances [J]. AJR Am J Roentgenol,2003, 180(5): 1359-1364.
[9]钱 斌, 胡晓华, 陈宏伟, 等. 肝脏上皮样血管内皮瘤CT与MRI特征及病理对照 [J]. 中华放射学杂志, 2012, 46(2): 172-174.
[10]REST C C, BOTTON E, ROBINET G, et al. FDG PET in epithelioid hemangioendothelioma [J]. Clin Nucl Med, 2004, 29(12): 789-792.
[11]NGUYEN B D. Epithelioid Hemangiendothelioma of the liver with F-18 FDG PET imaging [J]. Clin Nucl Med, 2004, 29(12): 828-830.
[12]LIN E, AGOFF N. Recurrent hepatic epithelioid hemangiendothelioma detection by FDG PET/CT [J]. Clin Nucl Med, 2007, 32(12):949-951.
[13]KITAPCI M T, AKKAS B E, GULLU I, et al. FDG-PET/CT in the evaluation of epithelioid hemangioendothelioma of the liver: the role of dual-time-point imaging. A case presentation and review of the literature [J]. Ann Nucl Med, 2010, 24(11): 549-553.
[14]GRENADER T, VERNEA F, REINUS C, et al. Malignant epithelioid hemangioendothelioma of the liver successfully treated with pegylated liposomal doxorubicin [J]. J Clin Oncol, 2011, 29(25): 722-724.
[15]HAAR G T, COUSSIOS C. High intensity focused ultrasound: physical principles and device [J]. Int J Hyperthermia, 2007, 23(2): 89-104.
[16]鲍家启, 刘爱国, 胡克非, 等. 射频治疗肝脏恶性肿瘤的CT评价(附35例分析) [J]. 医学影像学杂志, 2003, 12(3): 62-68.
[17]MEHRABI A, KASHFI A, FONOUNI H, et al. Primary malignant hepatic epithelioid hemangioendothelioma: a comprehensive review of the literature with emphasis on the surgical therapy [J]. Cancer, 2006, 107(25): 2108-2121.
[18]CARDINAL J, DE VERA M E, MARSH J W, et al. Treatment of hepatic epithelioid hemangioendothelioma: a singleinstitution experience with 25 cases [J]. Arch Surg, 2009, 144(12): 1035-1039.
[19]LERUT J P, ORLANDO G, ADAM R, et al. The place of liver transplantation in the treatment of hepatic epitheloid hemangioendothelioma:report of the European liver transplant registry [J]. Ann Surg, 2007, 246(2): 949-957.
[20]GROTZ T E, NAGORNEY D, DONOHUE J, et al. Hepatic epithelioid haemangioendothelioma: is transplantation the only treatment option? [J]. HPB (Oxford), 2010, 12(14): 546-545.
Hepatic epithelioid hemangioendothelioma: imaging features and experience in clinical diagnosis and treatment
NING Zhouyu, CHEN Qiwen, ZHU Xiaoyan, XU Litao, WANG Haiyong, ZHUANG Liping, ZHANG Chenyue, MENG Zhiqiang (Department of Integrative Cancer, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China) Correspondence to: MENG Zhiqiang E-mail: mengzhq@yeah.net
Background and purpose:Hepatic epithelioid hemangioendothelioma (HEHE) is an extremely rare, vascularly original tumor, and would be misdiagnosed easily in the clinical and imaging characteristics. This study aimed to investigate the imaging features of HEHE and our experience in clinical diagnosis and treatment, and to provide important reference for the diagnosis and treatment of HEHE in the future.Methods:This study retrospectively analyzed clinical manifestations, imaging features, pathological characteristics and treatment effects of 5 HEHE cases confirmed by pathology at Department of Integrative Cancer, Fudan University Shanghai Cancer Center.Results:The ratio of male to female patients was 2 to 3. HEHE predominantly occurred in middle-aged female patients whose ages range from 26 to 65 (mean=45.6). Imaging features of HEHE included multifocal hepatic disease (n=2), systemic multi-center multi-tissue occurrence (n=3). The ultrasound images showed isoechoic or hypoechoic lesions with no obvious blood flow signal in the lesions. CT plain scan showed isointensity or hypointensity, while MR unenhanced with hypointense T1 signal and hyperintense T2 signal. The density or signal was uneven. Contrast-enhanced CT and MR images showed “slow in slow out”, obvious and variable degrees of peripheral rim enhancement. High FDG uptake showed delayed imaging characteristics (PET/CT). DSA angiography showed the tumor blood vessels were slim. After transcatheter arterial chemoembolization (TACE) surgery, lipiodol deposition within the lesion was not ideal. Under the microscope, tumor cells showed epithelial differentiation; angiogenesis was also visible. Immunohistochemistrystaining showed CD31 and CD34 positive in all the 5 cases. Two cases treated with TACE combined with high intensity focused ultrasound (HIFU) and/or radiofrequency ablation (RFA) had good result.Conclusion:The clinical and radiological characteristics of HEHE are distinctive. Currently, for patients with systemic multi-organizational multi-center lesions, TACE combined with HIFU and/or RFA might be the most effective treatment method.
Liver neoplasm; Epithelioid hemangioendothelioma; Diagnosis; Transcatheter arterial chemoembolization; High intensity focused ultrasound; Radiofrequency ablation
10.19401/j.cnki.1007-3639.2016.12.007
R735.7
A
1007-3639(2016)12-1004-08
2016-05-21
2016-08-08)
孟志强 E-mail: mengzhq@yeah.net

