1,4-二(2-苄硒乙氧基)蒽诱导人喉癌Hep-2细胞凋亡的研究
李 莎,张思楠,秦大斌,杨 军,伍春莲,3
1.西华师范大学西南野生动植物资源保护省部共建教育部重点实验室,四川 南充 637009;
2.西华师范大学化学化工学院,四川 南充 637009;
3.西南大学三峡库区生态环境与生物资源省部共建国家重点实验室,重庆 400715
1,4-二(2-苄硒乙氧基)蒽诱导人喉癌Hep-2细胞凋亡的研究
李 莎1,张思楠1,秦大斌2,杨 军1,伍春莲1,3
1.西华师范大学西南野生动植物资源保护省部共建教育部重点实验室,四川 南充 637009;
2.西华师范大学化学化工学院,四川 南充 637009;
3.西南大学三峡库区生态环境与生物资源省部共建国家重点实验室,重庆 400715
背景与目的:硒是人类生命活动中必不可少的微量元素之一,对人类健康的巨大作用是其他物质无法替代的。硒的小分子化合物1,4-二(2-苄硒乙氧基)蒽{1,4-bis[2-(benzylselanyl)ethoxy]anthracene,BSEA}具有杀菌消炎的作用,但BSEA的抗癌作用尚未见报道。该研究旨在探讨BSEA诱导人喉癌Hep-2细胞凋亡及其作用机制。方法:不同浓度的BSEA处理人喉癌Hep-2细胞24 h后,采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法检测细胞生长抑制率;在荧光显微镜下观察细胞形态;Annexin Ⅴ-FITC法检测细胞凋亡;JC-1检测线粒体膜电位;酶标分析仪检测caspase-3和caspase-8活性;实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)分别检测Bax、XIAP mRNA和蛋白表达水平。结果:BSEA处理人喉癌Hep-2细胞24 h后,BSEA对其生长抑制呈剂量依赖性,IC50为35.74 μmol/L;80 μmol/L BSEA处理的Hep-2细胞在荧光显微镜下可观察到明显的凋亡小体;磷脂酰丝氨酸外翻加剧;线粒体膜电位开始下降;caspase-3活性的影响呈剂量依赖趋势,而caspase-8活性未见显著变化;Bax的mRNA和蛋白表达水平上升,XIAP的mRNA和蛋白表达水平下降。结论:BSEA对人喉癌Hep-2细胞生长有明显的抑制作用,并能通过线粒体途径诱导细胞凋亡。
1,4-二(2-苄硒乙氧基)蒽;Hep-2细胞;细胞凋亡;线粒体途径
喉癌是头颈部最主要的癌症之一[1]。近期,Zheng等[2]统计分析25类主要癌症,我国喉癌城市患者大概是农村的两倍,98.7%的年龄在40岁以上,男性比女性多。喉癌会严重影响患者的心理和生活质量,特别是沟通和饮食问题[3]。硒是生命活动的必需微量元素之一,作为“抗癌先锋”,其小分子化合药物已经用于治疗前列腺癌[4-5]、肝癌[6]、黑色素瘤[7]和结肠癌[8-9]等,给癌症患者带来了希望。将硒与碳杂环以不同形式进行结合,发现碳杂环硒化合物对肿瘤有抑制作用。而硒唑呋喃和依布硒啉是生物活性高且毒性低的有机硒化合物,使有机硒的杂环化合物成为研究热点[10]。1,4-二(2-苄硒乙氧基)蒽{1,4-bis[2-(benzylselanyl) ethoxy]anthracene,BSEA}是一种新合成的碳杂环硒化合物(图1)。但BSEA对喉癌的作用机理尚未见报道。因此,本研究探讨BSEA对体外培养的人喉癌Hep-2细胞凋亡机制,为小分子化合物抗癌机理提供新的思路。
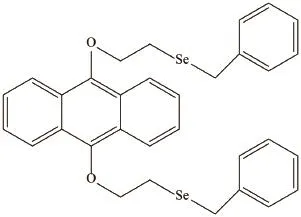
图 1 BSEA的化学结构式Fig. 1 Chemical structure of BSEA
1 材料和方法
1.1 药品及试剂
BSEA由西华师范大学化学化工学院秦大斌教授提供;RPMI-1640粉末购自美国Gibco公司;Biozol RNA Kit(Biomiga EZgeneTM)购自美国Biomiga公司;线粒体膜电位检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒和Caspase活性检测试剂盒均购自碧云天生物技术研究所;PrimeScriptTMRT reagent Kit购自宝生物工程(大连)有限公司;SsoFastTM Evagreen Supermix购自美国Bio-Rad公司;其余试剂均为分析纯。
1.2 细胞培养
人喉癌细胞株Hep-2购自川北医学院生化与分子免疫研究所;人喉癌Hep-2细胞用含有10%灭活的胎牛血清(fetalbovine serum,FBS)、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640完全培养液(pH=7.4)于37 ℃、CO2体积分数为5%的培养箱中培养。
1.3 BSEA的配制
BSEA用二甲基亚砜(dimethyl sulfoxide,DMSO)配成100 mmol/L的母液,-20 ℃储存。使用前,用含10%FBS的RPMI-1640培养液配成不同浓度的工作液,DMSO的终浓度不超过0.1%。
1.4 检测细胞活性
取对数生长期的Hep-2细胞,加入不同浓度的BSEA(0、10、20、40、80和100 μmol/L),培养24 h后,每孔各加入四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)10 μL,培养4 h后,每孔再加150 μL的DMSO,振荡10 min,用酶标仪测490 nm处的吸光度(D)值。按下式计算不同浓度的药品对细胞的生长抑制,抑制率=(1-给药组平均D值/对照组平均D值)×100%。
1.5 观察细胞形态
取对数生长期的Hep-2细胞,在6孔板内预先放置灭菌盖玻片,每孔加细胞悬液2 mL进行培养;待细胞在盖玻片上贴壁良好后,加入不同浓度的BSEA(0、10、20、40、80和100 μmol/L),培养24 h后,取出玻片,避光滴加吖啶橙(acridine orange,AO)染色液30 μL,用PBS清洗盖玻片2次,室温避光温育1~2 min,在荧光显微镜下观察细胞形态变化并拍照。
1.6 检测细胞凋亡
取对数生长期的Hep-2细胞接种于6孔板中,加入不同浓度的BSEA(0、10、20、40、80和100 μmol/L),培养24 h后,收集各浓度实验组与空白对照组细胞,100×g离心5min,去上清,根据Annexin V-FITC试剂盒进行荧光观察并拍照。
1.7 检测线粒体膜电位
取对数生长期的Hep-2细胞接种于6孔板中,加入不同浓度的BSEA(0、10、20、40、80和100 μmol/L),培养24 h后,收集各浓度实验组与空白对照组细胞,100×g离心5min,去上清,根据JC-1线粒体膜电位检测试剂盒进行荧光观察并拍照。
1.8 检测Caspase-3和Caspase-8的活性
不同浓度的BSEA(0、10、20、40、80和100 μmol/L)处理Hep-2细胞24 h后,收集细胞,根据caspase活力检测试剂盒的操作方法测定caspase-3和caspase-8的活力。收集1×106个以上细胞,加入500 μL细胞裂解液,冰水浴上放置10 min,加入DTT和荧光标记底物IETD-AFC或DEVD-AFC,37 ℃反应2 h,利用试剂盒中提供的caspase-8催化产生的黄色产物pNA,作为定量caspase酶活性的标准品,发现颜色变化明显时即可用酶标仪测定405 nm处的D值。
1.9 检测细胞Bax和XIAP mRNA表达水平
总RNA的提取参照Biozol RNA Kit(Biomiga EZgeneTM)的试剂盒说明进行;反转录按照宝生物工程(大连)有限公司的PrimeScriptTMRT reagent Kit说明进行,反转录结束后,将反转录的cDNA置于-20 ℃冰箱中保存备用;由宝生物工程(大连)有限公司设计合成引物,内参基因为人的ACTB和GADPH,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)在Bio-Rad CFX96 RTFQ-PCR仪上进行。基因引物序列见表1。

表 1 基因引物序列Tab. 1 Gene-specific primer sequence
1.10 检测Bax和XIAP蛋白表达水平
Hep-2细胞经不同浓度的BSEA(0、10、20、40、80和100 μmol/L)处理24 h后,PBS洗2次,细胞全蛋白质提取按照上海捷瑞生物工程有限公司通用蛋白裂解抽提试剂盒说明书进行提取,用10%SDS-聚丙烯酰胺凝胶电泳分离,将蛋白转移至PVDF膜上,丽春红染色,室温封闭1.5 h,PBST洗膜,Bax、XIAP及内参GAPDH一抗温育过夜,PBST洗膜,二抗室温轻摇温育1~2 h,PBST洗膜,将膜置于凝胶成像系统下扫描检测并分析处理。
1.11 统计学处理
2 结 果
2.1 BSEA抑制Hep-2细胞生长
B S E A在浓度为1 0、2 0、4 0、8 0和100 μmol/L处理Hep-2细胞24 h后,用MTT法检测细胞活性,得到细胞生长抑制率分别是28.27%、33.64%、51.64%、59.81%和77.34%,BSEA对Hep-2细胞的IC50为35.74 μmol/L。BSEA对Hep-2细胞的增殖具有明显的抑制作用,并呈剂量依赖关系(图2)。

图 2 不同浓度的BSEA对Hep-2细胞的抑制作用Fig. 2 Inhibitory effect on Hep-2 cells with different concentrations of BSEA
2.2 荧光显微镜下观察细胞形态变化
不同浓度的BSEA处理Hep-2细胞24 h后,经AO染色后,在荧光显微镜下观察,发现细胞均有不同程度的凋亡,甚至可以看到凋亡小体。空白对照组的正常细胞贴壁生长,多不规则形,细胞膜完整无缺损,胞体丰富饱满,核膜完整,细胞呈绿色荧光(图3A)。当BSEA浓度为10 μmol/L时,Hep-2细胞与对照组相比,核有微弱松散的现象,但核膜仍然完整,细胞呈黄绿色荧光(图3B);当BSEA浓度为20 μmol/L时,细胞核松散更加严重,细胞膜开始变形(图3C),随后开始出现晚期凋亡细胞;当BSEA浓度为40 μmol/L时,细胞膜破裂,细胞呈橙黄色(图3D);当BSEA浓度为80 μmol/L时,细胞膜大量破裂,开始出现大量的凋亡细胞,可发现许多凋亡小体的出现,此时细胞呈现出橙红色(图3E)。随着BSEA浓度进一步增大,当为100 μmol/L时,细胞几乎全部死亡并且已经脱落,细胞结构不完整,荧光染色观察时可见少数细胞碎片,呈现红色荧光(图3F)。
2.3 BSEA对细胞凋亡的影响
Annexin V-FITC检测结果显示,随着BSEA的浓度升高,多数细胞由发出的绿色荧光变成红色荧光,可见细胞在低浓度药品下多数细胞出现凋亡现象,随着浓度的增高,细胞死亡的现象越加明显(图4)。
2.4 BSEA对线粒体膜电位的影响
经JC-1荧光探针检测,随着BSEA的浓度增加,细胞凋亡数目的增加,细胞发出的荧光也由橘红色变为绿色,即线粒体膜电位逐渐降低。其中阳性对照组为线粒体膜电位完全丧失而呈现绿色荧光(图5)。
2.5 BSEA对Caspase-3和Caspase-8活性的影响
Caspase活性检测发现,caspase-3活性随着药品浓度的增加而增加,而caspase-8活性随药品浓度的增加未见显著变化(图6)。
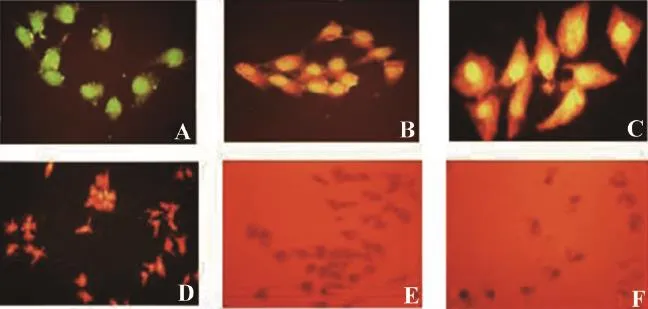
图 3 不同浓度的BSEA对Hep-2细胞形态的影响Fig. 3 Effects of BSEA with different concentrations on the morphology change of Hep-2 cells under fluorescence microscope

图 4 不同浓度的BSEA对Hep-2细胞膜的影响Fig. 4 Effects of BESA with different concentrations on Hep-2 cell membrane
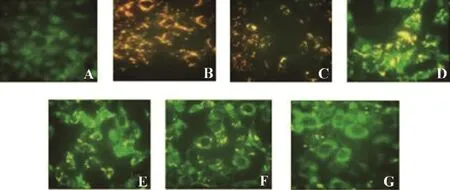
图 5 不同浓度BSEA对Hep-2细胞线粒体膜电位的影响Fig. 5 Effects of BSEA with different concentrations on mitochondrial membrane of Hep-2 cells

图 6 不同浓度BSEA对Hep-2细胞caspase-3和caspase-8活性的影响Fig. 6 Effects of BSEA with different concentrations on activity of caspase-3 and caspase-8 of Hep-2 cells
2.6 BSEA对Bax和XIAP基因在mRNA水平上表达的影响
实验结果表明,随着BSEA浓度的提高,Bax基因的mRNA表达量也随之升高,而XIAP基因的mRNA表达量在降低(图7)。
2.7 BSEA对Bax和XIAP蛋白表达量的影响
根据BCA标准曲线,算出蛋白质上样量为35 μg。与正常对照组相比,随着BSEA药物浓度的增加,XIAP的蛋白表达量呈减少趋势,而Bax的蛋白表达量呈增加趋势,并且具有一一对应的关系,即具有正效应关系(图8)。
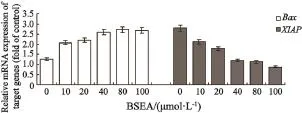
图 7 不同浓度的BSEA对Bax和XIAP基因表达量的影响Fig. 7 Effects of expression of Bax and XIAP gene with different concentrations of BSEA on Hep-2 cells
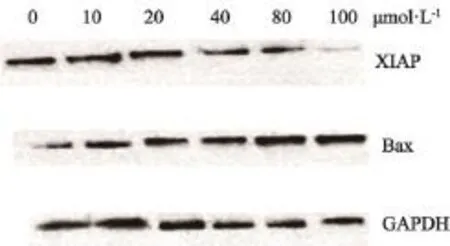
图 8 Western blot检测Bax和XIAP蛋白表达变化Fig. 8 The protein expression of Bax and XIAP detected by Western blot
3 讨 论
硒具有明显的抗癌效果,其碳杂环化合物的抗癌性类似于已经证明具有抗癌作用的一些金属碳杂环化合物[11]。有研究发现,亚硒酸钠通过超氧化物和p53依赖的线粒体途径诱导前列腺癌细胞凋亡[12]。Chun等[13]提出,硒药抗癌过程中survivin基因表达抑制。L-甲基-硒代半胱氨酸作为核心蛋白的调节器,能上调核心蛋白的药物毒性,通过TIEG1阻遏物结合位点来发挥作用[14]。另有报道,CHEK-2是一种肿瘤抑制基因,含硒药物对CHEK-2的磷酸化增加更加明显[15]。此外,Steinbrenner等[16]认为,硒药会引起胰岛素信号级联,导致Akt激活,并伴有下游PI3K/Akt信号通路的活化。细胞死亡有凋亡和坏死两种形式。本研究通过MTT实验、荧光染色观察和Annexin V-FITC/PI等发现,BSEA对Hep-2细胞有明显的生长抑制,并诱导其发生细胞凋亡。细胞凋亡途径中死亡受体途径和线粒体途径是主要诱导哺乳动物细胞凋亡的途径。经各种刺激(如DNA损伤、氧化应激、紫外线及生长因子缺乏等)诱导细胞凋亡实验中发现线粒体膜的通透性会增加,释放出其内的各种蛋白质(如Cyt-C),线粒体膜电位降低[17]。Cyt-C释放活化caspase-9,再激活下游的caspase-3,引起线粒体凋亡途径的级联反应。JC-1检测和caspase活性检测结果提示,BSEA可能通过线粒体途径诱导人喉癌Hep-2细胞凋亡。细胞凋亡过程还涉及基因调控,本研究主要考察Bax和XIAP基因的表达水平。Bax是促进细胞色素c的释放关键因子之一,在凋亡信号的刺激下Bax可从细胞质转位到线粒体膜上,从而启动线粒体凋亡途径[18]。X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是IAP家族中最强的凋亡抑制因子,在线粒体凋亡途径中,XIAP能直接结合并抑制caspase-9、caspase-3和caspase-7,而XIAP表达的降低可能减少对caspase-9和caspase-3的抑制,最终导致细胞凋亡[19]。本研究结果显示,BSEA可促进Bax表达,抑制XIAP表达,从而促进细胞凋亡。因此,BSEA诱导Hep-2细胞凋亡的作用机制主要是线粒体途径。XIAP的表达对caspase-8的激活无影响,但可阻止激活caspase-3而使凋亡受体途径的信号传导中断[20]。另外也可抑制caspase-3对caspase-8的正反馈激活使死亡信号不能被放大,二者共同作用的结果是阻断受体途径引起的细胞凋亡[21]。但本文检测发现,XIAP的mRNA和蛋白表达水平下降,caspase-3的活性升高,说明BSEA不是通过死亡受体途径诱导细胞凋亡的。因此,化合物BSEA诱导Hep-2细胞凋亡而造成细胞死亡的作用机制主要是线粒体凋亡途径。近年来越来越多的研究者证实,细胞凋亡与细胞自噬之间存在复杂的串话。Lin等[22]研究发现,XIAP不仅抑制细胞凋亡,也能通过上调Beclin 1表达,再经NF-κB信号通路诱导细胞自噬的形成。因此,推测100 μmol/L剂量组mRNA表达水平比80 μmol/L剂量组高是由于有细胞自噬调控的参与,而100 μmol/L剂量组蛋白质表达水平比80 μmol/L剂量组低可能是由于细胞凋亡和细胞自噬相关蛋白之间相互作用。在本研究基础上,有待进一步研究BSEA对细胞自噬的影响。
综上所述,人喉癌Hep-2细胞在BSEA的作用下有不同程度的抑制,BSEA浓度越高其抑癌作用越强,并且主要通过线粒体凋亡途径诱导细胞凋亡,这为小分子化合物抗癌机理提供了依据,也为其在临床癌症的治疗中的应用提供了理论基础和实验依据。
[1]IQBAL A, WARRAICH R, UDEABOR S E, et al. Role of human papillomavirus infection and other factors in patients with head and neck squamous cell carcinoma[J]. Oral Dis, 2014, 20(3): 288-293.
[2]ZHENG R, ZENG H, ZHANG S, et al. National estimates of cancer prevalence in China, 2011[J]. Cancer Lett, 2015, 370(1): 33-38.
[3]MIAO S, MAO X, PEI R, et al. Antitumor activity of polysaccharides from Lepista sordida against laryngocarcinoma in vitro and in vivo[J]. Int J Biol Macromol, 2013, 60: 235-240.
[4]FACOMPRE N, EL-BAYOUMY K. Potential stages for prostate cancer prevention with selenium: implications for cancer survivors[J]. Cancer Res, 2009, 69(7): 2699-2703.
[5]GONTERO P, MARRA G, SORIA F, et al. A randomized double-blind placebo controlled phase Ⅰ-Ⅱ study on clinical and molecular effects of dietary supplements in men with precancerous prostatic lesions. Chemoprevention or“chemopromotion”?[J]. Prostate, 2015, 75(11): 1177-1186.
[6]BJÖRKHEM-BERGMAN L, EKSTRÖM L, ERIKSSON L C. Review: Exploring anticarcinogenic agents in a rat hepatocarcinogenesis model--focus on selenium and statins[J]. In Vivo, 2012, 26(4): 527-535.
[7]CASSIDY P B, FAIN H D, CASSIDY J P Jr, et al. Selenium for the prevention of cutaneous melanoma[J]. Nutrients, 2013, 5(3): 725-749.
[8]QI Y, SCHOENE N W, LARTEY F M, et al. Selenium compounds activate ATM-dependent DNA damage response via the mismatch repair protein hMLH1 in colorectal cancer cells[J]. J Biol Chem, 2010, 285(43): 33010-33017.
[9]HU Y, MCINTOSH G H, LE LEU R K, et al. Combination of selenium and green tea improves the efficacy of chemoprevention in a rat colorectal cancer model by modulating genetic and epigenetic biomarkers[J]. PLoS One, 2013, 8(5): e64362.
[10]LI Q S, WU D M, ZHU B C, et al. Organic selenium resin in solid phase synthesis and its application in constructing medicinally relevant small organic molecules[J]. Mini Rev Med Chem, 2013, 13(6): 854-869.
[11]COMBS G F Jr, CLARK L C, TURNBULL B W. An analysis of cancer prevention by selenium[J]. Biofactors, 2001, 14(1-4): 153-159.
[12]ZHAO R, XIANG N, DOMANN F E, et al. Expression of p53 enhances selenite-induced superoxide production and apoptosis in human prostate cancer cells[J]. Cancer Res, 2006, 66(4): 2296-2304.
[13]CHUN J Y, HU Y, PINDER E, et al. Selenium inhibition of survivin expression by preventing Sp1 binding to its promoter[J]. Mol Cancer Ther, 2007, 6(9): 2572-2580.
[14]HU Y, SPENGLER M L, KUROPATWINSKI K K, et al. Selenium is a modulator of circadian clock that protects mice from the toxicity of a chemotherapeutic drug via upregulation of the core clock protein, BMAL1[J]. Oncotarget, 2012, 2(12): 1279-1290.
[15]GUPTA S, JAWORSKA-BIENIEK K, LUBINSKI J, et al. Can selenium be a modifier of cancer risk in CHEK2 mutation carriers?[J]. Mutagenesis, 2013, 28(6): 625-629.
[16]STEINBRENNER H, SPECKMANN B, SIES H. Toward understanding success and failures in the use of selenium for cancer prevention[J]. Antioxid Redox Signal, 2013, 19(2): 181-191.
[17]LI W, HUANG Y, ZHAO X, et al. Swainsonine induces caprine luteal cells apoptosis via mitochondrial-mediated caspase-dependent pathway[J]. J Biochem Mol Toxicol, 2014, 28(10): 456-464.
[18]DELBRIDGE A R, STRASSER A. The BCL-2 protein family, BH3-mimetics and cancer therapy[J]. Cell Death Differ, 2015, 22(7): 1071-1080.
[19]DE ALMAGRO M C, VUCIC D. The inhibitor of apoptosis (IAP) proteins are critical regulators of signaling pathways and targets for anti-cancer therapy[J]. Exp Oncol, 2012, 34(3): 200-211.
[20]HAMACHER-BRADY A, CHOE SC, KRIJNSE-LOCKER J, et al. Intramitochondrial recruitment of endolysosomes mediates Smac degradation and constitutes a novel intrinsic apoptosis antagonizing function of XIAP E3 ligase[J]. Cell Death Differ, 2014, 21(12): 1862-1876.
[21]THORNBERRY N A, LAZEBNIK Y. Caspases: Enemines within[J]. Science, 1998, 281(5381): 1312-1316.
[22]LIN F, GHISLAT G, LUO S, et al. XIAP and cIAP1 amplifications induce Beclin 1-dependent autophagy through NF-κB activation[J]. Hum Mol Genet, 2015, 24(10): 2899-2913.
The research on apoptosis of human laryngeal cell line Hep-2 induced by 1,4-bis[2-(benzylselanyl) ethoxy] anthracene
LI Sha1, ZHANG Sinan1, QIN Dabin2, YANG Jun1, WU Chunlian1,3(1.Key Laboratory of Southwest China Wildlife Resources Conservation, Ministry of Education, China West Normal University, Nanchong 637009, Sichuan Province, China; 2.College of Chemistry and Chemical Engineering, China West Normal University, Nanchong 637009, Sichuan Province, China; 3.State Key Laboratory Breeding Base of Eco-environments and Bio-resources of the Three Gorges Reservoir Region, Southwest University, Chongqing 400715, China)
Background and purpose:Selenium is one of the essential trace elements for human activities, and plays an incomparable role in maintaining human health. It was reported that selenium compound 1,4-bis[2-(benzylselanyl)ethoxy](BSEA) anthracene has antiseptic and antiphlogistic effects. However, the mechanisms underlying anticancer effects of BSEA are rarely reported. BSEA-induced apoptosis in human laryngeal carcinoma Hep-2 cells and its mechanisms were studied.Methods:Methyl thiazolyl tetrazolium (MTT) assay was used to determine inhibition ratio of Hep-2 cells 24 hours after Hep-2 cells were treated with different concentrations of BSEA. Fluorescence microscope was used to observe the morphology change of apoptosis in Hep-2 cells. The apoptosis was detected by Annexin Ⅴ-FITC. Mitochondrial membrane potential was assayed by JC-1. Microplate reader detected the activity of caspase-3 and caspase-8. The mRNA and protein levels of Bax and XIAP were measured by real-time fluorescent quantitative polymerase chainreaction (RTFQ-PCR) and Western blot.Results:The results showed that BSEA caused a dose-dependent inhibition of the growth of human laryngeal carcinoma cell line Hep-2 in vitro, and IC50was 35.74 μmol/L. The apoptotic bodies were distinctly observed at a concentration of 80 μmol/L of BSEA by AO fluorescence staining. This study found that the eversion of phosphatidyl serine intensified, and mitochondrial membrane potential also began to decline. The activity of caspase-3 appeared the tendency of dependence on dosage, while the activity of caspase-8 did not change significantly. The mRNA and protein expression level of Bax increased, whereas the mRNA and protein expression level of XIAP decreased.Conclusion:Therefore, BSEA could obviously inhibit human laryngeal carcinoma Hep-2 cells proliferation and induce apoptosis via the mitochondrial pathway.
1,4-bis[2-(benzylselanyl)ethoxy]anthracene; Hep-2 cells; Apoptosis; Mitochondrial pathway
10.19401/j.cnki.1007-3639.2016.12.005
R739.65
A
1007-3639(2016)12-0989-07
2016-04-26
2016-07-14)
四川省教育厅重大培育项目(13CZ0029);中国博士后基金(2013M540391);三峡库区生态环境与生物资源省部共建重点实验室开放课题基金项目(SKL-2011-05)。
伍春莲 E-mail: wcl_xj@163.com

