降调ACSS2对非小细胞肺癌A549细胞增殖、凋亡和迁移的影响
卢晓霞,常 淑,毕明宏,王雅萍
1.蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233000;
2.蚌埠医学院组织移植安徽省重点实验室,安徽 蚌埠 233000;
3.蚌埠医学院第一附属医院图书馆,安徽 蚌埠 233000
降调ACSS2对非小细胞肺癌A549细胞增殖、凋亡和迁移的影响
卢晓霞1,2,常 淑3,毕明宏1,王雅萍1
1.蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233000;
2.蚌埠医学院组织移植安徽省重点实验室,安徽 蚌埠 233000;
3.蚌埠医学院第一附属医院图书馆,安徽 蚌埠 233000
背景与目的:代谢水平的改变是肿瘤细胞生长的主要特征之一,有研究证实,乙酰辅酶A合成酶2(cytosolic acetyl-CoA synthetase 2,ACSS2)在肿瘤细胞的代谢中起着至关重要的作用。本研究拟通过RNA干扰技术抑制非小细胞肺癌(non-small cell lung cancer,NSCLC)A549细胞中ACSS2的表达,探讨ACSS2对A549细胞增殖、凋亡和迁移的影响。方法:设计并合成针对ACSS2的特异性干扰片段ACSS2-siRNA及与ACSS2没有同源性的阴性对照,瞬时转染NSCLC A549细胞,通过实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测ACSS2 mRNA的表达情况,四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)实验检测转染组与对照组细胞的增殖情况,流式细胞仪检测细胞的凋亡率,细胞划痕实验检测细胞迁移能力。结果:通过转染体外合成的干扰片段ACSS2-siRNA,NSCLC A549细胞中ACSS2 mRNA呈显著低表达。ACSS2-siRNA干扰组的细胞较对照组增殖活性明显减弱,凋亡增加,迁移能力减弱。结论:降调ACSS2表达能显著抑制A549细胞增殖、迁移能力,促进凋亡尤其是早期凋亡明显增加。
肺肿瘤;乙酰辅酶A合成酶2;RNA干扰
据国际癌症研究机构(International Agency for Research on Cancer,IARC)2012年统计,肺癌的新发病例数约为180万,占癌症总数的1 2.9%,约占死亡人数的20%[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)在肺癌中约占85%~90%[2]。虽然现有的系统性化疗、放疗和分子靶向治疗等治疗手段不断进展,但由于目前大多数患者在诊断时已属晚期而失去手术机会,其死亡率仍然居高不下。有研究显示,恶性肿瘤细胞的特征包括共同的自给自足生长信号、生长不敏感信号、逃避凋亡、无限复制的潜力、持续的血管生成、组织侵袭和转移[3]。肿瘤细胞代谢的改变可以认为是其第七大重要特征。Warburg等[4]比较正常肝细胞和肝癌细胞的代谢特点时发现,癌细胞的葡萄糖摄取能力及糖酵解代谢增强,呈现葡萄糖的高摄取率、糖酵解代谢增强及代谢产物乳酸增加的现象,被称为瓦尔堡效应。细胞生长、增殖与代谢是密切配合的。肿瘤细胞在营养受限的情况下可以通过代谢途径增强增殖能力的说法仍然存在争议。目前,对于肿瘤细胞在代谢的哪些方面可能具有临床意义的易损靶点尚不明确[5]。乙酰辅酶A是三大营养物质代谢的核心,在能量代谢、基因表达和细胞增殖等方面起着重要作用。有研究发现,在低氧及其脂类物质耗尽的情况下,乙酰辅酶A主要依靠乙酰辅酶A合成酶2(cytosolic acetyl-CoA synthetase 2,ACSS2)催化乙酸盐生成[6]。
临床影像学研究发现,人类多数肿瘤都有对于乙酸盐的活跃吸收,包括前列腺、肝、肺和脑部肿瘤[7-9]。ACSS2在多种肿瘤中高表达,而在相应正常组织中低或无表达。Schug等[10]报道在新陈代谢应激的情况下ACSS2表达呈上调趋势,沉默ACSS2表达可以抑制移植瘤的生长,可见在低氧或脂类耗尽的情况下,ACS22对于肿瘤细胞的生长起重要作用。本研究拟在细胞水平探索ACSS2的生物学功能。利用瞬时转染技术在肺癌A549细胞中降调ACSS2,用实时荧光定量聚合酶链反应(realtime fluorescent quantitative polymerase chain reaction,RTFQ-PCR)技术检测ACSS2 mRNA的表达水平。应用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、流式细胞术和细胞划痕实验检测ACSS2对细胞增殖、凋亡和迁移能力的影响。
1 材料和方法
1.1 细胞培养
NSCLC细胞株A549与正常支气管上皮细胞株16HBE购自上海耀新生物科技有限公司,采用含10%胎牛血清、100 U/mL青霉素及0.1 mg/mL链霉素的RPMI 1640细胞培养液,于37 ℃、CO2体积分数为5%的培养箱中常规培养。
1.2 RTFQ-PCR检测细胞中ACSS2表达情况
按照Trizol试剂说明书提取A549细胞和16HBE细胞RNA,使用紫外分光光度仪分析纯度及浓度。按照逆转录试剂盒说明书操作方法将其逆转录为cDNA。
通过Genebank设计ACSS2 PCR扩增引物序列,通过Primer-Blast同源性检测证实目的基因序列为293 bp,由生工生物工程(上海)股份有限公司合成。用于RTFQ-PCR的引物ACSS2正义序列:5’-CTGCTACTTTCCCATTCTTT-3’,反义序列:5’-CTCCACCTCTGCTGTACTCA-3’。β-actin购自生工生物工程(上海)股份有限公司。
使用日本TaKaRa公司的SYBR® Premix Dimer Eraser™(Perfect Real Time)试剂盒进行RTFQ-PCR实验,方法与步骤按照说明书进行。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,56.9 ℃退火30 s,72 ℃延伸34 s,共40个循环扩增。记录各样品Ct值,计算各组目的基因相对表达量。△CtACSS2=CtACSS2-Ctβ-actin;△△Ct=△Ct肿瘤-△Ct正常平均值;目的基因相对表达量(relative quantification,RQ)为2-△△Ct。
1.3 siRNAs的序列合成与转染
1.3.1 siRNAs序列合成
ACSS2-siRNAs序列片段由上海吉玛生物制药公司设计合成。目的序列正义链:5’-GCGAGUGCUUCGGAAGAUUTT-3’;反义链:5’-AAUCUUCCGAAGCACUCGCTT- 3’;阴性对照序列正义链:5’-UUCUCCGAACG UGUCACGUTT-3’;反义链:5’-ACGUGA CACGUUCGGAGAATT-3’。
1.3.2 siRNAs转染
选用生长状态良好的对数生长期细胞进行转染,实验步骤参照上海吉玛制药技术有限公司转染手册及LipofectamineTM2000转染说明。转染细胞分为实验组、阴性对照组和空白对照组。具体如下(以24孔板为例,其他孔相应调整)。转染前1天,将1.0×105个细胞接种在24孔板上,在24 h内细胞汇合达50%~70%。经预实验优化试剂用量分别为20 pmol siRNA和2 μL LipofectamineTM2000,培养基最终体积为500 μL/孔。转染6 h后更换培养基继续培养,12 h内进行流式细胞仪检测转染效率。24~72 h后收获细胞进行转染后的其他实验。
1.4 RNA干扰效果鉴定
1.4.1 流式细胞仪检测5(6)-羧酸荧光素标记的ACSS2-siRNA转染情况
脂质体介导的5(6)-羧酸荧光素标记的ACSS2-siRNA转染步骤同上,转染后将细胞置于37 ℃、CO2体积分数为5%的恒温箱中避光培养。6~8 h后取出细胞,经PBS洗涤3遍后,在4 ℃的条件下,223.8×g离心5 min,收集细胞进行流式细胞术转染效率检测。
1.4.2 RTFQ-PCR
按照Trizol试剂说明书提取转染前和转染后A549细胞RNA,使用紫外分光光度仪分析纯度及浓度。按照逆转录试剂盒说明书操作方法将其逆转录为cDNA。使用SYBR® Premix Dimer Eraser™(Perfect Real Time)试剂盒进行RTFQ-PCR实验,方法与步骤按照说明书进行。反应条件为:95.0 ℃预变性30 s,95.0 ℃变性5 s,56.9 ℃退火30 s,72.0 ℃延伸34 s,共40个循环扩增。记录各样品Ct值,计算各组目的基因相对表达量。△CtACSS2=CtACSS2-Ctβ-actin;△△Ct=△Ct肿瘤-△Ct正常平均值;目的基因RQ为 2-△△Ct。
1.5 MTT法检测细胞增殖
将处于对数期的细胞接种于96孔板,进行转染。转染细胞分为实验组、阴性对照组和未处理组。分别在转染后24、48、72和96 h加入浓度为5 mg/mL的MTT 20 μL,混匀,避光温育4 h。吸弃培养液,每孔加入150 μL二甲基亚砜,室温下避光振荡10 min。酶标仪检测490 nm处吸光度(D)值。实验重复3次,按以下公式计算细胞增殖抑制率(%):细胞增殖抑制率=(1-实验组D值/对照组D值)×100%,绘制生长曲线。
1.6 流式细胞术检测细胞凋亡
将处于对数生长期的细胞接种于6孔板,于37℃、CO2体积分数为5%的恒温箱中温育24 h后进行LipofectamineTM2000介导的siRNA转染,分为实验组、阴性对照组和未处理组。48 h后计数,以每管取5×105个细胞移至流式管中,按照凋亡检测试剂盒说明书步骤操作如下:加入500 μL的Binding Buffer悬浮细胞后加入5μL Annexin V-FITC混匀,继续加入5 μL Propidiμm Iodide,混匀;室温、避光反应5~15 min;在1 h内,采用流式细胞仪检测。每组重复3次(转染后处理细胞过程均以强光照射,总照射时间大于1 h,于荧光显微镜下观察无绿色荧光)。
1.7 细胞划痕实验检测细胞迁移能力
将处于对数期的细胞接种于6孔板,进行转染。转染细胞分为实验组、阴性对照组和未处理组,于24 h铺满6孔板,进行划痕。采用含3%胎牛血清、1%青链霉素双抗的RPMI 1640细胞培养液,于37 ℃、C02体积分数为5%的培养箱中常规培养。分别在转染后0、24和48 h观察细胞愈合程度并拍照。
1.8 统计学处理
2 结 果
2.1 RTFQ-PCR检测肺癌细胞A549中ACSS2呈高表达
通过RTFQ-PCR检测NSCLC A549细胞与正常支气管上皮细胞株16HBE中ACSS2 mRNA的表达情况。结果显示,A549中ACSS2的相对表达量约为正常支气管上皮细胞株16HBE的(2.61±0.05)倍,差异有统计学意义(P<0.05,图1)。
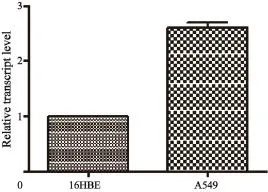
图 1 RTFQ-PCR检测ACSS2 mRNA在NSCLC细胞株及正常支气管上皮细胞株中的表达Fig. 1 The expression of ACSS2 mRNA in bronchial epithelial cell and NSCLC cells detected by RTFQ-PCR
2.2 siRNA转染细胞效果检测
使用流式细胞仪对转染后标记有5(6)-羧酸荧光素的细胞进行转染效率检测,转染效率大于70%(图2)。

图 2 流式细胞仪检测细胞转染效率Fig. 2 The transfection efficiency of ACSS2 siRNA
2.3 转染ACSS2-siRNA能沉默ACSS2 mRNA表达
对转染后72 h的细胞进行RTFQ-PCR检测。结果显示,ACSS2-siRNA干扰组ACSS2mRNA表达量(0.26±0.44)较空白对照组(1.00±0.51)及阴性对照组(1.06±0.40)显著降低,差异有统计学意义(P<0.05),阴性对照组与空白对照组差异无统计学意义(图3)。

图 3 RTFQ-PCR检测转染后ACSS2基因mRNA的表达水平Fig. 3 RTFQ-PCR was used to detect the expression of ACSS2 mRNA
2.4 转染ACSS2-siRNA能抑制A549细胞增殖
MTT法检测转染后24、48、72和96 h ACSS2-siRNA对NSCLC细胞系A549的生长抑制作用,结果显示,转染后24、48、72和96 h,siACSS2对细胞的生长抑制率分别为(8.5±5.2)%、(17.3±3.6)%、(22.9±4.1)%和(29.7±6.5)%,与对照组相比,转染后24 h细胞抑制率差异无统计学意义(P=0.06),48、72和96 h细胞抑制率差异有统计学意义(P<0.05),降调ACSS2可明显抑制细胞增殖(图4)。
2.5 转染ACSS2-siRNA能促进细胞凋亡
流式细胞术检测转染ACSS2-siRNA对A549细胞凋亡的影响,siACSS2转染后48 h,使用流式细胞仪对三组细胞进行细胞凋亡分析,结果显示,ACSS2-siRNA转染组较阴性对照组及空白对照组细胞凋亡率明显上升,早期细胞凋亡率分别为21.60±2.92、5.70±2.51和8.50±1.60,ACSS2-siRNA转染组细胞早期凋亡率明显高于阴性对照组及空白对照组(P<0.05),而后两者之间差异无统计学意义。说明降调ACSS2能够促进肺癌细胞A549发生早期凋亡(图5)。
2.6 转染ACSS2-siRNA能抑制细胞迁移
细胞划痕实验检测ACSS2-siRNA对细胞迁移能力的影响,结果应用Image-Pro plus 6.0分析,分别测量0、24和48 h的划痕宽度,平均迁移距离=(0 h的划痕宽度-24或48 h的划痕宽度)/2。24 h实验组细胞平均迁移(32.6±5.8) μm,阴性对照组平均迁移(44.6±8.4) μm,空白对照组平均迁移(42.9±8.0) μm,三组之间差异无统计学意义(P>0.05)。48 h实验组细胞平均迁移(83.1±7.7) μm,阴性对照组平均迁移(120.3±8.3) μm,空白对照组平均迁移(125.5±7.6) μm,实验组与空白对照组细胞迁移距离差异有统计学意义(P<0.05,图6)。

图 4 MTT检测ACSS2-siRNA转染对A549细胞的生长抑制作用Fig. 4 MTT was used to test the inhibition of cell growth after ACSS2-siRNA transfection

图 5 降调ACSS2表达对NSCLC A549细胞凋亡率的影响Fig. 5 The impact of ACSS2 knockdown on apoptosis rate of NSCLC cell A549

图 6 细胞划痕实验检测细胞迁移能力Fig. 6 Wound healing assay was used to detect cell migration
3 讨 论
肝癌肿瘤模型的研究结果显示,ACSS2基因的缺失降低了肿瘤的发生率[5]。Mashimo等[11]认为ACSS2在脑神经胶质瘤及其转移肿瘤中表达上调并且具有广泛的免疫反应性。另外在Ⅱ、Ⅲ期恶性神经胶质瘤中患者生存时间短可能与ACSS2高表达相关。提示ACSS2可能是潜在的肿瘤治疗的靶点或者是评价预后的可能指标。
本研究前期在组织水平证实,NSCLC的癌组织中存在ACSS2高表达,而正常肺组织表达量极少。现通过体外细胞培养进一步探索了ACSS2对于NSCLC A549细胞的生物学功能的影响。实验利用RNA干扰技术设计合成siRNA片段,通过LipofectamineTM2000转入A549细胞内,经流式细胞仪鉴定其转染效率大于70%,RTFQ-PCR验证细胞ACSS2 mRNA表达明显下调。通过MTT、细胞划痕实验检测细胞增殖及迁移能力减弱,通过流式细胞仪检测细胞凋亡能力增强。提示ACSS2在肺腺癌的发生、发展中可能起重要作用,其表达量的多少对A549细胞的生物学功能有重要影响。但是其在体内对于NSCLC细胞的生长、转移是否至关重要,降调ACSS2能否显著抑制NSCLC的发生、发展,是否能通过其预测患者预后尚需要进一步更深入的研究。本研究在体外细胞水平上是通过肺腺癌细胞株A549进行的,A549细胞不能够完全代表其他类型的NSCLC,体外细胞实验不能够完全模拟体内生理环境,故实验存在一定的局限性。本研究通过ACSS2-siRNA干扰技术降调ACSS2表达,但只进行了基因水平的鉴定,下一步应该在蛋白水平进行鉴定其是否有蛋白表达量的减少。另外,动物水平及与临床治疗有关的研究也是后续研究的方向。在机制研究方面,需要更深入的研究,寻找其具体参与的分子调控机制。为肺癌的靶向治疗及预后评价方面提供依据。
[1]TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2]GOLDSTRAW P, CROWLEY J, CHANSKY K, et al. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours [J]. J Thorac Oncol, 2007, 2(8): 706-714.
[3]HANAHAN D, WEINBERG R A. The Hallmarks of Cancer[J]. Cell, 2000, 100(1): 57-70.
[4]WARBURG O. On respiratory impairment in cancer cells[J]. Science, 1956, 124(3215): 269-270.
[5]COMERFORD S A, HUANG Z, DU X, et al. Acetate dependence of tumors [J]. Cell, 2014, 159(7): 1591-1602.
[6]YOSHII Y, FURUKAWA T, YOSHII H, et al. Cytosolic acetyl-CoA synthetase affected tumor cell survival under hypoxia: the possible function in tumor acetyl-CoA/acetate metabolism [J]. Cancer Sci, 2009, 100(5): 821-827.
[7]HO C L, YU S C, YEUNG D W. 11C-acetate PET imaging in hepatocellular carcinoma and other liver masses [J]. J Nucl Med, 2003, 44(2): 213-221.
[8]NOMORI H, SHIBATA H, UNO K, et al. 11C-Acetate can be used in place of 18F-fluorodeoxyglucose for positron emission tomography imaging of non-small cell lung cancer with higher sensitivity for well-differentiated adenocarcinoma [J]. J Thorac Oncol, 2008, 3(12): 1427-1432.
[9]SPICK C, POLANEC S H, MITTERHAUSER M, et al. Detection of bone metastases using 11C-acetate PET in patients with prostate cancer with biochemical recurrence[J]. Anticancer Res, 2015, 35(12): 6787-6791.
[10]SCHUG Z T, PECK B, JONES D T, et al. Acetyl-CoA synthetase 2 promotes acetate utilization and maintains cancer cell growth under metabolic stress [J]. Cancer Cell, 2015, 27(1): 57-71.
[11]MASHIMO T, PICHΜMANI K, VEMIREDDY V, et al. Acetate is a bioenergetic substrate for human glioblastoma and brain metastases [J]. Cell, 2014, 159(7): 1603-1614.
The influence of ACSS2 knockdown on the proliferation, apoptosis and migration of NSCLC cell line A549
LU Xiaoxia1,2, CHANG Shu3, BI Minghong1, WANG Yaping1(1. Department of Medical Oncology, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, Anhui Province, China; 2. Anhui Key Laboratory of Tissue Transplantation of Bengbu Medical College, Bengbu 233000, Anhui Province, China; 3. Department of Library, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, Anhui Province, China)
Background and purpose:Metabolism change is one of the main characteristics of the tumor development. Many studies have confirmed that cytosolic acetyl-CoA synthetase 2 (ACSS2) plays a critical role in hydrocarbon metabolism of cancer cells. This study aimed to explore the effect of ACSS2 on cellular proliferation, apoptosis and migration of A549 cells by RNA interference.Methods:The ACSS2 interference fragment ACSS2-siRNA and negative control were designed and synthesized for RNA interference followed by the transient transfection in non-small cell lung cancer (NSCLC) cell line A549. Real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) was used to detect ACSS2 mRNA expression. Methyl thiazolyl tetrazolium (MTT), flow cytometry and wound healing assay were used to detect cell proliferation, apoptosis rate and migration.Results:The expression of ACSS2 mRNA was significantly decreased after transfection with the interference fragment ACSS2-siRNA in NSCLC cell line A549. The proliferation and migration activity of ACSS2-siRNA treated cells were decreased significantly compared with the control group. The apoptosis rate, especially the early apoptosis, was increased..Conclusion:Knockdown of the ACSS2 expression in NSCLC cell line A549 can significantly inhibit the cell proliferation, migration ability and pro-mote the apoptosis rate, especially early apoptosis. This study indicates that ACSS2 may contribute to the progression of human lung adenocarcinoma and may have the potential to serve as a novel therapeutic target.
Lung neoplasm; Cytosolic acetyl-CoA synthetase 2; RNA interference
10.19401/j.cnki.1007-3639.2016.12.003
R734.2
A
1007-3639(2016)12-0974-07
2016-05-25
2016-07-18)
毕明宏 E-mail: bmh2003@126.com

