貂源肺炎克雷伯氏菌对小白鼠的致病性及其药物防治研究
黄迪海,郭卉,王贵升,盛晓丹,黄兵,秦春芝,张从敬,刘霞,秦卓明,*
(1. 山东省健牧生物药业有限公司 济南 250100;2. 济南市动物生物药品工程技术研究中心 济南 250100;3. 山东省农业科学院家禽研究所 济南 250021; 4. 山东省动物疫病预防与控制中心 济南 250022)
貂源肺炎克雷伯氏菌对小白鼠的致病性及其药物防治研究
黄迪海1,2,郭卉1,2,王贵升4,盛晓丹1,2,黄兵3,秦春芝1,2,张从敬1,2,刘霞1,2,秦卓明1,2,3*
(1. 山东省健牧生物药业有限公司 济南 250100;2. 济南市动物生物药品工程技术研究中心 济南 250100;3. 山东省农业科学院家禽研究所 济南 250021; 4. 山东省动物疫病预防与控制中心 济南 250022)
为评价貂源肺炎克雷伯氏菌(抗原型K2-5)的致病性和药物防控效果,利用水貂和小白鼠分别进行动物回归试验和半数致死量(LD50)毒力测定,旨在建立小白鼠致病模型。同时,按1 LD50剂量接种小白鼠,选用盐酸洛美沙星分别按0.05(低)、0.2 mg/只(高)两个不同的剂量进行饮水预防和治疗,同时设攻毒和健康对照,观察、记录和比较试验结果。结果表明:该菌对小白鼠腹腔注射的LD50为6.29 CFU/0.3 mL。药物试验表明,高剂量组预防和治疗效果显著优于低剂量组,预防组优于单纯的治疗组,而攻毒组则100%发病,存活率仅为60%。该结果为临床防控貂源肺炎克雷伯氏菌病提供了依据。
水貂;肺炎克雷伯氏菌;LD50;盐酸洛美沙星;疗效
肺炎克雷伯氏菌(Klebsiellapneumoniae)为革兰氏阴性杆菌,广泛分布于自然界,亦存在于健康人与动物的呼吸道和肠道中,是一种可以引起人和多种动物患病的条件性致病菌,可引起支气管炎、肺炎、泌尿系统和创伤感染、败血症、脑膜炎、腹膜炎等[1-2]。肺炎克雷伯氏菌毒力因子主要包括:荚膜多糖(K抗原)、Ⅰ型菌毛、脂多糖(O抗原)、铁摄入能力等。荚膜多糖是肺炎克雷伯氏菌的主要毒力因子。根据荚膜多糖(K抗原)分型,可将肺炎克雷伯氏菌分为82个抗原型。其中K1、K2和K5型与人和动物体的严重感染性疾病有密切关系。
近年来,水貂感染肺炎克雷伯氏菌导致肺炎和败血症的病例逐渐增多,对水貂造成了严重的经济损失,是危害貂仅次于大肠杆菌的第二大革兰氏阴性菌,日益引起人们的关注[3-4]。由于肺炎克雷伯氏菌发病快、耐药性强,对该病的防控十分困难。建立合适的动物致病模型,快速筛选出敏感药物是控制该病的关键。本试验结合临床发病病例,从临床药物控制失败的貂群中分离出一株肺炎克雷伯氏菌,在对其进行鉴定的基础上,评价了其对貂和小白鼠的致病性,构建了小鼠发病模型,结合水貂用药特点,筛选出盐酸洛美沙星等敏感药物,生物利用度高,预防和治疗效果好,为临床水貂克雷伯氏菌肺炎的防控提供了技术依据。
1 材料
1.1 菌株 肺炎克雷伯氏菌,分离自患肺炎的水貂,由山东省动物疫病预防与控制中心鉴定和分型,抗原型为K2-5型。
1.2 试验动物 水貂(母)15只,420日龄,由潍坊诸城某养殖场提供。SPF级昆明小白鼠155只,雌雄各半,体重18~22 g,鼠粮及垫料若干;均由济南朋悦实验动物繁育有限公司,生产资质SCXK(鲁)20140007。
1.3 药品与试剂 盐酸洛美沙星可溶性粉,规格为2.5%,生产批号20150501,由山东省健牧生物药业有限公司生产。营养肉汤,批号20140705;营养琼脂,批号:20150428,北京奥博星生物技术有限责任公司。氨苄西林、阿莫西林、卡那霉素、林可霉素、氟苯尼考、多西环素、环丙沙星、恩诺沙星、盐酸洛美沙星、粘杆菌素B和庆大霉素标准药敏片,杭州滨和微生物试剂有限公司,批号:20150327。
1.4 仪器 超净工作台,型号:LCT-2DC-A,济南绿之洁科技有限公司;恒温摇床培养箱,型号:HZQ-Q,东联电子技术开发有限公司;恒温培养箱,型号DHP-420,北京市永光明医疗仪器有限公司;手提式蒸汽灭菌器,型号:GMSX-260,北京市永光明医疗仪器有限公司。
2 方法
2.1 药敏试验 按照WHO推荐的Kirby-Bauer法[5]进行药敏试验。
2.2 试验菌液制备 菌种复苏后划线接种于普通营养琼脂平板,37 ℃培养24 h;挑取单菌落,接种于灭菌营养肉汤培养基试管中,37 ℃培养24 h;取培养液5 mL,接种于含普通营养琼脂的2个克氏瓶中,37 ℃培养24 h;用营养肉汤70 mL洗脱菌苔,重悬,将菌液加入带有玻璃珠的锥形瓶内,37 ℃摇床振荡1 h,即得试验菌液;对试验菌液进行10倍梯度稀释,接种普通营养琼脂平板,培养24 h,计数。
2.3 动物回归试验和小鼠致病模型建立 水貂组将试验菌液按10-4、10-5、10-6、10-7四个梯度稀释后,每个稀释度菌液接种3只420日龄健康水貂,按0.3 mL/200 g体重的剂量腹腔注射作为试验组,同时设置灭菌生理盐水对照组。接种后每天观察水貂发病情况,记录分析菌株对水貂的致病性,病死水貂剖检、分菌鉴定。小白鼠组将试验菌液按10-5、10-6、10-7、10-8四个梯度稀释后,每个稀释度菌液接种5只小白鼠,腹腔注射剂量0.3 mL/只,同时设置生理盐水对照组。攻毒后,每天观察小白鼠发病和死亡情况,病死小白鼠剖检,分菌鉴定。
2.4 LD50测定 试验分7组,每组10只小白鼠,包括6个攻毒组和1个对照组。试验小白鼠攻毒前12 h禁食,自由饮水。试验菌液分别按10-6、10-7、10-8、10-9、10-10、10-11六个梯度稀释,对小白鼠腹腔注射,注射剂量为每20 g体重0.3 mL;对照组腹腔注射相同剂量的灭菌生理盐水。攻毒后连续观察14 d,并统计死亡数据。按Karber法计算LD50,即logLD50=Xk-i(Σp-0.5),其中Xk为最大剂量的对数,Σp为死亡率的总计,i为剂量对数的间距[5]。
2.5 药物防治 试验分6组,参考LD50数据,试验菌液按LD50剂量攻毒。药物防治分为预防组和治疗组,预防组提前用药2 d,攻毒后继续用药3 d;治疗组攻毒后6 h开始用药,连用3 d,小白鼠每天的饮水量按3 mL计算,全天饮用盐酸洛美沙星水溶液,药液每天更换;同时做阳性攻毒对照组和空白对照组(表1)。观察记录小白鼠发病和死亡情况,统计死亡率;死亡小白鼠剖检,肉眼观察病变,自肝脏、肺脏分菌鉴定。

表1 盐酸洛美沙星对肺炎克雷伯氏菌感染小白鼠的防治试验分组
3 结果
3.1 细菌分离和药物敏感试验 分离株耐药性强,对氨苄西林、阿莫西林、卡那霉素、林可霉素、氟苯尼考、多西环素、环丙沙星、恩诺沙星等常见的兽用抗生素耐药,对盐酸洛美沙星、粘杆菌素B、庆大霉素中敏。
3.2 水貂动物回归试验和小鼠疾病模型建立 试验菌液活菌含量为3.15×1010CFU/mL。试验组水貂在接种试验菌液6 h后,各组水貂均表现为精神极度沉郁,卧地不起,急促喘气,食欲废绝,眼睛有大量分泌物等症状,个别出现腹泻;10-4、10-7组24 h各死亡1只,另外10只也在48 h内相继死亡(表2)。剖检可见肺脏出血,坏死,肝脏、肾脏表面有少量出血点,肠道无明显变化。并再次从病死水貂肺脏、肝脏和大脑分离到该菌,表明该分离株对水貂有很强的致病性。
试验菌液活菌含量为2.8×1010CFU/mL。小白鼠攻毒后6 h发病,表现为精神沉郁、站立不稳、被毛逆立、呼吸急促等症状,采食量和饮水量减少。24 h后,小白鼠开始出现死亡,除10-8剂量组72 h死亡率80%外,其他3组均在48 h内全部死亡(表2)。病死小白鼠剖检,可见胸腔、肺脏有积液,肝脏肿大淤血,肺部有出血,肠壁充血、变薄;从病死小白鼠肝脏、肺脏中分离到该菌。小白鼠和水貂发病时间、发病症状和死亡率等相似。
3.3 LD50测定 试验菌液活菌含量为3.15×1010CFU/mL。小白鼠攻毒后,立即表现为精神沉郁、呆立症状,30 min后恢复正常;10-11稀释度试验组无明显症状,10-6、10-7、10-8、10-9、10-10稀释度试验组在攻毒后6 h开始发病,表现为精神沉郁、站立不稳、被毛逆立、呼吸急促等症状,采食量和饮水量减少。10-6和10-7稀释度试验组小白鼠在3 d内全部死亡;10-8稀释度试验组小白鼠在5 d内全部死亡;10-9和10-10稀释度试验组小白鼠在7 d内分别死亡7只和5只,剩余小白鼠14 d仍存活;10-11稀释度试验组小白鼠均存活(表3)。按Karber法计算,LD50为10-9.7/0.3 mL,LD50的95%可信区间为10-9.24~10-10.14/0.3 mL,即按1.89 CFU/只的剂量腹腔注射小白鼠,可使50%的小白鼠发生死亡。
病死小白鼠剖检,可见胸腔、肺脏有积液,肝脏肿大淤血,肺部有出血,肠壁充血、变薄;从病死小白鼠肝脏、肺脏中分离细菌,经鉴定,为肺炎克雷伯氏菌。
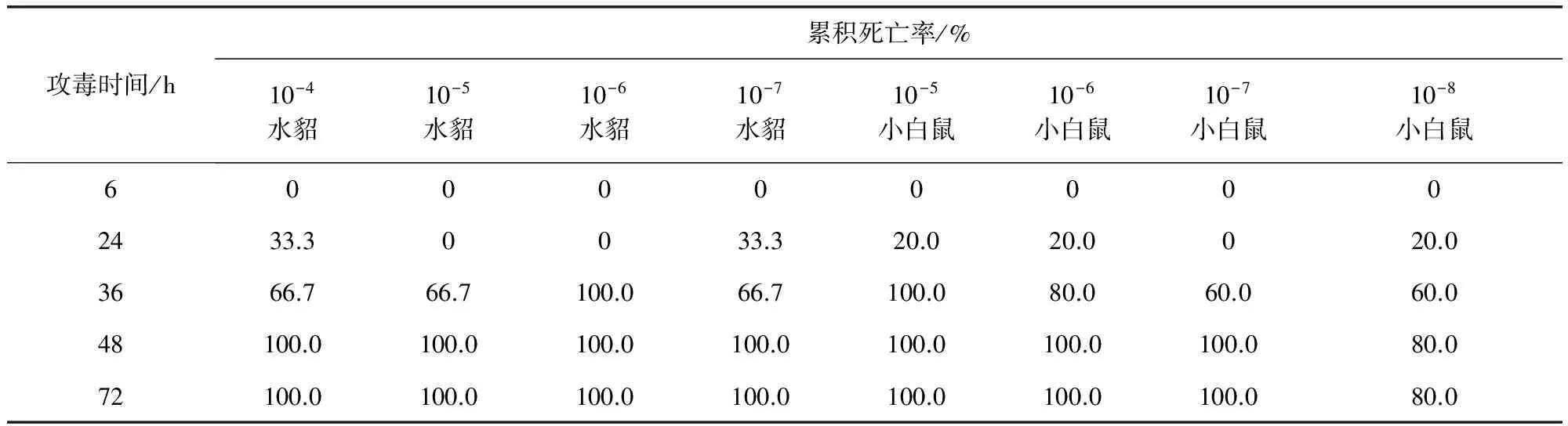
表2 各攻毒试验组动物在不同时间的死亡率
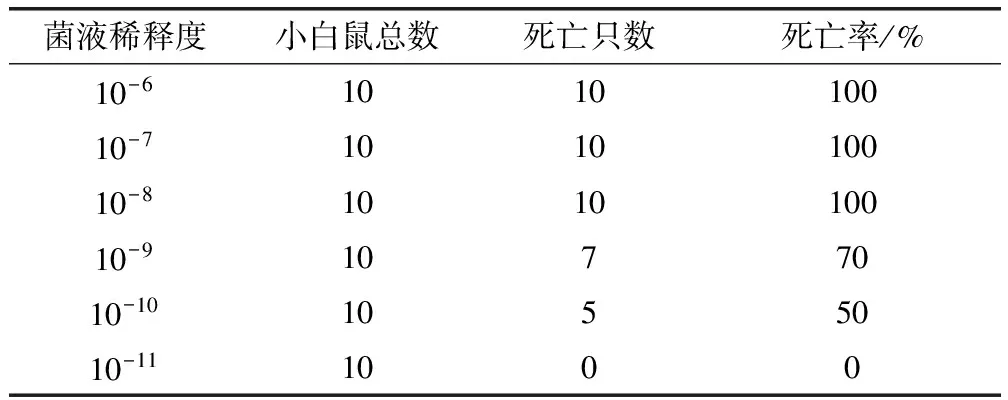
表3 LD50试验组小白鼠攻毒后的死亡情况
3.4 防治效果 小白鼠饮用盐酸洛美沙星水溶液,无明显毒副作用;小白鼠攻毒后的症状表现与LD50组一致,药物防治组症状较轻;病死小白鼠剖检,可见胸腔、肺脏有积液,肝脏肿大淤血,肺部有出血,肠壁充血、变薄;病死小白鼠肝脏、肺脏分菌,经鉴定,为肺炎克雷伯氏菌。
盐酸洛美沙星对貂源肺炎克雷伯氏菌人工感染的小白鼠具有一定的疗效,其中,药物预防高剂量组最佳,100%存活,预防低剂量组和治疗高剂量组一致,存活率均为80%,治疗低剂量组无明显效果(表4)。治疗组和阳性攻毒组死亡均发生在攻毒后3 d内,之后均存活;预防低剂量组死亡发生在1 d内,之后均存活且症状恢复正常,表明药物预防组小白鼠攻毒后在较快时间内恢复健康。
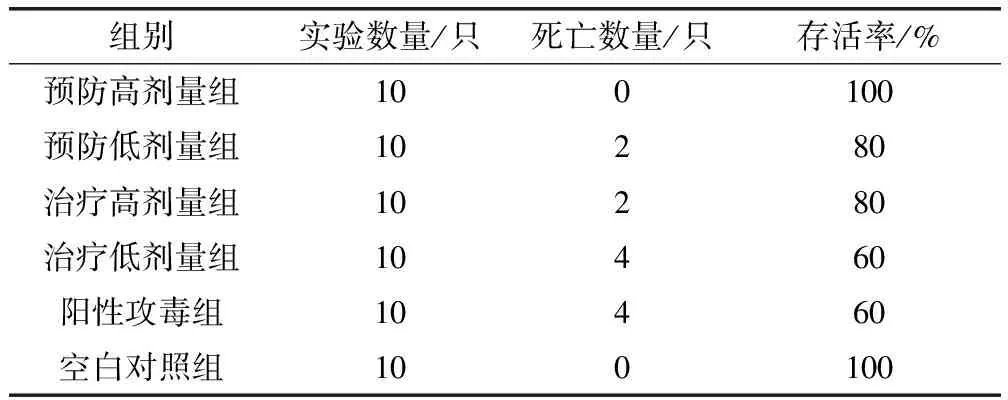
表4 盐酸洛美沙星对克雷伯氏菌感染小白鼠的防治效果
4 讨论
国内外已有学者报道过肺炎克雷伯氏菌对小白鼠的半数致死量,L. Kristopher Siu等[6]测定了15株人源分离株的腹腔注射LD50,分别从<102~ 3.5×105CFU/只;Shankar-sinha Sunita等[7]测定了人源野生型分离株和O抗原缺失株的气管攻毒LD50,分别是2×103CFU/只和6×104CFU/只;张诗渝[8]测定了鼠分离株KPm0912与标准株KP1300的皮下注射LD50,分别为5.5×104CFU/只 和6.5×105CFU/只;郝中香等[9]测定了四株扭角羚分离株的腹腔注射LD50,最强株是2.9×107CFU/只;马磊等[10]从竹鼠中分离的克雷伯氏菌腹腔注射的半数致死量为4.5×107CFU/只;钟世勋[11]从毛皮动物分离的肺炎克雷伯氏菌K1腹腔注射的LD50为3.06×107CFU/只;王剑等[12]从水貂中分离的两株克雷伯氏菌KP-ZC1和KP-ZC2的腹腔注射LD50分别为9.8×105CFU/只、6.2×105CFU/只;李富祥等[13]从仔猪中分离的KP14013株对小白鼠腹腔注射的LD50为3×101.8CFU/只。本试验菌株(K2-5型)对小白鼠腹腔注射LD50为1.89 CFU/只,毒力明显强于上述报道。试验过程中发现,菌株培养6代以后,致病性显著下降,100 CFU腹腔注射,小白鼠死亡率为0,剂量增大至10000 CFU时,小白鼠死亡率才能达到100%,原因可能是传代造成毒力因子的丢失,有待进一步研究。
动物回归试验发现,貂源肺炎克雷伯氏菌按每200 g体重0.3mL腹腔注射3.15×103CFU,48 h可导致水貂100%死亡,证实了该菌是引起水貂肺炎和大量死亡的病原。再次从病死水貂的脑组织中分离到该菌,说明该菌能通过血脑屏障,对于其致病机理的研究和防控具有重要的借鉴作用。
盐酸洛美沙星属于氟喹诺酮类抗菌药,其抗菌机理是抑制DNA回旋酶的A亚单位的切割及封口活性,阻碍细菌DNA合成而导致细菌死亡,该药物对细菌选择性高,不良反应少,口服吸收好,生物利用度为85%,血药浓度高而持久,t1/2约7 h,每日给药一次即可[14]。粘菌素B和庆大霉素内服用药很少吸收[15],适合注射使用。水貂攻击性强、捕捉难度大,在规模化养殖条件下,应优先选择全群防治、口服用药的疫病防控措施。本试验证实了混饮使用盐酸洛美沙星对感染肺炎克雷伯氏菌的小白鼠具有良好的防治效果,有助于进一步研究该药物对水貂感染肺炎克雷伯氏菌的防治效果,为经济动物专用药物的研制和应用提供参考。
肺炎克雷伯氏菌对洛美沙星等氟喹诺酮类药物的耐药机制是:编码DNA旋转酶的gyrA 基因及编码拓扑异构酶Ⅳ的parC基因变异,导致DNA旋转酶和拓扑异构酶Ⅳ的结构、构象发生变化,使药物不能与酶-DNA复合物稳定结合,起不到阻止细菌DNA合成的作用[15];ram A基因过度表达可能促进Acr AB外排系统表达增加,从而导致肺炎克雷伯氏菌对氟喹诺酮类耐药性增加[16]。因此,在氟喹诺酮类药物应用的同时,应注意监测肺炎克雷伯氏菌耐药基因的变化。
[1] 王世若. 兽医微生物学及免疫学[M] .长春: 吉林科学技术出版社, 1990: 8.
[2] 贾艳. 猪源肺炎克雷伯菌菌毛致病的分子基础及其免疫相关抗原表位的筛选[D] . 长春:吉林大学, 2007 .
[3] 项方, 王殿永, 栾杨, 等. 一例由肺炎克雷伯氏菌引起的水貂肺炎的诊治[J]. 特种经济动物,2015(5):12-13.
[4] 时代, 潘玲. 一例水貂肺炎克雷伯菌感染的诊治报告[J]. 畜牧与兽医,2015, 47(5): 150-151.
[5] National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animal approved standard[M]. 2nd ed. Wayne, Pa NCCLS, 2003: M31~ A2.
[6] L. Kristopher Siu, Chang-Phone Fung, Feng-Yee Chang,etal. Molecular typing and virulence analysis of serotype K1Klebsiellapneumoniaestrains isolated from liver abscess patients and stool samples from noninfectious subjects in Hong Kong, Singapore, and Taiwan[J]. Journal of Clinical Microbiology, 2011, 49 (11): 3761-3765.
[7] Shankar-sinha Sunita, Valencia Gabriel A, Janes Brian K,etal. TheKlebsiellapneumoniaeO antigen contributes to bacteremia and lethality during murine pneumonia[J]. Infection and Immunity, 2004, 72(3):1423-1430.
[8] 张诗渝. 肺炎克雷伯杆菌的分离鉴定及其对小鼠的致病性研究[D]. 南京:南京农业大学, 2013.
[9] 郝中香, 廖红, 刘丹, 等. 扭角羚肺炎克雷伯氏菌的分离鉴定[J]. 中国畜牧兽医, 2015, 42(1): 203-208.
[10]马磊,颜其贵,万莉,等.竹鼠肺炎克雷伯氏菌的分离鉴定[J]. 中国人兽共患病学报, 2011, 27(9): 825-827.
[11]钟世勋. 毛皮动物肺炎克雷伯氏菌分离菌株的系统发育分析及其微胶囊疫苗的研制[D]. 泰安:山东农业大学, 2013.
[12]王剑, 韩耀东, 杨广. 水貂源肺炎雷伯菌的分离鉴定及致病性测定[J]. 中国动物检疫, 2014, 31(10): 66-69.
[13]李富祥, 李华春, 赵德宏, 等. 肺炎克雷伯氏菌强毒株的分离鉴定及16-23SrRNA ITS序列分析[J]. 中国畜牧兽医, 2015, 42(2): 352-357.
[14]李端. 药理学(第四版)[M]. 北京: 人民卫生出版社, 1999: 291-293.
[15]中华人民共和国兽药典: 2010年版: 兽药使用指南(化学药品卷)[M]. 北京: 中国农业出版社,2011, 3: 32, 64.
[16]王林峰, 王选锭. 肺炎克雷伯氏菌耐药机制研究进展[J]. 中国抗生素杂志, 2004, 29(6): 324-328.
[17]Mazzariol A, Zuliani J, Cornaglia G,etal. Acr AB efflux system: expression and contribution to fluoroquinolone resistance inKlebsiellaspp [J]. Antimicrob Agents Chemother, 2002, 46(12): 3984.
(编辑:陈希)
Pathogenicity and Medicine Treatment ofKlebsiellapneumoniaefrom Mink in Mice
HUANG Di-hai1,2, GUO Hui1,2, WANG Gui-sheng4, SHENG Xiao-dan1,2, HUANG Bing3,QIN Chun-zhi1,2, ZHANG Cong-jing1,2, LIU Xia1,2, QIN Zhuo-ming1,2,3*
( 1.ShandongJianmuBiologicalPharmaceuticalCo.,Ltd,Jinan250100,China; 2.JinanEngineeringTechnologyResearchCenterforAnimalBiologics,Jinan250100,China; 3.InstituteofPoultryScience,ShandongAcademyofAgriculturalScience,Jinan250100,China;4.ShandongProvincialCenterforAnimalDiseaseControlandPrevention,Jinan250022,China)
15 minks and 155SPF Kunming mice were inoculated in order to assess the pathogenicity and medicine treatment ofKlebsiellapneumoniae(K2-5 antigen)from minks as well as to establish a mouse model of pathogenic. Firstly, the median lethal dose (LD50) in mice was evaluated by intraperitoneal inoculation using Karber method, and the LD50was 6.29 CFU/0.3 mL. Then, only one LD50dose ofKlebsiellapneumoniaewas challenged with mice, lomefloxacin hydrochloride(LH) was selected as the medicine to prevent and control by drinking water at 0.5 mg or 2.0 mg dose against the K2-5 antigen type ,respectively. Furthermore, the establishment of the bacteria injected group and the blank group as the healthy control, which were also observed, recorded and compared. The results show that the preventive and therapeutic effect of high dose group is better than that of low dose group, prevention group is better than that of single treatment group, while, the bacterial inoculation group is 100% morbidity and survival rate is only 60%. The results provide a basis for the clinical prevention and control of mink sourceKlebsiellapneumoniabacteria.
mink;Klebsiellapneumoniae; LD50; lomefloxacin hydrochlorid; treatment
黄迪海,从事新兽药研发方面工作。
秦卓明。E-mail: qinzm1997@163.com
2016-06-23
A
1002-1280 (2016) 08-0044-05
S852.6

