液相色谱-串联质谱法检测牛奶中4种阿维菌素类药物残留量的研究
王亦琳,叶妮,尹晖,孙雷,王鹤佳
(中国兽医药品监察所,北京 100081)
液相色谱-串联质谱法检测牛奶中4种阿维菌素类药物残留量的研究
王亦琳,叶妮,尹晖,孙雷*,王鹤佳
(中国兽医药品监察所,北京 100081)
建立了一种可同时检测牛奶中4种阿维菌素类药物(阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素)残留的液相色谱-串联质谱方法(LC-MS/MS)。牛奶样品经乙腈提取,高速离心去除蛋白质等杂质,C18柱净化。以0.1%甲酸水溶液和0.1%甲酸乙腈溶液为流动相进行洗脱,流速0.4 mL/min,采用基质匹配标准溶液外标法定量。结果表明:阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素在0.5~100 ng/mL浓度范围内均呈现良好的线性关系,相关系数(R2)均大于0.996;4种阿维菌素类药物的定量限均为0.5 μg/kg。阿维菌素在0.5~5 μg/kg添加浓度范围内,伊维菌素在0.5~20 μg/kg添加浓度范围内,多拉菌素在0.5~30 μg/kg添加浓度范围内,埃谱利诺菌素在0.5~40 μg/kg添加浓度范围内,回收率为66.4%~120%;批内与批间相对标准偏差均小于20%。该方法具有简便快速、灵敏度高、定性准确,重复性好等特点,可以满足牛奶中4种阿维菌素类药物残留检测的要求。
阿维菌素类药物;残留;牛奶;液相色谱-串联质谱
阿维菌素类药物(avermectins, AVMs)是由链霉菌Streptomycesavermitilis产生的一组大环内酯类抗生素[1],其作用机制独特,具有较高的驱虫活性,因而作为一种抗寄生虫药被广泛应用于牛、羊等动物。目前已商品化的阿维菌素类药物主要包括阿维菌素(Avermectin)、伊维菌素(Ivermectin)、多拉菌素(Doramectin)和埃普利诺菌素(Eprinomectin)等,其中阿维菌素和伊维菌素是目前兽医临床上用量最大的抗寄生虫药物[2-4]。阿维菌素类药物具有较高的脂溶性,在体内主要分布于动物肝脏和脂肪组织中,且在体内残留时间较长。阿维菌素类药物对哺乳动物的毒性很低,但是长期食用含有此类药物的奶产品会对人类健康产生潜在威胁。我国农业部第235号公告《动物性食品中兽药最高残留限量》中规定阿维菌素禁用于泌乳期牛、羊,多拉菌素禁用于泌乳期牛,伊维菌素在牛奶中的最高残留限量(MRL)为10 μg/kg。欧盟等世界其他国家组织也都制定了阿维菌素类药物的最高残留限量,2015年国际食品法典委员会(Codex Alimentarius Committee)发布的兽药最高残留限量标准中,牛奶中伊维菌素的MRL为10 μg/kg、多拉菌素的MRL为15μg/kg、埃谱利诺菌素的MRL为20 μg/kg, 阿维菌素在牛奶中不得检出[5-7]。
阿维菌素类药物分子量大,极难气化,主要采用高效液相色谱法和液相色谱-串联质谱法进行分析。20世纪80年代以来,随着稳定、简便的荧光衍生化条件和串联质谱以及相应的样品提取和净化方法的不断完善,该类药物的残留分析技术也有了较大发展,但该类药物的多残留检测方法多集中于对猪、牛、羊等动物组织样品中的残留分析研究,而有关牛奶中的残留检测较少[8-13]。现有国标中针对牛奶中阿维菌素类药物残留的检测,样品前处理方法比较复杂,且方法的灵敏度也较低[14-15]。本文建立的液相色谱-串联质谱法操作步骤简单,检测灵敏度高,可以满足阿维菌素类药物在牛奶中的多残留检测要求。
1 材料与方法
1.1 仪器 日本岛津公司Shimadzu 30A液相色谱仪-美国AB SCIEX公司QTRAP 6500质谱仪(配电喷雾离子源); AE260电子天平,Mettler Toledo公司;BiofugeStrators高速冷冻离心机,贺利氏公司;Organomation Associates氮吹仪,Jnc公司;SIR4涡旋混合器,IKA公司。1.2 药品和试剂 阿维菌素、伊维菌素、埃普利诺菌素标准品,购自中国兽医药品监察所,含量≥98%;多拉菌素标准品,购自中国兽医药品监察所,含量≥94.3%;甲醇(色谱纯)、乙腈(色谱纯),美国Fisher公司;正己烷(分析纯)、异辛烷(分析纯),国药集团化学试剂有限公司;Bond ElutC18固相萃取柱:500mg/6mL,美国Agilent公司;所用水为超纯水。
1.3 标准溶液配制 精密称定阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素标准品各约10 mg,分别置于10 mL棕色量瓶中,用乙腈溶解并稀释成浓度为1 mg/mL的标准储备液;准确量取标准储备液各100 μL,分别于10 mL量瓶中,用乙腈溶解并稀释成浓度为10 μg/mL的阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素标准工作液;准确量取10 μg/mL的标准工作液各100 μL,分别于10 mL量瓶中,用50%乙腈水溶液溶解并稀释成浓度为100 ng/mL的阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素标准工作液。
1.4 洗涤液配制 取乙腈30 mL、水70 mL和三乙胺20 μL,混匀。
1.5 样品前处理
1.5.1 样品的提取 称取试料(2+0.02)g于50 mL离心管中,加乙腈8 mL,涡旋混匀后中速水平振荡5 min,8000 r/min离心8 min,转移上清液至另一50 mL离心管中,加水10 mL、三乙胺25 μL,混匀,备用。1.5.2 样品的净化 C18固相萃取柱依次用乙腈5 mL和洗涤液5 mL活化,取备用液过柱,依次用洗涤液5 mL、异辛烷5 mL淋洗,抽干,用乙腈5 mL洗脱,收集洗脱液于10 mL试管中,于50 ℃水浴氮气吹干。用50%乙腈水溶液1.0 mL溶解残余物,涡动1 min。过微孔滤膜,供液相色谱-串联质谱仪测定。
1.6 仪器条件
1.6.1 色谱条件 色谱柱为BEH C18(50×2.1 mm,1.7 μm),流动相A相为0.1%甲酸水溶液;B相为0.1%甲酸乙腈溶液,梯度洗脱:0~1 min保持70% B;1~3 min,70% B线性变化到100% B;3~4 min保持100% B;4~6 min保持70% B;流速:0.4 mL/min;柱温30 ℃;进样量5 μL。
1.6.2 质谱条件 电喷雾离子源(ESI+);电喷雾电压为5500 V;离子源温度为550 ℃;辅助气1为50 psi;辅助气2为50 psi;气帘气为30 psi;碰撞气为Medium;检测方式为多反应监测(MRM)。待测药物定性、定量离子对及对应去簇电压、碰撞能量参考值见表1。

表1 待测药物定性、定量离子对及对应去簇电压、碰撞能量参考值
2 结果与分析
2.1 基质添加标准曲线 精密量取适宜浓度的阿维菌素类标准工作液适量,用50%乙腈水溶液稀释成含各药物浓度分别为0.5、1、2、5、10、20、50和100 ng/mL的系列混合标准工作液,从中各取1.0 mL,分别加入到空白牛奶经提取、净化和吹干后的残余物中,充分溶解,过微孔滤膜,作为基质匹配标准溶液上机测定。分别以阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素的特征离子质量色谱峰面积与其对应的基质匹配标准溶液浓度作图,得到相应的标准曲线,线性回归方程及相关系数见表2。阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素在0.5~100 ng/mL浓度范围内,特征离子质量色谱峰面积与浓度均呈良好的线性关系,R2均大于0.996。

表2 阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素的线性范围、回归方程和相关系数
2.2 方法准确度及精密度 采用标准添加法,在空白牛奶中添加适宜浓度的阿维菌素类标准工作液,阿维菌素的添加浓度为0.5、1、2、5 μg/kg;伊维菌素的添加浓度为0.5、5、10、20 μg/kg;多拉菌素在牛奶中的药物浓度为0.5、7.5、15、30 μg/kg;埃谱利诺菌素的添加浓度为0.5、10、20、40 μg/kg。每种浓度5个样品平行试验,重复3批次,按照1.5项样品前处理方法处理之后上机测定,基质匹配标准溶液外标法定量,计算回收率、批内、批间变异系数,结果汇总见表3。试验结果表明,牛奶中阿维菌素在0.5~5 μg/kg添加浓度范围内,回收率范围为84.9%~120%;伊维菌素在0.5~20 μg/kg添加浓度范围内,回收率范围为66.4%~107%;多拉菌素在0.5~30 μg/kg添加浓度范围内,回收率范围为76.1%~107%;埃谱利诺菌素在0.5~40 μg/kg添加浓度范围内,回收率范围为78.4%~103%;批内与批间RSD均小于20%。结果表明本方法定量准确,重复性好。
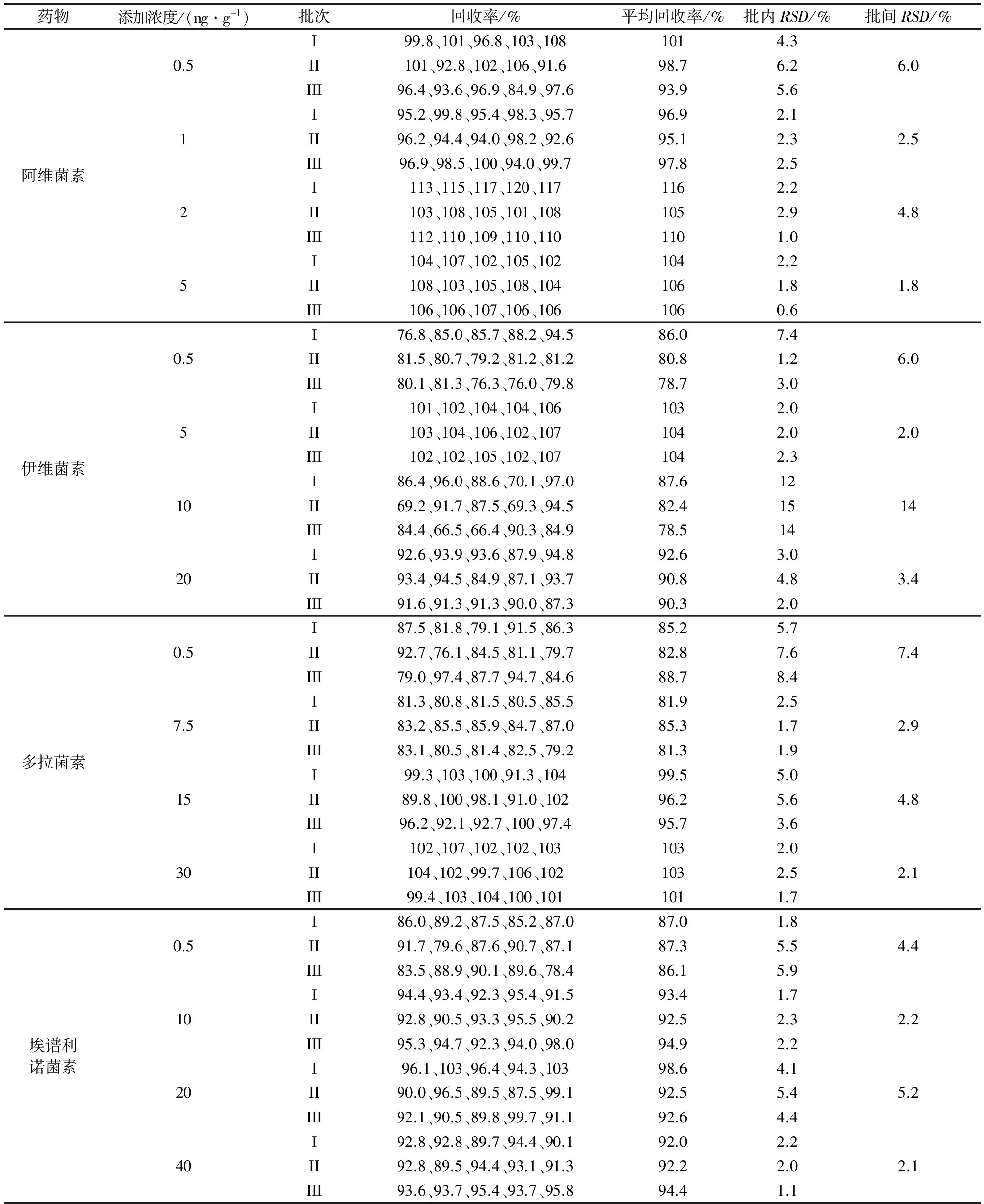
表3 空白牛奶中4种阿维菌素类药物的回收率(n=5)
2.3 方法灵敏度 添加适量浓度的阿维菌素类标准工作液于2 g空白牛奶中,经前处理后测定,观察药物特征离子质量色谱峰信噪比(S/N) 和对应药物浓度, S/N>10(按PtP算)作为方法的定量限,得出阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素的定量限为0.5 μg/kg。由表3可见,添加浓度为0.5 μg/kg时,阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素的回收率均大于76.0%,批内、批间的RSD分别低于8.5%、7.5%。表明该方法在定量限水平的可靠性好,且灵敏度高,完全满足阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素在牛奶中残留检测的需要[16]。0.5 μg/kg空白牛奶基质匹配标准溶液中4种阿维菌素类药物的特征离子质量色谱图见图1。
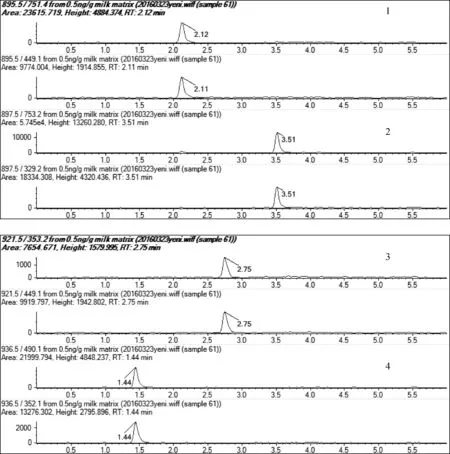
(1:阿维菌素(895.5>751.4,895.5>449.1);2:伊维菌素(897.5>753.2,897.5>329.2);3:多拉菌素(921.5>449.1,921.5>353.2);4:埃普利诺菌素(936.5>490.1,936.5>352.1)图1 0.5 ng/g空白牛奶添加试样溶液中阿维菌素类药物特征离子质量色谱图
3 讨论与小结
3.1 提取条件的选择 已有文献或国家标准方法记载的提取过程,多数用乙腈提取两次后加2~3倍的水或淋洗液作为净化备用液,或者用乙腈-二氯甲烷提取并正己烷去脂后直接过滤检测。前者过柱体积较大,耗时且容易堵塞萃取柱,后者未经萃取柱净化,上机液体杂质干扰较大。本方法根据称样量,选择适宜体积的乙腈提取一次,在上清液中加1倍体积的水,可以有效提取其中的阿维菌素类药物,同时通过高速离心又能很好地去除蛋白质等大量杂质的干扰,并且在不影响回收率的前提下尽可能减少过柱体积,为实际应用过程中进行大批量样品检测节省了时间,提高了检测效率。
3.2 净化条件的选择 已有方法的净化过程,有的用氧化铝柱净化,有的用C18柱,经过比较试验,发现采用C18柱(500 mg/6 mL)进行净化效果最好。由于牛奶样品中可能含有脂肪或其他杂质成分,因此,淋洗时在原标准基础上增加了洗涤液淋洗的步骤,能够较为有效地去除杂质,降低杂质及样品基质对有效成分的干扰,使本方法的各项技术参数均满足兽药残留检测方法的要求。
3.3 定量方法的选择 采用本方法对牛奶试料经前处理后上机测试发现存在一定的基质效应,因此在定量方法选择时采用了基质匹配标准溶液法进行定量,可以很好的消除基质带来的基质效应干扰,提高方法定量的准确性。
3.4 仪器检测条件的建立 通过大量查阅国内外相关文献及已颁布的阿维菌素类药物残留检测方法国家标准,归纳总结其中的仪器检测条件作为参考,结合本实验室实际的仪器设备条件和工作经验,反复优化各项检测参数,使得建立的检测方法能够满足阿维菌素类药物残留检测。如在实验中发现:4种阿维菌素类药物在ESI+模式下, [M+ Na]+峰强度最高,响应值稳定。因此在建立MRM检测方法时,采用各个药物的[M+ Na]+峰作为母离子进行二级质谱扫描,选取信号强度最高的两个特征碎片离子作为子离子,分别优化各项质谱参数,使方法的灵敏度和准确度满足相关的要求。
本文建立了一种同时检测牛奶中阿维菌素、伊维菌素、多拉菌素和埃谱利诺菌素的多残留分析方法。该方法具有良好的可操作性和重现性,方法灵敏度和精密度均能满足兽药残留分析方面的要求。
[1] Mrozik H, Eskola P, Linn B O,etal. Discovery of novel avermectins with unprecedented insecticidal activity[J]. Cellular and Molecular Life Sciences, 1989, 45(3): 315- 316.
[2] Shoop W L, Egerton J R, Eary C H,etal. Eprinomectin: a novel avermectin for use as a topical endectocide for cattle[J]. International Journal for Parasitology, 1996, 26(11):1237-1242 .
[3] Celestina T V, Kolar L, Gobec I,etal. Factors influencing dissipation of avermectins in sheep faeces[J]. Ecotoxicology and Environmental Safety, 2010, 73(1): 18-23.
[4] 扈洪波, 朱蓓蕾, 李俊锁. 阿维菌素类药物的研究进展[J]. 畜牧兽医学报, 2000, 31(6): 520-529.
[5] 中华人民共和国农业部公告第235 号. 动物性食品中兽药最高残留限量[S].
[6] Official Journal of the European Union. EU Pesticides database[EB/OL]. (2010-11-10). http://ec.europa.eu/sanco_pesticides/public/index.cfm.
[7] Maximum residue limits (MRLs) and risk management recommendations(RMRs) for residues of veterinary drugs in foods.[EB/OL]. (2015-02). http://www.fao.org/input/download/standards/45/MRL2_2015e.pdf
[8] 何继红, 申屠芬琴. 阿维菌素类药物残留分析技术研究进展[J]. 动物医学进展, 2009, 30(5): 98-100.
[9] 程林丽, 安洪泽, 沈建忠, 等. 牛奶中4种阿维菌素类药物的高效液相色谱快速测定[J]. 中国农业大学学报, 2010, 15(4): 95-98.
[10]Hernando M D,Suàrez-Barcena J M,Bueno M J M,etal. Fast separation liquid chromatography- tandem mass spectrometry for the confirmation and quantitative analysis of avemectin residues in food [J]. J chromatogr: A,2007,1155:62- 73.
[11]王海, 刘素英, 单吉浩,等.液相色谱法测定猪组织中阿维菌素类药物残留量[J]. 中国兽药杂志, 2005, 39(9):12-15.
[12]宫小明, 董静, 孙军, 等. 动物源性食品中阿维菌素类药物残留的QuEChERS-液质联用法测定[J].分析测试学报, 2010, 29(9): 933-937.
[13]Koichi Inoue, Yukiko Yoshimi, Tomoaki Hino,etal. Simultaneous determination of avermectins in bovine tissues by LC-MS/MS[J]. Journal of Separation Science, 2009, 32(21): 3596-3602.
[14]GB 29696-2013. 牛奶中阿维菌素类药物多残留的测定高效液相色谱法[S].
[15]GB/T 22968-2008. 牛奶和奶粉中伊维菌素、阿维菌素、多拉菌素和乙酰氨基阿维菌素残留量的测定液相色谱-串联质谱法[S].
[16]李俊锁,邱月明,王超. 兽药残留分析[M]. 上海:上海科学技术出版社, 2002: 40.
(编辑:侯向辉)
The Research of Avermectins Residues in Milk by LC-MS/MS
WANG Yi-lin, YE Ni, YIN Hui, SUN Lei*, WANG He-jia
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
A LC-MS/MS method was established for the determination of avermectins residues in milk. Avermectin, ivermectin, doramectin and eprinomectin were extracted with acetonitrile and the protein was deposited by high speed centrifugation, then the sample solution was purified with C18 column. The mobile phase were water (0.1% formic acid) and acetonitrile (0.1% formic acid), the flow rate was 0.4 mL/min. The method was quantified by matrix matching standard curves. A good linearity of the calibration curves was obtained with the range of 0.5~50 ng/mL for avermectin, ivermectin, doramectin and eprinomectin,the correlation coefficientR2>0.996. The limit of quantification of 4 avermectins was 0.5 μg/kg. The average recoveries of avermectins residues from spiked milk were 66.4%~120%, for avermectin at the concentrations of 0.5~5 μg/kg, ivermectin at the concentrations of 0.5~20 μg/kg, doramectin at the concentrations of 0.5~30 μg/kg, and for eprinomectin at the concentrations of 0.5~40 μg/kg. The intra- and inter-batch variation coefficients were both less than 20%. This method can be applied for the determination of avermectins residues in milk.
avermectins; residues; milk;LC-MS/MS
王亦琳,硕士,从事兽药残留研究工作。
孙雷。E-mail:sunlei@ivdc.org.cn
2016-06-30
A
1002-1280 (2016) 08-0033-06
S859.84

