鲤I-IFN-γ作为锦鲤疱疹病毒核酸疫苗免疫佐剂的效果研究
于慧,张瑞雪,王好,周井祥*,刘艳辉
(1.吉林农业大学动物科学技术学院,长春 130118;2.吉林省水产科学研究院,长春130033)
鲤I-IFN-γ作为锦鲤疱疹病毒核酸疫苗免疫佐剂的效果研究
于慧1,张瑞雪1,王好1,周井祥1*,刘艳辉2*
(1.吉林农业大学动物科学技术学院,长春 130118;2.吉林省水产科学研究院,长春130033)
为了研究鲤Ⅰ-IFN-γ的免疫效果,根据鲤Ⅰ-IFN-γ的mRNA基因序列(GenBank),构建真核表达质粒pEGFP-N1-Ⅰ-IFN-γ,重组表达质粒与不同剂量的转染试剂EndoFectionTM Max混合后转染鲤鱼肌肉细胞,通过荧光倒置显微镜观察,重组表达质粒pEGFP-N1-Ⅰ-IFN-γ在细胞中成功表达。以多种免疫剂量的重组表达质粒与pIRES-ORF81混合对鲤鱼进行肌肉注射,每周免疫一次,共免疫三次,免疫前采血,收集血清,通过酶联免疫吸附试验(ELISA)检测抗体水平。结果表明:于第三次免疫后两周,抗体水平达到最高,联合免疫与单独免疫核酸疫苗pIRES-ORF81相比,抗体水平明显升高,但差异不显著(P>0.05)。鲤Ⅰ-IFN-γ作为锦鲤疱疹病毒的免疫佐剂具有一定的免疫效果。
鲤I型γ干扰素;锦鲤疱疹病毒;核酸疫苗pIRES-ORF81;免疫效果
锦鲤疱疹病毒(Koi Herpesvirus,KHV)能够引发鲤鱼发生高致病性的锦鲤疱疹病毒病(Koi Herpesvirus Disease,KHVD),病毒传播迅速,致死率极高。世界动物卫生组织(OIE)已经将KHVD列为必需报告的疾病[1]。目前仍然没有治疗该病的特效药物,只能通过相关免疫手段对其进行预防,接种疫苗被认为是水产病毒性疾病预防和治疗的最适当方法,单一疫苗对鱼的免疫效果并不能达到预期目标。因此,利用佐剂或免疫刺激剂来增加疫苗功效是一种新的途径。
干扰素(Interferon, IFN)是一种重要的细胞因子,可作为生化制剂类免疫佐剂,具有抗病毒功效,能在病毒感染后迅速起效[2]。细胞和机体通常需要病毒、核酸、细菌内毒素等刺激才能产生干扰素。Ⅰ型干扰素γ(Ⅰ-IFN-γ)是发展先天免疫反应的重要组份[3]。它可激活IFN刺激因子(ISGs)转录,编码不同的抗病毒蛋白,释放抗病毒物质,干扰病毒复制、增殖,调节机体细胞分化[4]、生长[5]。
尽管在鱼类的干扰素活性很久以前就被人所知,但直到2003年三种鱼的Ⅰ-IFN-γ才被克隆,分别为斑马鱼[6](Daniorerio),大西洋鲑(Salmosalar)[7]和河豚鱼。目前已经在部分硬骨鱼中克隆到了Ⅰ型IFN基因,其中包括,鲶(Ictaluruspunctatus)[8],虹鳟(Oncorhynchusmykiss)[9],黑鲈(Micropterussalmoides)[10],三棘鱼(Gasterosteusaculeatus)[11],牙鲆(Paralichtsolivaceus)[12],舌齿鲈(Diceutrarchuslabrax)[13],鲤(Capriuscarpio)[14],石斑鱼(Epiuephelusseptemfas-ciatus)[15],大黄鱼(Larimichthyscrocea)[16]等,并发现其中鲤、石斑鱼、舌齿鲈的Ⅰ型IFN-γ基因在鱼体抗病毒过程中起到重要作用。鱼的Ⅰ-IFN-γ有独特的基因组,5个外显子,4个内含子结构,这点是有别于其它物种的关键[17]。
在病毒感染鱼的初期,Ⅰ-IFN-γ是发展先天免疫反应重要组份[3]。通过病毒感染细胞产生和释放Ⅰ-IFN-γ导致IFN刺激因子的(ISGs)激活和转录,编码不同的抗病毒蛋白,通过抗病毒物质干扰病毒复制,抗增殖和免疫调节活动[18]。关于Ⅰ-IFN-γ反应在鱼类异疱疹病毒科中了解比较少[19]。在体外研究中,CyHV-3有能力抑制源于鲤鱼脑细胞(CCB)的成纤维细胞中Ⅰ-IFN-γ反应,在头肾白细胞(HKL)中并无此现象。但如果先用多聚肌苷酸胞苷酸(poly I: C)刺激CCB细胞,激活Ⅰ-IFN-γ反应,通过细胞单层培养,发现这样能够减缓CyHV-3传播速度。体外研究发现,CyHV-3感染时,皮肤和肠中IFN编码的基因表达上调[20-21]。
本研究选择构建pEGFP-N1-Ⅰ-IFN-γ真核表达质粒,研究pEGFP-N1-Ⅰ-IFN-γ与PIRES-ORF81核酸疫苗组成的联合制剂的免疫原性,为KHVD疫苗的研制提供新的思路。
1 材料
1.1 动物 150条健康鲤鱼,体重为150~200 g,购自新立湖的渔场,在25℃水族箱饲养2周后再进行试验。
1.2 质粒和病毒 重组质粒PIRES-ORF81由本试验室保存[22],KHV阳性血清由本试验室保存[23]。
1.2 主要试剂 焦磷酸二乙酯(DEPC),北京鼎国公司;反转录试剂,TaKaRa;DL5000 Marker,DL2000 Marker,pMD18-T Vector,限制性内切酶,T4DNA连接酶,TaKaRa公司;DNA凝胶回收试剂盒,AxyGen公司;质粒转染试剂EndoFectinTM-Max,长春维尔特科技有限公司;羊抗鼠IgG-HRP,上海信然生物技术有限公司;抗鲤鱼IgM单克隆抗体,AQUATIC Diagnostic Ltd。
2 方法
2.1 鲤Ⅰ-IFN-γ基因的引物设计与合成 根据GenBank上登录的鲤Ⅰ-IFN-γ基因序列,用Primer Premiers 5.0软件设计引物,上游引物P3序列:5’-GAGCTCAATTTGAGAAAAAAATCGTAACAAA-3’ ;下游引物P4序列:5’-AAGCTTAATTTGAGAAAAAAATCGTAACAAA-3’ ;划线部分依次为限制性酶切位点SacⅠ和HindⅢ,送去生工(上海)公司合成引物。
2.2 Ⅰ-IFN-γ基因的扩增 试验所用器材需提前用DEPC水处理,取新鲜鲤鱼头肾样品及脾脏样品充研磨成粉末状待用,用TRIzol法提取RNA并进行反转录。产物用于PCR扩增,基因扩增体系为25 uL,用梯度PCR仪摸索最适退火温度,确定PCR反应条件为:95 ℃ 预变性5 min,94 ℃ 变性 30 s,61.5 ℃退火30 s,72 ℃ 延伸 1 min,35 个循环,72 ℃ 10 min,反应结束 4 ℃ 保存。
2.3 Ⅰ-IFN-γ基因的克隆及鉴定 将回收的Ⅰ-IFN-γ目的基因连接至pMD-18T克隆载体,将连接产物转入大肠杆菌DH5α菌种,向含Amp的固体LB平板中涂100 μL上述菌液,恒温(37 ℃)过夜培养,挑取的白色单个菌落接种于液体培养基中,碱裂解法提取质粒,用SacⅠ和HindⅢ进行双酶切鉴定,阳性质粒送到生工(上海)进行基因测序,命名为pMD18-T-Ⅰ-IFN-γ。2.4 构建重组质粒pEGFP-N1-Ⅰ-IFN-γ 将目的基因Ⅰ-IFN-γ与pEGFP-N1载体16 ℃过夜连接。转入DH5α感受态细胞内,向含Kana液体LB培养基内加入挑取的单菌落,160 r/min震荡培养(37 ℃,12~14 h),碱裂解法提取质粒经PCR鉴定、双酶切鉴定,选取阳性质粒命名为pEGFP-N1-Ⅰ-IFN-γ并送至生工(上海)进行测序。
2.5 重组质粒的体外表达
2.5.1 重组质粒pEGFP-N1-Ⅰ-IFN-γ的大量提取与纯化 将pEGFP-N1-Ⅰ-IFN-γ质粒的菌液进行划线培养,挑单一白色菌落至液体培养基中振荡培养至对数生长期,之后进行菌液的扩摇,收集菌体进行质粒大量提取,采用质粒大提试剂盒,方法参照AxyGen质粒大量说明书。使用分光光度计测定重组表达质粒在260 nm波长时的吸光值,根据重组表达质粒的浓度计算公式:质粒浓度(μg/μL)=OD260×稀释倍数×50 μg/mL。2.5.2 重组质粒pEGFP-N1-Ⅰ-IFN-γ的转染 将重组表达质粒、EndoFectionTM Max试剂和L-15培养基静置使之升至室温。用L-15培养基分别稀释重组表达质粒pEGFP-N1-Ⅰ-IFN-γ和转染试剂EndoFectionTM Max,稀释后室温静置5min。将稀释后的重组质粒pEGFP-N1-Ⅰ-IFN-γ于不同浓度的转染试剂EndoFectionTM Max充分混匀,室温静置5~20 min形成DNA-EndoFectionTM复合物。向每个细胞培养孔中逐滴加入DNA-EndoFectionTM复合物,边滴加边轻柔前后晃动培养板。操作时,应避免把转染试剂直接滴在细胞生长的位置.在26 ℃培养箱中孵育细胞,转染24 h后在荧光倒置显微镜下观察转染情况并采集图片。分别提取细胞(转染后)总RNA,方法与提组织RNA相似,再进行RT-PCR及PCR。
2.6 重组质粒与核酸疫苗联合免疫体内试验 免疫试验前,随机挑选11尾试验鱼进行KHVD的检测,PCR检测呈阴性后,将鱼分6组,每组10尾(表1)。注射剂量均稀释为200 μL/尾,三次免疫间隔14 d。

表1 鲤鱼免疫分组及免疫剂量
2.7 重组表达质粒诱导鲤的免疫效果检测 尾静脉采血于免疫前,在一免及二免后第一周,三免后一到三周。标记的灭菌EP管中贮存采取的血液,静置(37 ℃,2 h),4 ℃过夜,隔天离心6000 r/min(4 ℃,15 min),收集血清后贮存于-20 ℃,用于ELISA检测。在96孔酶标板中,用包被液将纯化后的病毒液稀释,每孔100 μL,4 ℃放置一夜洗涤后加入封闭液(新鲜配制的脱脂牛奶),置于22 ℃,孵育2 h后,再次洗涤,然后加入待测血清22 ℃孵育3 h;洗涤5次后加入单克隆抗体22 ℃孵育1 h;洗涤5次后加入酶标二抗22 ℃孵育1 h;再次洗涤5次,加入100 μL底物溶液,22 ℃孵育10 min;再加入50 μL终止液;最后将酶标板放入酶标仪中,测定在OD 450 nm时的ELISA数据,记录结果。
3 结果
3.1 Ⅰ-IFN-γ的PCR扩增 分别以提取的鲤鱼头肾RNA及脾脏RNA为模板,反转录为cDNA后,再分别以Ⅰ-IFN-γ的P1,P2序列为引物,通过PCR扩增得到552 bp的预期大小的目的片段,如图1所示。
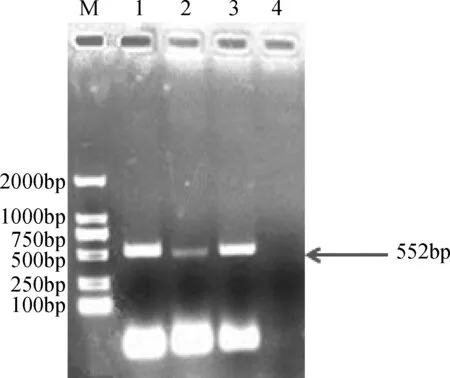
M: DNA分子量标准;1-3:PCR产物(Ⅰ-IFN-γ);4:阴性对照图1 Ⅰ-IFN-γPCR扩增产物
3.2 Ⅰ-IFN-γ基因克隆质粒的鉴定 用限制性内切酶SacⅠ和HindⅢ对pMD18-T-Ⅰ-IFN-γ阳性质粒进行双酶切鉴定。结果显示在552bp位置有条带,同时有一条2000bp以上条带。与预期相符,说明pMD18-T-Ⅰ-IFN-γ质粒构建成功,如图2所示。

M:DNA分子质量标准;1:双酶切产物(pMD18-T-Ⅰ-IFN-γ)图2 双酶切鉴定pMD18-T-Ⅰ-IFN-γ
3.3 重组质粒pEGFP-N1-Ⅰ-IFN-γ鉴定 分别用限制性内切酶SacⅠ和HindⅢ对阳性重组质粒pEGFP-N1-Ⅰ-IFN-γ进行双酶切鉴定。结果显示的目的片段大小与预期结果相符,在552 bp位置有条带,同时各有一条片段大小为4645 bp的载体条带。进一步说明已经成功将Ⅰ-IFN-γ基因克隆到pEGFP-N1真核表达载体上,如图3所示。
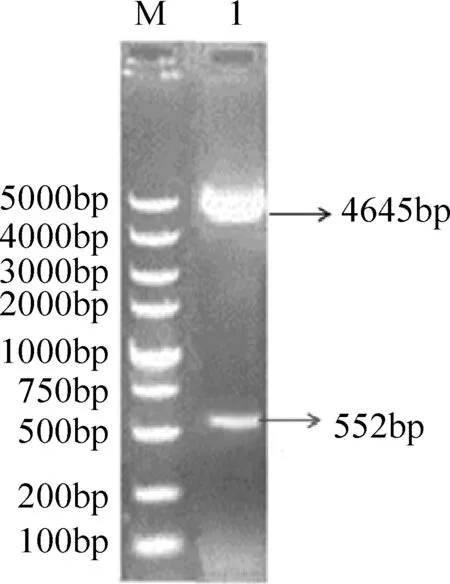
M:DNA分子质量标准;1: pEGFP- N1-Ⅰ-IFN-γ酶切结果图3 酶切鉴定重组质粒pEGFP-IFN-N1-Ⅰ
3.4 重组表达质粒浓度 根据2.9.2中的计算方法计算pEGFP-N1-IL-10,pEGFP-N1-Ⅰ-IFN-γ和PIRES-ORF81的浓度分别为0.85、0.9、0.8μg/μL。
3.5 重组表达质粒的转染 根据2.1中所述步骤,将重组质粒pEGFP-N1-IL-10和pEGFP-N1-Ⅰ-IFN-γ转染至锦鲤鳍条细胞中,在倒置荧光显微镜下可观察到有质粒成功转入细胞,如图4所示。
3.6 RT-PCR检测真核表达质粒的转染情况 转染成功后的细胞用Trizol裂解,提取细胞总RNA,RT-PCR,以cDNA作为模板,用P1,P2作为引物进行PCR检测。电泳位置在552 bp处观察到目的条带,说明pEGFP-N1-Ⅰ-IFN-γ已转染成功,如图5所示。
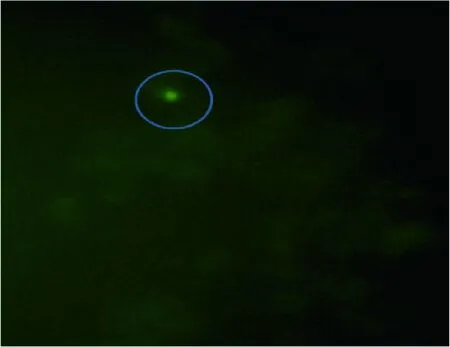
1:重组质粒的pEGFP-Ⅰ-IFN-γ转染结果图4 重组质粒pEGFP-N1-Ⅰ-IFN-γ的转染结果

M:DNA 分子质量标准;1:阴性对照;2:Ⅰ-IFN-γPCR产物图5 Ⅰ-IFN-γ基因的PCR扩增结果
3.7 鲤鱼组织的PCR检测 在试验鲤鱼中随机挑选任意11尾,模板:组织基因组,阳性对照:KHV,图6为试验结果,11尾鱼的检测结果呈阴性,可以进行下一步试验。
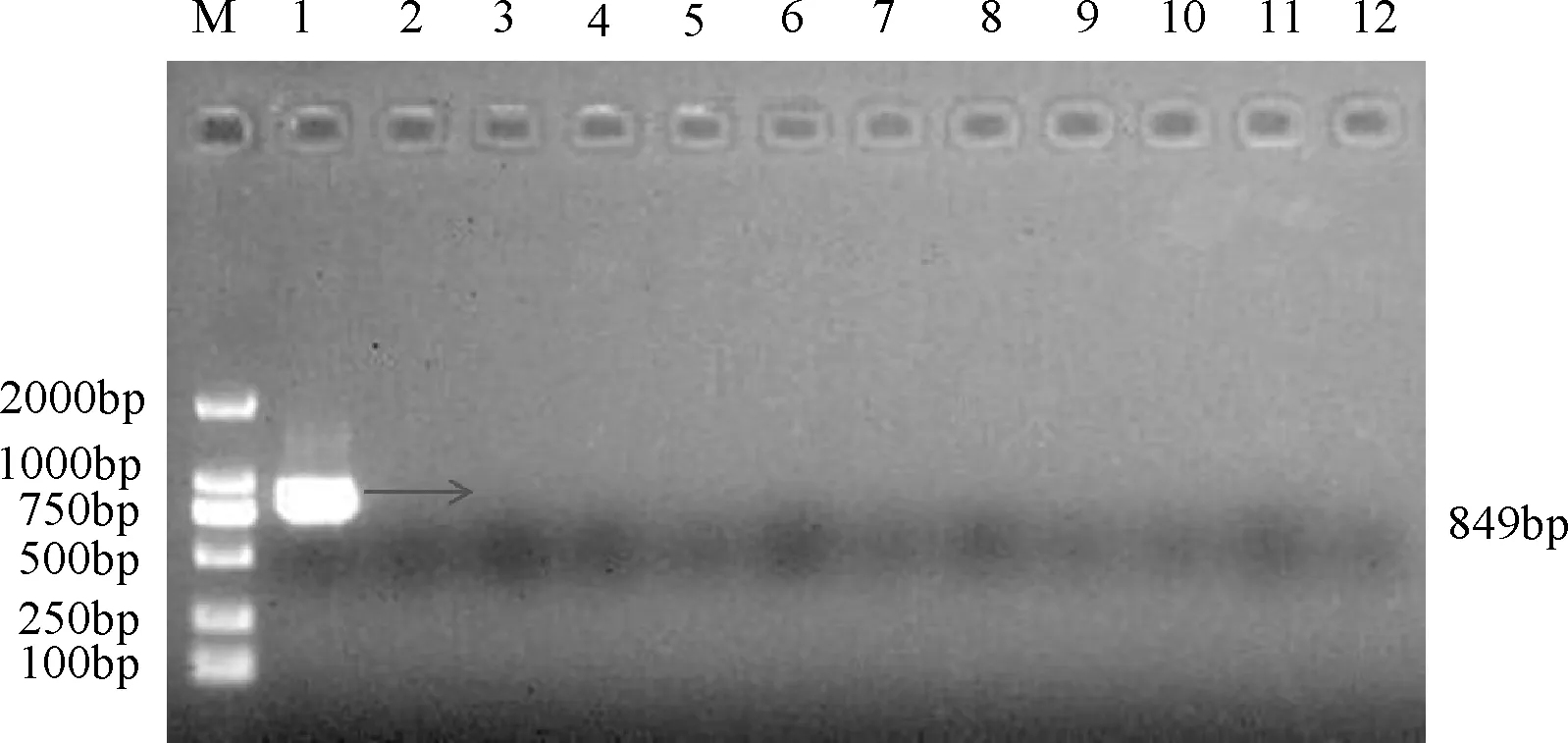
1:阳性对照;2-12:鲤鱼组织DNA的PCR结果;M:DNA分子质量标准图6 鲤鱼组织PCR检测结果
3.8 鲤鱼血清中抗体水平ELISA检测结果 注射前要进行一次采血,再向不同试验组鲤鱼注射分别注射对应的免疫剂,一免及二免后一周,三免后第一至三周,尾静脉采血。通过间接ELISA法检测注射免疫剂后鲤鱼血清中的抗体水平。通过平均数和标准差的计算,最终得出表中数据。表2为结果。

表2 鲤鱼血清抗体水平检测(OD450)
依表所见,除了PBS组和空白组,其它各组鲤鱼血清中均能检测出KHV特异性抗体,免疫次数增多抗体水平随之增加。三免后两周,抗体水平达到峰值,之后趋于下降。增加质粒浓度抗体水平稍有增加,但不明显。PBS组和空白组这两组与注射重组质粒组的抗体水平差异明显(P<0.05)。
根据间接ELISA检测试验结果绘制折线图(图7),可知混合制剂pEGFP-N1-Ⅰ-IFN-γ+pIRES-ORF81相比单一核酸疫苗pIRES-ORF81抗体水平有所升高,但差异不显著(P>0.05)。
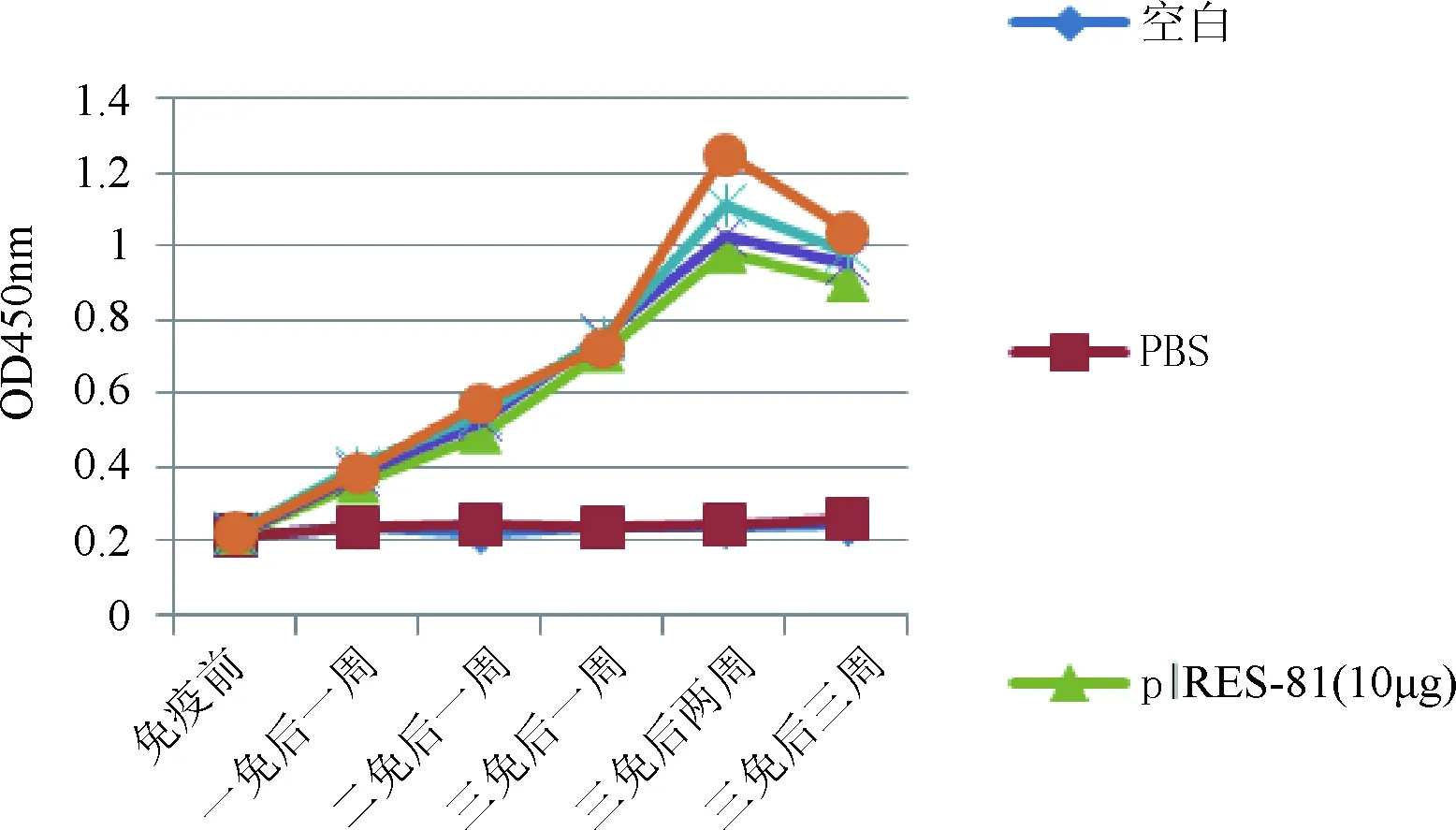
图7 各组的血清抗体水平折线图
根据间接ELISA检测试验结果,绘制各组的抗体水平的曲线,得出的免疫剂量为5 μg时,就可达到较好的抗体水平,随着免疫剂量的增加,抗体水平有所升高。
4 讨论与小结
硬骨鱼的干扰素具种属特异性,某种鱼的干扰素对其它鱼类抗病毒无作用。目前,已经鉴定了干扰素Ⅰ型对许多病毒的反应[24]。其中重组斑马鱼、鲶鱼[25]、草鱼、虹鳟[26]的干扰素都具有抗病毒的活性。在抑制病毒复制方面,干扰素Ⅰ型扮演了重要角色,可诱导蛋白表达,抑制病毒mRNA翻译,增加宿主细胞的抵抗力,并能够在感染早期限制病毒传播和扩散。在机体抗病毒的非特异性免疫应答中起重要作用。
以Ⅰ-IFN-γ的上述特性为依据,为了探索其是否适合作为免疫佐剂,与锦鲤疱疹病毒病的疫苗联合使用,我们进行了体外细胞转染实验,以探究目的蛋白是否能在体外锦鲤鳍条细胞中表达,通过倒置显微镜观察和RT-PCR检测,重组质粒pEGFP-N1-Ⅰ-IFN-γ成功转入了锦鲤鳍条细胞中,说明重组质粒pEGFP-N1-Ⅰ-IFN-γ能在细胞中正确表达,为接下来的体内试验提供参考依据。
体内试验选用生长发育较快的幼鱼,意在降低核酸疫苗的剂量,另外希望能让外源基因在宿主体内大量表达。免疫的最佳用量可根据鱼的大小不同进行调整。本试验采取肌肉注射的免疫方法,将联合免疫制剂pEGFP-N1-Ⅰ-IFN-γ+pIRES-ORF81注射入试验鱼体内,相比单一核酸疫苗pIRES-ORF81,联合免疫制剂所产生的抗体水平更高,免疫效果更好。
[1] Eide K E, Miller-Morgan T, Heidel J R,etal. Investigation of koi herpesvirus latency in koi[J]. J. Virol. 2011,85:4954-4962.
[2] 王世若, 王兴龙, 韩文瑜. 现代动物免疫学(第二版)[M].吉林:吉林科学技术出版社, 2001: 430 - 438.
[3] Zhang Peng,Lu Ling,Yao Qing,etal. Molecular, functional, and gene expression analysis of zebrafish hypoxia-inducible factor-3α.[J]. AJP: Regulatory, Integrative and Comparative Physiology (Online),2012,30311.
[4] Sen G C. Viruses and interferons[J]. Annu Rev Microbiol,2001, 55: 255-281.
[5] Ying Nie,Yan-Yi Wang. Innate immune responses to DNA viruses[J]. Protein & Cell,2013,41.
[6] Leu J H, Yan S J, Lee T F,etal. Complete genomic organization and promoter analysis of the round-spotted pufferfish JAK 1, JAK 2, JAK 3, and TYK 2 genes[J]. DNA and cell biology, 2000, 19(7): 431-446.
[7] McCurley Amy T,Callard Gloria V. Time Course Analysis of Gene Expression Patterns in Zebrafish Eye During Optic Nerve Regeneration.[J]. Journal of Experimental Neuroscience,2010,20:104.
[8] Kumari Jaya,Bgwald Jarl,Dalmo Roy A. Eomesodermin of atlantic salmon: an important regulator of cytolytic gene and interferon gamma expression in spleen lymphocytes.[J]. PLAS One,2013,82.
[9] Expression analysis of cDNAs encoding channel catfish type I interferons[J]. Fish & shellfish immunology, 2006, 21(1): 42-59.
[10]Casani D, Randelli E, Costantini S,etal. Molecular characterisation and structural analysis of an interferon homologue in sea bass (Dicentrarchus labrax L.)[J]. Molecular immunology, 2009, 46(5): 943-952.
[11]Chang M, Nie P, Collet B,etal. Identification of an additional two-cysteine containing type I interferon in rainbow trout Oncorhynchus mykiss provides evidence of a major gene duplication event within this gene family in teleosts[J]. Immunogenetics, 2009, 61(4): 315-325.
[12]Shijuan Shan,Chenchen Qi,Yaoyao Zhu,etal. Expression profile of carp IFN correlate with the up-regulation of interferon regulatory factor-1 (IRF-1) in vivo and in vitro: the pivotal molecules in antiviral defense[J]. Fish and Shellfish Immunology,2016,03:019.
[13]Ohtani M, Hikima J, Hwang S D,etal. Transcriptional regulation of type I interferon gene expression by interferon regulatory factor-3 in Japanese flounder, Paralichthysolivaceus[J]. Dev Comp Immunol, 2012,36: 697-706.
[14]Xu Qiao , Chang Ming , Sun Rong,etal. The first non-mammalian CXCR5 in a teleost fish: molecular cloning and expression analysis in grass carp ( Ctenopharyngodon idella )[J]. BMC Immunology, 2010, 11(1).
[15]Wei Xinxian,Li Xiao-zheng,Xiaocong Zheng,etal. Toll-like receptors and interferon associated immune factors responses to spring viraemia of carp virus infections in common carp (Cyprinus carpio )[J]. Fish and Shellfish Immunology,2016,05:043.
[16]Ohta T, Ueda Y, Ito K,etal.Anti-viral effects of interferon administration on sevenband grouper, Epinephelus septemfasciatus[J]. Fish Shellfish Immunol, 2011, 30: 1064-1071.
[17]Sun B, Robertsen B, Wang Z,etal. Identification of an Atlantic salmon IFN multigene cluster encoding three IFN subtypes with very different expression properties [J]. Developmental & Comparative Immunology, 2009, 33(4): 547-558.
[18]Ooi E L, Verjan N, Haraguchi I,etal. Innate immunomodulation with recombinant interferon-α enhances resistance of rainbow trout (Oncorhynchus mykiss) to infectious hematopoietic necrosis virus[J]. Developmental & Comparative Immunology, 2008, 32(10): 1211-1220.
[19]Zou Jun,Bird Steve,Secombes Chris. Antiviral sensing in teleost fish.[J]. Current Pharmaceutical Design,2010,1638.
[20]Zou J, Secombes C J. Teleost fish interferons and their role in immunity[J]. Developmental & Comparative Immunology, 2011, 35(12):1376-1387.
[21]Adamek M, Steinhagen D, Irnazarow I,etal. Biology and host response to Cyprinid herpesvirus 3 infection in common carp[J]. Developmental & Comparative Immunology, 2014, 43(2): 151-159.
[22]Adamek M, Rakus K, Chyb J,etal. Interferon type I responses to virus infections in carp cells: In vitro studies on Cyprinid
herpesvirus 3 and Rhabdovirus carpio infections[J]. Fish & Shellfish Immunology, 2012, 33(3): 482-493.
[23]李新伟.锦鲤疱疹病毒ORF25、ORF81基因核酸疫苗的构建及免疫原性的研究[D].吉林:吉林农业大学, 2012.
[24]朱霞, 李新伟, 王好,等. 一株锦鲤疱疹病毒的分离与鉴定[J]. 中国预防兽医学报, 2011, 33(5):340-343.
[25]Chan T, Barra N G, Lee A J,etal. Innate and adaptive immunity against herpes simplex virus type 2 in the genital mucosa[J]. Journal of reproductive immunology, 2011, 88(2): 210-218.
[26]Willem B. Van Muiswinkel, Miki Nakao. A short history of research on immunity to infectious diseases in fish[J]. Developmental and Comparative Immunology, 2014, 43: 130-150.
[27]Chan T, Barra N G, Lee A J,etal. Innate and adaptive immunity against herpes simplex virus type 2 in the genital mucosa[J]. Journal of reproductive immunology, 2011, 88(2): 210-218.
(编辑:陈希)
Immune Effect of Carp I-IFN-γ as Koi Herpesvirus Nucleic Acid Vaccine Adjuvants
YU Hui1, ZHANG Rui-xue1, WANG Hao1, ZHOU Jing-xiang1*, LIU Yan-hui2*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China; 2.JilinProvinceFisheryScienceInstitute,Changchun130118,China)
Study on the carp Ⅰ-IFN-γ immune effect, on the basis ofⅠ-IFN mRNA gene sequence Genbank login, The eukaryotic recombinant plasmid pEGFP-N1-Ⅰ-IFN were constructed.Mixing recombinant expression plasmid and transfection reagents in several immune dose transfected carp muscle cells. The expression of recombinant expression plasmid pEGFP-N1-Ⅰ-IFN-γ in carp muscle cells were observed by fluorescent inverted microscope.By using the mixture of recombinant expression plasmidin several immune dose and pIRES - ORF81 injected Carp′s intramuscular and immunized once a week, three times in total. Blood was sampling before injection and serum was collected to detect antibody levels by enzyme-linked immunosorbent assay(ELISA). Two weeks after the third immunization,experiment result showed that antibody titer reach the highest level. Compared with pIRES - ORF81alone immune,antibody level of combined immunization increased obviously, but no significant difference was observed between them(P>0.05). Show that carp Ⅰ - IFN -γ have certain immune effectas koi herpesvirus immune adjuvant.
Ⅰ-IFN-γ; koi herpesvirus; nucleic acid vaccine pIRES- ORF81; immune effect
公益性行业专项-锦鲤疱疹病毒病核酸疫苗的研制及初步应用(106037-2016-2018);国家现代农业产业体系项目(CARS-46-29)
于慧,硕士研究生,从事病毒分子学方面研究。
周井祥,E-mail:zhjxnd@126.com;刘艳辉,E-mail:liuyanhui9@163.com
2016-07-04
A
1002-1280 (2016) 08-0009-07
S852.6

