替吉奥单药与替吉奥联合奥沙利铂在胃癌术后辅助化疗中的临床疗效观察
黄露迷 冀晓辉 王春梅 王东林 李代蓉*
(重庆市肿瘤研究所肿瘤内科,重庆 400030)
替吉奥单药与替吉奥联合奥沙利铂在胃癌术后辅助化疗中的临床疗效观察
黄露迷 冀晓辉 王春梅 王东林 李代蓉*
(重庆市肿瘤研究所肿瘤内科,重庆 400030)
目的比较替吉奥单药与替吉奥联合奥沙利铂方案在胃癌术后(ⅢA~ⅢC期)辅助化疗中的疗效和安全性。方法 回顾性分析2009年10月至2014年3月该院收治的90例胃癌患者的临床资料,分为单药组(替吉奥单药)及联合组(替吉奥联合奥沙利铂)。结果 单药组与联合组的中位肿瘤进展时间分别为8.62个月和8.23个月,1年无复发生存率分别为27.3%和28.6%,两组比较差异无统计学意义(P>0.05)。两组的不良反应主要为骨髓抑制、胃肠道反应、口腔黏膜炎、末梢神经毒性及肝肾功能损害。联合组骨髓抑制、胃肠道反应明显高于单药组,差异有统计学意义(P<0.05)。结论 替吉奥单药与替吉奥联合奥沙利铂在胃癌术后Ⅲ期治疗中疗效相当,但单药组患者耐受更好。
胃癌;化疗;辅助;替吉奥
胃癌是最常见的消化道恶性肿瘤之一。目前,手术及放化疗是针对胃癌的主要治疗方法,而手术是胃癌治疗的根本方式。术后病理分期为Ⅲ期的患者局部复发率和转移率高,因此术后辅助化疗在预防复发和转移中起着重要的作用。本研究回顾性地分析替吉奥单药以及替吉奥联合奥沙利铂方案在治疗胃癌术后ⅢA-ⅢC期患者中的疗效及安全性,报道如下。
1 资料与方法
1.1 临床资料:选取本院2009年10月1日至2014年3月30日行全胃或胃大部R0切除术,术后根据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)分期方案进行分期[1],ⅢA~ⅢC期患者90例,其中男 60例,女 30例。分为单药组(替吉奥单药)及联合组(替吉奥联合奥沙利铂)。单药组42例,年龄40~81岁,平均63.7岁,其中年龄>60岁的27例。联合组48例,年龄39~80岁,平均60.3岁,其中年龄>60岁的20例。所有患者KPS(Karnofsky Performance Status)评分均>60分,化疗前检查白细胞>4.0×109/L,血小板>100×109/L,肝肾功能、心电图基本正常,两组患者一般资料比较差异无统计学意义(P>0.05)。患者签署化疗同意书后,接受替吉奥单药或替吉奥联合奥沙利铂方案治疗。
1.2 治疗方法。替吉奥单药方案:替吉奥胶囊(生产厂家齐鲁制药有限公司)40~60毫克/次,口服,1天2次,连用28 d,停14 d。替吉奥联合奥沙利铂方案:替吉奥胶囊(生产厂家齐鲁制药有限公司)40~60毫克/次,口服,1天2次,连用14 d,停7 d。奥沙利铂(生产厂家江苏恒瑞医药股份有限公司,批号H20000337)130 mg/m2。加入5%葡萄糖注射液500 mL,静脉滴注180 min,每3周1次。所有患者均接受4~6个周期的化疗。化疗过程中同时给予抑酸、保肝、止吐等对症治疗,如出现不良反应,则及时对症处理。每化疗2个周期行影像学检查评价疗效。
1.3 评价标准:观察患者的肿瘤进展时间(TTF),TTF指化疗结束第1天至首次出现复发或转移或失访患者的末次联系日期的时间,并根据TTF计算1年无复发生存率,化疗不良反应评价参照美国国家癌症研究所抗肿瘤药物毒性反应评价标准。随访方法:患者化疗结束后第1年每3个月,第2年每4个月复查CT或MRI。不良反应按美国癌症研究所常见毒性判定标准(NCI-CTC)3.0版进行评定,分为0~Ⅳ度。
1.4 统计学处理:采用SPSS 13.0统计软件进行数据处理,率和构成比的比较采用χ2检验,生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结 果
单药组与联合组的中位TTF分别为8.62个月和8.23个月,1年RFS分别为27.3%和28.6%,两组患者的TTF和1年RFS比较差异无统计学意义(P>0.05),两组的不良反应主要为骨髓抑制、胃肠道反应、口腔黏膜炎、末梢神经毒性及肝肾功能损害。联合组骨髓抑制、胃肠道反应明显高于单药组,差异有统计学意义(P<0.05)。单药组中1例因骨髓抑制中止化疗,联合组中3例因胃肠道反应(1例)、骨髓抑制反应(2例)中止化疗,均为年龄>60岁老龄患者。见表1。
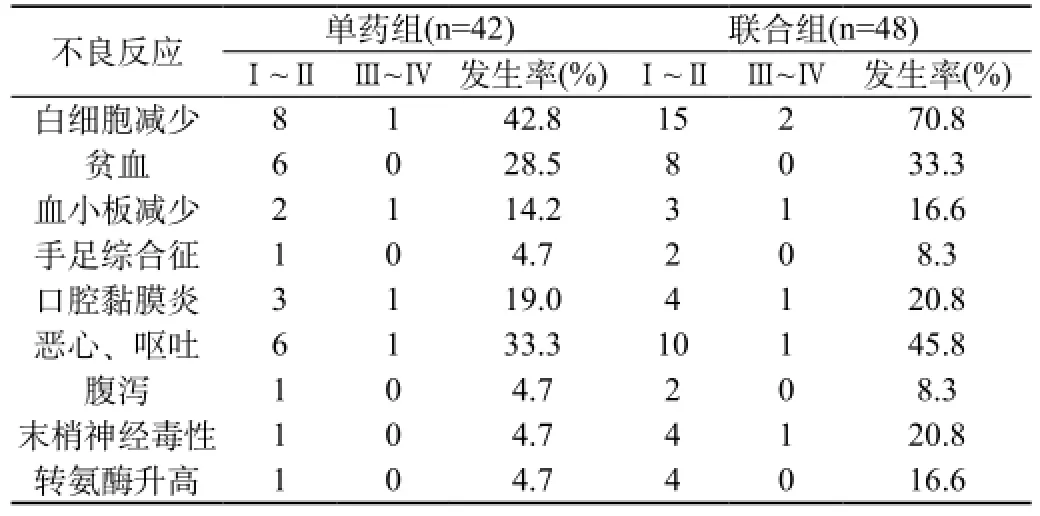
表1 两组患者不良反应比较
3 讨 论
胃癌是常见的消化道肿瘤,尽管近年来胃癌的发病率呈下降趋势,但其仍然是世界第四大恶性肿瘤[2],严重危害人类的健康。手术切除仍然是治疗胃癌的主要手段,但由于患者发病初期临床症状隐匿、无典型阳性体征及缺乏早期筛查,大多数胃癌患者初诊时已是局部晚期或存在远处转移,无法行根治行手术[3],即使能手术完整切除,但治愈率低,导致患者病死率高、预后差。对于术后分期为ⅢA~C期的患者,即存在肿瘤局部深部浸润及区域淋巴结转移,术后出现转移和复发的概率高。如何提高此类术后患者生存期、提高生活质量是临床亟待解决的问题。术后辅助化疗是提高患者疗效的措施,术后辅助化疗的目的旨在消除亚临床转移灶、降低复发及转移率、延长生存期[4]。但胃癌术后是否有必要行辅助化疗仍存在争议,且目前尚无标准的辅助化疗方案。术后辅助化疗的疗效不确切,关于胃癌的有效治疗仍然是富于挑战性的课题。
早在20世纪60年代人类已经开始对胃癌的化疗方案进行了探索。目前对胃癌使用有效的药物包括氟尿嘧啶、顺铂、奥沙利铂等,胃癌辅助化疗的主要方法仍然是联合化疗,5-氟尿嘧啶(5-FU)和顺铂(DDP)是胃癌常用化疗方案[6]。与最佳支持治疗相比,联合化疗可以缓解患者症状、延长生存期、起到姑息治疗作用。一项Meta分析报道[5],胃癌术后辅助治疗中使用含氟尿嘧啶方案有益于生存。但5-FU受半衰期影响需长时间输注,而DDP胃肠道反应重,且老年患者,由于自身心肺等重要脏器功能存在不同程度的减退,术后化疗耐受性差,严重时不能完成化疗[7],影响术后辅助化疗疗效。因而寻找一种患者耐受性好,且有效的方案是临床长期探索的问题。
替吉奥是一种新型的口服氟尿嘧啶类药物,由替加氟(FT)、吉美嘧啶(CDHP)及奥替拉西钾(OXO)组成[8]。其中FT在体内逐渐转化成5-氟尿嘧啶(5-FU),CDHP能抑制肝脏的5-FU分解代谢酶,阻止5-FU被降解,提高体内5-FU浓度,而OXO口服后分布于胃肠道,能够特异性抑制肠道黏膜细胞内乳清酸核糖转移酶,阻断5-FU 的磷酸化,使5-FU 的磷酸化产物降低而减少其胃肠道不良反应。于传统的氟尿嘧啶相比,具有方便、耐受性好的特点,既可增强抗肿瘤作用,延长作用时间,又可减轻胃肠道不良反应[9-10]。日本ACTS-GC研究[11]对比术后单药替吉奥化疗和随访观察者,3年总生存率和无复发生存率均有统计学差异。另一项SPIRITS试验[12],比较了替吉奥单药和替吉奥联合顺铂治疗患者的总生存期(OS)及无进展生存期(PFS),结果证实联合化疗可降低复发风险及死亡风险。奥沙利铂是第3代铂类抗肿瘤药物,与顺铂和卡铂相比,作用强,且骨髓抑制等不良反应发生率较低。国内外多项研究表明[13-16],在亚洲人群中,含替吉奥方案在OS、TTF、不良反应上都优于含5-FU方案,且单药在晚期胃癌的有效率为31%~49%,替吉奥联合奥沙利铂也是安全有效的。
本研究以替吉奥替代5-FU,奥沙利铂替代顺铂,比较了替吉奥单药与替吉奥联合奥沙利铂在辅助治疗胃癌术后Ⅲ期患者中的疗效及不良反应,结果显示两组中患者的中位肿瘤进展时间及1年无复发生存率均无明显差异,但是联合组中骨髓抑制、胃肠道反应发生率明显高于单药组,且单药组因不良反应暂停化疗发生率低于联合用药组。本研究中选取的90例患者中,其中老年患者47例,单药组27例,联合组20例,老龄患者对化疗耐受性更差,因不良反应暂停化疗的均为>60岁老龄患者,但相比之下,老年联合组不良反应更高,与单药足相比差异有统计学意义,这说明两药在胃癌术后辅助化疗中的效果相当,替吉奥单药化疗安全、有效,且不良反应率低,患者更容易耐受。对于老年及KPS评分较低患者替吉奥单药化疗可作为术后辅助化疗的较理想选择。与国内外其他研究报道相比,本研究有效率略低,考虑与患者年龄大、耐受性较差、样本量不足有关,且本研究观察时间较短,需进一步扩大样本量及观察时间,对各年龄段患者及总生存期进行观察,为改善胃癌术后局部晚期患者辅助化疗疗效提供更有力的依据。
[1] NCCN胃癌临床实践指南专家组.胃癌临床实践指南(中国版)[S].2014.
[2] Jemal A,Siegel R,Ward E,et al.Cancerstatistics,2009[J].CA Cancer J Clin,2009,59(4):225–249.
[3] 王婕敏,林三仁.胃癌研究及诊治新进展[J].胃肠病学和肝病学杂志,2012,21(1):3-5.
[4] 孙燕,石远凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2008.
[5] 周一,黄镜,杨林,等.奥沙利铂联合替吉奥在胃癌术后辅助化疗中的安全性分析[J].中华肿瘤杂志,2012,34(11):860-862.
[6] Ba Y.Development of adjuvant treatment of gastric cancer[J]. Chinl Clin Oncol,2013,40(15):879-882.
[7] Unek IT,Unek T,Oztop I.Bimonthly regim en of high-dose 1eucovorin infusional 5 fluorouracil epirubicin andcisplatin (Modified ECF)as adjuvant chemotherapy in re-sected gastric adenocarcinoma[J].Chemotherapy,2012,58(3):233-240.
[8] Zhong D,Wu R,Wang X,et al.Combination Chemotherapy with S-1 and Oxaliplatin (SOX) as First-Line Treatment in Elderly Patients with Advanced Gastric Cancer[J].Pathol Oncol Res, 2015,21(5):864-873.
[9] 朱仲玲,薛津怀,阎昭,等.肿瘤患者单次和多次口服替吉奥片的药动学研究[J].中国肿瘤临床,2011,10(38):594-597.
[10] Fukushima M.Antitumor activity and function of S-1,a new oraltegafur-based formulation[J].Gan To Kagaku Ryoho,2006, 33(Suppl 1):19-26.
[11] Sakuramoto S,Sasako M,Yamaguchi T,et a1.Adjuvantchemotherapy for gastric cancer with S-1,an oral foropy-rimidine[J].N Engl J Med,2007,357(18):1810-1820.
[12] WasaburoK,HiroyukiN,TakuoH,et al.S-1 plus cisplatinversus S-1 alone for first-line treatment to fadvancedgastriccancer (SPIRITS trial):aphaseⅢtrial[J].Lancet Oncol,2008,9(3):215-221.
[13] Kim H,Eun J W,Lee H,et al.Gene expression changes in patientmatched gastric normal mucosa,adenomas,and carcinomas[J]. Exper Mol Pathol,2011,90(2):201-209.
[14] 张晓飞,杨康,苏先旭.奥沙利铂联合替吉奥在胃癌术后辅助化疗中的研究[J].重庆医学,2013,42(26):3l07-3109.
[15] Yang J,Zhou Y,Min K,et a1.S-1-based vs non-s-1-basedchemotherapy in advanced gastric cancer,~a meta-analysis[J].World J Gastroenteml,2014,20(33):11886-11893.
[16] Koike M,Mino K,Shoji H,et a1.A case of complete response tomuhiple liver metastasis of gastric can cer after discontinuation of S-1administration[J].Gan To Kagaku Ryoho,2014,41 (7):893-896.
Clinical Effective Observation of S-1 versus S-1 Plusoxaliplatin Program in Adjuvant Chemotherapy of Postoperative Gastric Cancer
HUANG Lu-mi, JI Xiao-hui, WANG Chun-mei, WANG Dong-lin, LI Dai-rong*
(Department of Oncology, Chongqing Cancer Institute, Chongqing 400030, China)
Objective To investigate the efficacy and safety of S-1 versus S-1 plusoxaliplatin program in the adjuvant chemotherapy in the patients with postoperative gastric cancer(stage Ⅲ). Methods The clinical data in 90 patients with postoperative gastric cancer, treated with S-1 or S-1 plusoxaliplatin in our hospital from October 2009 to March 2014 were retrospectively analyzed. Results Median time to progression of the S-1 group and the S-1 plusoxaliplatin group were 8.62 months vs 8.23 months. The 1 year recurrence free survival(RFS)of the two group were 27.3% vs 28.6%. There were no statistically significant differences between the two groups(P>0.05).The mainly adverse reactions in the two groups were myeIosuppression, gastrointestinal reactions, mucositis, peripheral nerve toxicity, hepatic and renal function damage. The occurrence rate of myeiosuppression and gastrointestinal reactions in the S-1 plusoxaliplatin group was significantly higher than that in the S-1 group(P<0.05). Conclusion S-1 and S-1 plus oxaliplatin in postoperative gastric cancer(stage Ⅲ) treatment curative effect quite, with S-1 group having better tolerance.
Gastric cancer; Chemotherapy; Adjuvant; S-1
R735.2
B
1671-8194(2016)36-0001-03
*通讯作者:E-mail: lidairong@sohu.com

