注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效及其对患者心功能的影响研究
李 骅,刘 阳,刘晓雪
·中医·中西医结合·
注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效及其对患者心功能的影响研究
李 骅,刘 阳,刘晓雪
目的 分析注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效及其对患者心功能的影响。方法 选取2014年1月—2016年6月襄阳市中心医院收治的脓毒症休克患者86例,按随机数字表法分为对照组与观察组,每组43例。在常规治疗基础上,对照组患者予以血必净注射液治疗,观察组患者在对照组基础上加用注射用乌司他丁治疗;两组患者均连续治疗1周。比较两组患者治疗前后心率、血压、急性生理学与慢性健康状况评价系统Ⅱ(APACHEⅡ)评分、尿量、炎性因子〔包括肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、白介素6(IL-6)〕水平、心肌酶指标〔包括乳酸脱氢酶(LDH)、心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB)〕,并观察两组患者治疗期间不良反应发生情况。结果 治疗前两组患者心率、收缩压、舒张压比较,差异无统计学意义(P>0.05);治疗后观察组患者心率低于对照组,收缩压、舒张压高于对照组(P<0.05)。治疗前两组患者APACHEⅡ评分、尿量比较,差异无统计学意义(P>0.05);治疗后观察组患者APACHEⅡ评分低于对照组,尿量多于对照组(P<0.05)。治疗前两组患者TNF-α、CRP、IL-6水平比较,差异无统计学意义(P>0.05);治疗后观察组患者TNF-α、CRP、IL-6水平低于对照组(P<0.05)。治疗前两组患者LDH、cTnI、CK-MB水平比较,差异无统计学意义(P>0.05);治疗后观察组患者LDH、cTnI、CK-MB水平低于对照组(P<0.05)。两组患者治疗期间均未发生严重不良反应。结论 注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效确切,可有效降低患者炎性因子水平,改善患者心功能。
脓毒症;休克;注射用乌司他丁;血必净注射液;治疗结果
李骅,刘阳,刘晓雪.注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效及其对患者心功能的影响研究[J].实用心脑肺血管病杂志,2016,24(12):73-76.[www.syxnf.net]
LI H,LIU Y,LIU X X.Clinical effect of ulinastatin for injection combined with xuebijing injection on septic shock and the impact on cardiac function[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(12):73-76.
脓毒症是感染、休克、烧伤及创伤等的一种严重并发症[1-2]。脓毒症休克是指由脓毒症引起的休克,即脓毒症患者予以足量液体复苏后仍存在顽固低血压、低灌注状态或脏器功能障碍,其也是ICU患者死亡的主要原因之一[3-4]。脓毒症休克的常见并发症为心肌损伤,若未及时采取有效措施治疗则短期内会引发多脏器功能障碍综合征[5]。目前,临床治疗脓毒症休克的主要方法包括早期目标导向治疗、初始抗生素治疗、血糖控制、机械通气及予以血管活性药物、重组人活化蛋白C、肾上腺皮质激素等。注射用乌司他丁是一种广谱蛋白酶,能调节炎性因子释放,改善休克患者微循环状态,缓解缺血再灌注损伤。血必净注射液具有减轻外周血液循环阻力,增加心肌收缩功能,促进体内毒素清除等作用。近年来注射用乌司他丁、血必净注射液治疗脓毒症休克均取得了较好的临床效果,但其对患者心功能影响的研究报道较少。本研究旨在探讨注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效及其对患者心功能的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月—2016年6月襄阳市中心医院收治的脓毒症休克患者86例,按随机数字表法分为对照组与观察组,每组43例。对照组中男26例,女17例;年龄43~75岁,平均年龄(60.3±6.1)岁;基础疾病:脓血症15例,急性胆囊炎11例,腹腔感染6例,重症肺炎6例,重症胰腺炎5例。观察组中男25例,女18例;年龄41~74岁、平均年龄(59.8±6.6)岁;基础疾病:脓血症14例,急性胆囊炎10例,腹腔感染7例,重症肺炎7例,重症胰腺炎5例。两组患者性别(χ2=0.048)、年龄(t=0.365)、基础疾病(χ2=0.710)比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患者及其家属均签署知情同意书。排除标准:(1)伴有终末期慢性疾病患者;(2)存在肝、肺、肾等功能异常患者;(3)过敏体质患者。
1.2 脓毒症休克的诊断标准 参照“2012国际严重脓毒症和脓毒症休克治疗指南”中的诊断标准[6]:(1)有明确感染;(2)收缩压<90 mm Hg(1 mm Hg=0.133 kPa)或收缩压下降>40 mm Hg,且持续时间>1 h,需依赖药物维持血压;(3)伴有全身炎症反应综合征。
1.3 方法 两组患者均予以常规治疗,包括6 h早期目标导向治疗和24 h集束化治疗,同时予以抗感染、营养支持、补液及维持内环境稳定等治疗。在此基础上,对照组患者予以血必净注射液(生产厂家:天津红日药业股份有限公司;国药准字Z20040033;规格:10 ml/支)治疗,即血必净注射液50 ml加入0.9%氯化钠溶液100 ml中静脉滴注,2次/d;观察组患者在对照组基础上加用注射用乌司他丁(生产厂家:广东天普生化医药股份有限公司;国药准字H19990133;规格:5万U)治疗,即注射用乌司他丁20 万U持续静脉泵注,2次/d。两组患者均连续治疗1周。
1.4 观察指标 比较两组患者治疗前后心率、血压(收缩压、舒张压)、急性生理学与慢性健康状况评价系统Ⅱ(APACHEⅡ)评分、尿量、炎性因子〔包括肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、白介素6(IL-6)〕水平、心肌酶指标〔包括乳酸脱氢酶(LDH)、心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB)〕,并观察两组患者治疗期间不良反应发生情况。(1)采用沈阳威今基因科技有限公司生产的ZSX型心率变异检测仪检测患者心率;采用上海迈哲电子科技有限公司生产的RKXYY-1型电子血压计测量患者血压。(2)采用APACHEⅡ评分评估患者病情及预后,APACHEⅡ评分由急性生理学评分、年龄评分和慢性健康状况评分3部分组成,总分0~71分,评分越高表明患者病情越严重,预后越差。(3)分别于治疗前后采集患者清晨空腹肘静脉血3 ml,置于含适量抗凝剂的试管内,缓慢摇动试管12次以混匀血液,确保试管已封闭以避免样本在离心过程中蒸发,3 000 r/min离心10 min,分离血浆,置于-20 ℃下保存待测,采用酶联免疫吸附试验(ELISA)检测TNF-α、CRP、IL-6水平;采用日本日立7600型全自动生化分析仪检测LDH、cTnI、CK-MB水平。
2 结果
2.1 心率、血压 治疗前两组患者心率、收缩压、舒张压比较,差异无统计学意义(P>0.05);治疗后观察组患者心率低于对照组,收缩压、舒张压高于对照组,差异有统计学意义(P<0.05,见表1)。
2.2 APACHEⅡ评分、尿量 治疗前两组患者APACHEⅡ评分、尿量比较,差异无统计学意义(P>0.05);治疗后观察组患者APACHEⅡ评分低于对照组,尿量多于对照组,差异有统计学意义(P<0.05,见表2)。
2.3 炎性因子水平 治疗前两组患者TNF-α、CRP、IL-6水平比较,差异无统计学意义(P>0.05);治疗后观察组患者TNF-α、CRP、IL-6水平低于对照组,差异有统计学意义(P<0.05,见表3)。
2.4 心肌酶指标 治疗前两组患者LDH、cTnI、CK-MB水平比较,差异无统计学意义(P>0.05);治疗后观察组患者LDH、cTnI、CK-MB水平低于对照组,差异有统计学意义(P<0.05,见表4)。
Table 1 Comparison of heart rate and blood pressure between the two groups before and after treatment
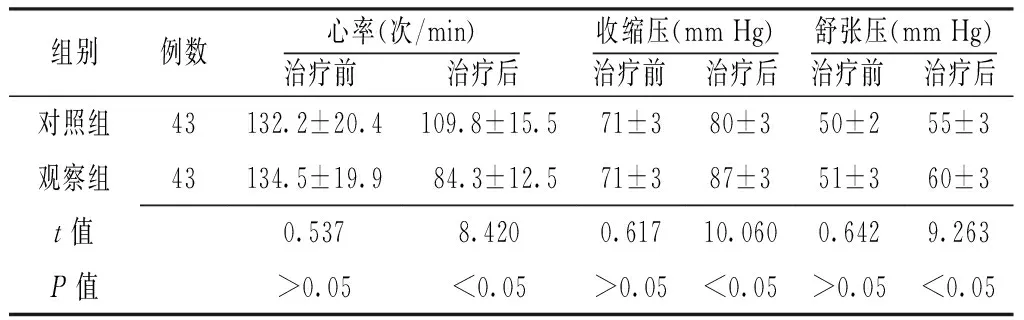
组别例数心率(次/min)治疗前 治疗后收缩压(mmHg)治疗前 治疗后舒张压(mmHg)治疗前 治疗后对照组43132.2±20.4109.8±15.571±380±350±255±3观察组43134.5±19.9 84.3±12.5 71±387±351±360±3t值0.5378.4200.61710.0600.6429.263P值>0.05<0.05>0.05<0.05>0.05<0.05
Table 2 Comparison of APACHEⅡ score and urine volume between the two groups before and after treatment

组别例数APACHEⅡ评分(分)治疗前 治疗后尿量(ml/h)治疗前 治疗后对照组4323.2±3.017.9±2.421.8±4.2 74.3±15.3 观察组4323.5±3.212.4±2.120.3±4.4105.2±18.4t值0.42311.4261.6118.463P值>0.05<0.05>0.05<0.05
注:APACHEⅡ=急性生理学与慢性健康状况评价系统Ⅱ
2.5 不良反应 两组患者治疗期间均未发生严重不良反应。
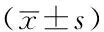
表3 两组患者治疗前后炎性因子水平比较
注:TNF-α=肿瘤坏死因子α,CRP=C反应蛋白,IL-6=白介素6
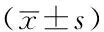
表4 两组患者治疗前后心肌酶指标比较
注:LDH=乳酸脱氢酶,cTnI=心肌肌钙蛋白I,CK-MB=肌酸激酶同工酶
3 讨论
近年来,脓毒症休克的发病率、病死率呈逐年上升趋势[7]。目前,临床多采用平均动脉压、中心静脉压、尿量及血乳酸水平等指标对脓毒症休克的诊断和预后评估进行综合判断。随着临床诊疗技术的提高,脓毒症休克的诊治方法有了很大进步。血必净注射液是一种中成药,由丹参、红花、当归、川芎、赤芍组成,具有清热凉血、活血化瘀的功效。现代药理学研究表明,血必净注射液具有抑制多种炎性递质、保护血管内皮细胞功能、改善微循环、调节免疫功能及抗细胞凋亡等作用[8-11]。注射用乌司他丁是一种具有广谱蛋白酶抑制作用的糖蛋白,药理学研究表明,注射用乌司他丁具有调节炎性因子释放及抗炎作用,可稳定组织细胞的溶酶体膜,清除氧自由基,改善休克患者的循环状态,降低机体血液黏度等[12-13]。
本研究结果显示,治疗后观察组患者心率、APACHEⅡ评分低于对照组,收缩压、舒张压高于对照组,尿量多于对照组,提示注射用乌司他丁联合血必净注射液治疗脓毒症休克患者的临床疗效较好。研究表明,炎性因子与脓毒症休克的发生、发展密切相关[14]。TNF-α是导致感染性休克的关键递质,细菌感染可间接或直接刺激机体释放过量TNF-α,从而形成免疫炎症瀑布样连锁反应,且TNF-α水平随疾病进展而升高,是导致病情恶化的重要原因[14]。CRP是组织损伤或感染时迅速释放的急性蛋白,其水平在各种组织损伤、急性炎症等发生后数小时迅速上升[15]。IL-6主要由B细胞、T细胞及巨噬细胞等多种细胞分泌产生,能调节多种细胞的生长与分化,在急性期反应、免疫应答及免疫反应中具有重要作用[16]。本研究结果显示,治疗后观察组患者TNF-α、CRP、IL-6水平低于对照组,提示注射用乌司他丁联合血必净注射液可抑制脓毒症休克患者炎性反应。心肌损伤是脓毒症休克常见的早期并发症,临床表现为低血压、心力衰竭及心律失常,可加重其他脏器功能损伤,LDH、cTnI、CK-MB是公认的反映心肌损伤程度的指标[17]。本研究结果显示,治疗后观察组患者LDH、cTnI、CK-MB水平低于对照组,提示注射用乌司他丁联合血必净注射液可有效改善脓毒症休克患者心功能。
综上所述,注射用乌司他丁联合血必净注射液治疗脓毒症休克的临床疗效确切,可有效降低患者炎性因子水平,改善患者心功能,值得临床推广应用。但本研究样本量小,观察时间较短,且观察指标较少,仍需在后续工作中进行多中心、大样本量研究进一步证实,以期为临床有效诊治脓毒症休克提供参考价值。
[1]PROCESS INVESTIGATORS,YEALY D M,KELLUM J A,et al.A randomized trial of protocol-based care for early septic shock[J].N Engl J Med,2014,370(18):1683-1693.
[2]田慧艳,于斌,胡振杰,等.早期乳酸动态监测指标对严重脓毒症及脓毒症休克患者预后的评价[J].河北医药,2015,37(10):1449-1453.
[3]HOLST L B,HAASE N,WETTERSLEV J,et al.Lower versus higher hemoglobin threshold for transfusion in septic shock[J].N Engl J Med,2014,371(15):1381-1391.
[4]DU Y,WANG L,SHI H.Comparison of clinical effect of dopamine and norepinephrine in the treatment of septic shock[J].Pak J Pharm Sci,2015,28(4 Suppl):1461-1464.
[5]麦舒桃,韩云,谢东平,等.脓毒症休克患者早期中医证候要素与PiCCO监测指标的关系研究[J].广州中医药大学学报,2014,31(3):335-338.
[6]DELLINGER R P,LEVY M M,RHODES A,et al.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock,2012[J].Intensive Care Med,2013,39(2):165-228.
[7]吴铁军,张丽娜,亢翠翠.Treg/Th17失衡在脓毒症发病机制中的作用[J].中国病理生理杂志,2011,27(12):2411-2413.
[8]陆逢时,骆斯敏,金同新.血必净治疗重症脓毒症和脓毒症休克疗效分析[J].华夏医学,2015,28(2):42-44.
[9]李国春,勇超.探讨血必净注射液对严重烧伤患者休克期并发脓毒症的效果[J].中国医药导刊,2014,16(3):540-541.
[10]戴晓刚,李树钧,王建宏,等.血必净联合丙氨酰谷氨酰胺对重症急性胰腺炎患者IL-10、IL-15、IL-18、内毒素及TNF-α的影响[J].中国煤炭工业医学杂志,2013,16(10):1581-1584.
[11]丁国娟,吕铁.血必净注射液联合参附注射液治疗脓毒症效果探讨[J].中国全科医学,2015,18(11):1300-1303.
[12]孙晓琪.乌司他丁治疗老年脓毒症患者凝血功能障碍的疗效[J].中国老年学,2014,34(5):1373-1374.
[13]朱瑶丽,朱春丽,王小华.乌司他丁对脓毒症休克患者血常规、血乳酸及降钙素原的影响[J].西北药学杂志,2015,30(5):618-620.
[14]王晓燕,张流忠,周莉,等.脓毒症患者血清CRP、TNF-α水平变化及意义[J].山东医药,2012,52(34):34-35.
[15]李丽娟,陈炜,古旭云,等.血浆PCT和CRP水平的动态变化对脓毒症严重程度的评估及其相关性研究[J].中国实验诊断学,2013,17(6):1010-1013.
[16]赵若愚,鲍逸民,杨永青.血清PCT、IL-6、NT-proBNP、CTnI和D-D测定水平在急诊脓毒症患者早期诊断中的临床研究[J].标记免疫分析与临床,2016,23(6):613-616.
[17]张新亮,秦延军,卞晓华,等.液体复苏对创伤致严重脓毒症和脓毒性休克患者心肌损伤的影响[J].中华危重病急救医学,2012,24(4):710-712.
(本文编辑:李洁晨)
Clinical Effect of Ulinastatin for Injection Combined with Xuebijing Injection on Septic Shock and the Impact on Cardiac Function
LIHua,LIUYang,LIUXiao-xue.
DepartmentofIntensiveMedicine,theCentralHospitalofXiangyang,Xiangyang441021,China
Objective To analyze the clinical effect of ulinastatin for injection combined with xuebijing injection on septic shock and the impact on cardiac function.Methods A total of 86 patients with septic shock were selected in the Central Hospital of Xiangyang from January 2014 to June 2016,and they were divided into control group and observation group according to random number table,each of 43 cases.Based on conventional treatment,patients of control group received xuebijing injection,while patients of observation group received ulinastatin for injection combined with xuebijing injection;both groups continuously treated for 1 week.Heart rate,blood pressure(including SBP and DBP),APACHEⅡ score,urine volume,inflammatory cytokines(including TNF-α,CRP and IL-6)and myocardial enzyme indicators(including LDH,cTnI and CK-MB)before and after treatment,and incidence of adverse reactions during the treatment were compared between the two groups.Results No statistically significant differences of heart rate,SBP or DBP was found between the two groups before treatment(P>0.05);after treatment,heart rate of observation group was statistically significantly lower than that of control group,while SBP and DBP of observation group were statistically significantly higher than those of control group(P<0.05).No statistically significant differences of APACHEⅡ score or urine volume was found between the two groups before treatment(P>0.05);after treatment,APACHEⅡ score of observation group was statistically significantly lower than that of control group,while urine volume of observation group was statistically significantly more than that of control group(P<0.05).No statistically significant differences of TNF-α,CRP or IL-6 was found between the two groups before treatment(P>0.05),while TNF-α,CRP and IL-6 of observation group were statistically significantly lower than those of control group after treatment(P<0.05).No statistically significant differences of LDH,cTnI or CK-MB was found between the two groups before treatment(P>0.05),while LDH,cTnI and CK-MB of observation group were statistically significantly lower than those of control group after treatment(P<0.05).No one of the two groups occurred any obvious adverse reactions during the treatment.Conclusion Ulinastatin for injection combined with xuebijing injection has certain clinical effect in treating septic shock,can effectively reduce the inflammatory cytokines levels and improve the cardiac function.
Sepsis;Shock;Ulinastatin for injection;Xuebijing injection;Treatment outcome
441021湖北省襄阳市中心医院重症医学科(李骅,刘晓雪),急诊科(刘阳)
R 631 R 441.9
B
10.3969/j.issn.1008-5971.2016.12.019
2016-09-07;
2016-12-19)

