家蝇几丁质结合蛋白(Md-CBPⅠ)的表达纯化及活性分析
袁野,闫恕,张丹丹,孔令聪,裴志花,刘树明,马红霞,2*
(1. 吉林农业大学,动物科学技术学院,长春 130118;2.吉林农业大学,动物生产及产品质量安全教育部重点实验室,长春 130118)
家蝇几丁质结合蛋白(Md-CBPⅠ)的表达纯化及活性分析
袁野1,闫恕1,张丹丹1,孔令聪1,裴志花1,刘树明1,马红霞1,2*
(1. 吉林农业大学,动物科学技术学院,长春 130118;2.吉林农业大学,动物生产及产品质量安全教育部重点实验室,长春 130118)
为了研究家蝇几丁质结合蛋白(Md-CBPⅠ)在家蝇防御体系中的相关活性,采用PCR技术,对从鸡源沙门氏菌诱导家蝇幼虫构建的抑制性消减文库(SSH)中筛选到的家蝇幼虫几丁质结合蛋白Ⅰ基因(Muscadomesticachitin binding proteinⅠ,Md-CBPⅠ)进行扩增,并成功构建了重组表达质粒pET-32a-Md-CBPⅠ,于大肠杆菌BL21(DE3)中得以高效表达,纯化并获得了Md-CBPⅠ融合蛋白。进一步对该蛋白的亲和活性进行了研究,发现Md-CBPⅠ融合蛋白对几丁质以及纤维素均有一定的结合作用,且其对几丁质的结合作用相对较好。试验为家蝇几丁质结合蛋白生物学活性和免疫学活性的研究奠定了基础。
家蝇;几丁质结合蛋白;克隆;原核表达
家蝇长期处于病原菌丛生的环境中,但却不易被其所感染,根源在于其体内所产生的多种抗菌物质[1],几丁质就是其产生的众多抗菌物质中的一种。在昆虫体内几丁质与几丁质结合蛋白结合成为一种特殊的复合体:几丁质蛋白复合体,从而对外界损伤、摄入毒素以及病原体感染起着重要的防御作用[2-3],该复合体也是昆虫体壁重要的组成部分,二者的缺失将会导致表皮功能异常甚至丧失,并且对昆虫的生长,体态协调,变态发育,繁殖能力有很大的影响。此外,一部分几丁质结合蛋白还具有抗细菌、抗真菌和抗病毒活性[4]。由此可见,几丁质结合蛋白在家蝇防御体系中起着不可或缺的作用,但该蛋白的相关活性还有待深入研究。
为此,本研究以鸡源沙门氏菌诱导家蝇三日龄幼虫抑制性消减文库中筛选出来的差异基因为基础,对家蝇几丁质结合蛋白Ⅰ基因进行克隆及原核表达,并对其亲和活性进行了检测,为该蛋白的深入研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 文库、菌种及表达载体 鸡源沙门氏菌诱导家蝇三日龄幼虫SSH文库及5'RACE-Ready cDNA由吉林农业大学兽医药理与毒理学实验室完成[5],大肠杆菌DH5α和BL21(DE3)以及原核表达载体pET-32a(+)由吉林农业大学兽医药理与毒理学实验室保存。1.1.2 主要试剂及工具酶 Ex Taq 酶,dNTP,限制性内切酶(EcoRⅠ、XhoⅠ),T4 DNA连接酶,DNA Marker(DL2000,λ-HindⅢdigest),pMD18-T Vector,宝生物工程(大连)有限公司;异丙硫代β-D半乳糖苷(IPTG),氨苄青霉素(AMP),北京鼎国有限公司;DNA凝胶回收试剂盒,生工生物工程(上海)股份有限公司;其余试剂均为国产分析纯试剂。1.1.3 引物合成和DNA测序 引物的合成和重组质粒DNA测序由博仕生物工程股份有限公司完成。
1.2 方法
1.2.1Md-CBPⅠ的筛选及全长基因的克隆 从本实验室构建的鸡源沙门氏菌诱导家蝇三日龄幼虫SSH文库中筛选获得家蝇差异表达序列Md-CBPⅠ,该序列与GenBank中登陆号为LOC105262293的序列相似度为98%。根据Md-CBPⅠORF序列剪掉信号肽,并用Primer5.0软件设计全长PCR引物(表1)。
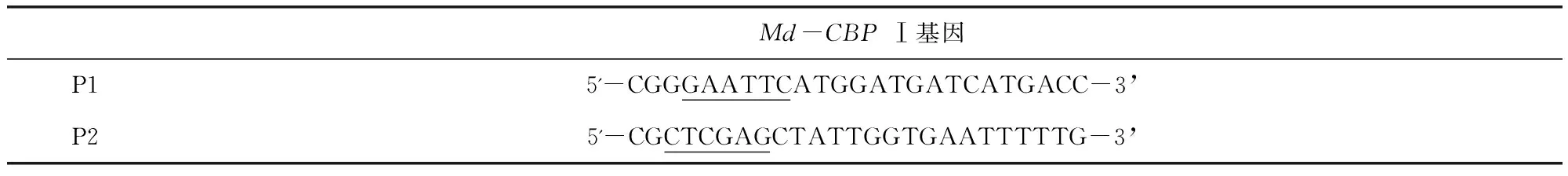
表1 Md-CBPⅠ基因的全长引物设计
以家蝇三日龄幼虫5'-RACE-Ready cDNA为模板进行PCR扩增,将PCR产物纯化后连接至pMD18-T Vector(命名为pMD18-T-Md-CBPⅠ)并转入大肠杆菌感受态细胞DH5α中,随机挑取单克隆菌落,提取质粒并双酶切鉴定,将阳性克隆的菌液送至博仕生物工程股份有限公司进行测序。1.2.2 生物信息学分析方法 采用ExPASy的在线软件Protparam(http://web.expasy.org/protparam/)预测Md-CBPⅠ编码蛋白的理化性质,对其序列进行分析;采用MEGA软件进行多重序列比对分析,并使用临位法构建了系统进化树;运用EMBL工具Pfam(http://pfam.xfam.org/search/)对该基因的保守区完整性进行鉴定;根据cuticleDB 数据库的Hidden Markov Modeling 软件(http://bioinformatics2.biol.uoa.gr/cuticleDB/index.jsp),预测了Md-CBPⅠ所属的表皮蛋白家族;通过Prosite软件(http://prosite. expasy.org/),预测了Md-CBPⅠ基因所含有的磷酸化及糖基化等功能性位点;利用PSIPRED软件(http://bioinf.cs.ucl.ac.uk/psipred/),对本基因的二级结构进行了预测并分析。
1.2.3 重组表达质粒的表达与纯化 将测序验证后的阳性克隆子和原核表达载体pET-32a(+)经限制内切酶双酶切回收后,用T4 DNA连接酶进行连接。将连接产物转入大肠杆菌感受态细胞DH5α中,随机挑取单克隆菌落提取质粒进行PCR及双酶切鉴定,将阳性克隆菌液进行测序验证。将测序正确的重组表达质粒pET-32a-Md-CBPⅠ转入大肠杆菌BL21(DE3)感受态细胞中,挑取阳性克隆的单克隆菌落至LB(Amp)培养液中,1% IPTG诱导表达,诱导4 h时收集菌体超声破碎,分别取上清和沉淀进行分析,处理后的产物经蛋白电泳SDS-PAGE(15%)进行分析。
将以上步骤处理后的上清液加入到经过Wash Buffer(50 mM NaH2PO4,300 mM NaCl,PH 8.0)平衡过后的镍离子亲和层析柱中,冰上结合2 h后收集流出液。分别用20 mL Wash Buffer平衡,200 mL Elution Buffer(10 mM-200 mM Imidazole,50 mM NaH2PO4,300 mM NaCl,PH 8.0)梯度洗脱,收集洗脱液。分别将20 μL流出液以及各个梯度的洗脱液处理后经蛋白电泳SDS-PAGE(15%)进行分析。
1.2.4 pET-32a-Md-CBPⅠ融合蛋白的亲和性质分析 各取2 mL几丁质珠和2 mL纤维素(经结合缓冲液处理过夜)入层析柱,将使用结合缓冲液处理后的蛋白以3倍体积加入到以上层析柱(室温孵育3 h)并收集流出液。分别用洗涤缓冲液洗涤5次,每次孵育15 min,收集每次的流出液,最后用8 M尿素洗脱,收集洗脱液。分别将20 μL流出液以及洗脱液处理后经蛋白电泳 SDS-PAGE(15%)进行分析[6-7]。
1.2.5 生物活性检测 利用牛津杯法,分别检测纯化后的融合蛋白对大肠杆菌,金黄色葡萄球菌,沙门氏菌的生物活性。取100 μL菌液(105CFU/mL) 均匀涂布于琼脂平板上,放入牛津杯,杯内加入纯化后的融合蛋白(4 μg/μL),37 ℃过夜培养,观察抑菌圈大小。
2 结果与分析
2.1Md-CBPⅠ全长基因的扩增及克隆Md-CBPⅠ经PCR扩增后获得348 bp大小的条带。将纯化产物与pMD18-T载体连接,限制性内切酶双酶切验证和测序验证均为阳性,证明pMD18-T-Md-CBPⅠ构建成功。Md-CBPⅠ全长ORF基因PCR扩增和pMD18-T-Md-CBPⅠ双酶切鉴定(图1)。
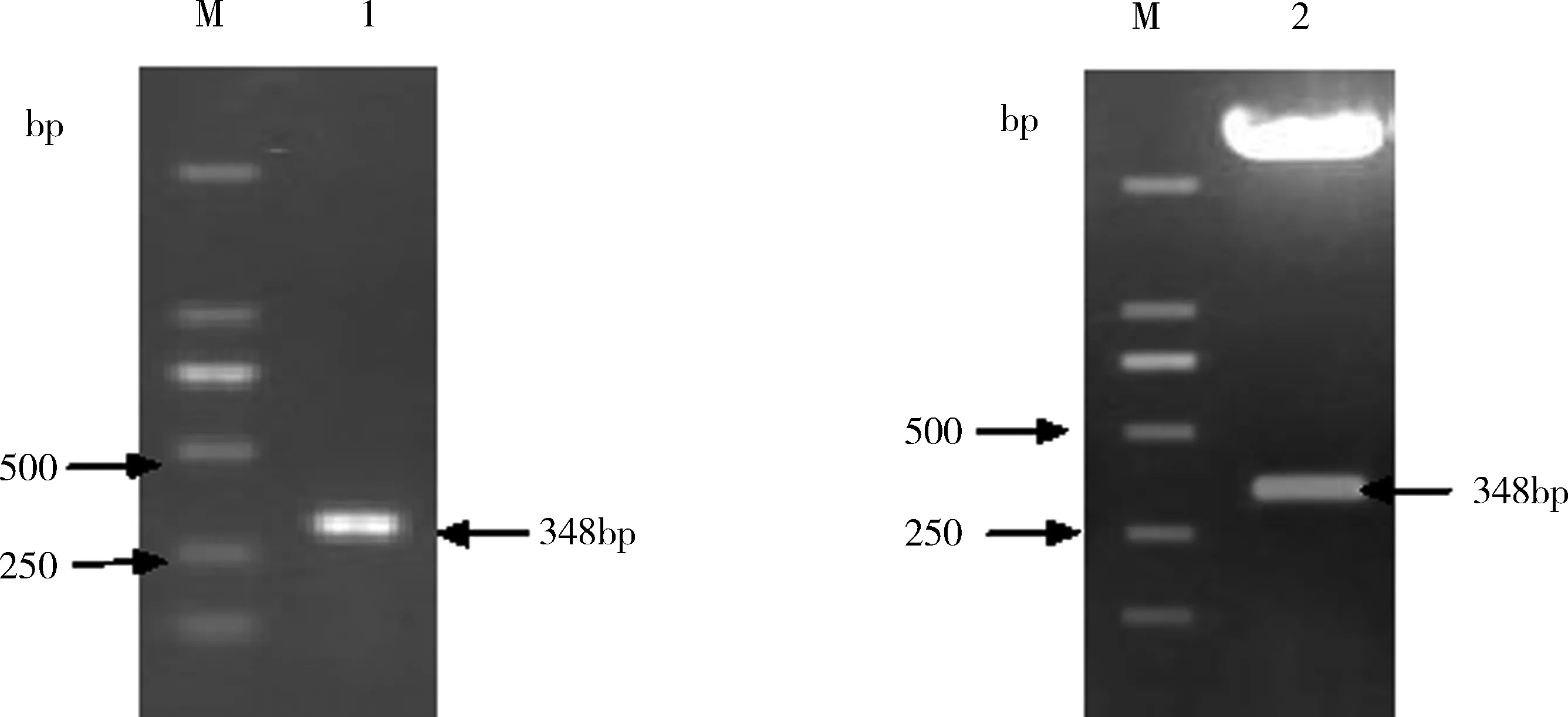
M:DNA分子量标准DL2000;1:重组质粒Md-CBPⅠ的全长PCR产物;2:重组质粒pMD18-T- Md-CBPⅠ的EcoRⅠ和XhoⅠ双酶切图1 Md-CBPⅠ全长ORF基因PCR扩增和pMD18-T- Md-CBPⅠ双酶切鉴定
2.2 生物信息学分析
2.2.1 序列分析 全长序列分析显示该基因全长为570 bp,ORF为393 bp,剪掉信号肽后为348 bp,共编码114个氨基酸。预测后的等电点为5.63,预测分子量约为14.1 kD。带正电残基(Arg+Lys)为8,带负电残基(Asp+Glu)为33。该蛋白的不稳定系数为9.19,说明该蛋白很稳定。脂肪指数为37.54,亲水性系数为-2.031,说明该蛋白为亲水性蛋白。
2.2.2 基因的同源性及系统进化树构建 系统进化树分析表明Md-CBPⅠ与家蝇其它表皮蛋白和厩螫蝇表皮蛋白亲缘关系较远(图2)。
2.2.3 编码蛋白结构域预测 通过保守区鉴定后,结果显示,Md-CBPⅠ编码的蛋白质在57-108位氨基酸处含有Chitin-Bind 4保守基序,该保守基序作为几丁质结合位点的R-R保守区域的扩展版本,为此,可以确定该家族为昆虫表皮蛋白,属于CPR家族(图3)。
相关软件预测显示Md-CBPⅠ编码的蛋白质属于表皮蛋白 RR-1亚族。该亚族存在于柔软表皮层中,与预测中幼虫表皮蛋白基因相符。
Prosite分析表明,该基因在102-105位氨基酸处含有磷酸化位点。可能与Md-CBPⅠ编码的蛋白质的功能密切相关。
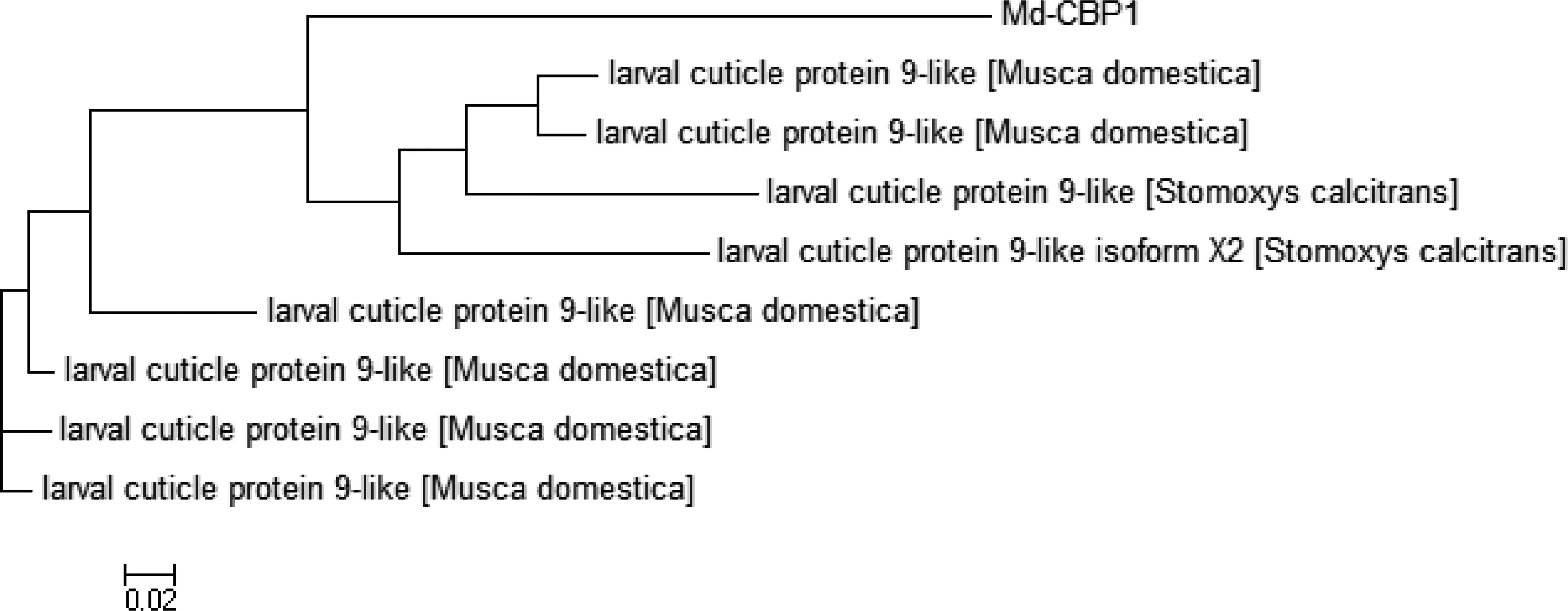
图2 Md-CBPⅠ与蝇类其它表皮蛋白的系统进化分析
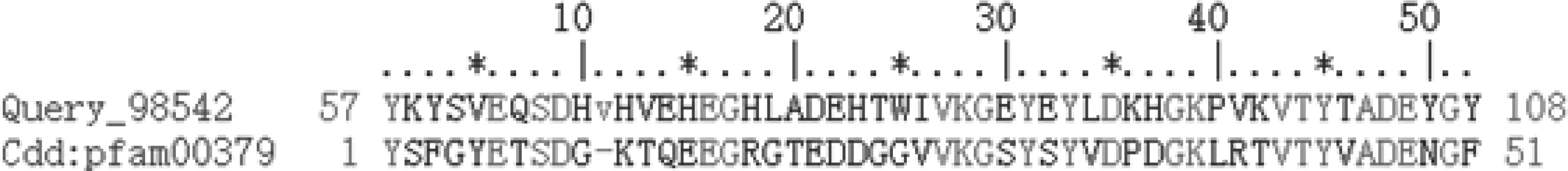
图3 Pfam对Md-CBPⅠ的保守区分析
2.2.4 编码蛋白二级结构分析 β-折叠是表皮蛋白-几丁质相互作用所必需的基本结构[12],二级结构预测结果显示,在几丁质结合区域中β-折叠的比率高达60.7%,无α-螺旋结构(图4)。
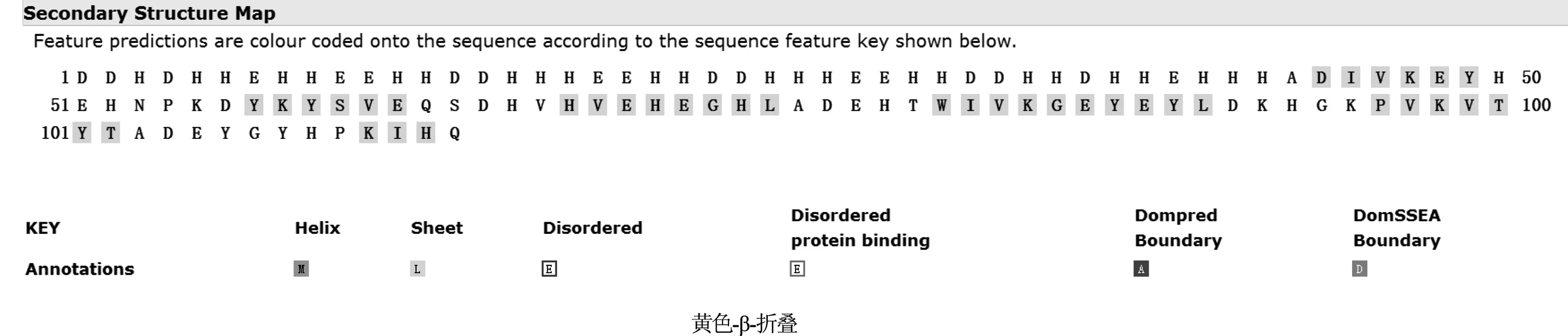
图4 Md-CBPⅠ的二级结构预测
2.3 重组表达质粒的表达与纯化 将重组表达质粒通过PCR及限制性内切酶双酶切验证,在约348 bp处有一条清晰的条带,与目的基因大小相符(图5)。通过测序验证,成功构建了重组表达质粒pET-32a-Md-CBPⅠ。
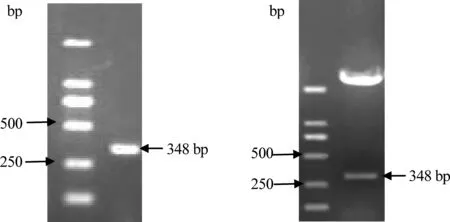
M:DNA分子量标准DL2000;1:重组质粒pET-32a-Md-CBPⅠ的PCR鉴定;2:pET-32a-Md-CBPⅠ双酶切图5 重组质粒pET-32a-Md-CBPⅠ的PCR及双酶切鉴定
取重组菌诱导前后的表达产物以及破碎后的上清和沉淀进行SDS-PAGE电泳,结果显示,诱导的重组菌约在40 kD左右出现表达带,而未诱导菌无此条带(图6),说明融合蛋白成功获得表达;对其可溶性行进分析,结果显示融合蛋白主要在上清中表达,属于可溶性表达;对融合蛋白进行纯化,并将纯化后的蛋白经过蛋白电泳SDS-PAGE检测,在约40 kD大小处得到单一条带,表明获得较高纯度的融合蛋白(图6)。
2.4 亲和性质分析 将流出液以及洗脱液通过蛋白电泳SDS-PAGE分析后显示,与几丁质和纤维素结合的蛋白大小在40 kD左右,与目的蛋白大小一致(图7)(为保证体外亲和试验的特异性,结合缓冲液含有较高的盐离子浓度,并通过洗涤缓冲液反复洗涤,除去非特异性结合的蛋白[11])。在上样量保持相同的条件下,几丁质亲和实验中洗脱液的浓度相对较高,结果显示,纯化后的融合蛋白均可以与几丁质以及纤维素特异性结合,且融合蛋白对几丁质的结合能力要比纤维素高。
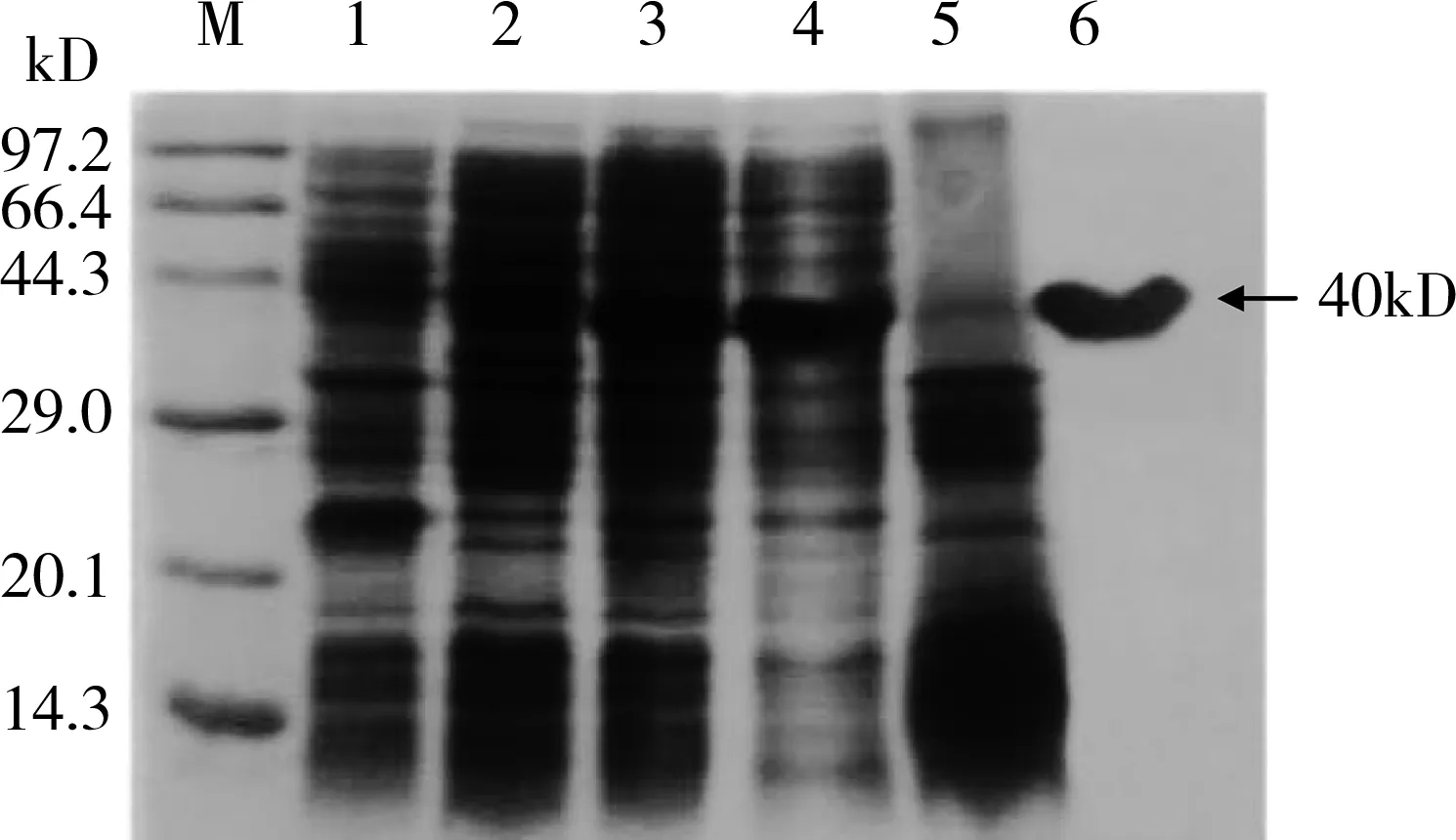
M:低分子量蛋白Marker;1:E.coli BL21/pET-32a诱导后;2:E.coli BL21/pET-32a-Md-CBPⅠ诱导后;3:E.coli BL21/pET-32a-Md-CBPⅠ诱导4 h后;4-5:pET-32a-Md-CBPⅠ超声破碎后上清及沉淀;6:纯化后的融合蛋白图6 重组质粒pET-32a-Md-CBPⅠ表达产物及融合蛋白纯化的SDS-PAGE分析
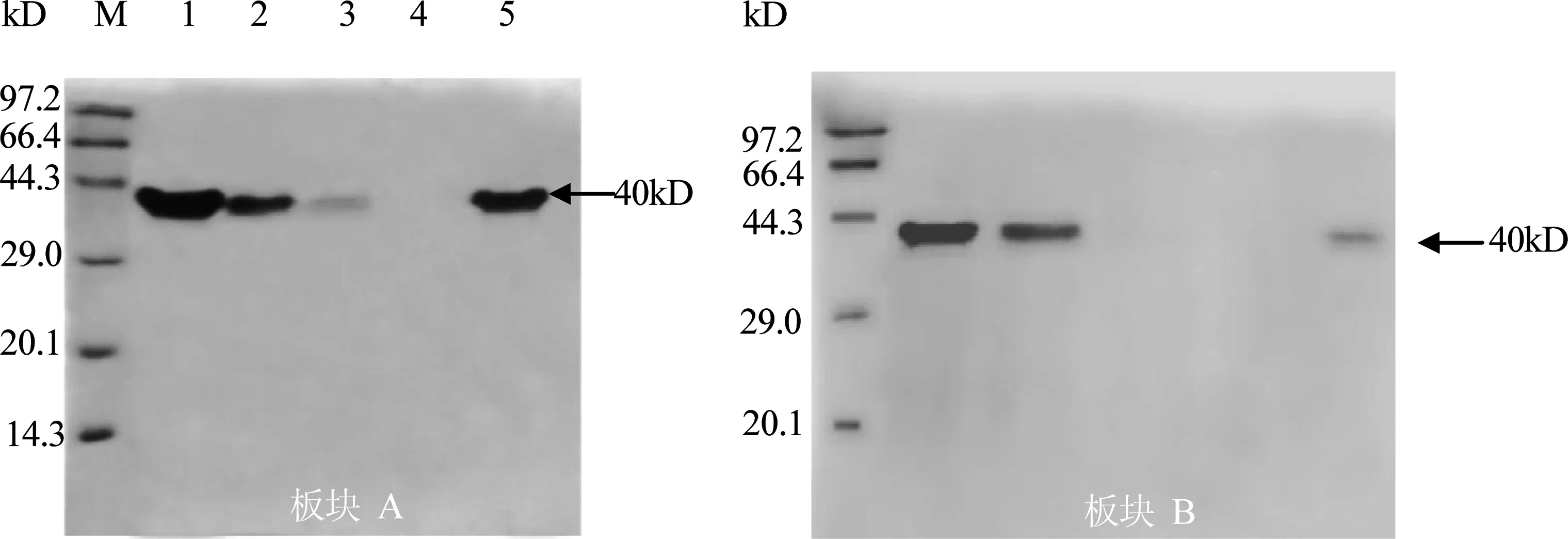
板块A:几丁质; 板块B:纤维素;M:低分子量蛋白Marker; 1.融合蛋白; 2.流出液; 3.第一次洗涤组分;4.最后一次洗涤组分; 5.洗脱液溶出的融合蛋白图7 pET-32a-Md-CBPⅠ融合蛋白亲和性质分析结果
由于原核表达的融合蛋白结合能力较弱,所以将洗脱液的组分浓缩。泳道5为浓缩20倍后的结果。
2.5 生物活性检测 经检测纯化后的融合蛋白对大肠杆菌,金黄色葡萄球菌,沙门氏菌均无抑菌活性。
3 讨论
几丁质是家蝇众多抗菌物质中的一类,家蝇体内含有大量高纯度的几丁质,而幼虫表皮和蛹壳是提取几丁质的主要原料,其中蛆壳中的几丁质含量达95%以上[8-9]。近年来,国内外学者已对家蝇几丁质的作用有了一定的了解,但对其编码基因以及防御、免疫等方面的研究才刚刚起步。本研究以鸡源沙门氏菌诱导家蝇三日龄幼虫抑制性消减文库中筛选出来的差异基因为基础,对家蝇几丁质结合蛋白Ⅰ基因进行克隆及原核表达,并对表达产物进行亲和性质分析。
根据序列分析显示,Md-CBPⅠ属于CPR家族,该家族是因含有R&R保守区而命名的,是节肢动物中最大的表皮蛋白家族。目前,该家族中的几种昆虫已经成功获得全基因组序列,其中对果蝇、冈比亚按蚊、西方蜜蜂、家蚕、金小蜂和赤拟谷盗的表皮蛋白基因已经进行了详细的人工标注[10]。
本文首次报道了含有R&R保守序列的扩展版本chitin_bind_4的家蝇几丁质结合蛋白。通过信号肽预测软件,发现Md-CBPⅠ基因含有一个包含17个氨基酸残基的信号肽序列,其为表皮蛋白的常见特征。Md-CBPⅠ基因属于表皮蛋白的RR-2亚家族,该家族对昆虫表皮的硬化起着关键的作用,且其编码的氨基酸序列中,含有大量的组氨酸和赖氨酸,相关研究证明,这两种氨基酸在硬化反应中也具有一定意义[11-12]。通过对构建的进化树我们发现,Md-CBPⅠ与家蝇其它表皮蛋白和厩螫蝇表皮蛋白亲缘关系较远。但其功能是否与其他表皮蛋白有差异,还有待于进一步研究。
此外,试验进一步对该蛋白的亲和活性进行了研究,发现其对几丁质以及纤维素都有一定的结合作用,显示了该蛋白对多糖底物的结合能力。相关文献显示,几丁质结合蛋白结合多糖底物的能力可能赋予了该蛋白抗菌、抗真菌以及抗病毒活性[13-14]。试验采用的是大肠杆菌原核表达系统,大肠杆菌的胞质环境是高度还原的,所产生的蛋白并不包含稳定的二硫键,而二硫键是几丁质结合蛋白的一个重要特征,这可能是Md-CBPⅠ融合蛋白无抑菌活性的原因。而Md-CBPⅠ是否含有抗真菌以及抗病毒活性,或在真核表达系统中是否含有相应的活性还有待进一步研究。这也验证了筛选自鸡沙门氏菌诱导后构建的SSH文库中的Md-CBPⅠ基因,其在诱导后表达量的增加可能对家蝇对沙门氏菌的耐受起着重要的作用。
[1] 左红梅. 大肠杆菌诱导家蝇幼虫抑制性消减文库构建及部分差异基因分析[D]. 长春: 吉林农业大学,2011.
[2] Kuraishi T, Hori A, Kurata S. Host-microbe interactions in the gut of Drosophila melanogaster [ J ]. Frontiers in Physiology, 2013, 4: 375-375.
[3] Shirk P D, Perera O P, Shelby K S,etal. Unique synteny and alternate splicing of the chitin synthases in closely related Heliothine moths [J] . Gene, 2015: 19.
[4] Destoumieux D, Mu M, Cosseau C,etal. Penaeidins, antimicrobial peptides with chitin-binding activity, are produced and stored in shrimp granulocytes and released after microbial challenge [ J ] . Journal of Cell Science, 2000, 113 (3):461-469.
[5] 王东方,张惠,马红霞,等.猪肺炎支原体诱导家蝇幼虫抑制性消减文库的构建[ J ] .中国兽医学报, 2013 , 33 (3) : 358-361.
[6] Rebers J E , Willis J H. A conserved domain in arthropod cuticular proteins binds chitin [ J ] . Insect Biochemistry and Molecular Biology, 2001 , 31 (11) : 1083-1093.
[7] 唐亮.家蚕表皮几丁质结合蛋白的纯化与鉴定[D]. 重庆:西南大学,2010.
[8] 王璐,王效杰.家蝇几丁质的研究进展[ J ] . 沈阳医学院学报, 2013 , 15(1) : 58-60.
[9] Tetreau G, Cao X, Chen Y R,etal. Overview of chitin metabolism enzymes in Manduca sexta: Identification, domain organization, phylogenetic analysis and gene expression [J]. Insect Biochemistry & Molecular Biology, 2015, 31: 114-126.
[10]孙汝江.中华蜜蜂表皮蛋白基因的克隆与功能分析[D].山东:山东农业大学,2014.
[11]Kramer K J , Kanost M R , Hopkins T L ,etal. Oxidative conjugation of catechols with proteins in insect skeletal systems [J]. Tetrahedron, 2001 , 57(2) : 385-392.
[12]Kerwin J L , Turecek F , Xu R ,etal. Mass spectrometric analysis of catechol-histidine adducts from insect cuticle [ J ] . Analytical Biochemistry, 1999 , 268(2) : 229-237.
[13]Kawabata S , Nagayama R , Hirata M ,etal. Tachycitin, a small granular component in horseshoe crab hemocytes, is an antimicrobial protein with chitin-binding activity [ J ] . J Bio Chem, 1996 , 20(6) : 1253-1260.
[14]Huang X , Xie W , Gong Z. Chracteristics and antifungal activity of a chitin binding protein from Ginkgo Biloba [ J ] . FEBS Lett, 2000 , 478(1/2) : 123-126.
[15]Chen K Y , Hsu T C , Huang P Y ,etal. Penaeus monodon chitin-binding protein (PmCBP) is involved in white spot syndrome virus (WSSV) infection [ J ] . Fish & Shellfish Immunology, 2009 , 27(3) : 460-465.
[16]Vaaje-Kolstad G, Horn S J, Aalten D M F V,etal. The non-catalytic chitin-binding protein CBP21 from Serratia marcescens is essential for chitin degradation. J Biol Chem[J]. Journal of Biological Chemistry, 2005, 280-280.
[17]Petutschnig E K, Jones A M E, Liliya S,etal. The lysin motif receptor-like kinase (LysM-RLK) CERK1 is a major chitin-binding protein in arabidopsis thaliana and subject to chitin-induced phosphorylation.[J]. Journal of Biological Chemistry, 2010, 285(37):28902-28911.
(编辑:陈希)
Expression,Purification and Activity Analysis of Chitin Binding Protein(Md-CBPⅠ)fromMuscadomestica
YUAN Ye1,YAN Shu1,ZHANG Dan-dan1,KONG Ling-cong1, PEI Zhi-hua1,LIU Shu-ming1, MA Hong-xia1,2*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;2.AnimalProduction&ProductQualityandSecurityoftheMinistryofEducation,JilinAgriculturalUniversity,Changchun130118,China)
In order to research the activities ofMd-CBPⅠ in musca domestica defence system,Md-CBPⅠwas screened from suppression subtractive library(SSH) inMuscadomesticalarvae induced bySalmonellapullorumof chickens and also amplified by PCR techniques. The recombinant expression plasmid of pET-32a-Md-CBPⅠ was constructed successfully and expressed inE.ColiBL21(DE3). fusion protein was obtained by purification, further more, the preliminary study was made on the affinity of which revealed that the fusion protein has binding affinity of both chitin and cellulose, and the affinity of chitin was stronger than cellulose. This research laid a foundation for further research on biological activity and immunological activity ofMd-CBPⅠ.
Muscadomestica; chitin binding protein; clone; prokaryotic expression
国家自然科学基金资助项目(31572574,31502121);吉林省世行贷款农产品质量安全项目(2011-Y05)
2015-11-04
A
1002-1280 (2016) 01-0008-06
S852.65

