碳源对StSte12基因调控玉米大斑病菌生长和分生孢子发育的影响
张运峰
(唐山师范学院 生命科学系,河北 唐山063000)
碳源对StSte12基因调控玉米大斑病菌生长和分生孢子发育的影响
张运峰
(唐山师范学院 生命科学系,河北 唐山063000)
以葡萄糖、蔗糖、乳糖和可溶性淀粉为碳源分别培养玉米大斑病菌野生型和StSte12基因RNAi阳性转化子,研究碳源对StSte12基因调控玉米大斑病菌菌丝生长和分生孢子发育的影响,为阐明StSte12基因的功能和病菌的致病机制奠定基础。结果表明,StSte12基因对玉米大斑病菌菌丝生长和分生孢子发育均有重要的调控作用,StSte12基因的表达量下降后,菌丝的生长势变弱,颜色变浅,生长速度显著下降,产孢量显著降低。4种供试碳源中,可溶性淀粉对StSte12基因调控菌丝生长和发育的影响最大,蔗糖最小;乳糖对StSte12基因调控分生孢子发育没有显著影响,而其他3种碳源的影响均达到显著水平。
玉米大斑病菌;StSte12基因; 碳源; 菌丝生长; 分生孢子发育
玉米大斑病是由玉米大斑病菌(Setosphaeriaturcica)引起的玉米叶部病害,主要发生在气候冷凉湿润的地区,在严重流行年份减产可达50%以上[1]。StSte12基因(S.turcicaSte12)属于Ste12-like基因,与酿酒酵母(Saccharomycescerevisiae)、稻瘟病菌(Magnaporthegrisea)等真菌的Ste12-like基因有较高的同源性,其转录蛋白StSte12是Fus3/Kss1-homolog途径(又称Pathogenicity MAPK cascad)的主要转录因子,具有典型转录因子所特有的STE homeodomain 和ZnF_C2H2锌指结构;将StSte12基因在酿酒酵母ste12缺失突变体中表达时能够恢复该酵母突变细胞缺失的生理特征[2]。近期的研究表明,StSte12基因在玉米大斑病菌中调控附着胞发育,是病菌致病力形成的关键因子之一[3]。但StSte12基因对玉米大斑病菌生长和孢子发育的调控作用,以及该调控作用是否受不同碳源的影响尚不明确。本研究拟以玉米大斑病菌StSte12基因的RNAi(RNA interference)阳性转化子及其野生型菌株为试验材料,分析蔗糖、葡萄糖、可溶性淀粉和乳糖4种碳源对菌丝生长、菌落形态和分生孢子发育的影响,阐明碳源对StSte12基因功能的影响,分析影响StSte12基因功能的可能营养物质及其代谢途径,为深入研究玉米大斑病菌StSte12转录因子的调控机制奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株 玉米大斑病菌野生型菌株01-23(WT)和StSte12 RNAi阳性转化子(StRNAi 3-6和StRNAi 9-10),由河北农业大学真菌毒素与植物分子病理学实验室保存。StRNAi 3-6和StRNAi 9-10的StSte12基因表达量分别为野生型菌株的38%和67%[2]。
1.1.2 基础培养基 配方:土豆200 g、葡萄糖 20 g、琼脂15 g、去离子水1 000 mL。
1.1.3 化学试剂 葡萄糖、蔗糖、可溶性淀粉、乳糖等化学试剂均为国产化学纯。
1.2 试验设计
分别用等量的供试碳源代替基础培养基中的葡萄糖,研究不同碳源对玉米大斑病菌野生型菌株及StSte12 RNAi阳性转化子(StRNAi)菌丝生长和孢子发育的影响,每个处理重复8次。供试培养基碳源为:葡糖糖、蔗糖、可溶性淀粉和乳糖。
1.3 试验方法
将在PDA平板培养基上25 ℃条件下生长7 d的试验菌株菌盘(直径8 mm)接种于不同碳源培养基平板(直径90 mm)的中心,25 ℃恒温、黑暗条件下培养8 d,每天测量菌落直径,以培养时间为横坐标、菌落直径为纵坐标绘制菌丝生长曲线,计算菌丝生长速率,菌丝生长速率(mm/d)=菌落直径(mm)/培养时间(d),取第4~8天菌丝生长速率的平均值作为各处理的平均菌丝生长速率(V);以WT为对照,计算StSte12 RNAi阳性转化子的菌丝生长抑制率(I),I=(VWT-VStRNAi)/VWT×100%。观察并记录菌落形态和菌丝特征。收集培养8 d时的菌丝和分生孢子,显微观察菌丝和孢子形态,利用血球计数板统计分生孢子数量。
1.4 数据分析
采用Excel 2013、SPSS统计软件对试验数据进行系统处理与分析。
2 结果与分析
2.1 碳源对StSte12基因调控玉米大斑病菌菌丝生长速度的影响
由图1可以看出,野生型菌株和StSte12 RNAi阳性转化子在4种碳源培养基上均能生长,并且在8 d的培养时间内,一定程度上菌落直径随培养时间呈线性增加(R2>0.99),在4种碳源培养基上StSte12 RNAi阳性转化子的生长速度均低于野生型菌株01-23(图1)。以野生型菌株为对照,计算StSte12 RNAi阳性转化子的菌丝生长抑制率(图2),结果发现,StSte12 RNAi阳性转化子StRNAi 3-6的菌丝生长受抑制程度显著高于StSte12 RNAi阳性转化子StRNAi 9-10(P<0.05),并且抑制程度受到碳源种类的显著影响。可溶性淀粉对转化子StRNAi 3-6的抑制率(31.4%)显著高于其他3种碳源(平均26.5%),而葡萄糖、乳糖和可溶性淀粉等3种碳源对转化子StRNAi 9-10的抑制率(平均14.1%)极显著高于蔗糖(1.5%)。以蔗糖为碳源时,StRNAi 9-10的菌丝生长速率与野生型菌株01-23没有显著差异(P>0.05)。以上试验结果表明,StSte12基因的表达水平与菌丝生长速率有关,即StSte12基因调控着玉米大斑病菌菌丝的生长,但其调控作用受环境中的碳源种类影响,对于StSte12基因表达水平较低的转化子StRNAi 3-6,不同碳源之间的影响差异显著,而对于StSte12基因表达水平较高的转化子StRNAi 9-10,不同碳源之间的影响差异极显著。4种碳源中,总体上可溶性淀粉的影响最强,蔗糖的影响最弱。
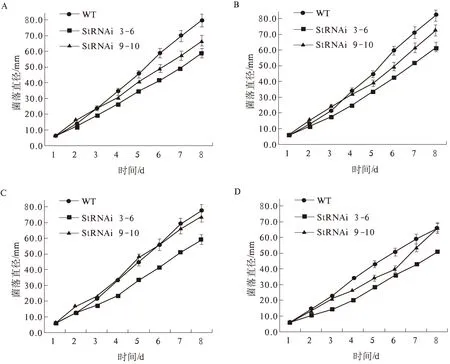
A.葡萄糖; B.乳糖; C.蔗糖; D.可溶性淀粉图1 玉米大斑病菌野生型菌株和StSte12 RNAi阳性转化子的菌落生长曲线
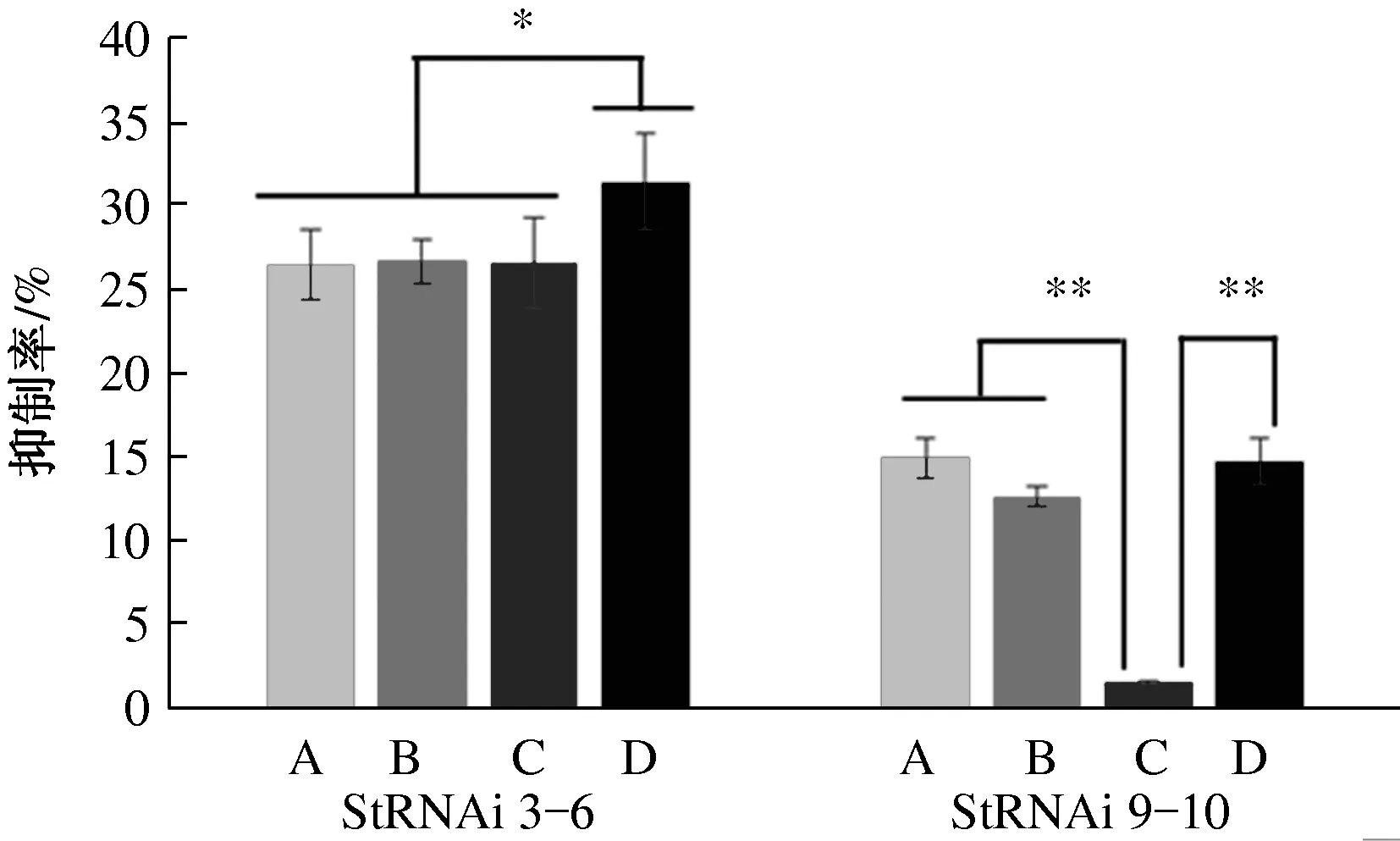
A.葡萄糖, B.乳糖, C.蔗糖, D.可溶性淀粉;*表示P < 0.05,**表示P < 0.01图2 碳源对StSte12基因调控玉米大斑病菌菌丝生长速度的影响
2.2 碳源对StSte12基因调控玉米大斑病菌菌落形态的影响
StSte12 RNAi阳性转化子StRNAi 3-6的菌落形态与野生型菌株显著不同,菌落颜色变浅,气生菌丝减少,菌落平伏,菌丝生长势减弱,在4种碳源培养基上的菌落形态基本一致,受碳源种类的影响较小;StSte12 RNAi阳性转化子StRNAi 9-10的菌落形态与野生型菌株基本一致,但菌落颜色受碳源种类的影响非常显著,白色菌丝体的面积按葡萄糖、蔗糖、乳糖、可溶性淀粉的顺序逐渐扩大(图3)。以上试验结果表明,StSte12对玉米大斑病菌的菌丝颜色、长势和气生菌丝数量有一定的调控作用,尤其对菌丝颜色的调控最明显,随着StSte12基因表达量的降低,菌丝颜色变浅,推测StSte12基因可能与菌丝的黑色素合成有关,StSte12基因表达量的降低会抑制菌丝黑色素的合成。StSte12基因表达量减少约1/3时对菌丝颜色的调控作用受碳源种类影响显著,按葡萄糖、蔗糖、乳糖和可溶性淀粉的顺序对黑色素合成的抑制作用逐渐增强,但当StSte12基因表达量减少约2/3时对菌丝颜色的调控作用受碳源种类的影响较小。
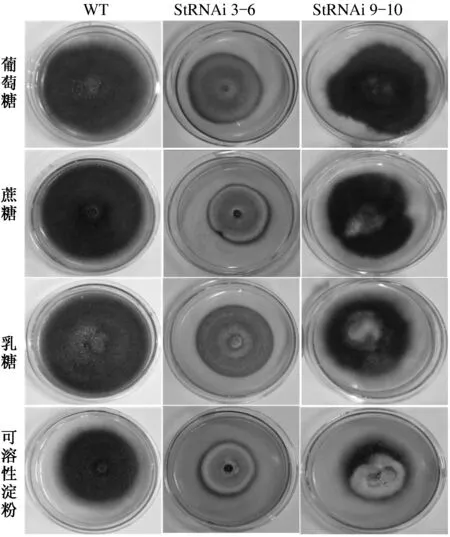
图3 碳源对StSte12基因调控玉米大斑病菌菌落形态的影响
2.3 碳源对StSte12基因调控玉米大斑病菌产孢量的影响
碳源种类对玉米大斑病菌分生孢子的产生有显著影响。对于野生型菌株来说,葡萄糖和可溶性淀粉培养基上的产孢量最高,其次为蔗糖培养基,产孢量仅为葡萄糖培养基的51%,乳糖培养基的产孢量最低,仅为葡萄糖培养基的14%(图4)。碳源对StSte12基因RNAi阳性转化子StRNAi 9-10产孢量的影响与对野生型菌株基本一致,但是,除了乳糖培养基以外,StRNAi 9-10的产孢量均较野生型菌株
显著下降,葡萄糖培养基上下降了66%,蔗糖培养基上下降了47%,可溶性淀粉培养基上下降了67%。StSte12基因RNAi阳性转化子StRNAi 3-6在4种碳源培养基上几乎都不产生分生孢子(图4)。试验结果表明,StSte12基因对玉米大斑病菌分生孢子的发育有重要的调控作用,StSte12基因的表达量下降时,产孢量显著减少。除了乳糖以外,葡萄糖、蔗糖和可溶性淀粉对StSte12基因调控产孢量的影响均达显著水平。
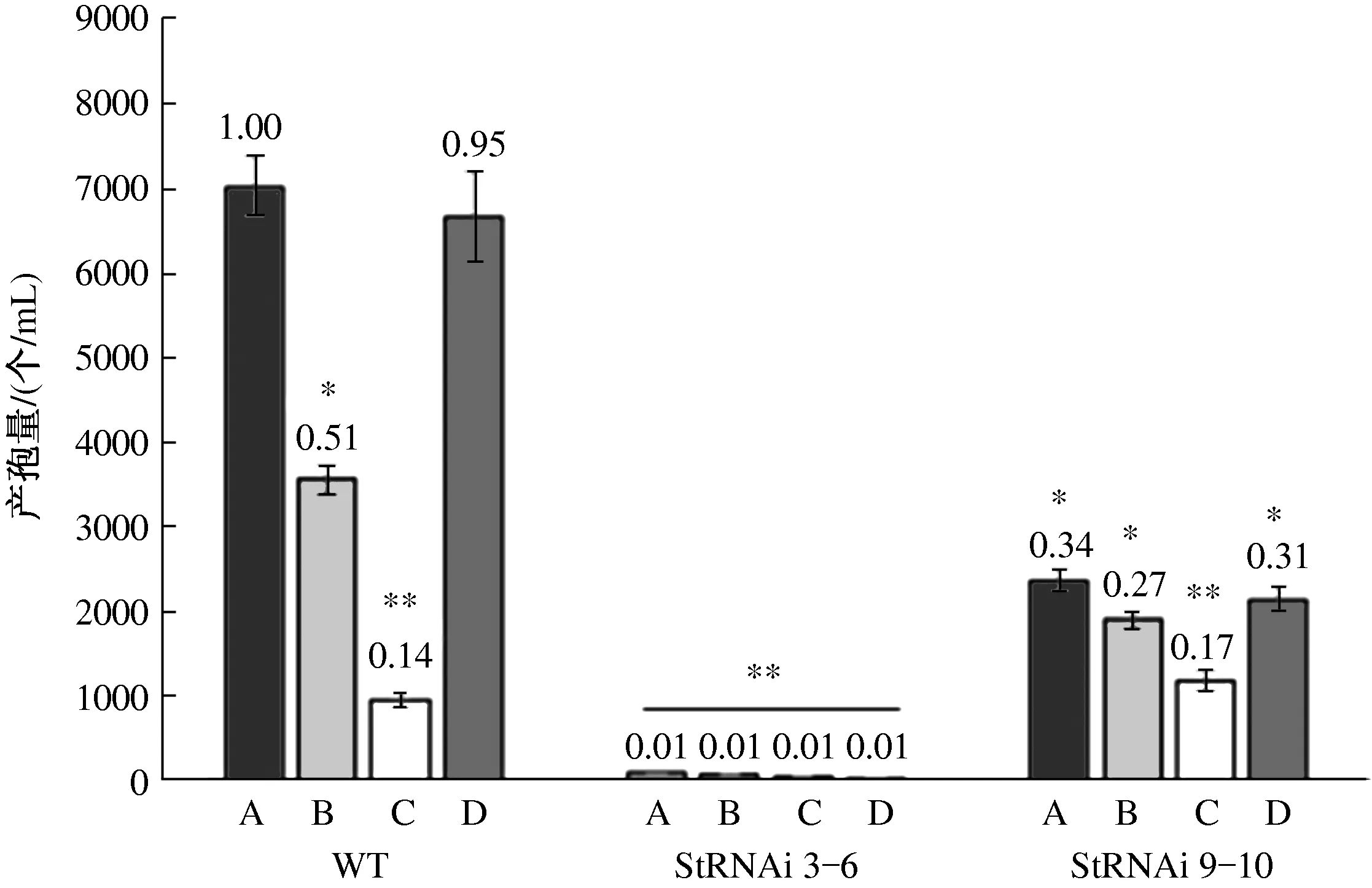
A.葡萄糖, B.蔗糖, C.乳糖, D.可溶性淀粉; 图中数字为各处理与WT在葡萄糖培养基上产孢量的比值;*表示P<0.05,**表示P<0.01
2.4 碳源对StSte12基因调控玉米大斑病菌菌丝和分生孢子形态的影响
显微观察3种供试菌株在4种碳源培养基上的菌丝和分生孢子形态,结果表明,StSte12基因RNAi阳性转化子StRNAi 9-10与野生型菌株的分生孢子形态和菌丝形态在4种供试碳源培养基上基本一致。与其他2个供试菌株相比,StRNAi 3-6的菌丝纤弱,分节小甚至无分节,颜色较浅,在葡萄糖、蔗糖和乳糖培养基上的表现基本一致,但在可溶性淀粉培养基上,菌丝颜色更浅,更纤细,生长势更弱(图5)。试验结果表明,StSte12基因对玉米大斑病菌菌丝长势和颜色有一定的调控作用,可溶性淀粉对该调控作用有一定的影响,此试验结果与2.1和2.2的结果一致。
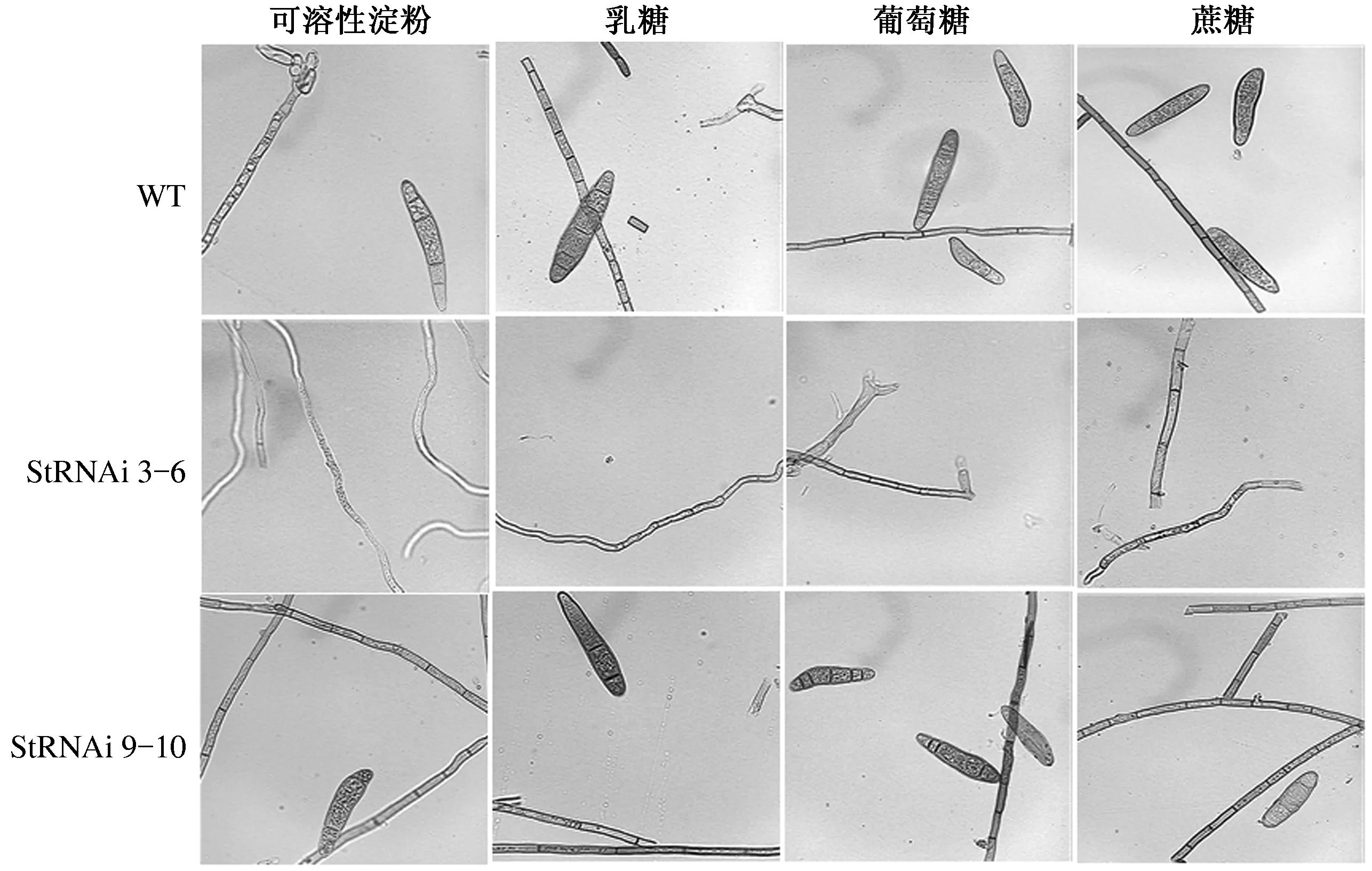
图5 碳源对StSte12基因调控玉米大斑病菌菌丝和分生孢子形态的影响
3 结论与讨论
Ste12基因最早是在酿酒酵母中发现的,其是丝裂原活化蛋白激酶(MAPK)途径下游的一个关键调控因子[4],主要功能是调控酵母细胞的交配反应、假菌丝发育及侵入生长[5]。Madhani等[6]已经证实,Ste12基因也存在于丝状真菌以及人类和植物的一些病原菌中。周端咏等[7]研究表明,香蕉枯萎病菌Ste12基因在病原菌侵染寄主的过程中起主要作用。在黄瓜炭疽病菌[8]、西瓜炭疽病菌[9]和番茄枯萎病菌[10]中,缺失Ste12基因的菌株毒力显著下降,这表明Ste12基因在病菌侵染植株的过程中发挥重要作用。
张长志等[11]发现,玉米大斑病菌Ste12同源蛋白StSte12具有Ste12-like所特有的DNA结合结构域和空间结构,该蛋白在附着胞发育中发挥重要功能。本试验研究了StSte12基因对玉米大斑病菌菌丝和分生孢子发育的调控作用,结果表明,StSte12基因对菌丝生长和分生孢子发育均有重要的调控作用,该基因的表达量下降后,菌丝的生长势变弱,颜色变浅,生长速度下降,产孢量显著降低。目前,有多篇关于Ste12-like基因调控病原真菌菌丝发育的报道,如白色念珠菌(Candidaalbicans)Ste12的下游靶基因CHS7缺失突变体的菌丝异常弯曲,在培养基表面不能辐射状生长[12];轮枝镰孢菌(Fusariumverticillioides)Ste12的下游靶基因CHS5缺失突变体的菌丝细胞膨大,对抗真菌药物Nikkomycin Z敏感,病菌的致病性降低[13];稻瘟病菌和尖孢镰刀菌(Fusariumoxysporum)的Ste12-like功能缺失突变体因不能产生正常的侵染性菌丝而导致致病性丧失或下降[8,14]。这些研究结果均表明,Ste12基因对菌丝发育的调控作用与病菌的致病性显著相关。
碳源是真菌合成碳水化合物和氨基酸骨架的主要来源,同时也是植物病原真菌生长发育的重要营养来源之一。本试验研究了碳源对StSte12基因调控玉米大斑病菌菌丝和分生孢子发育的影响,结果表明,在4种供试碳源中,可溶性淀粉对StSte12基因调控菌丝生长和发育的影响最大,而乳糖对StSte12基因调控分生孢子发育的影响最小。其可能的原因是:可溶性淀粉属于多糖,病菌需要将其降解为寡糖或单糖才能吸收利用,在同等质量条件下,多糖的吸收利用比单糖和双糖需要消耗更多的能量,需要更长的时间,因此不利于病菌的营养生长,即菌丝的生长发育;乳糖本身就不利于玉米大斑病菌分生孢子的产生,野生型菌株在乳糖培养基上的产孢量很少,即乳糖对玉米大斑病菌分生孢子产生有一定的抑制作用,这种抑制作用可能抵消了StSte12基因对分生孢子产生的调控作用。
[1] 赵辉,高增贵,张小飞,等.我国玉米大斑病菌生理小种种群动态分析[J].沈阳农业大学学报,2008, 39(5):551-555.
[2] 吴敏,谷守芹,李坡,等.玉米大斑病菌转录因子StSte12的活性及其对酵母生长的功能互补分析[J].中国农业科学,2012,45(16):3281-3287.
[3] Gu S Q,Li P,Wu M,etal.StSTE12 is required for the pathogenicity ofSetosphaeriaturcicaby regulating appressorium development and penetration[J].Microbiological Research,2014,169(11): 817-823.
[4] Zhao X,Mehrabi R,Xu J R.Mitogen activated protein kinase pathways and fungal pathogenesis[J].Eukaryot Cell,2007,6:1701-1714.
[5] Errede B,Ammerer G.STE12,a protein involved in cell-type-specific transcription and signal transduction in yeast, is part of protein-DNA complexes[J]. Genes and Development,1989,3:1349-1361.
[6] Madhani H D,Fink G R.Combinatorial control required for the specificity of yeast MAPK signaling [J]. Science, 1997,275:1314-1317.
[7] 周端咏,刘一贤,谢德啸,等.香蕉枯萎病菌Ste12 基因的克隆与序列分析[J].热带作物学报,2011,32(12):2298-2301.
[8] Park G,Xue C,Zheng L,etal.MST12 regulates infectious growth but not appressorium formation in the rice blast fungusMagnaporthegrisea[J].Molecular Plant-Microbe Interactions,2002,15:183-192.
[9] Hoi J W,Herbert C,Bacha N.Regulation and role of a STE12-like transcription factor from the plant pathogenColletotrichumlindemuthianum[J].Molecular Microbio-logy,2007,64:68-82.
[10] Tsuji G,Fujii S,Tsuge S.TheColletotrichumlagenariuSTE12-like geneCST1 is essential for appressorium penetration[J].Molecular Plant-Microbe Interactions,2003,16:315-325.
[11] 张长志,李坡,谷守芹,等.玉米大斑病菌转录因子StSte12的表达特性分析及其调控基因的筛选[J].中国农业科学,2013,46(8):1603-1609.
[12] Sanz M,Carrano L,Jiménez C,etal.Candidaalbicansstrains deficient in CHS7,a key regulator of chitin synthase Ⅲ, exhibit morphogenetic alterations and attenuated virulence[J].Microbiology,2005,151:2623-2636.
[13] Larson T M, Kendra D F, Busman M,etal.Fusariumverticillioideschitin synthases CHS5 and CHS7 are required for normal growth and pathogenicity [J]. Current Genetics,2011,57(3):177-189.
[14] Rispail N,Di Pietro A.FusariumoxysporumSte12 controls invasive growth and virulence downstream of the Fmk1 MAPK cascade [J]. Molecular Plant-Microbe Interactions,2009,22:830-839.
Effects of Carbon Sources on Regulation ofStSte12 to Mycelial Growth and Conidial Development ofSetosphaeriaturcica
ZHANG Yunfeng
(Department of Life Science,Tangshan Normal University,Tangshan 063000,China)
The wild type isolate andStSte12 RNAi positive transformants were cultured on media with glucose,lactose,sugar or soluble starch as carbon source,to analyze the effects of carbon sources on regulation ofStSte12 to mycelial growth and conidial development ofSetosphaeriaturcica,in order to clarify the function ofStSte12 and mechanisms of fungal pathogenicity.The results demonstrated thatStSte12 paid a key role in mycelial growth and conidial development ofS.turcica.With the decrease of gene expression ofStSte12, the mycelial growth ability was weakened, hypha color was lightened, mycelial growth speed was significantly attenuated and the conidial number was significantly decreased.The regulation ofStSte12 to mycelial growth was significantly affected by carbon sources, among which the effect of soluble starch was the strongest and the sugar was the weakest.Except lactose,the other three carbon sources had significantly effects on regulation ofStSte12 to conidial development ofS.turcica.
Setosphaeriaturcica;StSte12 gene; carbon sources; mycelial growth; conidial development
2015-06-12
国家自然科学基金项目(31271997);河北省自然科学基金项目(C2014105067);唐山师范学院团队建设基金项目(2014E04)
张运峰(1982-),男,河北石家庄人,讲师,主要从事植物病理学研究。E-mail:yunfengzhang1982@126.com
S435.131
A
1004-3268(2016)01-0071-05

