大蒜素对番茄叶霉菌不同生理小种的抑制作用
薛东齐,许向阳,姜景彬,王窦逗,李景富*
(1.东北农业大学 园艺学院,黑龙江 哈尔滨 150030; 2.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030)
大蒜素对番茄叶霉菌不同生理小种的抑制作用
薛东齐1,许向阳1,姜景彬1,王窦逗2,李景富1*
(1.东北农业大学 园艺学院,黑龙江 哈尔滨 150030; 2.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030)
研究大蒜素对番茄生产上叶霉菌主流生理小种1.2.3.4以及2014年新发现生理小种2.5、2.4.5和1.2.3.4.9的抑制作用,为开发安全、高效的植物源农药奠定基础。首先制备大蒜素抽提母液,采用定硫法对其中的大蒜素进行定量测定,发现当溶液中滴加4 mL浓硝酸、溶液pH值为2.0时能够更为准确地测得大蒜素的含量,试验测得大蒜素含量为0.52%。在此基础上,进行了大蒜素对4个叶霉菌生理小种菌丝生长、孢子萌发的抑制试验,离体叶片上的病害预防试验以及苗期药效试验。结果表明,当大蒜素剂量>25 μL/mL时,其对叶霉菌生理小种菌丝生长的抑制活性较高,其中对1.2.3.4的抑制率最高,对1.2.3.4.9的抑制率最低,对其他2个生理小种的抑制率差异不显著。当大蒜素剂量<7.5 μL/mL时,其对4个生理小种孢子萌发的抑制效应存在差异,其中对1.2.3.4.9的孢子萌发抑制率最低,对1.2.3.4的孢子萌发抑制率最高。当大蒜素剂量为125 μL/mL时,其对叶霉菌4个生理小种在离体叶片上的预防效果均超过95%。苗期药效试验表明,在相等剂量下,大蒜素对叶霉菌的防治效果高于多菌灵和甲基托布津,说明大蒜素是一种可以替代化学药剂防治叶霉病的有效抑菌物质。
番茄叶霉病; 生理小种; 大蒜素; 抑制率; 防治效果; 抑菌物质; 植物源农药
番茄是世界上的一种重要蔬菜作物,由番茄叶霉病菌[Cladosporiumfulvum(Cook) Ciferri]引起的番茄叶霉病是我国乃至世界番茄生产上的主要病害之一,其造成番茄严重减产、果实质量降低,甚至植株死亡[1]。C.fulvum具有生理小种多、分化速度快等特点,这增加了病害防治的难度。普通的化学药剂难以长期有效地防治叶霉病,控制该病暴发最有效的方法是培育抗病品种。目前,应用于抗病育种的抗病基因主要有Cf-5和Cf-9[2],但是这些基因已经被一些生理小种克服。因此,寻找一种防治叶霉病更为有效的方法迫在眉睫。
近些年,大蒜(AlliumsativumL.)提取物的生防功效得到较多研究。大蒜酶酶解蒜氨酸生成的大蒜素等18种含硫化合物是有效的抗癌[3]、抗肿瘤[4]、抗菌生物活性物质[5],已被广泛应用于人体和动物的抗菌治疗。大蒜素具有植物广谱抗菌素特性,大蒜粗提液对黄瓜枯萎病菌(Fusarumoxysporumsp.cucumerinumOwen)[6]、黄瓜黑星病菌(CladosporiumcucumerinumEll.et Arthur)[7]、白菜黑斑病菌[Alternariabrassicae(Berk.) Sace.][8]、辣椒疫霉病菌(PhytophthoracapsiciLeonian)[9]、番茄灰霉病菌(BotrytiscinereaPers.)[10]、番茄早疫病菌[Alternariasolani(Ellis er Martin) Jones et grout][11],以及一些土传病菌都具有明显的抑菌效果。为此,本试验利用大蒜素的抑菌特性,研究大蒜素对番茄生产上的叶霉菌主流生理小种1.2.3.4[12],以及对2014年东北农业大学园艺学院番茄课题组新发现的生理小种2.5[13]、2.4.5[13]和1.2.3.4.9[14]的抑制作用,为开发安全、高效的植物源农药奠定基础,也为番茄无公害生产提供安全保障。
1 材料和方法
1.1 供试材料
主要包括紫皮大蒜(市售),乙醚(分析纯),5%氯化钡溶液,0.1%甲基橙溶液,有效成分60%多菌灵可湿性粉剂(市售),有效成分70%甲基托布津可湿性粉剂(市售),番茄叶霉菌生理小种1.2.3.4、2.5、2.4.5、1.2.3.4.9(东北农业大学园艺学院番茄课题组保存),PDA培养基,番茄品种Money maker。
1.2 试验方法
1.2.1 大蒜素抽提母液制备 选取新鲜的大蒜鳞茎,准确称量120 g,用无菌水洗净后加石英砂置于研钵中研磨成浆,室温放置30 min,加100 mL无菌水浸提5 min后,加30 mL乙醚萃取大蒜素,重复萃取3次,将3次萃取得到的乙醚层合并,30 ℃水浴除去乙醚,得到大蒜素抽提母液。0.2 μm滤膜过滤,将大蒜素抽提母液定容至10 mL,置于4 ℃保存。
1.2.2 大蒜素含量测定 取2 mL的大蒜素抽提母液,采用定硫法测定抽提母液中的大蒜素含量[15-16]。
1.2.3 大蒜素抑菌活性测定
1.2.3.1 大蒜素对叶霉菌不同生理小种菌丝生长的抑制作用测定 采用生长速率法[17]进行抑菌试验,将灭菌后的PDA培养基冷却至40 ℃,加入适量的大蒜提取液,配制成含量分别为5、10、15、20、25、30、35、40 μL/mL的带药培养基平板。分别将叶霉菌生理小种1.2.3.4、1.2.3.4.9、2.4.5、2.5的菌饼(直径5 mm)置于冷却的带药PDA培养基平板中央,每皿1片,3次重复,以无菌水处理为对照。将培养皿置于25 ℃培养箱,黑暗条件下培养,3 d后采用十字交叉法测量菌落直径,计算抑制率。菌落直径(mm)=每处理菌落直径-5;抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.3.2 大蒜素对叶霉菌不同生理小种孢子萌发的抑制作用测定 采用悬滴法[18]测定大蒜素对叶霉菌孢子萌发的抑制作用。分别将叶霉菌不同生理小种在25 ℃下培养8~10 d,待其产孢,配制成106个/mL的孢悬液。将大蒜提取液配制成含量分别为1、2.5、5、7.5、10、12.5、15、20 μL/mL的溶液,然后与等体积的孢悬液充分混合,每处理重复3次,以无菌水处理为空白对照(CK)。于25 ℃黑暗条件下培养8 h,40倍物镜下镜检各处理孢子萌发情况,孢子芽管长度超过孢子直径的一半时视为萌发孢子[19],计算孢子萌发抑制率。孢子萌发抑制率=(对照孢子萌发数-处理孢子萌发数)/对照孢子萌发数×100%。
1.2.3.3 大蒜素在番茄离体叶片上的病害预防试验 挑取新鲜的4叶期Money maker番茄真叶,蒸馏水冲洗干净,晾干后置于含量分别为25、50、75、100、125 μL/mL的大蒜素溶液中,浸透3 min。将浸透过大蒜素的番茄叶片置于底部铺有湿滤纸的培养皿中,分别接种叶霉菌生理小种1.2.3.4、1.2.3.4.9、2.4.5、2.5的菌饼(直径5 mm),每叶1片,3次重复,以无菌水浸透为对照。将培养皿置于25 ℃、湿度为95%的培养箱中,黑暗条件下培养,待对照充分发病后,测量病斑直径,计算预防效果。预防效果=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。
1.2.3.4 大蒜素对叶霉菌的苗期药效试验 将叶霉菌不同生理小种在25 ℃下培养8~10 d,待其产孢,将孢子混合后,配制成106个/mL的孢悬液。喷雾接种4叶期的Money maker,每5株为一组,接种后保湿24 h,置于温度25 ℃、湿度95%的恒温恒湿培养室中,7 d后分别单独喷施含量为20、40、60、80、100、150、200 μL/mL的大蒜素溶液,以及质量浓度为100、200、300、400、500、800、1 000 μg/mL的多菌灵和甲基托布津溶液,以喷施蒸馏水为对照,每处理重复3次。待对照充分发病后,调查各处理每株的全部叶片,连续调查5 d(5次),采用分级计数法[20]计算防治效果。病情指数=(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)×100;防治效果=(对照区病情指数-处理区病情指数)/对照区病情指数×100%。
1.3 数据统计分析
调查所得数据采用SPSS 17.0进行差异显著性检验,柱状图由Origin 8.0和Excel 2007绘制,半最大效应浓度(EC50)由GraPhpad Software计算。
2 结果与分析
2.1 抽提母液中的大蒜素含量
采用定硫法对大蒜素进行定量测定,在测定过程中对氧化剂浓硝酸的添加量、溶液酸碱度进行摸索。由图1a可知,大蒜素含量随着浓硝酸用量的增加呈现先增后减的趋势,当滴加4~6 mL浓硝酸时,所测得的大蒜素含量处于较高水平,且在滴加4 mL浓硝酸时,大蒜素含量最高,为0.52%。由图1b可知,溶液的pH值变化也对大蒜素的测定结果影响较大,最佳溶液pH值为2.0;当pH值大于3.0时,由于溶液的酸度减小,致使弱碱性阳离子发生水解,从而导致测定结果降低。因此,本试验采用滴加4 mL浓硝酸,在溶液pH值为2.0的条件下进行大蒜素含量的测定,测得抽提母液中的大蒜素含量为0.52%。
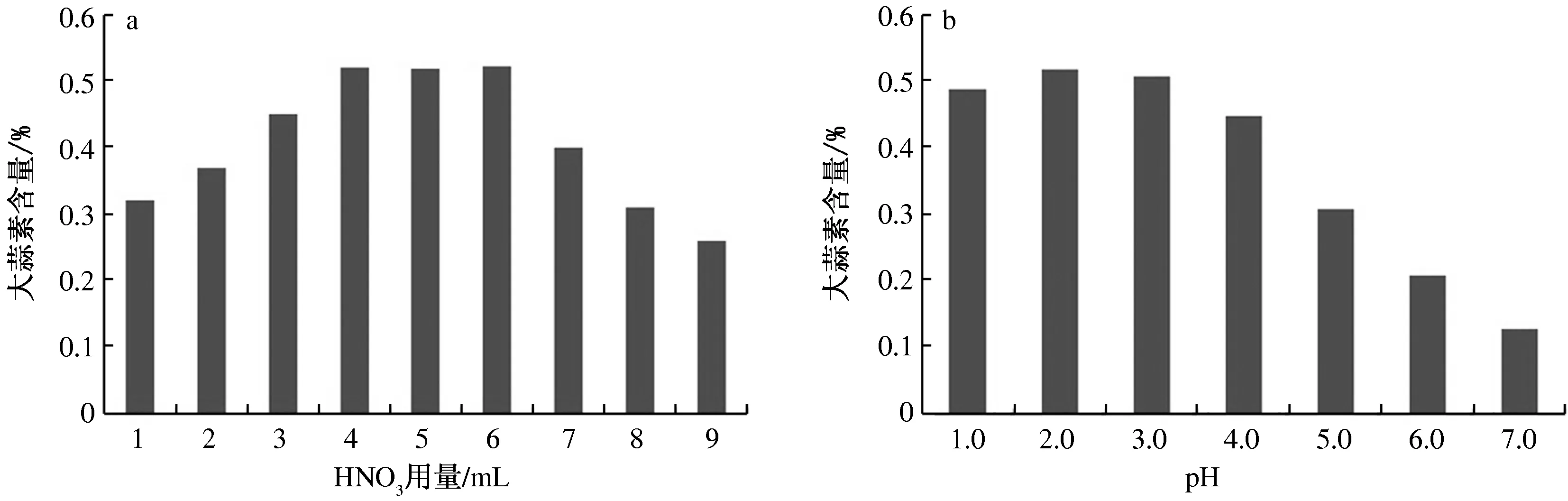
图1 氧化剂用量和溶液pH值对大蒜素测定结果的影响
2.2 大蒜素对叶霉菌不同生理小种菌丝生长的抑制作用
由表1可知,随着不同处理大蒜素剂量的提高,大蒜素对叶霉菌4个生理小种的抑制作用逐渐增强。当大蒜素剂量低于25 μL/mL(130 μg/mL)时,其对4个叶霉菌生理小种的抑制效果相对较差,抑制率低于75%;当大蒜素剂量为30 μL/mL(156 μg/mL)时,其对4个叶霉菌生理小种的平均抑制率为90%左右;当剂量达到35 μL/mL(182 μg/mL)时,抑制率大于95%,并与其他低剂量处理间存在显著差异,但与40 μL/mL(208 μg/mL)处理差异不显著,抑菌效果明显。由大蒜素对不同叶霉菌菌丝生长的抑制率可知,在大蒜素剂量一定时,其对4个叶霉菌生理小种的抑制率存在一定的差异性,且这种差异性在大蒜素剂量低于20 μL/mL(104 μg/mL)时表现更明显,而在高剂量时大蒜素对不同叶霉菌的抑制效果表现较高的一致性。总体来看,大蒜素对叶霉菌生理小种1.2.3.4抑制率最高,对其他3个生理小种的抑制率差异不显著,说明叶霉菌生理小种1.2.3.4的生理活性以及抗药性低于其他3个生理小种,从而也间接证实生理小种1.2.3.4.9、2.4.5、2.5可能是致病性更强的生理小种。

表1 大蒜素对叶霉菌不同生理小种菌丝生长的抑制效应
注:同列不同小写字母表示差异显著(P<0.05),表3同。
2.3 大蒜素对叶霉菌不同生理小种孢子萌发的抑制作用
利用不同剂量的大蒜素对叶霉菌4个生理小种的分生孢子进行萌发抑制试验,计算孢子萌发抑制率和大蒜素抑菌的EC50,结果见表2。从表2可以看出,4个生理小种的孢子萌发抑制率均随大蒜素剂量的增加而增大。在各处理剂量下,大蒜素对生理小种1.2.3.4.9的孢子萌发抑制率最低,对生理小种1.2.3.4的孢子萌发抑制率最高,其对4个叶霉菌生理小种的孢子萌发抑制率呈现出与表1结果一致的趋势。由EC50值可知,大蒜素对叶霉菌生理小种1.2.3.4.9的EC50最大,其后依次是2.4.5、2.5、1.2.3.4;生理小种2.4.5与2.5彼此间并无显著性差异,而生理小种1.2.3.4.9与1.2.3.4之间存在显著性差异,并分别与2.4.5、2.5存在显著性差异。
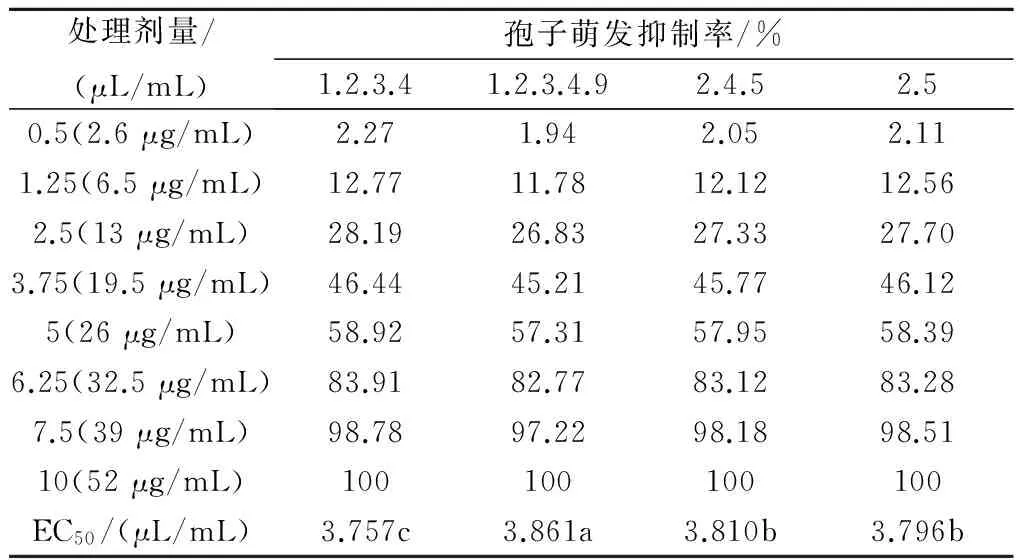
表2 大蒜素对叶霉菌不同生理小种孢子萌发的抑制效应
注:同行不同小写字母表示差异显著(P<0.05),表4同。
2.4 大蒜素对番茄离体叶片上叶霉病的预防效果
将4个叶霉菌生理小种菌饼接种于不同大蒜素剂量处理的Money maker叶片上3 d后,观察大蒜素对番茄离体叶片上叶霉病的预防作用。由图2可知,随着浸透叶片的大蒜素剂量的增高,叶霉菌在离体叶片上的病斑直径均表现出明显减小的趋势,且叶霉菌生理小种1.2.3.4.9的菌丝体长势强于1.2.3.4、2.4.5、2.5。

图2 大蒜素对番茄离体叶片上叶霉病的预防效果观察
由表3可知,当大蒜素剂量为75 μL/mL(390 μg/mL)时,其预防效果分别为83.62%(1.2.3.4)、72.25%(1.2.3.4.9)、77.18%(2.4.5)、73.81%(2.5),与对照具有显著差异;当大蒜素剂量为100 μL/mL
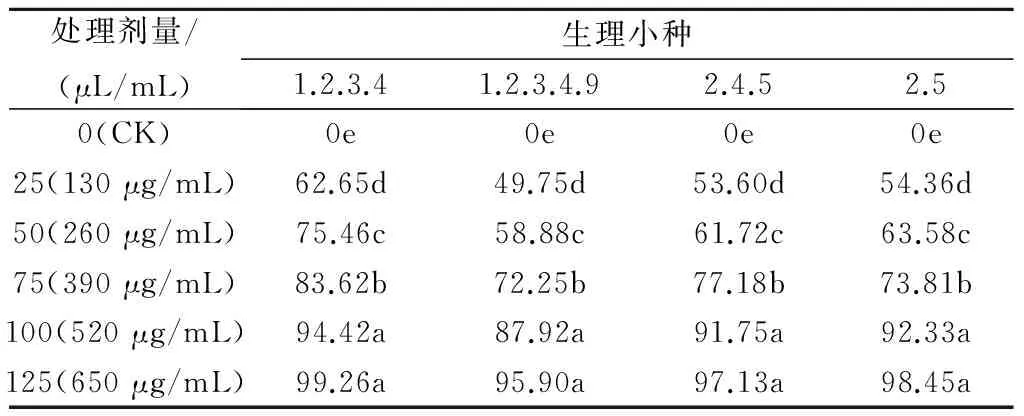
表3 大蒜素对番茄离体叶片上叶霉病的预防效果 %
(520 μg/mL)时,其对生理小种1.2.3.4、2.4.5、2.5的预防效果均达到90%以上,对1.2.3.4.9的预防效果为87.92%;当大蒜素剂量为125 μL/mL(650 μg/mL)时,其对4种叶霉菌生理小种的预防效果均超过95%。由此可见,低剂量的大蒜素处理番茄叶片后,对叶霉菌不同生理小种的预防效果存在差异性,而高剂量(≥100 μL/mL或520 μg/mL)的大蒜素处理后,对不同叶霉菌生理小种均起到较好的预防效果。
2.5 大蒜素对叶霉菌的苗期药效试验结果
对不同剂量梯度的大蒜素、多菌灵、甲基托布津分别进行叶霉菌药效试验,结果见表4。由表4可知,在近相等剂量下,大蒜素对叶霉病的防治效果高于多菌灵和甲基托布津;低剂量(<300 μg/mL)的药剂处理对叶霉病的防治效果不理想,但在剂量达到1 000 μg/mL后,三者对叶霉病的防治效果均超过95%。多菌灵与甲基托布津的EC50值相等,说明二者对叶霉病的防治效果相当。对3种药剂效果进行方差分析可知,在95%的置信度下,多菌灵与甲基托布津对叶霉病的防治效果没有显著差异,但两者均显著低于大蒜素的防治效果,说明大蒜素是一种可以替代化学药剂防治叶霉病的有效抑菌物质。

表4 大蒜素、多菌灵、甲基托布津对叶霉菌的苗期药效试验结果
3 结论与讨论
近几年,番茄叶霉病对番茄的安全生产造成了严重的危害,其生理小种分化强烈,目前番茄叶霉菌主流生理小种为1.2.3.4,生产上主要应用含叶霉菌抗性基因Cf-5、Cf-9的番茄品种来抵御该生理小种的侵染。但2014年本课题组首次在国内分离到番茄叶霉菌生理小种2.5、2.4.5和1.2.3.4.9,这3个生理小种能够攻克抗病基因Cf-5、Cf-9。如何有效地防治这3个叶霉菌生理小种成为急需解决的难题。目前大蒜素在蔬菜作物病害防治方面的作用已受到重视。研究表明,大蒜素能够抑制番茄早疫病菌、黄瓜枯萎病菌、番茄灰霉病菌、辣椒疫霉病菌的菌丝生长和孢子萌发,并对番茄早疫病菌和番茄灰霉病菌造成的田间病害起到防治作用[21]。因此,利用大蒜素这种安全无污染的抑菌物质防治叶霉菌成为本研究主要探讨的问题。
大蒜素(C6H10S2O)微溶于水,却极易溶于乙醚,它是蒜氨酸酶酶解蒜氨酸的产物,常温下极不稳定,易降解为阿霍烯、烯丙基次磺酸等硫氧化物。目前多采用有机溶剂萃取法提取大蒜素。宋卫国等[22]、尹晓东等[20]、刘莹[16]通过对乙醇、乙酸乙酯、乙醚等萃取剂的比较分析发现,乙醚能够最大量地萃取蒜泥中的大蒜素。与GC-MS、HPLC方法测定大蒜素含量相比,定硫法因其灵敏、简单、快捷也被广泛应用,但由于测定过程中氧化剂以及溶液酸度的不同,极易使测定结果产生较大差异[23]。本试验采用定硫法对大蒜素进行定量测定,通过对氧化剂用量、溶液酸碱度进行摸索,优化出定硫法测定大蒜素含量的最适条件,即在溶液中滴加4 mL浓硝酸、溶液pH值为2.0的条件下能够更为准确地测得其含量,试验测得抽提母液的大蒜素含量为0.52%。
通过测定大蒜素对叶霉菌生理小种1.2.3.4、1.2.3.4.9、2.4.5、2.5菌丝生长、孢子萌发的抑制效果,本研究首次报道了大蒜素对叶霉菌不同生理小种具有抑制作用,明确了大蒜素对4个叶霉菌生理小种抑制率的差异性,表现为1.2.3.4>2.5>2.4.5>1.2.3.4.9,说明叶霉菌生理小种1.2.3.4.9的生理活性以及抗药性强于其他3个生理小种,不同叶霉菌生理小种间表现出的这种差异性可能与其所含有的无毒基因的差异性有关[24]。低剂量的大蒜素处理离体番茄叶片,对叶霉菌不同生理小种的预防效果具有差异性,这可能是由于不同生理小种对大蒜素剂量的忍耐范围不同引起的;而高剂量的大蒜素处理离体番茄叶片,对叶霉菌的预防效果表现基本一致,这与尉婷婷等[19]、程智慧等[6]对大蒜素抑菌作用研究的结果相同。苗期药效试验表明,多菌灵、甲基托布津对叶霉病的防治效果均低于大蒜素,说明大蒜素是一种可以替代化学药剂防治叶霉病的有效抑菌物质,本研究为开发高效、安全的植物源农药奠定了基础,也为番茄无公害安全生产提供了保障。
[1] Veloukas T,Bardas G A,Karaoglanidis G S,etal.Ma-nagement of tomato leaf mould caused byCladosporiumfulvumwith trifloxystrobin[J].Crop Protection,2007,26:845-851.
[2] Kruijt M,Kip D J,Joosten M H,etal.TheCf-4 andCf-9 resistance genes againstCladosporiumfulvumare conserved in wild tomato species[J].Mol Plant Microbe Interact,2005,18:1011-1021.
[3] Kmowles L M,Milner J A.Diallyl disulfide induces ERK phosphorylation and alters gene expression profiles in human colon tumor cells[J].The Journal of Nutrition,2003,133(9):2901-2906.
[4] Chung J G,Lu H F,Yeh C C,etal.Inhibition of N-acetyltransferase activity and gene expression in human colon cancer cell lines by diallyl sulfide[J].Food and Chemical Toxicology,2004,42(2):195-202.
[5] Calvo-Gómez O,Morales-López J,López M G.Solid-phase microextraction-gas chromatographic-mass spectrometric analysis of garlic oil obtained by hydrodistillation[J].Journal of Chromatography A,2004,1036:91-93.
[6] 程智慧,宋莉,孟焕文.大蒜鳞茎粗提物对黄瓜枯萎病的抑菌作用和防病效果[J].西北农林科技大学学报(自然科学版),2008,36(5):113-118.
[7] 王云帆,王刚,杨生玉,等.大蒜提取物防治黄瓜黑星病的初步研究[J].西北农林科技大学学报(自然科学版),2005,33(10):7-10.
[8] 王刚,韩艳霞,王云帆.利用大蒜提取物防治白菜黑斑病研究[J].北方园艺,2006(6):159-160.
[9] 苏莉.大蒜(AlliumsativumL.)鳞茎粗提物对辣椒疫霉病抑制效应及其机理[D].杨凌:西北农林科技大学,2008.
[10] 耿建峰,黑田克利,田中一久.洋葱油和大蒜提取物对灰霉菌的作用效果[J].中国蔬菜,2008(5):20-22.
[11] 徐文静,郑陪和,杜茜,等.大蒜抑菌成分提取方法及抑菌活性的研究[J].吉林农业科学,2008,33(3):50-54.
[12] 李春霞,许向阳,康立功,等.2006—2007年东北三省番茄叶霉病菌生理小种变异的监测[J].中国蔬菜,2009(2):42-45.
[13] Li S,Zhao T T,Li H J,etal.First report of races 2.5 and 2.4.5 ofCladosporiumfulvum(syn.Passalorafulva),causal fungus of tomato leaf mold disease in China[J].Journal of General Plant Pathology,2015,81(2):162-165.
[14] 柴敏,于拴仓,丁云花,等.北京地区番茄叶霉病菌致病性分化新动态[J].华北农学报,2005,20(2):97-100.
[15] 马往校,段敏,孙新涛,等.定硫法测定大蒜中大蒜素含量及影响因素[J].天然产物研究与开发,2002,14(6):22-23.
[16] 刘莹.大蒜素测定方法研究[D].泰安:山东农业大学,2014.
[17] 孙桂琳,刘小平,王红丽,等.大蒜生理活性物质对几种植物病原真菌的体外抑菌活性[J].新疆农业科学,2008,45(6):1012-1016.
[18] 孙广宇,宗兆锋.植物病理学实验技术[M].北京:中国农业出版社,2002:58-60.
[19] 尉婷婷,程智慧,冯武焕.大蒜鳞茎粗提物对番茄灰霉病的抑菌和防治效果[J].西北农业学报,2010,19(6):176-180.
[20] 尹晓东,魏松红,刘冰,等.大蒜提取液对番茄两种真菌病害的抑制作用[J].沈阳农业大学学报,2008,39(1):89-91.
[21] Babu S,Seetharaman K.Fungitoxic properties of some plant extracts againstAlternarissolani,the tomato leaf blight pathogen [J].Journal of Ecotoxicology and Environmental Monitoring,2000,10(2):157-159.
[22] 宋卫国,李宝聚,石延霞,等.大蒜提取物抑制番茄灰霉菌活性测定[J].中国蔬菜,2005(8):21-22.
[23] 张坤玲,卜欣立,张玮.大蒜素测定方法的研究进展[J].石家庄职业技术学院学报,2010,22(6):51-53.
[24] 芦丽亚,杨宁,赵凌侠.番茄叶霉菌及番茄抗性基因分子生物学研究进展[J].园艺学报,2009,36(6):911-922.
Inhibition of Allicin on Different Races of Tomato Leaf Mold
XUE Dongqi1,XU Xiangyang1,JIANG Jingbin1,WANG Doudou2,LI Jingfu1*
(1.College of Horticulture,Northeast Agricultural University,Harbin 150030,China; 2.College of Life Science,Northeast Agricultural University,Harbin 150030,China)
This experiment studied the inhibition effect of allicin on the leaf mold mainstream physiological race in tomato production(1.2.3.4),and the newly discovered physiological races in 2014(2.5,2.4.5 and 1.2.3.4.9),to lay a foundation for the development of safe,effective botanical pesticides.At first,allicin extract was prepared and the allicin content was quantitatively determinated using sulphur test method.The result showed that when 4 mL of concentrated nitric acid was dropped and pH was 2.0,the content of allicin could be measured more accurately.In this study the allicin content was 0.52%.Based on this,we studied the inhibition effect on mycelial growth and spore germination,preventive effect on isolate leaves and control efficacy at seedling stage of allicin with the four races as control targets.The results showed that when the concentration of allicin was more than 25 μL/mL,its inhibition effect on mycelial growth was higher.The highest mycelium inhibition rate was determined on race 1.2.3.4,the lowest mycelium inhibition rate was on race 1.2.3.4.9,and the inhibition rate between the other two physiological races had no significant difference.When the allicin concentration was less than 7.5 μL/mL,its inhibition effects on spore germination showed difference among the four races,with the highest spore germination inhibition rate on race 1.2.3.4,and the lowest spore germination inhibition rate on race 1.2.3.4.9.When the concentration of allicin was 125 μL/mL,the preventive effects on the four races on isolate lea-ves were all more than 95%.Seedling efficacy trials showed that under the condition of equal concentration,the control efficacy of allicin was better than carbendazim and thiophanate-methyl on tomato leaf mold,indicating that allicin is an effective antimicrobial substance,and it can substitute for chemicals to control tomato leaf mold.
tomato leaf mold; race; allicin; inhibitory rate; control effect; antimicrobial substance; plant-derived pesticides
2015-07-08
“十二五”国家科技支撑计划项目(2012BAD02B02-7);国家自然科学基金项目(NSFC 31272171)
薛东齐(1987-),男,河南开封人,在读博士研究生,研究方向:番茄遗传育种。 E-mail:xuedongqi2009@hotmail.com
*通讯作者:李景富(1943-),男,黑龙江绥化人,教授,主要从事番茄遗传育种研究。E-mail:lijf_2005@126.com
S436.412.1
A
1004-3268(2016)02-0071-06

