硫属铜基诊疗试剂的研究进展
芮西川, 姚鑫斌, 安 璐, 田启威, 杨仕平
(上海师范大学 生命与环境科学学院,上海 200234)
硫属铜基诊疗试剂的研究进展
芮西川, 姚鑫斌, 安 璐, 田启威, 杨仕平
(上海师范大学 生命与环境科学学院,上海 200234)
基于近红外光热治疗的诊疗一体化技术是一种新兴的具有广阔应用前景的癌症治疗方法.它可以通过对肿瘤的可视化检测分析,进而实施个体差异化治疗.硫属铜基纳米材料具有强近红外吸收、高光热转换效率、廉价以及制备方法简单等诸多优点,因此基于该类材料的癌症诊疗一体化成为了近些年的研究热点.介绍了近年来硫属铜基纳米材料在癌症诊断、治疗以及一体化上的最新研究进展.
硫属铜基; 影像介导; 光热治疗; 诊疗一体化
0 引 言
恶性肿瘤是目前全世界人类疾病死亡的主要原因之一,已经成为严重危害人类生命健康、制约社会经济发展的一类重大疾病[1].因此,对肿瘤的诊断和治疗,成为了当今国内外科学家广泛研究的课题.近红外光热治疗是一种将生物组织穿透能力强、破坏作用小的近红外光能量转换成热能,用高温局部杀死肿瘤细胞的微创治疗技术,与其他恶性肿瘤疗法相比具有非侵入性、副作用小等诸多优点,因此得到了快速发展[2].该技术目前仍然面临着诸多挑战,如肿瘤病灶的精确定位、早期诊断、实时监测以及提高治疗的有效性等[3].近红外光热诊疗一体化技术将近红外光热治疗技术和肿瘤诊断技术集成,可以很好解决这些问题[4].它既可以对肿瘤进行可视化检测,又可以动态评估肿瘤的光热治疗效果,从而实现针对肿瘤差异的个体化治疗,因此具有广阔的应用前景[5].而近红外光热诊疗试剂的开发则是该项技术发展的关键.
纳米诊疗试剂不仅具有特殊的稳定性,而且在生物体内循环时间较长,有利于其对肿瘤的靶向效果和长时间对肿瘤进行实时监测,是目前发展前景较好的诊疗试剂[4].目前研究比较广泛的近红外光热诊疗试剂主要有四类:1)碳材料近红外光热诊疗试剂,如石墨烯、碳纳米管近红外光热诊疗试剂等,美国加利福尼亚大学的Dai和苏州大学刘庄[6]开发了多种基于碳材料的近红外光热诊疗试剂,具有非常好的诊断治疗效果;2)贵金属近红外光热诊疗试剂,如金、钯等,基于金的纳米囊泡技术,美国国立卫生研究院的Chen[7]开发了多种金的近红外光热诊疗试剂;3)有机聚合物近红外光热诊疗试剂,如聚吡咯、聚苯胺等,基于聚吡咯纳米粒子,北京大学戴志飞课题组[8]开发了多种光热-CT、光热-光声等联用的诊疗试剂;4)金属化合物近红外光热诊疗试剂,如硫化铜、氧化钨等,美国德克萨斯大学的Li[9]和东华大学胡俊青[10]开发了多种超小的基于硫化铜的近红外光热诊疗试剂.
相对于其他类诊疗试剂,基于硫化铜纳米材料的诊疗试剂具有其独特的优势,1)硫化铜类诊疗试剂价格相对低廉、制备方法简单,很大程度降低了治疗费用;2)具有近红外吸收的硫化铜类纳米材料粒径可调,如2 nm的硫化铜纳米材料仍具有特别强的近红外吸收性质.这类材料具有更好的药代动力学、清除性质和更高的肿瘤组织积累[9];3)64Cu放射性核素的半衰期为12.7 h,易于整合到硫化铜纳米粒子中而无需引入金属螯合剂,基于成像的定量分析,这种[64Cu]硫化铜纳米粒子可以用于正电子发射计算机扫描正电子发射断层成像(PET)和定量组织分析,进而也能够应用于纳米粒子治疗的术前设计和术中监测[11].
在过去几年,关于硫化铜诊疗试剂应用于肿瘤的分子成像和治疗的技术被广泛研究[12],本文综述了硫属铜基纳米粒子作为一种诊疗试剂在生物医学应用方面的进展,特别是癌症的检测,如光声成像(PAI)、正电子发射断层成像(PET)和治疗,如光热治疗(PTT)和放射治疗(RT).另外,还讨论了硫属铜基诊疗试剂向临床转化所面临的挑战.
1 基于硫属铜基纳米材料的影像检测
作为分子生物学和成像科学的交叉学科,分子影像学能够在分子和细胞层次进行疾病和药物活性的非侵入式评估[13].以纳米粒子为基础的分子成像技术能够重现活体生物分布特性并且能够评估体内清除机理[14].这项技术可以帮助获取如纳米颗粒的特异性吸收、细胞吸收的速率、非均相肿瘤环境中材料的分布以及肿瘤靶点清除速率和路径等重要的信息.由于基于硫属铜基纳米材料的强近红外吸收性能以及64Cu的长半衰期,研究者正在探索如何将之作为一种潜在的造影剂用于PET和PAI[15].
1.1 PET
PET是将微量的正电子核素示踪剂注射到人体内,然后采用特殊的体外探测仪探测这些正电子核素在人体各脏器内的分布情况,是一种功能强大的成像方法.作为一种评估器官或者组织的靶向效率和药代动力学的方法,它能够提供一种可控的具有高灵敏性和定量可读性[16]的放射性核素追踪剂.Gambhir课题组[17]利用64Cu和其非放射性的自然状态natCu具有相同的化学性质这一特性,和放射性纳米粒子自由螯合剂这一概念,将64Cu直接掺杂到硫化铜纳米粒子矩阵中.与传统放射性标记技术利用的各种放射性金属螯合剂相比,自由螯合剂最明显的优势就是方法简单:不需要额外的合成步骤将放射性金属螯合剂共轭到纳米粒子上.这些螯合剂,连同放射性核素可能会在全身用药后脱离纳米粒子,影响数据的准确性.同时,引入放射性金属螯合剂可能会显著地改变纳米粒子的表面性质(如电荷,亲水性等),进而影响药代动力学和生物分布.

图1 (a)小鼠瘤内注射PEG-64Cu硫化铜纳米粒子(NPs);(b)在1,24,48 h后全身micro-PET/CT成像;(c)材料在体内的分布情况[18]
基于64Cu的长半衰期,美国德克萨斯大学的M.D.安德森癌症中心的李春课题组[18]合成了一系列包含64Cu的硫化铜纳米粒子,并以该纳米粒子为PET造影剂,研究了其在肿瘤检测以及生物代谢上的应用.例如,将64CuCl2加入普通硫化铜纳米材料的溶液中,简单地合成了聚乙二醇(PEG)包裹的含64Cu的硫化铜纳米粒子.通过调整64Cu /Cu在反应物中的比例,可以控制64Cu标记的硫化铜纳米粒子的特性.PEG包裹的64Cu标记的硫化铜经瘤内注射到HTH83 ATC荷瘤小鼠体内后,肿瘤对其具有明显的吸收和截留,具有非常好的造影效果(图1).
硫属铜基纳米材料作为一种治疗试剂,其潜在的安全问题一直是该类材料临床转化急需克服的问题.64Cu作为一种良好的PET造影剂可以很好地追踪该类纳米材料的代谢问题,从而为该类材料的临床应用提供有效的数据支撑.为研究硫化铜的粒径对材料代谢的影响,李春教授课题组[9]开发了一类约5 nm的聚乙烯吡咯烷酮(PVP)包覆的硫化铜纳米点.然后将5.6 nm和19 nm硫化铜纳米材料进行64Cu标记,利用PET手段研究其代谢情况,如图2所示,该类材料具有非常好的造影效果.5.6 nm的64Cu硫化铜纳米点,具有更快的系统清除率,与19 nm硫化铜相比具有更短的终端半衰期.这些数据说明64Cu标记的硫化铜纳米点能够从单核吞噬细胞系统内高效清除.

图2 (a) 19 nm硫化铜NPs和(b)5.6 nm硫化铜NPs的PET/CT图[9]
因此,64Cu标记的硫化铜具有非常好的PET造影效果,是一类良好的PET造影剂.同时,该类材料还具有半衰期长、制备简单、廉价等优点,在癌症检测以及相关的检测方面具有广阔的应用前景[19].
1.2 PAI

图3 硫化铜-铁蛋白纳米笼的合成及其光声成像[23]
PAI是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法.当脉冲激光照射到造影剂后,在造影剂的光吸收域将产生超声信号,这种由光激发产生的超声信号称为光声信号.PAI结合了纯光学组织成像中高选择特性和纯超声组织成像中深穿透特性的优点,可得到高分辨率和高对比度的组织图像,从原理上避开了光散射的影响,突破了高分辨率光学成像深度“软极限”(-1 mm),可实现50 mm的深层活体内组织成像[20].由于生物体内生色团的存在,PAI能够直接得到生物组织的成像.因此,为了提高癌症检测的灵敏度和分辨率,需要引入具有增强光声信号的外源造影剂.生物组织在近红外区域具有相对低的吸收系数和低的散射系数,因此该类造影剂在生物领域具有非常好的应用前景[21].
硫化铜纳米材料具有非常强的近红外吸收性能,因此是一类良好的PAI造影剂.由于其在1 064 nm波长处的强吸收,可以使用1 064 nm掺钕的钇铝石榴石作为PAI的光源.而掺钕的钇铝石榴石在1 064 nm激发下具有纳秒级脉冲宽度的高脉冲能力,可转换成一种更强的光声信号,具有更大的信噪比以及更大的视场[22].2016年,深圳大学黄鹏课题组[23]以铁蛋白为模板剂开发了一种硫化铜-铁蛋白纳米笼光声试剂(图 3).相比于普通的硫化铜纳米材料,该材料不仅具有非常好的生物兼容性,而且能使光声信号显著增强,具有良好的造影效果.另外,Yang等[24]报道了一种基于硫化铜的酶激活的PAI造影剂.首先,通过间质金属蛋白酶裂解肽将吸收红光的BHQ3和具有近红外吸收的硫化铜纳米粒子偶联,此时该类材料的光声信号被BHQ3猝灭.当该类材料富集在肿瘤时,间质金属蛋白酶将连接肽裂解,硫化铜和BHQ3分离,此时硫化铜的光声信号被还原,使得肿瘤部位光声信号显著增强.
2 基于硫属铜基纳米材料的癌症治疗
2.1 光热治疗
图4 光热治疗技术示意图[25]
光热治疗技术是一种重要的微创治疗技术,与其他疗法相比具有非侵入性、副作用小等优点,因此,近红外光热治疗技术近年来得到了极大的发展.该技术是利用光热转换试剂,将激光的光能转换成热能,实现局部高温,从而杀死癌细胞,如图4所示.波长为700~1 400 nm的近红外激光,对生物组织的穿透能力非常强,在穿透过程中光吸收衰减很小,在光热治疗上得到了广泛应用[25].开发高效的、生物兼容性强、具有靶向性的近红外光热转换试剂是使用近红外光热治疗的一个先决条件.

图5 硫化铜超结构及其光热治疗效果[27]
2016年,具有强近红外吸收性能的硫化铜,作为光热治疗试剂被广泛研究[26].为了改善光热转换效率,采取了两种策略去修改和优化硫化铜纳米粒子的物理、化学性质.第一种方法是探讨纳米粒子的成分、大小、形状对光吸收性质以及光热转换效率的影响.如本课题组开发了两类具有增强光热性能的硫化铜光热治疗试剂,一种是硫化铜超级结构材料,利用其散射激光的能力,增强了它对近红外激光的吸收,从而增强近红外光热转换效果.这种硫化铜超级结构在980 nm激光激发下光热转换效率比相应的硫化铜六方纳米片要高50%(图5)[27];另一种是利用局域表面等离子共振原理,通过改变硫化铜的组成,可以显著提高自掺杂非定量比硫化铜的近红外吸收,从而大大提高其光热转换性能.基于此开发了一种光热转换效率达到25.7%的Cu9S5纳米晶体.这两类材料在肿瘤治疗上具有非常好的杀伤效果.
第二种方法是引入不同的表面涂层材料控制硫化铜的粒径、生物相容性和光学性质.除了柠檬酸和PEG,硫化铜纳米粒子还能够引入半胱氨酸[28]、带有磷脂的PEG[29]和牛血清白蛋白(BSA)[30]以改善生物相容性.还可以通过PVP等表面活性剂控制硫化铜纳米粒径,制备超小的硫化铜纳米点,提高其代谢,降低生物毒性[9].通过在硫化铜表面偶联靶向抗体,增强光热治疗材料对肿瘤的特异性识别,增强肿瘤的治疗效果[31].
2.2 放射治疗
肿瘤放射治疗是利用放射线治疗肿瘤的一种局部治疗方法.放射线包括放射性同位素产生的α、β、γ射线和各类X射线治疗机或加速器产生的X射线、电子线、质子束及其他粒子束等.64Cu因为具有一个中等半衰期(12.7 h)和通过β发射的衰减而被用于放射治疗(Radiation Therapy)[18].李春课题组[12]以人类Hth83 ATC原位癌为模型,研究了PEG-64Cu -硫化铜纳米粒子的放射治疗在肿瘤治疗上的应用(图6).结果表明该类材料的放射治疗能能够显著延长带有该肿瘤的裸鼠的存活时间,并且没有急性毒副作用.
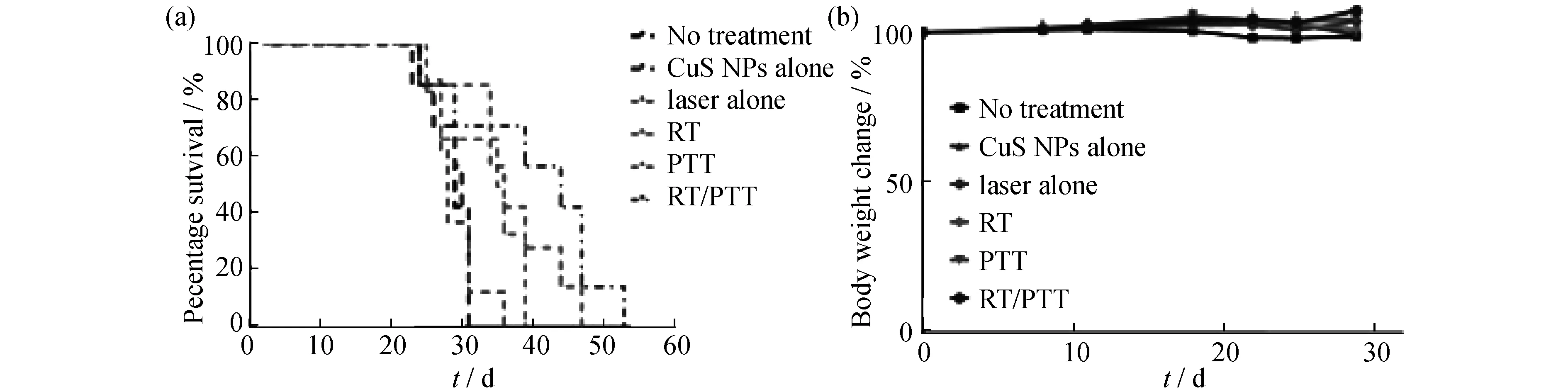
图6 不同治疗手段下小鼠的存活率以及经不同治疗后的体重变化[12]
3 基于硫属铜基纳米材料的癌症诊疗
目前研究比较多的硫化铜类光热诊疗一体化的试剂主要是基于非侵入式成像模式,如PET[32]、磁共振成像(MRI)[33]、PAI[34]、荧光[35]等影像介导的光热治疗试剂.
3.1 PET介导的硫属铜基诊疗试剂
PEG-64Cu -硫化铜纳米粒子已经被用于多种肿瘤模型的PET介导的光热治疗(PTT).例如,在PET介导的PTT中,纳米粒子可以利用PET的定量能力,对富集到甲状腺癌和乳腺癌模型中的纳米粒子进行定量分析.通过PET影像追踪能力,可以发现随着时间推移,纳米粒子在肿瘤内逐渐富集.静脉注射24 h后,每克肿瘤组织大约可以富集6.5%的注射剂量.这些数据可以用来筛选合适的激光功率和治疗时间,对光热治疗具有非常好的指导作用[36].
3.2 PAI介导的硫属铜基诊疗试剂
由于硫化铜类纳米材料本身具有很强的近红外吸收能力,单一的硫化铜类纳米材料可以同时实现PAI和光热治疗.因此硫化铜纳米材料可以通过PAI介导的光热治疗独自实现诊疗的功能[34].
硫化铜近红外吸收性能不仅仅可以用于光热治疗,同时还可以用于PAI.陈华兵课题组[37]以牛血清白蛋白为模板剂,成功制备了超小的硫化铜纳米粒子,具有非常好的生物兼容性和很强的近红外吸收性能(图7).因此该蛋白质包覆的超小硫化铜可以同时实现PAI和光热治疗,具有非常好的应用前景.

图7 基于CuS-BSA的PAI介导的PTT[37]
3.3 MRI介导的硫属铜基诊疗试剂
MRI具有高组织分辨率、空间分辨率和无硬性伪迹、无放射损伤等优点,而且在不同对比剂的条件下,可同时测量血管和心脏的血流变化,临床应用广泛.MRI是利用原子核在磁场内共振所产生信号后经重建影像的一种成像技术.因此将MRI和光热治疗结合起来,可以实现MRI介导的光热治疗,提高诊断的分辨率,增强治疗效果,降低治疗副作用[38].

图8 基于超小的Fe3O4@Cu2-XS[39]
基于此,本课题组以超小的四氧化三铁为内核,通过逐层生长的方法,在四氧化铁外围包覆了一层硫化铜,制备了一类同时具有MRI影像功能和光热治疗功能的、超小的Fe3O4@Cu2-XS多功能纳米材料,可以同时实现MRI和PTT功能[39](图8).另外,Fu课题组[40],以牛血清白蛋白(BSA)为模板,一步制备了CuS/Gd2O3复合材料,该材料可以很大程度上提高材料的生物兼容性,实现MRI介导的PTT.
3.4 荧光介导的硫属铜基诊疗试剂
荧光成像技术是基于造影剂本身发光性质的成像手段.该技术具有无创伤性,可在不同时间点进行多次重复检测,快速扫描成像(<5 min),使实验动物整体成像,同一实验动物体内获得全部时间点的整体数据等特点,可用于实时监测光热治疗,降低光热治疗的副作用.上转换发光材料由于其激发光波段位于生物窗口,因此具有信噪比高,背景干扰少等优点,广泛用于小动物影像检测[41].
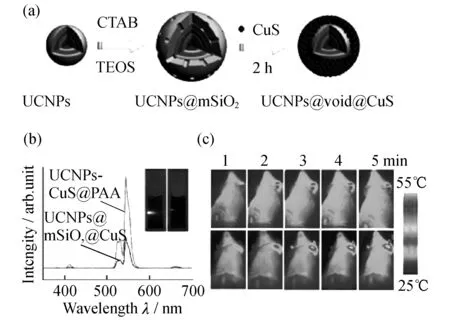
图9 基于UCNPs@CuS的荧光介导的光热治疗[35]
将上转换发光材料(UCNPs)和硫化铜类光热治疗试剂耦合,即可以实现荧光介导的光热治疗.Liu课题组[35]首先在UCNPs表面包覆一层非晶的二氧化硅层,然后再通过物理吸附的方式将预合成的超小的硫化铜富集在UCNPs表面,成功地制备了同时具有上转换发光性质和近红外吸收性能的UCNPs@CuS复合材料.该类材料不仅具有近红外荧光标记的功能,还具有光热治疗的作用,实现了荧光介导的光热治疗(图9).
4 总结和展望
围绕硫属铜的近红外性能,以基于硫属铜基纳米材料的光热治疗、放射治疗、PET检测、PAI检测以及影像介导的光热治疗为主题,讨论了硫属铜基诊疗试剂在癌症检测和治疗上的研究进展.相较于其他纳米材料,硫化铜纳米材料的研究尚处于初级阶段.在文献中,硫化铜纳米粒子应用到生物上的报道数量正在不断增加.由于其独特的物理化学性质,硫属铜基纳米材料也就成为了诊疗医学上的理想材料[42].
尽管体外体内实验都已经证实了硫属铜基纳米材料具有非常好的检测和治疗性能,但是要将之应用于生物体内,该类材料仍有很多问题需要克服,如材料的药代动力学,药效学以及长期的毒性.在临床应用转化方面,这部分工作显得尤其重要.到目前为止,硫属铜基纳米材料的毒性数据不仅是有限的,更是不完全的,即需要更多的体内实验以全面评估硫化铜的毒性.除此之外,还需要通过大量的对比试验,如体内药理学和长期毒性等,筛选出最优的实验条件,从而制备出最理想的诊疗试剂,即廉价、低毒、高效的硫属铜基诊疗试剂.
[1] Siegel R L,Miller K D,Jemal A.Cancer statistics [J].CA:A Cancer Journal for Clinicians,2015,65(1):5-29.
[2] Melamed J R,Edelstein R S,Day E S.Elucidating the fundamental mechanisms of cell death triggered by photothermal therapy [J].ACS Nano,2015,9(1):6-11.
[3] Cheng L,Wang C,Feng L Z,et al.Functional nanomaterials for phototherapies of cancer [J].Chemical Reviews,2014,114(21):10869-10939.
[4] Lim E K,Kim T,Paik S,et al.Nanomaterials for theranostics:recent advances and future challenges [J].Chemical Reviews,2015,115(1):327-394.
[5] Nguyen K T,Zhao Y L.Engineered hybrid nanoparticles for on-demand diagnostics and therapeutics [J].Accounts of Chemical Research,2015,48(12):3016-3025.
[6] Liang C,Diao S,Wang C,et al.Tumor metastasis inhibition by imaging-guided photothermal therapy with single-walled carbon nanotubes [J].Advanced Materials,2014,26(32):5646-5652.
[7] Song J B,Yang X Y,Orit J,et al.Ultrasmall gold nanorod vesicles with enhanced tumor accumulation and fast excretion from the body for cancer therapy [J].Advanced Materials,2015,27(33):4910-4917.
[8] Jin Y S,Li Y Y,Ma X B,et al.Encapsulating tantalum oxide into polypyrrole nanoparticles for X-ray CT/photoacoustic bimodal imaging-guided photothermal ablation of cancer [J].Biomaterials,2014,35(22):5795-5804.
[9] Zhou M,Li J,Liang S,et al.CuS nanodots with ultrahigh efficient renal clearance for positron emission tomography imaging and image-guided photothermal therapy [J].ACS Nano,2015,9(7):7085-7096.
[10] Song G,Han L,Zou W,et al.A novel photothermal nanocrystals of Cu7S4hollow structure for efficient ablation of cancer cells [J].Nano-Micro Letters,2014,6(2):169-17.
[11] Melancon M P,Zhou M,Li C.Cancer theranostics with near-infrared light-activatable multimodal nanoparticles [J].Accounts of Chemical Research,2011,44(10):947-956.
[12] Zhou M,Zhao J,Tian M,et al.Radio-photothermal therapy mediated by a single compartment nanoplatform depletes tumor initiating cells and reduces lung metastasis in the orthotopic 4T1 breast tumor model [J].Nanoscale,2015,7(46):19438-19447.
[13] Willmann J K,Van B N,Dinkelborg L M,et al.Molecular imaging in drug development [J].Dressnature Reviews Drug Discovery,2008,7(7):591-607.
[14] Jokerst J V,Gambhir S S.Molecular imaging with theranostic nanoparticles [J].Accounts of Chemical Research,2011,44(10):1050-1060.
[15] Zhou M,Tian M,Li C.Copper-based nanomaterials for cancer imaging and therapy [J].Bioconjugate Chemistry,2016,27(5):1188-1199.
[16] Phelps M E.PET:the merging of biology and imaging into molecular imaging [J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2000,41(4):661-681.
[17] Weissleder R.Molecular imaging in cancer [J].Science,2006,312(5777):1168-1171.
[18] Zhou M,Chen Y Y,Adachi M,et al.Single agent nanoparticle for radiotherapy and radio-photothermal therapy in anaplastic thyroid cancer [J].Biomaterials,2015,57(0):41-49.
[19] Li C.A targeted approach to cancer imaging and therapy [J].Nature Materials,2014,13(2):110-115.
[20] Wang L V,Hu S.Photoacoustic tomography:invivoimaging from organelles to organs [J].Science,2012,335(6075):1458-1462.
[21] Li W Y,Brown P K,Wang L V,et al.Gold nanocages as contrast agents for photoacoustic imaging [J].Contrast Media & Molecular Imaging,2011,6(5):370-377.
[22] Geng K,Zhou M,Song S L,et al.Copper sulfide nanoparticles as a new class of photoacoustic contrast agent for deep tissue imaging at 1 064 nm [J].ACS Nano,2012,6(8):7489-7496.
[23] Wang Z,Huang P,Jacobson O,et al.Biomineralization-inspired synthesis of copper sulfide-ferritin nanocages as cancer theranostics [J].ACS Nano,2016,10(3):3453-3460.
[24] Yang K,Zhu L,Nie L,et al.Visualization of protease activity in vivo using an activatable photo-acoustic imaging probe based on CuS nanoparticles [J].Theranostics,2014,4(2):134-141.
[25] Manohar S,Ungureanu C,Leeuwen T G V.Gold nanorods as molecular contrast agents in photoacoustic imaging:the promises and the caveats [J].Contrast Media & Molecular Imaging,2011,6(5):389-400.
[26] Cui J B,Rui J,Xu S Y,et al.Cu7S4nanosuperlattices with greatly enhanced photothermal efficiency [J].Small,2015,11(33):4183-4190.
[27] Tian Q W,Tang M H,Sun Y G,et al.Hydrophilic flower-like CuS superstructures as an efficient 980 nm laser-driven photothermal agent for ablation of cancer cells [J].Advanced Materials,2011,23(31):3542-3547.
[28] Liu X,Li B,Fu F,et al.Facile synthesis of biocompatible cysteine-coated CuS nanoparticles with high photothermal conversion efficiency for cancer therapy [J].Dalton Transactions,2014,43(30):11709-11715.
[29] Huang Y Z,Lai Y L,Shi S G,et al.Copper sulfide nanoparticles with phospholipid-PEG coating forinvivonear-infrared photothermal cancer therapy [J].Chemistry-An Asian Journal,2014,10(2):370-376.
[30] Zhang C,Fu Y Y,Zhang X,et al.BSA-directed synthesis of CuS nanoparticles as a biocompatible photothermal agent for tumor ablation in vivo [J].Dalton Transactions,2015,44(29):13112-13118.
[31] Zhou M,Song S L,Zhao J,et al.Theranostic CuS nanoparticles targeting folate receptors for PET image-guided photothermal therapy [J].Journal of Materials Chemistry B,2015,3(46):8939-8948.
[32] Zhou M,Zhang R,Huang M,et al.A chelator-free multifunctional [64Cu]-CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy [J].Journal of the American Chemical Society,2010,132(43):15351-15358.
[33] Wang F,Li Q,Lin L,et al.Monodisperse copper chalcogenide nanocrystals:Controllable synthesis and the pinning of plasmonic resonance absorption [J].Journal of the American Chemical Society,2015,137(37):12006-12012.
[34] Zhang L,Gao S,Zhang F,et al.Activatable hyaluronic acid nanoparticle as a theranostic agent for optical/photoacoustic image-guided photothermal therapy [J].ACS Nano,2014,8(12):12250-12258.
[35] Liu B,Li C X,Xie Z X,et al.808 nm photocontrolled UCL imaging guided chemo/photothermal synergistic therapy with single UCNPs-CuS@PAA nanocomposite [J].Dalton Transactions,2016,45:13061-13069.
[36] Chen F,Hao H,Shreya G,et al.In vivo tumor vasculature targeting of CuS@MSN based theranostic nanomedicine [J].ACS Nano,2015,9(4):3926-3934.
[37] Tao Y,Yong W,Ke H,et al.Protein-nanoreactor-assisted synthesis of semiconductor nanocry-stals for efficient cancer theranostics [J].Advanced Materials,2016,28(28):5923-5930.
[38] Yap J T,Carney J P,Hall N C,et al.Image-guided cancer therapy using PET/CT [J].Cancer Journal,2004,10(4):221-233.
[39] Tian Q W,Hu J,Zhu Y,et al.Sub-10 nm Fe3O4@Cu2-xS core-shell nanoparticles for dual-modal imaging and photothermal therapy [J].Journal of the American Chemical Society,2013,135(23):8571-8577.
[40] Fu Y Y,Zhao H X,Wang H,et al.Biomineralization of versatile CuS/Gd2O3hybrid nanoparticle for MR imaging and antitumor photothermal chemotherapy [J].Chemistry-An Asian Journal,2016,11(17):2458-2459.
[41] Xiao Q,Zheng X,Bu W,et al.A core/satellite multifunctional nanotheranostic for in vivo imaging and tumor eradication by radiation/photothermal synergistic therapy [J].Journal of the American Chemical Society,2013,135(35):13041-13048.
[42] Cui M L,Song G,Wang C,et al.Synthesis of cysteine-functionalized water-soluble luminescent copper nanoclusters and their application to the determination of chromium(VI) [J].Microchimica Acta,2015,182(7-8):1371-1377.
(责任编辑:顾浩然,郁 慧)
Recent advances of theranotics agents based on copper chalcogenide
RUI Xichuan, YAO Xinbin, AN Lu, TIAN Qiwei, YANG Shiping
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Near infrared photothermal theranostics is an emerging therapy that has great potential in cancer therapy.With this theranostics,more effective prevention,screening,and treatment strategies for individualized cancer therapy will be found.Theranostics agents for cancer based on copper chalcogenide nanomaterials have become one of the attractive research fields recently due to their strong near-infrared absorptions,higher photothermal conversion efficiencies,low cost,and easy preparation.This review introduces the recent advances related to the diagnosis,treatment,and theranostics based on the copper chalcogenide nanomaterials for cancer.
copper chalcogenide; image-guided; photothermal therapy; theranostics
2016-09-22
国家自然科学青年基金(21601124);上海市自然科学基金(16ZR1424700);上海师范大学一般科研项目(SK201609)
田启威,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:qiweitian@shnu.edu.cn
O 614.24
A
1000-5137(2016)06-0748-09

