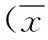5,6,7-三羟基-8-甲氧基黄酮的抗氧化及对高原缺氧小鼠的保护作用
马慧萍,景临林,樊鹏程,何 蕾,贾正平
5,6,7-三羟基-8-甲氧基黄酮的抗氧化及对高原缺氧小鼠的保护作用
马慧萍,景临林,樊鹏程,何蕾,贾正平

[摘要]目的对5,6,7-三羟基-8-甲氧基黄酮(TMF)的自由基清除及抗高原缺氧作用进行研究。方法采用1,1-二苯基-2-三硝基苯肼(DPPH)、羟自由基、超氧阴离子和一氧化氮清除方法评价TMF的抗氧化作用;利用常压密闭缺氧和低压性缺氧模型,通过测定缺氧小鼠心肌脑组织自由基代谢相关生化指标评价其抗缺氧活性。结果TMF对4种自由基均表现出一定的清除活性。与缺氧模型组相比,TMF能够显著延长缺氧小鼠的存活时间,降低缺氧小鼠心脑组织中丙二醛(MDA)含量,提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)的活力(P<0.01)。结论TMF是一种抗氧化活性优异的黄酮类化合物,能提高低压低氧小鼠抗氧化能力,减少自由基的损伤,表现出较好的抗缺氧活性。
[关键词]黄酮;抗氧化;抗缺氧;自由基清除
1材料与方法
1.1药品与试剂TMF按照本实验室报道的方法制备[4];乙酰唑胺(武汉远城科技发展有限公司);1,1-二苯基-2-三硝基苯肼(DPPH)(美国sigma公司);还原型辅酶I(NADH)、吩嗪硫酸甲酯(PMS)、抗坏血酸(Vc)、硫代巴比妥酸(TBA)、硝普钠、对氨基苯磺酸、盐酸萘乙二胺和芦丁(阿拉丁试剂公司);其余均为国产分析纯试剂。丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所)。
1.2实验动物清洁级BABL/C雄性小鼠74只,体重18~22 g,由兰州军区兰州总医院动物实验科提供,许可证号:SYXK(军)2014-0029。
1.3实验仪器Spectramax i3多功能酶标仪(Molecular Devices公司);RE-3000A旋转蒸发仪(上海亚荣生化仪器厂);SK3300L超声清洗器(上海精密仪器仪表有限公司);AE204型电子天平(美梅特勒-托利多仪器有限公司);UV2800SPC紫外可见分光光度计(上海舜宇恒平科学仪器有限公司),FLYDWC50-IIC低压低氧动物实验舱(贵州风雷航空军械有限公司)。
1.4实验方法
1.4.1DPPH清除实验:向125 μl不同摩尔浓度的样品溶液中分别加入0.1 mmol/L DPPH 70%乙醇溶液125 μl,室温下暗处反应30 min,以70%乙醇溶剂做空白对照,测量其在波长517 nm处的吸光度Ai。将125 μl 70%乙醇溶液分别与DPPH 70%乙醇溶液125 μl和125 μl样品溶液混合后,测定其在波长517 nm处的吸光度,分别计为A0和Aj。计算其清除率[清除率(%)=(1-Ai-Aj/A0)×100]及拮抗剂半抑制浓度(IC50)。
1.4.2羟自由基清除实验:向500 μl不同摩尔浓度样品溶液中依次加入50 μl 28 mmol/L脱氧核糖(溶于pH=7.0的0.2 mmol PBS)、50 μl EDTA(1 mmol/L)、50 μl的FeCl2(1 mmol/L)和50 μl H2O2(1 mmol/L),最后加入50 μl抗坏血酸(1 mmol/L)启动反应,37℃水浴孵育1 h后依次加入250 μl三氯乙酸(10%)和250 μl TBA(0.5%,溶于25 mmol/L的NaOH溶液),沸水中孵育0.5 h,测定532 nm处吸光度Ai,用500 μl蒸馏水代替样品溶液,测得吸光度A0,用PBS代替脱氧核糖测得吸光度Aj。计算其清除率及IC50。
1.4.3超氧阴离子(O2-)清除实验:向100 μl不同摩尔浓度的样品溶液中依次加入50 μl NADH(500 μmol/L,溶解于0.2 mol/L、pH=7.4的PBS中)、50 μl NBT(200 μmol/L)和50 μl PMS(20 μmol/L)。混合均匀后室温下反应8 min,测定其在560 nm处的吸光度Ai。用100 μl 70%乙醇替代样品,混合后测定其560 nm处的吸光度A0;用50 μl水取代PMS,混合后测定其在波长560 nm处的吸光度Aj。计算其清除率及IC50。
1.4.4一氧化氮(NO)清除实验:将100 μl不同摩尔的样品溶液与100 μl的硝普钠(10 mmol/L,溶解在磷酸缓冲液中0.05 mol/L,pH=7.4)混合均匀后,室温下孵育2.5 h,向混合溶液中加入900 μl蒸馏水和0.5 ml对氨基苯磺酸(33%,溶解在20%的乙酸溶液中),室温放置5 min,最后加入0.5 ml盐酸萘乙二胺(0.1% w/v),室温放置30 min后,测定540 nm处的吸光度Ai。用磷酸缓冲液代替硝普钠时测得吸光度Aj,用70%乙醇代替样品溶液时测得吸光度A0。计算其清除率及IC50。
1.4.5常压密闭缺氧实验:将50只雄性BABL/C小鼠随机分成5组:缺氧模型组、乙酰唑胺组(300 mg/kg)、TMF低、中、高剂量组(125、250、500 mg/kg),每组10只,连续灌胃给药5 d,最后一次给药60 min后,将小鼠分别放入250 ml广口瓶内(瓶内含5 g钠石灰),密封瓶口,立即开始计时,待小鼠停止呼吸时记录小鼠存活时间。利用存活时间和延长率评价药物的抗缺氧作用,确定TMF最佳给药剂量。延长率=(药物组存活时间-缺氧模型组存活时间)/缺氧模型组存活时间。
云盘系统通过互联网为企业和个人提供信息的存储、读取、下载等服务,具备安全稳定、海量数据存储的特点。系统可提供云存储服务、离线下载、文件智能分类浏览等功能,提供用户对在线数据操作的应用需求。
1.4.6低压低氧实验:将24只雄性BABL/C小鼠随机分成4组:正常组、缺氧模型组、乙酰唑胺组(300 mg/kg)、TMF高剂量组(500 mg/kg ),每组6只。给药方式同1.4.5。最后一次给药后,除正常组外,将其他3组置于低压低氧动物实验舱中,以100 m/min的速度减压至模拟8000 m海拔高度,并维持低压低氧9 h,随后快速升压至正常气压。立即将小鼠脱臼处死,取大脑和心脏组织,用4℃生理盐水制成10 %的组织匀浆用于相关生化指标的测定。MDA含量、SOD、CAT和GSH-Px活性测定按照相应的试剂盒说明书进行。
2结果
2.1TMF对DPPH清除作用结果如图1所示,TMF在0.03125~1 mmol/ml浓度范围内呈明显的量效关系,表现出较强的清除DPPH的能力,其活性优于阳性药Vc,与芦丁相当,其IC50分别为(0.148±0.001)、(0.301±0.002)和(0.152±0.004)mmol/ml。

图1 TMF对DPPH的清除作用TMF为5,6,7-三羟基-8-甲氧基黄酮,DPPH为1,1-二苯基-2-三硝基苯肼,Vc为抗坏血酸
2.2TMF对羟自由基清除作用从图2结果可以看出:随着TMF浓度的升高,其对羟自由基的清除能力逐渐增强,具有明显的剂量依赖性,经计算其IC50为(0.954±0.005)mmol/ml,显著强于Vc(1.655±0.031)mmol/ml,与芦丁活性相当(0.944±0.015)mmol/ml。

图2 TMF对羟自由基的清除作用TMF为5,6,7-三羟基-8-甲氧基黄酮,Vc为抗坏血酸
2.3TMF对O2-清除作用从图3结果可以看出:TMF在低浓度时对O2-清除能力弱于芦丁,但是在高浓度时强于芦丁,其在1 mmol/ml时清除率为76.67%。阳性药Vc在低浓度时的清除率较弱,但是当浓度>0.5 mmol/ml时,清除能力迅速增强,在2 mmol/ml时清除率可以达到72.04%。
2.4TMF对NO清除作用从图4可以看出TMF和芦丁在低浓度时,对NO清除能力较Vc强,但是随着浓度的增加,清除率增长缓慢,当浓度为1 mmol/ml,Vc对NO的清除能力最强,达到了77.07%。不同化合物清除NO的IC50依次为化合物TMF(0.287±0.005)mmol/ml 图3 TMF对O2-的清除作用TMF为5,6,7-三羟基-8-甲氧基黄酮,Vc为抗坏血酸,O2-为超氧阴离子 图4 TMF对NO的清除率TMF为5,6,7-三羟基-8-甲氧基黄酮,Vc为抗坏血酸,NO为一氧化氮 2.5常压密闭缺氧实验5组在常压密闭缺氧实验下存活时间分别为:缺氧模型组(34.65±0.88)min、乙酰唑胺组(40.12±2.17)min、TMF低、中、高剂量组分别为(35.04±1.69)、(42.13±3.07)和(46.48±3.12)min。与缺氧模型组比较,乙酰唑胺组和TMF中高剂量组均能明显延长常压密闭缺氧小鼠的存活时间,差异有统计学意义(P<0.01)。 2.6TMF对低压低氧小鼠心脑组织中MDA含量和抗氧化酶的影响结果如图5和表1所示,与正常组比较,缺氧模型组小鼠心、脑组织MDA含量显著升高(P<0.01),SOD、CAT和GSH-Px活性显著降低(P<0.01);经乙酰唑胺和TMF预处理后,缺氧小鼠心、脑组织中MDA含量显著降低(P<0.01或P<0.05),SOD、CAT和GSH-Px活力显著升高。TMF的效果略优于乙酰唑胺,但差异无统计学意义(P>0.05)。 图5 TMF对低压低氧小鼠心脑组织中MDA含量和抗氧化酶活性的影响TMF为5,6,7-三羟基-8-甲氧基黄酮,MDA为丙二醛、SOD为超氧化物歧化酶、CAT过氧化氢酶、GSH-Px为谷胱甘肽过氧化物酶。与正常组比较,bP<0.01;与缺氧模型组比较,cP<0.05,dP<0.01 表1 TMF对低压低氧小鼠心脑组织中MDA含量和抗氧化酶活性的影响±s) 3讨论 黄酮类化合物是一类重要的、在天然产物中广泛存在的多酚类天然有机化合物,是体内非常重要的次生代谢产物,也是许多药用植物的有效成分[5]。研究表明:黄酮类化合物具有抗肿瘤、抗炎、抗菌、降血压和神经保护等多种生物活性,而这些有益效应均与其具有的抗氧化活性密切相关[6]。为了阐明TMF的抗氧化活性,本研究考察了TMF对4种经典自由基的清除作用。DPPH是一种性质稳定的含氮自由基,其醇溶液呈深紫色,通过其颜色的变化可以反应待测物质自由基清除能力[7]。羟自由基是活性氧簇(ROS)中活性最强的自由基,它能够无选择性的攻击DNA、核酸和蛋白质等生物大分子,造成细胞组织损伤[8]。O2-自身活性较弱,但是其能够在体内转化成活性更强的H2O2和羟自由基[9]。NO是体内重要的功能分子,在体内发挥着重要的生理功能。但是过多NO会与O2-反应生成氧化性更强的过氧亚硝酸根离子(ONOO-),进而损伤组织器官[10]。从文中结果可以看出:TMF对4种自由基均表现出优异的清除活性,是一种活性优异的抗氧化剂。 自由基是机体正常代谢产物[11]。在正常生理状态下,机体通过内源性抗氧化体系(抗氧化酶和非酶抗氧化剂)及时清除生成的ROS,维持自由基代谢的稳态。但当机体处于低压低氧状态时,机体内氧化平衡出现紊乱,代谢产生的ROS无法及时清除,造成ROS蓄积,进而对机体产生损伤。有研究指出:抗氧化剂,例如维生素E和乙酰左旋肉碱等能够缓解低压低氧造成的损伤[2-3]。本研究结果也表明:灌胃给药高、中、低剂量的TMF均能不同程度地延长缺氧常压密闭缺氧小鼠的存活时间,且呈剂量依赖性,其中,TMF高剂量组的抗缺氧效果显著优于乙酰唑胺组。 大脑和心脏是机体中对低压低氧环境最为敏感的器官[12-13]。为了阐明TMF对低压低氧小鼠的保护作用,本研究对心脑组织中自由基代谢相关生化指标进行了测定。MDA是脂质过氧化的最终产物之一,是反映脂质过氧化程度重要指标[14]。低压低氧会导致小鼠心脑组织中MDA含量显著升高,经TMF预处理后,小鼠心脑组织中MDA含量显著降低,表明TMF能够抑制低压低氧诱导的脂质过氧化。SOD、CAT和GSH-Px是机体内重要的抗氧化酶系,是机体抵抗氧化应激损伤的第一道防线。SOD通过歧化反应将羟自由基转化为H2O2。生成的H2O2进而被CAT和GSH-Px清除,三者相互协同维持机体内自由基代谢的稳态[15]。低压低氧会导致小鼠心脑组织中SOD、CAT和GSH-Px的活性显著降低,抗氧化系统被破坏,导致自由基代谢紊乱和ROS大量蓄积。TMF能够提高低压低氧条件下小鼠心脑组织中抗氧化酶的活性,维持机体内自由基代谢稳态,减少低压低氧诱导的氧化应激损伤。 综上所述,5,6,7-三羟基-8-甲氧基黄酮表现出优异的体外自由基清除活性,是一种高效的抗氧化剂。体内实验研究表明:5,6,7-三羟基-8-甲氧基黄酮能够显著延长常压密闭缺氧小鼠的存活时间,缓解低压低氧对小鼠心脑组织的损伤,其机制可能与维持机体抗氧化酶的活性、调节自由基代谢有关。 [参考文献] [1]Maiti P, Singh S B, Sharma A K,etal. Hypobaric hypoxia induces oxidative stress in rat brain[J].Neurochem Int, 2006,49(8):709-716. [2]Bautista-Ortega J, Ruiz-Feria C A. L-arginine and antioxidant vitamins E and C improve the cardiovascular performance of broiler chickens grown under chronic hypobaric hypoxia[J].Poult Sci, 2010,89(10):2141-2146. [3]Wu Y C, Wang Y J, Tseng G F. Ascorbic acid and alpha-tocopherol supplement starting prenatally enhances the resistance of nucleus tractus solitarius neurons to hypobaric hypoxic challenge[J]. Brain Struct Funct, 2011,216(2):105-122. [4]景临林,范小飞,马慧萍,等.以白杨素为原料简便合成A环多氧黄酮的方法[J].化学试剂,2013,39(9):782-784,800. [5]延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,29(9):1534-1544. [6]Singh, M, Kaur, M, Silakari O. Flavones: An important scaffold for medicinal chemistry[J].Eur J Med Chem, 2014,84(1):206-239. [7]Brand-Williams W, Cuvelier M E, Berset C. Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Sci Technol, 1995,28(1):25-30. [8]Halliwell B, Gutteridge J M C. Role of free radicals and catalytic metal ions in human disease: An overview[J].Methods Enzymol, 1990,186(3):81-85. [9]Girgih A T, He R, Hasan F M,etal. Evaluation of the in vitro antioxidant properties of a cod (Gadus morhua) protein hydrolysate and peptide fractions[J].Food Chem,2015,173(4):652-659. [10]Taira J, Tsuchida E, Katoh M C,etal. Antioxidant capacity of betacyanins as radical scavengers for peroxyl radical and nitric oxide[J].Food Chem, 2015,166(1):531-536. [11]Lushchak V I. Free radicals, reactive oxygen species, oxidative stress and its classification[J].Chem Biol Interact, 2014,224(12):164-175. [12]Rauchova H, Vokurkova M, Koudelova J. Hypoxia-induced lipid peroxidation in the brain during postnatal ontogenesis[J].Physiol Res, 2012,61(1):89-101. [13]Karar J, Dolt K S, Mishra M K,etal. Expression and functional activity of pro-oxidants and antioxidants in murine heart exposed to acute hypobaric hypoxia[J].FEBS Lett, 2007,581(24):4577-4582. [14]Suji G, Sivakami S. Malondialdehyde a lipid-derived aldehyde alters the reactivity of Cys34 and the esterase activity of serum albumin[J].Toxicol In Vitro, 2008,22(3):618-624. [15]Liu J, Jia L, Kan J.etal. In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom (Agaricus bisporus)[J].Food Chem Toxicol, 2013,51(1),310-316. (收稿时间:2015-09-15修回时间:2015-10-20) ·论著· Protective Effect of 5, 6, 7-trihydroxy-8-methoxyflavone Antioxidant on Mice with Hypobaric Hypoxia MA Hui-ping, JING Lin-lin, FAN Peng-cheng, HE Lei, JIA Zheng-ping (Key Laboratory of Prevention and Cure for the Plateau Environmental Damage of PLA, Lanzhou General Hospital of Lanzhou Military Area Command, lanzhou 730050, China) [Abstract]ObjectiveTo study free radical scavenging and anti-hypoxia efficiency of 5, 6, 7-trihydroxy-8-methoxyflavone (TMF). MethodsThe antioxidation of TMF was evaluated using 1, 1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl radical, superoxide anion and nitric oxide radical scavenging methods. The anti-hypoxic activity of the TMF was evaluated using the normobaric hypoxia and hypobaric hypoxia models by detecting biochemical indexes of free radical metabolism in myocardial brain tissues of mice under hypobaric hypoxia condition. ResultsTMF showed some scavenging effect on four free radicals. Compared with those of hypobaric hypoxia models, TMF could enhance the survival time, decrease the malondialdehyde (MDA) level of brain and increase the activities of superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) of mice under normobaric hypoxia of mice under hypobaric hypoxia condition (P<0.01). ConclusionTMF is one of flavonoids with good anti-hypoxic activity, and it can improve the antioxidant capacity and reduce injuries of free radicals with good anti-hypoxic activity in mice under hypobaric hypoxia condition. [Key words]Flavone; Anti-oxidant; Anti-hypoxia; Free radical scavenging [DOI]10.3969/j.issn.2095-140X.2015.12.003 [文献标志码][中国图书资料分类号]R979.9A [文章编号]2095-140X(2015)12-0010-05 [通讯作者]贾正平,E-mail:1026573411@qq.com [基金项目][作者单位]730050 兰州,兰州军区兰州总医院药剂科全军高原损伤防治重点实验室