降植烷诱导小鼠类风湿关节炎的模型①
陶云霞 蔡 磊 沈 辉 朱玉强 邱玉华 顾巧丽 耿德春 施 勤
(苏州大学附属第一医院骨科,苏州215006)
[摘 要] 目的:利用降植烷构建一种模拟人类风湿性关节炎发病过程的小鼠模型。方法:6~8周雌性BALB/c小鼠30只,随机分为模型组和对照组,每组15只。模型组于0周、9周、18周时经腹腔注射0.5 ml降植烷;对照组注射0.5 ml生理盐水。观察各组小鼠后足足掌厚度变化,并对关节炎的肿胀程度进行评分;H&E染色评估滑膜增生和炎性细胞浸润程度;流式细胞术方法检测小鼠脾脏中巨噬细胞、树突状细胞、中性粒细胞、T细胞和B细胞的亚群变化。结果:21周时,模型组有11只小鼠出现足爪红肿,足掌平均厚度为(2.90±0.51)mm,与对照组(1.29±0.47)mm比较,差异有统计学意义(P<0.05);关节炎评分为9.55±2.80。H&E染色结果显示模型组胫骨远端骨小梁吸收破坏,累及骨皮质,关节软骨可见坏死脱落、纤维化,呈现出明显的类风湿关节炎病理改变。流式细胞术分析结果显示,造模21周时,脾脏细胞中CD11b、CD11c和GR1表达明显增加,提示巨噬细胞、树突状细胞和中性粒细胞亚群数量增加;同时,CD4、CD8、CD154的分子表达也明显上调,与对照组比较,差异有统计学意义(P<0.05)。结论:经腹腔注射降植烷能够成功诱导小鼠关节炎,并产生与RA患者类似的组织病理和免疫学改变。降植烷诱导的小鼠关节炎模型,能够较为准确地模拟临床类风湿关节炎的发病过程。
[关键词] 降植烷;类风湿关节炎;小鼠模型
doi:10.3969/j.issn.1000-484X.2015.11.012
降植烷诱导小鼠类风湿关节炎的模型①
陶云霞蔡磊②沈辉②朱玉强②邱玉华②顾巧丽耿德春施勤
(苏州大学附属第一医院骨科,苏州215006)
[摘要]目的:利用降植烷构建一种模拟人类风湿性关节炎发病过程的小鼠模型。方法:6~8周雌性BALB/c小鼠30只,随机分为模型组和对照组,每组15只。模型组于0周、9周、18周时经腹腔注射0.5 ml降植烷;对照组注射0.5 ml生理盐水。观察各组小鼠后足足掌厚度变化,并对关节炎的肿胀程度进行评分;H&E染色评估滑膜增生和炎性细胞浸润程度;流式细胞术方法检测小鼠脾脏中巨噬细胞、树突状细胞、中性粒细胞、T细胞和B细胞的亚群变化。结果:21周时,模型组有11只小鼠出现足爪红肿,足掌平均厚度为(2.90±0.51)mm,与对照组(1.29±0.47)mm比较,差异有统计学意义(P<0.05);关节炎评分为9.55±2.80。H&E染色结果显示模型组胫骨远端骨小梁吸收破坏,累及骨皮质,关节软骨可见坏死脱落、纤维化,呈现出明显的类风湿关节炎病理改变。流式细胞术分析结果显示,造模21周时,脾脏细胞中CD11b、CD11c和GR1表达明显增加,提示巨噬细胞、树突状细胞和中性粒细胞亚群数量增加;同时,CD4、CD8、CD154的分子表达也明显上调,与对照组比较,差异有统计学意义(P<0.05)。结论:经腹腔注射降植烷能够成功诱导小鼠关节炎,并产生与RA患者类似的组织病理和免疫学改变。降植烷诱导的小鼠关节炎模型,能够较为准确地模拟临床类风湿关节炎的发病过程。
[关键词]降植烷;类风湿关节炎;小鼠模型
doi:10.3969/j.issn.1000-484X.2015.11.012
中图分类号①本文受国家自然科学基金(No.81373236)和江苏省骨科临床医学研究中心(BL2012004)资助。;②苏州大学医学部免疫系,苏州215123。
作者简介:陶云霞(1983年-),女,主管技师,主要从事免疫学及医学检验技术方面的研究,E-mail: taoyx8493@163.com。
通讯作者及指导教师:施勤(1971年-),女,博士,副教授,硕士生导师,主要从事免疫学研究, E-mail: qshisz@126.com。
[Abstract]Objective:To establish a pristine-induced rheumatoid arthritis model in mice,and to evaluate its histological and immunological distinction.Methods: Thirty female BALB/c mice,6-8 weeks old,were randomly divided into 2 groups,a control group and pristine group.The mice in pristine group were injected intraperitoneally with 0.5 ml pristine three times at 0,9,and 18 weeks,while mice in the control group receiving saline at the same time.Arthritis score and paw thickness were measured and histopathological assessment of joint sections was performed.The expression of phagocytes,dendritic,neutrophils,T and B cells markers in spleen were determined by flow cytometry.Results: In model-marking group,11 mice were presented with macroscopic evidence of arthritis such as erythema or swelling.The paw thickness in pristine-induced mice was significant higher than that in the control groups[(2.90±0.51)mm vs(1.29±0.47 mm),P<0.05].In addition,arthritis score in pristine-induced mice was 9.55±2.80 at 21 weeks after first injection with 0.5 ml pristine.H&E staining revealed a significant increase of synovial inflammation,cartilage and bone destruction after stimulated with pristine.Meanwhile,the expression levels of CD11b,CD11c,GR1,CD4,CD8 and CD154 were obviously increased in model-marking group when compared with that in control group.Conclusion: The pristine-induced model presents the similar histological and immunological distinctions with human rheumatism arthritis,which can mimic the pathogenesis of rheumatism arthritis.
Pristine-induced rheumatoid arthritis model in mice
TAOYun-Xia,CAILei,SHENHui,ZHUYu-Qiang,QIUYu-Hua,GUQiao-Li,GENGDe-Chun,SHIQin.DepartmentofOrthopedics,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China
[Key words]Pristine;Rheumatoid arthritis;Mouse model
类风湿关节炎(Rheumatoid arthritis,RA)是一种以进行性、侵蚀性关节破坏为特征性病理改变的全身性自身免疫病。其基本病理改变主要是滑膜慢性炎症及关节软骨和骨质的破坏,临床特征为关节结构的炎症和肿胀、慢性进行性病程,并可致多个关节完全强直,最终导致功能的丧失,致残率高[1]。因此,为临床发病机制的研究及寻找新的诊疗手段,建立一种能准确模拟RA发病过程的动物模型尤为重要。目前,最为常用的RA模型为Ⅱ型胶原诱导的小鼠或大鼠模型,但其建模过程需要通过尾静脉注射Ⅱ型胶原和佐剂的混合物,操作难度大[2]。降植烷是一种常用的致炎剂,有文献报道其能不依赖于T或B细胞激活免疫系统引起免疫反应[3,4]。本文以BALB/c小鼠为研究对象,拟制备降植烷诱导的RA小鼠模型并对其免疫病理变化进行评价。
1材料与方法
1.1实验动物及分组6~8周雌性BALB/c小鼠30只,体质量25~30 g,由苏州大学实验动物中心提供。采用随机数字表法分为模型组及对照组,每组15只。SPF级动物房常规饲养。实验方案得到苏州大学附属第一医院动物伦理委员会批准。
1.2主要试剂降植烷,即2,6,10,14-四甲基十五烷,购于美国Sigma公司 。PE标记抗小鼠抗体CD11b、CD11c、Gr1,FITC标记CD4、CD8、CD21、CD23、CD80、CD86、CD154(CD40L),APC标记抗小鼠抗体B220均购置美国eBioscience公司。
1.3降植烷诱导RA小鼠模型的制备小鼠适应性饲养1周,造模组于0周、9周、18周时腹腔各注射0.5 ml降植烷;对照组于相同时间腹腔注射0.5 ml生理盐水。第21周时,采用颈椎脱臼法处死小鼠,保留小鼠脾脏及双侧后肢关节,分别行免疫学及组织病理学检测。
1.4小鼠足趾厚度的测定从第18周起,使用游标卡尺对小鼠同侧的后足跗跖关节肉厚处进行测量,每周测量2次,每次重复测量3次,取平均值。所有测量由两名实验者独立完成。
1.5关节炎指数评分(Arthritis index,AI)从第18周起,对各组小鼠关节肿胀程度进行评分,每周评测2次,每次重复测量3次,取平均值。采用关节炎评分法(0~4分)[5],0分:无关节炎;1分:有红色斑点或轻度肿胀;2分:关节部位中度肿胀;3分:严重肿胀;4分:严重肿胀且不能负重,四肢评分的和即为关节炎指数(最大分数16)。
1.6流式细胞检测脾细胞免疫分子表达变化取小鼠脾脏制成单细胞悬液,5×105个细胞加入各流式分析管,分别加入PE标记抗小鼠抗体CD11b、CD11c、Gr1,FITC标记CD4、CD8、CD21、CD23、CD80、CD86、CD154(CD40L),APC标记抗小鼠抗体B220 4℃避光孵育1 h,经洗涤,1%多聚甲醛固定,流式细胞仪分析细胞的免疫分子在脾脏细胞中的表达情况。
1.7组织学观察小鼠处死后切取后肢膝关节,剔除皮毛和肌肉浸泡于4%甲醛溶液固定3 d,而后放入10%EDTA液中脱钙30 d,常规石蜡包埋,4 μm切片,H&E染色,普通光镜观察。
2结果
2.1小鼠一般情况造模期间,小鼠无死亡。正常组小鼠精神状态好,能正常爬行,关节活动自如,无红肿;第三次注射免疫(18周)后,造模组有11只小鼠出现症状(成模率73.3%),具体表现为足爪红肿,体型消瘦,毛色杂乱稀疏,步态异常,倦怠易激惹;足部存在不同程度肿胀,关节增粗,黏膜红肿渗出。见图1。小鼠足掌厚度测量结果显示,21周时模型组小鼠后足肿胀最为明显,厚度为(2.90±0.51)mm,与对照组(1.29±0.47)mm比较,差异有统计学意义(t=-6.097;P<0.05);关节炎评分结果显示21周时11只成模小鼠中,有4只症状较轻,7只发病严重,关节炎指数为9.55±2.80。
2.2组织病理学观察正常小鼠膝关节结构完整无损,无骨小梁吸收,关节软骨光滑平整(图2A)。模型组小鼠膝关节结构被破坏,有骨小梁吸收,关节软骨可见坏死脱落,纤维化,关节腔狭窄。炎细胞大量浸润,伴有程度不同的软组织水肿(图2B)。
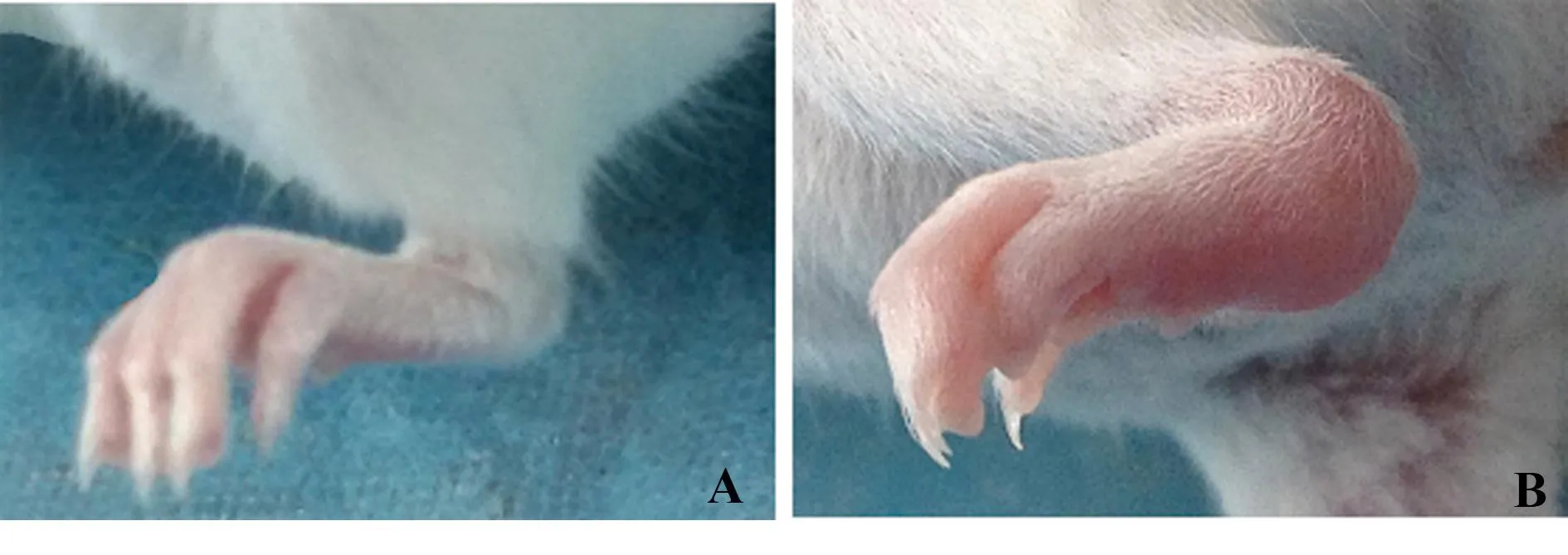
图1 21周时,小鼠右后肢大体改变Fig.1 Representative photographs of right hind paws of mice on week 21Note: A.Control group;B.Model-making group.
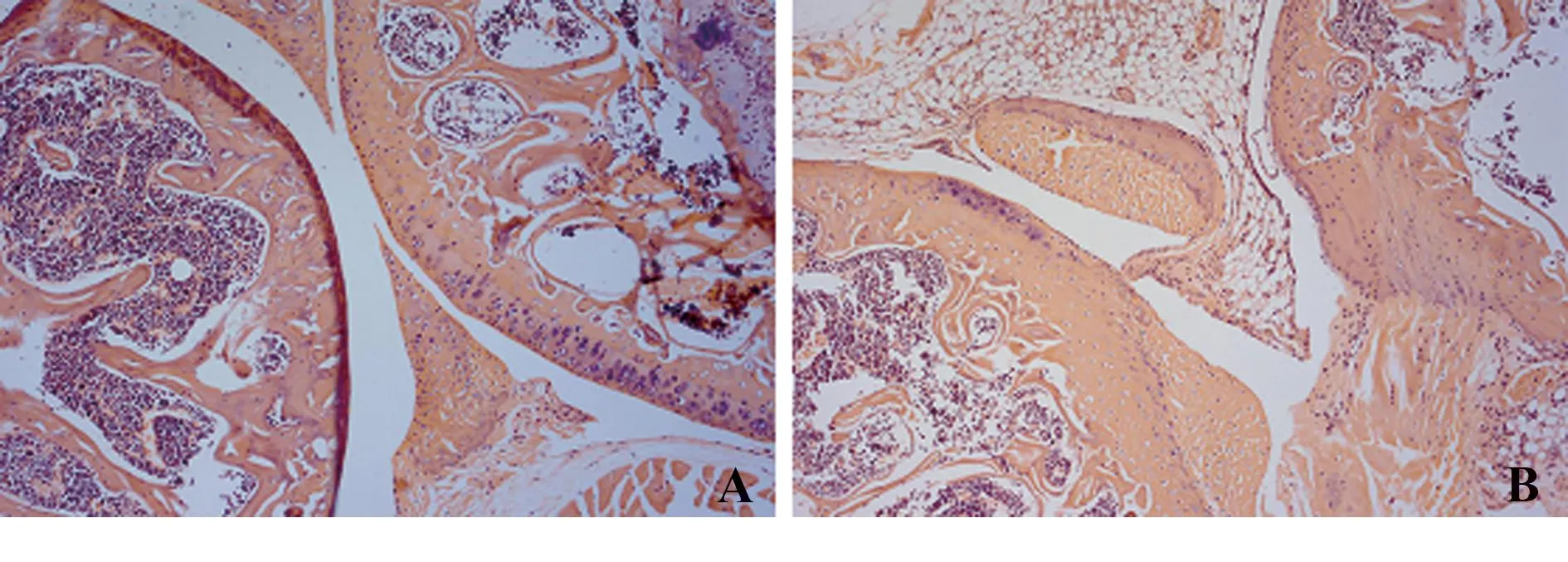
图2 小鼠右后肢膝关节H&E染色结果(×20)Fig.2 Right ankle joints of mice obtained on week 21 were stained with haematoxylin and eosin(×20)Note: A.Control group;B.Model-making group.
表1 小鼠脾脏中巨噬细胞(CD11b+)、树突状细胞(CD11c+)和中性粒细胞(GR1+)的阳性率(%,±s,n=15)Tab.1 Expression level of phagocytes(CD11b+),dendritic(CD11c+)and neutrophils(GR1+)in spleen(%,±s,n=15)
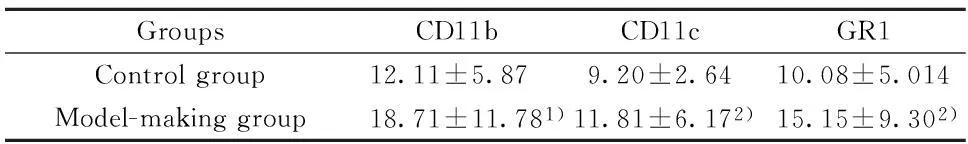
表1 小鼠脾脏中巨噬细胞(CD11b+)、树突状细胞(CD11c+)和中性粒细胞(GR1+)的阳性率(%,±s,n=15)Tab.1 Expression level of phagocytes(CD11b+),dendritic(CD11c+)and neutrophils(GR1+)in spleen(%,±s,n=15)
GroupsCD11bCD11cGR1Controlgroup12.11±5.879.20±2.6410.08±5.014Model-makinggroup18.71±11.781)11.81±6.172)15.15±9.302)
Note:Compared to model-making group,1)P<0.05,2)P<0.01.
表2 脾脏T细胞中CD4、CD8a和CD154的表达(%,±s,n=15)Tab.2 Expression of CD4,CD8a and CD154 on T cell in spleen(%,±s,n=15)
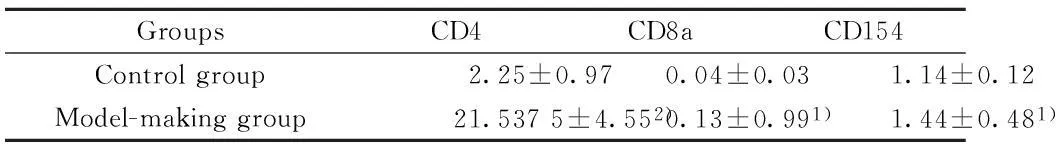
表2 脾脏T细胞中CD4、CD8a和CD154的表达(%,±s,n=15)Tab.2 Expression of CD4,CD8a and CD154 on T cell in spleen(%,±s,n=15)
GroupsCD4CD8aCD154Controlgroup2.25±0.970.04±0.031.14±0.12Model-makinggroup21.5375±4.552)0.13±0.991)1.44±0.481)
Note:Compared to model-making group,1)P<0.05,2)P<0.01.
2.3小鼠脾细胞流式细胞检测结果21周时取脾脏制成单细胞悬液,荧光抗体标记后经流式细胞仪检测,结果显示,模型组脾脏细胞中CD11b、CD11c和GR1表达明显增加,提示吞噬细胞、树突状细胞和中性粒细胞亚群数量增加(表1,P<0.05)。模型组中T细胞表面的表面标志CD4、CD8、CD154均有不同程度的增高,与对照组比较差异有统计学意义(表2,P<0.05)。模型组和对照组脾脏细胞中B220及CD21、CD23、CD80、CD86的表达未有明显差异(P>0.05,结果未列出)。
3讨论
类风湿性关节炎是一种累及全身关节的自身免疫性疾病,其病理特征是慢性炎细胞浸润和滑膜增生,最终导致关节软骨和骨质破坏[1]。迄今为止,RA发生的确切机制尚不清楚,还没有有效的预防和治疗方法,所以,建立一种能够准确模拟人类RA发病过程的动物模型对研究RA病因及药物治疗至关重要。
降植烷,即2,6,10,14-四甲基十五烷,是叶绿素分解后的产物。有学者发现降植烷能促进小鼠B淋巴细胞瘤的发生[6],而将降植烷经腹腔注射后能诱导产生狼疮特异性抗体,实验小鼠表现出明显的系统性红斑狼疮的特征[7-9]。在本研究中,笔者将0.5 ml降植烷经腹腔注射给BALB/c小鼠,并在9周和18周时各补注1次,21周时实验小鼠表现出明显的关节炎症状,发病率为73.7%,与Potter等[10]报道一致。组织学染色发现,实验小鼠关节滑膜增生明显,有大量炎性细胞浸润,以中性粒细胞和单核细胞为主,软骨和骨组织破坏明显,有血管翳形成,与人类RA患者病变关节组织病理改变类似。汪婷婷等[4]在降植烷诱导的大鼠关节炎模型中也发现了类似的病理改变。上述结果提示经腹腔注射降植烷能够诱导小鼠产生关节炎病理改变。
有研究表明,T细胞尤其是CD4+T细胞在RA发病过程中起重要作用[11]。在RA滑膜浸润的单核细胞中,30%~50%为T细胞,而且这些细胞多处于活化状态,并且通过与巨噬细胞相互作用,引起软骨和骨组织破坏[11-13]。笔者研究发现,降植烷免疫后的小鼠脾脏中CD4、CD8和CD154+T细胞数量明显增多,提示降植烷可能通过调节T细胞引起小鼠关节炎病理改变。Holmberg等[3]的研究表明降植烷是一种非免疫原性的佐剂,不能被T细胞或B细胞特异性识别,降植烷致关节炎的能力也就取决于其对免疫系统的非特异性刺激引起的自身反应性T淋巴细胞活化,引起关节急性炎症,随后进入慢性进展和反复发作阶段。因此,在免疫学特征方面,降植烷诱导的RA模型可能更类似于RA患者,更适于RA病理机制的研究。
B细胞在RA关节滑膜中的数量较少,但近年来的研究发现B细胞在RA发病机制中起重要作用[14]。Takemura等[15]证实RA滑膜中T细胞的激活和作用是B细胞依赖性的;B细胞作为一种抗原递呈细胞,向T细胞提供共刺激信号;B细胞还能通过分泌TNF-α等炎症因子、趋化因子以及类风湿因子等进一步加重RA关节破坏[16,17]。我们的结果显示在降植烷诱导小鼠狼疮性肾炎的起始阶段可引起B细胞功能活化[7],但是,在本研究中流式细胞检测结果表明,降植烷免疫后的小鼠脾脏内B细胞表面标志CD21、CD23、CD80、CD86的表达未有明显差异,我们推测B细胞功能在降植烷引起的后期免疫反应趋于稳定。
综上所述,经腹腔注射降植烷能够成功诱导小鼠关节炎,并产生与RA患者类似的免疫学改变,是一种可靠的RA动物模型,为探讨RA的发病机制及寻找RA的诊疗的新技术新方法提供研究工具和物质基础。
参考文献:
[1]Shimizu T,Takahata M,Kameda Y,etal.Sialic acid-binding immunoglobulin-like lectin 15(Siglec-15)mediates periarticular bone loss,but not joint destruction,in murine antigen-induced arthritis[J].Bone,2015,79:65-70.
[2]Asquith DL,Miller AM,McInnes IB,etal.Animal models of rheumatoid arthritis[J].Eur J Immunol,2009,39(8):2040-2044.
[3]Holmberg J,Tuncel J,Yamada H,etal.Pristane,a non-antigenic adjuvant,induces MHC class II-restricted,arthritogenic T cells in the rat[J].J Immunol,2006;176(2):1172-1179.
[4]汪婷婷,罗爱林,王金韬,等.降植烷诱导大鼠关节炎模型的建立及免疫学评价[J].中华风湿病学杂志,2008,28(4):318-321.
[5]Clark DN,Markham JL,Sloan CS,etal.Cytokine inhibition as a strategy for treating systemic lupus erythematosus[J].Clin Immunol,2013,148(3):335-343.
[6]Anderson PN,Potter M.Induction of plasma cell tumours in BALB-c mice with 2,6,10,14-tetramethylpentadecane(pristane)[J].Nature,1969,222(5197):994-995.
[7]高增燕,孙杰,王艳茹,等.降植烷诱导C57BL/J6狼疮性肾病鼠模型的建立和生物学鉴定[J].苏州大学学报:医学版,2010,30(3):498-501.
[8]Zhuang H,Han S,Xu Y,etal.Toll-like receptor 7-stimulated tumor necrosis factor α causes bone marrow damage in systemic lupus erythematosus [J].Arthritis Rheumatol,2014,66(1):140-151.
[9]Satoh M,Reeves WH.Induction of lupus-associated autoantibodies in BALB/c mice by intraperitoneal injection of pristane [J].J Exp Med,1994,180(6):2341-2346.
[10]Potter M,Wax JS.Genetics of susceptibility to pristane-induced plasmacytomas in BALB/cAn:reduced susceptibility in BALB/cJ with a brief description of pristane-induced arthritis [J].J Immunol,1981,127(4):1591-1595.
[11]Kurokawa M,Kato T,Masuko-Hongo K,etal.Characterisation of T cell clonotypes that accumulated in multiple joints of patients with rheumatoid arthritis [J].Ann Rheum Dis,1999,58(9):546-553.
[12]Hao L,Zhu G,Lu Y,etal.Deficiency of cathepsin K prevents inflammation and bone erosion in rheumatoid arthritis and periodontitis and reveals its shared osteoimmune role[J].FEBS Lett,2015,589(12):1331-1339.
[13]焦志军,尤海燕,陈蕾,等.类风湿性关节炎患者CD4+CD25+Foxp3+调节性T细胞检测及意义[J].中国免疫学杂志,2007,23(10):936-938.
[14]Edwards JC,Szczepanski L,Szechinski J,etal.Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis[J].N Engl J Med,2004,350(25):2572-2581.
[15]Takemura S,Klimiuk PA,Braun A,etal.T cell activation in rheumatoid synovium is B cell dependent[J].J Immunol,2001,167(8):4710-4718.
[16]Engelmann R,Wang N,Kneitz C,etal.Bone resorption correlates with the frequency of CD5 B cells in the blood of patients with rheumatoid arthritis[J].Rheumatology(Oxford),2015,54(3):545-553.
[17]Yeo L,Lom H,Juarez M,etal.Expression of FcRL4 defines a pro-inflammatory,RANKL-producing B cell subset in rheumatoid arthritis [J].Ann Rheum Dis,2015,74(5):928-935.
[收稿2015-07-11修回2015-08-26]
(编辑张晓舟)