锰源和锰水平对斜带石斑鱼幼鱼生长、抗氧化功能和矿物元素沉积的影响
聂家全,董晓慧,谭北平,迟淑艳,杨奇慧,刘泓宇,章双
(广东海洋大学 水产学院,水产动物营养与饲料实验室,广东 湛江 524088)
锰源和锰水平对斜带石斑鱼幼鱼生长、抗氧化功能和矿物元素沉积的影响
聂家全,董晓慧,谭北平,迟淑艳,杨奇慧,刘泓宇,章双
(广东海洋大学 水产学院,水产动物营养与饲料实验室,广东 湛江 524088)
摘要:为研究甘氨酸锰(GMn)和羟基蛋氨酸锰(HMn)对斜带石斑鱼Epinephelus coioides幼鱼生长、抗氧化功能和矿物元素沉积的影响,在基础饲料中添加0、2、4、8、16、32 mg/kg(以锰计)的甘氨酸锰或羟基蛋氨酸锰分别制成11种试验饲料,在水温为(28±2)℃条件下,投喂初始体质量为12.26 g的斜带石斑鱼幼鱼8周。结果表明:(1)对照组(不添加锰)的增重率(WGR)显著低于锰添加组(P<0.05),两个锰添加组的WGR均随锰添加量的增加逐渐升高后趋于稳定;以WGR为判据,通过折线模型分析表明,以GMn和HMn为锰源时,石斑鱼对饲料中锰的最适需要量分别为9.04、12.87 mg/kg,GMn的生物利用率相当于HMn的1.78倍。(2)石斑鱼肝脏中锰超氧化物歧化酶(Mn-SOD)活性随着锰添加水平的增加先升高后下降,丙二醛(MDA)含量随着锰添加水平的增加而减少;以肝脏Mn-SOD活性为判据,通过一元二次回归方程分析得出,以GMn和HMn为锰源时,石斑鱼对饲料中锰的最适需要量分别为21.15、20.61 mg/kg。(3)石斑鱼脊椎骨和全鱼的锰含量随饲料中锰含量的升高而显著增加(P<0.05);对照组脊椎骨的铁含量显著高于锰添加组(P<0.05),脊椎骨和全鱼的铁含量随饲料中锰含量的升高而显著减少(P<0.05)。研究表明,当饲料中锰含量满足斜带石斑鱼幼鱼生长需要时,进一步补充有机锰源对其生长性能无显著影响,甘氨酸锰的生物利用率高于羟基蛋氨酸锰,而两种锰源的抗氧化能力相似。
关键词:斜带石斑鱼;锰;生长性能;抗氧化能力;矿物元素沉积
锰是水产动物体内的必需微量元素之一,它是多种酶的组成成分,含锰的金属酶至少有3种:锰超氧化物歧化酶(Mn-SOD)、精氨酸酶和丙酮酸羧化酶[1]。锰是硫酸软骨素合成酶的必需辅助因子,参与构成骨骼基质硫酸软骨素的形成,维持骨骼正常发育[2],锰具有促进生长、增强免疫力和提高鱼体繁殖性能等作用[3]。研究表明,饲料中含有适量锰可以维持鱼类正常生长代谢,饲料中缺乏锰会导致鱼类成活率下降,生长缓慢,摄食量降低,骨骼畸形,晶状体白内障,组织中锰含量和Mn-SOD活性下降,胚胎死亡率升高,孵化率降低[3]。
斜带石斑鱼Epinepheluscoioide分布于中国的南海和东海,为近海暖水性底层广盐性鱼类,其具有生长快、抗病力强、肉质鲜美、经济价值高等特点,是中国南方广泛养殖的海水鱼类。目前,以硫酸锰作为锰源来研究鱼类对锰元素的营养需求较多,而关于鱼类对有机锰需求的研究却很少。为此,本研究中进行了不同添加水平的甘氨酸锰和羟基蛋氨酸锰饲料对斜带石斑鱼幼鱼生长、抗氧化力和矿物元素沉积影响的研究,以确定斜带石斑鱼饲料中锰的适宜添加量,为科学添加锰元素和精准研制石斑鱼饲料配方提供基础数据。
1材料与方法
1.1材料
试验用斜带石斑鱼幼鱼购于广东省雷州市覃斗镇某养殖场。
以酪蛋白(Alfa Aesar公司)和智利红鱼粉为主要蛋白源,玉米淀粉为糖源,玉米油、鱼油和卵磷脂为脂肪源制成基础饲料。基础饲料中包含(风干基础,均为质量分数%)酪蛋白46.0、鱼粉 、玉米淀粉25.0、鱼油3.0、玉米油3.0、卵磷脂2.0、维生素预混料0.3、矿物质预混料0.7、维生素C磷酸酯0.2、氯化胆碱0.5、磷酸二氢钙1.0、乙氧基喹啉0.05、诱食剂0.1、羧甲基纤维素钠2.0、-纤维素1.1。其中,维生素预混料(mg/kg饲料)包括硫胺素25、核黄素45、盐酸吡哆醇20、维生素B120.1、维生素K310、肌醇800、泛酸60、烟酸200、叶酸20、生物素1.20、维生素A 32、维生素D35、维生素E 120、微晶纤维素1661.7;去锰矿物质预混物(mg/kg饲料)包括氟化钠2、碘酸钙0.94、氯化钴50、硫酸铜10、硫酸亚铁80、硫酸锌50、硫酸镁1200、氯化钠100、沸石粉5507.06。基础饲料的粗蛋白、粗脂肪、灰分、锰含量分别为51.76%、8.83%、6.00%、4.35%(均为实测值)。
1.2方法
1.2.1试验饲料的配制在基础饲料中分别添加甘氨酸锰(广州天科科技有限公司)和羟基蛋氨酸锰(长沙兴嘉生物工程股份有限公司),锰的添加水平分别为0、2、4、8、16、32 mg/kg,共配制出11种饲料。不添加锰的饲料记为C-0(对照),添加甘氨酸锰的饲料记为GMn-2、GMn-4、GMn-8、GMn-16、GMn-32,添加羟基蛋氨酸锰的饲料记为HMn-2、HMn-4、HMn-8、HMn-16、HMn-32。经电感耦合等离子体原子发射光谱仪(ICP-AES)测定,饲料(以干物质计)中锰的实际含量:对照组为4.35 mg/kg;GMn组分别为6.31、9.32、12.87、20.86、35.80 mg/kg;HMn组分别为6.93、8.80、13.00、20.42、36.75 mg/kg。将各种饲料原料粉碎过后60目筛,按配方比例准确称重后混匀,搅拌15 min,少量组分采用逐级扩大法混合,然后加入鱼油、玉米油和卵磷脂,混匀后过40目筛,加入氯化胆碱和磷酸二氢钙,继续搅拌 15 min,将搅拌好的饲料压制成粒径为3.0 mm 的颗粒饲料,风干后用封口袋编号分装,于冰箱(-20 ℃)中保存备用。
1.2.2试验设计及饲养管理斜带石斑鱼幼鱼运回后暂养于广东省湛江市东海岛广东海洋大学海洋生物研究基地室外水泥池中,投喂不添加锰的基础饲料10 d,使鱼种逐渐适应饲料和养殖环境。试验共设11个组,每组设3个重复,试验在33个1 m3的聚乙烯玻璃钢桶中进行。挑选990尾健康无病、规格一致且活力较好的试验鱼(体质量为12.26 g±0.37 g)随机分配到33个养殖桶中,饲养8周。每天9:00、17:00饱食投喂,每天换水一次,海水盐度为25~30,水温为(28±2)℃,溶解氧>5 mg/L,水中锰离子含量为2.4~3.7 μg/L。
1.2.3样品的采集与测定试验结束时,从每桶中随机取20尾鱼,5尾用于全鱼矿物质含量的分析,15尾鱼从尾静脉采血,血样在冰箱(4 ℃)中静置5 h后,4 ℃下以4500 r/min离心15 min,制备血清,并置于-20 ℃下保存待分析。抽血后的鱼立即解剖,取其肝脏放入防冻管,并立即放入液氮罐中,取样结束后再放入超低温冰箱(-80 ℃)中保存,待测酶活力。
采用南京建成生物工程研究所的试剂盒测定肝脏碱性磷酸酶(AKP)、脂蛋白脂酶(LPL)、肝脂酶(HL)活性,肝脏与血清中的锰超氧化物歧化酶(Mn-SOD)活性、丙二醛(MDA)含量,按试剂盒说明书方法进行测定。将取出内脏的鱼体放入沸水中5 min,再用蒸馏水反复冲洗,去掉附着在脊椎骨上的肌肉,将脊椎骨在100 ℃下烘干2 h,然后粉碎,用乙醚抽提12 h后,再于105 ℃下烘干。饲料、脊椎骨和全鱼样品用优级纯的硝酸和双氧水消化后,用电感耦合等离子体原子发射光谱仪测定铜、铁、锰、锌含量。采用105 ℃烘干恒重法、凯氏定氮法(GB 6432-86)、索氏提取法(以乙醚为抽提液) (GB 6433-86)、高温灼烧法(GB 6538-86)分别测定饲料的水分、粗蛋白质、粗脂肪和灰分含量。
1.2.4计算公式
成活率(SR,%)=100×Nt/N0,
增重率(WGR,%)=100×(Wt-W0+W1)/W0,
饲料系数(FCR)=F/(Wt-W0+W1),
体长特定生长率(SGRL,%/d)=100×(lnLt-lnL0)/t,
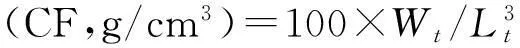
其中:Nt、N0分别为试验结束和试验开始时鱼的数量;Wt、W0分别为试验结束和试验开始时鱼的质量(g);W1为试验过程中死亡鱼的质量(g);Lt、L0分别为试验结束和试验开始时鱼的体长(cm);t为试验时间(d);F为摄食量(g)。
1.3数据处理
试验数据均以平均值±标准误表示。采用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA)和Duncan多重比较,显著性水平设为0.05。
2结果与分析
2.1不同锰水平组斜带石斑鱼的生长状况
从表1可见:两种锰添加组鱼的生长随饲料中锰添加量的增加而加快,增重率先升高后稳定;锰添加组增重率均显著高于对照组(P<0.05),其中,GMn-2、HMn-2和HMn-4组间增重率无显著性差异(P>0.05),均显著低于其他锰添加组(P<0.05),其他锰添加组间无显著性差异(P>0.05)。以增重率为判据,通过折线模型分析得出,以甘氨酸锰和羟基蛋氨酸锰为锰源时,石斑鱼对锰的最适需要量分别为9.04、12.87 mg/kg。用拐点以下直线斜率的比值计算得出:石斑鱼对甘氨酸锰的生物利用率相当于羟基蛋氨酸锰的1.78倍(图1)。
从表1还可见:石斑鱼幼鱼各组间成活率无显著性差异(P>0.05);除GMn-32组外,其余锰添加组的饲料系数均显著低于对照组(P<0.05),HMn-8组的饲料系数最低;除HMn-2组外,其余锰添加组的体长特定生长率均显著高于对照组(P<0.05),HMn-16组的体长特定生长率最高;对照组的肥满度显著高于锰添加组(P<0.05)。

表1 饲料中锰含量对斜带石斑鱼生长性能的影响
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
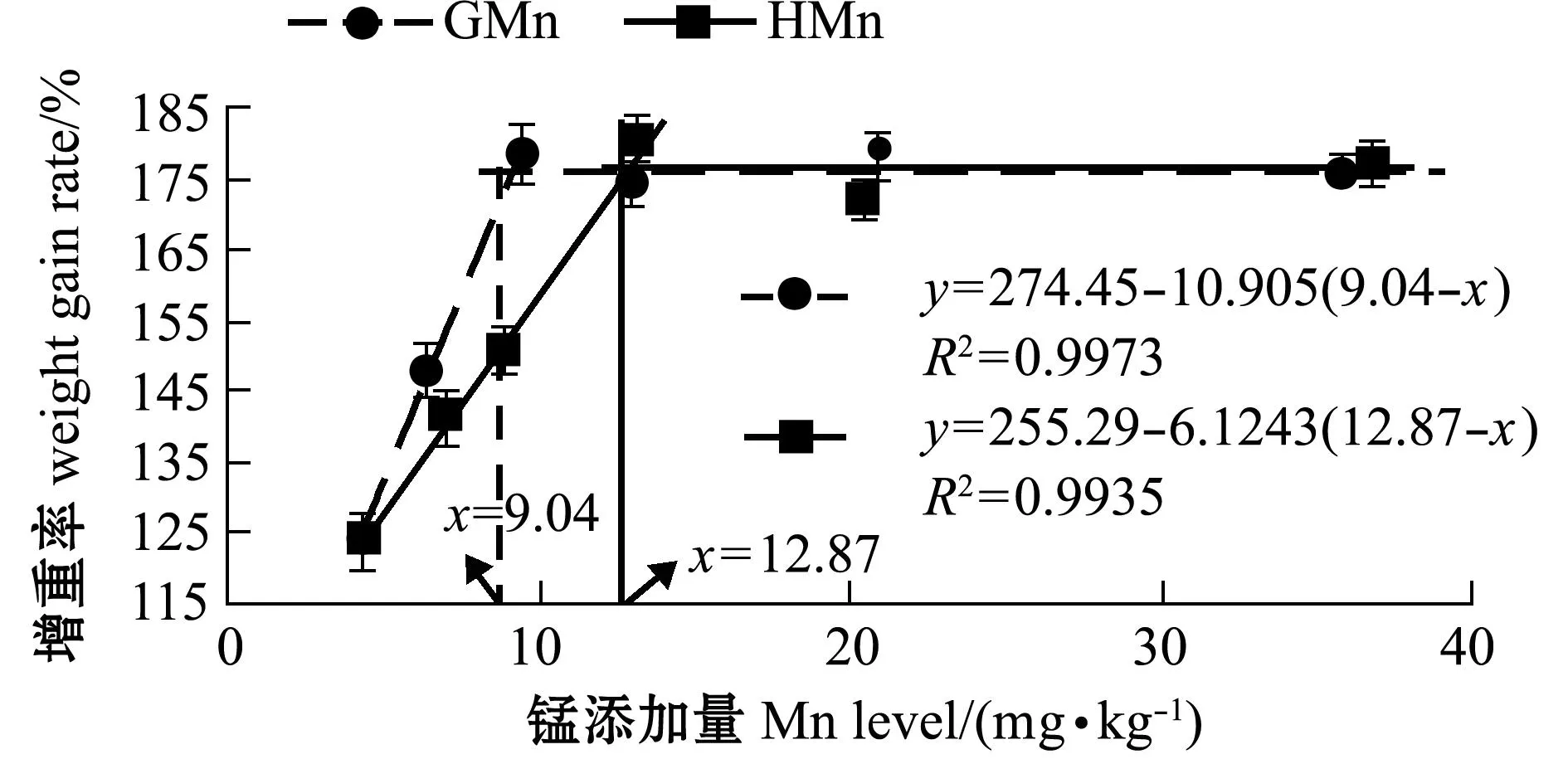
图1 饲料中锰添加量与斜带石斑鱼增重率的关系Fig.1 Relationship between dietary Mn level and weight gain rate in the grouper Epinephelus coioides
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2不同锰水平组斜带石斑鱼组织的抗氧化指标、碱性磷酸酶和总脂酶活性
从表2可见:各组石斑鱼血清Mn-SOD活性、MDA含量和肝脏LPL活性均无显著性差异(P>0.05);GMn组肝脏HL活性随锰水平的增加先升高后降低,HMn组肝脏HL活性随锰水平的增加而逐渐升高;对照组肝脏Mn-SOD活性显著低于锰添加组(P<0.05),肝脏Mn-SOD活性随着锰水平的增加先升高后降低,GMn-8和HMn-8组最高;肝脏MDA含量随着锰水平的增加而减少, GMn-8和HMn-8组最低;肝脏Mn-SOD活性和MDA含量在不同锰源的同一添加水平间无显著性差异(P>0.05)。以肝脏Mn-SOD活性为判据,通过一元二次回归方程分析得出,以甘氨酸锰和羟基蛋氨酸锰为锰源时,石斑鱼幼鱼对饲料中锰的最适需要量分别为21.15、20.61 mg/kg(图2)。
2.3不同锰水平组斜带石斑鱼脊椎骨和全鱼的锰、铜、锌、铁含量
从表3可见:各组石斑鱼幼鱼脊椎的铜、锌含量和全鱼的铜含量均无显著性差异(P>0.05);脊椎骨和全鱼的锰含量随饲料中锰水平的增加而增加,GMn-32和HMn-32组最高;全鱼的锌含量随饲料中锰水平的增加呈先升高后降低;对照组脊椎骨的铁含量显著高于锰添加组(P<0.05),脊椎骨和全鱼的铁含量随饲料中锰水平的增加而减少。以脊椎骨的锰含量为判据,用直线斜率的比值计算得出,石斑鱼对甘氨酸锰的生物利用率相当于羟基蛋氨酸锰的1.07倍。
表2饲料中锰含量对斜带石斑鱼抗氧化指标、碱性磷酸酶和总脂酶活性的影响
Tab.2Effects of dietary Mn level on antioxidative indices and activities of AKP,HL and LPL in the grouperE.coioides
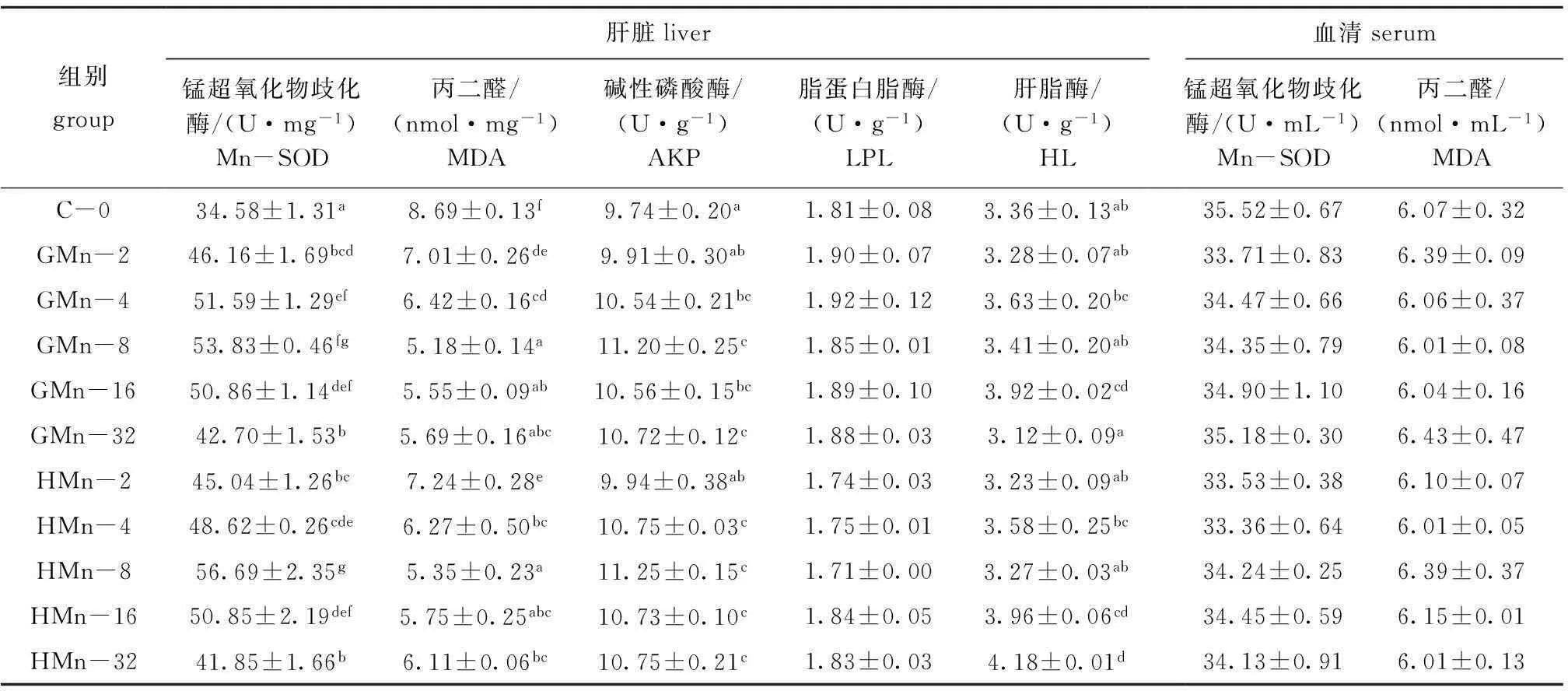
组别group肝脏liver锰超氧化物歧化酶/(U·mg-1)Mn-SOD丙二醛/(nmol·mg-1)MDA碱性磷酸酶/(U·g-1)AKP脂蛋白脂酶/(U·g-1)LPL肝脂酶/(U·g-1)HL血清serum锰超氧化物歧化酶/(U·mL-1)Mn-SOD丙二醛/(nmol·mL-1)MDAC-034.58±1.31a8.69±0.13f9.74±0.20a1.81±0.083.36±0.13ab35.52±0.676.07±0.32GMn-246.16±1.69bcd7.01±0.26de9.91±0.30ab1.90±0.073.28±0.07ab33.71±0.836.39±0.09GMn-451.59±1.29ef6.42±0.16cd10.54±0.21bc1.92±0.123.63±0.20bc34.47±0.666.06±0.37GMn-853.83±0.46fg5.18±0.14a11.20±0.25c1.85±0.013.41±0.20ab34.35±0.796.01±0.08GMn-1650.86±1.14def5.55±0.09ab10.56±0.15bc1.89±0.103.92±0.02cd34.90±1.106.04±0.16GMn-3242.70±1.53b5.69±0.16abc10.72±0.12c1.88±0.033.12±0.09a35.18±0.306.43±0.47HMn-245.04±1.26bc7.24±0.28e9.94±0.38ab1.74±0.033.23±0.09ab33.53±0.386.10±0.07HMn-448.62±0.26cde6.27±0.50bc10.75±0.03c1.75±0.013.58±0.25bc33.36±0.646.01±0.05HMn-856.69±2.35g5.35±0.23a11.25±0.15c1.71±0.003.27±0.03ab34.24±0.256.39±0.37HMn-1650.85±2.19def5.75±0.25abc10.73±0.10c1.84±0.053.96±0.06cd34.45±0.596.15±0.01HMn-3241.85±1.66b6.11±0.06bc10.75±0.21c1.83±0.034.18±0.01d34.13±0.916.01±0.13
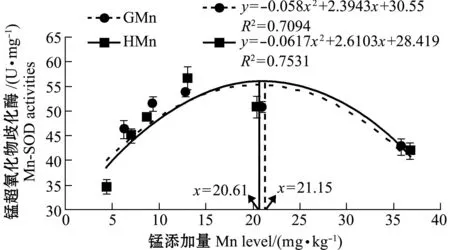
图2 饲料中锰添加量与石斑鱼肝脏Mn-SOD活性的关系Fig.2 Relationship between dietary Mn level and hepatic Mn-SOD activities in the grouper Epinephelus coioides
3讨论
3.1锰对斜带石斑鱼生长性能的影响
本研究结果表明,饲料中锰含量对石斑鱼幼鱼的成活率无显著影响,增重率却随着饲料中锰含量的增加逐渐增加后趋于平稳,超出生长需要量剂量的锰对石斑鱼幼鱼生长无显著影响。这与黄颡鱼Pelteobagrusfulvidraco[4]、异育银鲫Carassiusauratusgibelio[5]和军曹鱼Rachycentroncanadum[6]的生长相似。Ye等[7]报道饲料中锰添加量为1000 mg/kg时,斜带石斑鱼仍能正常生长。本研究中,锰最高添加量组的增重率与适宜需要量组无显著性差异,表明32 mg/kg的锰添加水平尚未引起石斑鱼幼鱼的不良反应;而摄食对照组饲料的石斑鱼幼鱼生长缓慢,饲料系数偏高,这表明基础饲料中的锰含量不能满足石斑鱼幼鱼生长的需要,锰是石斑鱼生长发育必需的微量元素。这与饲料缺锰导致虹鳟Oncorhynchusmykiss[8]、鲤Cyrinuscarpio[9]、异育银鲫[5]和黄颡鱼[4]生长缓慢、饲料利用率降低的研究结果类似。影响鱼体骨骼系统正常发育除了环境条件及遗传因子以外,还有饲料营养均衡的问题[10]。骨骼基质的硫酸软骨素是黏多糖的组成成分,黏多糖的合成必须有多糖聚合酶和半乳糖转移酶[2]。动物机体缺锰时,软骨组织受伤害,骨骼畸形。本研究中,体长特定生长率随饲料中锰含量的增加而逐渐升高,GMn-16组和HMn-16组的特定生长率达最大值,这表明饲料中添加一定量的锰能够促进石斑鱼骨骼的生长发育,而GMn组的肥满度呈现先降低后升高的趋势,HMn组的肥满度呈现先降低后趋于平稳的趋势,这表明饲料中添加适量锰能降低肥满度,有助于增加鱼的体长。
表3饲料中锰含量对斜带石斑鱼脊椎骨和全鱼矿物元素含量的影响
Tab.3Effects of dietary Mn level on mineral accumulation in vertebrae and whole fish in the grouperE.coioides
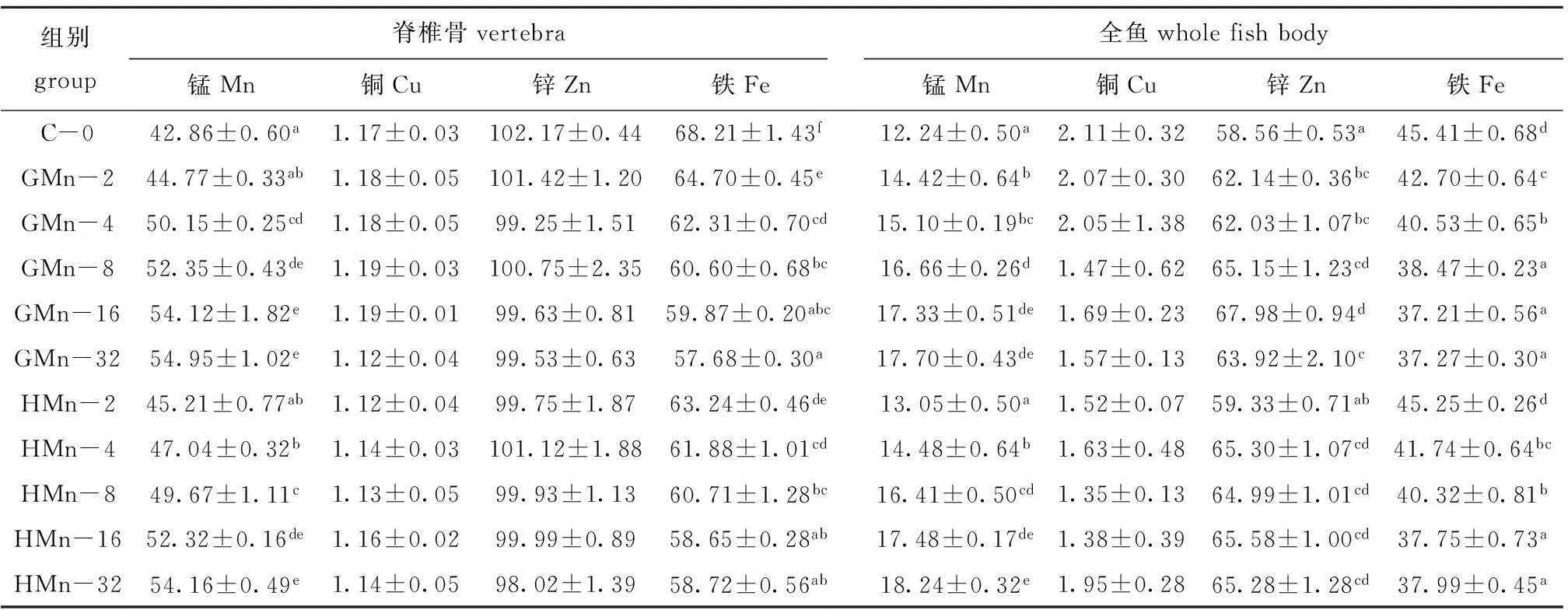
mg/kg
以增重率和脊椎骨的锰含量为判据,斜带石斑鱼对甘氨酸锰的生物利用率相当于羟基蛋氨酸锰的1.78和1.07倍。试验动物种类、规格、饲料配方和生理功能等差异,以及有机锰溶解度和络合强度不同均可引起试验动物对有机锰的生物利用率不同。本研究中所用甘氨酸锰和羟基蛋氨酸锰的螯合强度适中,但甘氨酸锰水溶性较高,羟基蛋氨酸锰微溶于水。Leach等[10]认为,单独应用矿物质溶解度不能显示有机微量元素产品潜在的生物可利用性。从石斑鱼摄入有机锰到吸收需要经过两个pH变化较大的消化器官,即偏酸性的胃和偏碱性的肠,在此过程中,有机微量元素可能与饲料的其他成分发生很多反应,以减少到达小肠吸收位点的数量。目前,关于提高有机微量元素生物学利用率和其在低pH消化道中的结构完整性还存在争议[11]。
鱼类对锰需要量的判据主要有生长性能、饲料利用率、组织中锰含量和肝脏Mn-SOD活性等。以增重率和饲料利用率为判据得出的锰需要量低于以骨骼矿化为判据的需要量。本研究中,以增重率为判据时,石斑鱼对饲料中甘氨酸锰和羟基蛋氨酸锰的需要量分别为9.04、12.87 mg/kg;而以肝脏Mn-SOD活性为判据时,对甘氨酸锰和羟基蛋氨酸锰的需要量分别为21.15、20.61 mg/kg。以增重率为判据得出的锰需要量低于以肝脏Mn-SOD活性为判据的需要量。这表明以增重率为判据得出的锰需要量未能够满足石斑鱼在抗氧化方面的需求。Tan等[4]对黄颡鱼的研究也发现,以增重率为判据时,对锰的需要量(5.5 mg/kg)低于以肝脏Mn-SOD活性为判据时的需要量(6.4 mg/kg)。本研究中的石斑鱼全鱼和脊椎骨的锰含量随着饲料中锰水平的增加而逐渐升高,但尚未达到最大值,当石斑鱼生长最快时并不一定是锰蓄积量达到最大值时,因此,全鱼和脊椎骨的锰含量不适宜作为石斑鱼对锰需要量的判据,这与Tan等[4]研究黄颡鱼对锰需要量的判据相似。但Pan等[5]研究异育银鲫对锰需要量时却指出,脊椎骨和残骸的锰含量随着饲料中锰水平的增加而升高,出现最适需要量值,适宜作为判据,而肝脏SOD活性是一个不显著的指标,不适合作为判据。Lin等[12]研究奥尼罗非鱼Oreochromisniloticus×O.aureus对锰需要量时认为,肝脏Mn-SOD活性和全鱼的锰含量均适合作为判据。鱼类对锰需要量的判据有多种,鱼种、试验配方、锰源、养殖环境等因素均可影响到判据的选择。
3.2锰对斜带石斑鱼抗氧化指标、碱性磷酸酶和总脂酶活性的影响
氨基酸螯合锰结构与动物体内酶的结构相似,能有效地提高鱼体细胞免疫、体液免疫和抗氧化能力。本研究中,对照组鱼肝脏Mn-SOD活性显著低于锰添加组,锰添加组Mn-SOD活性随锰含量的增加先升高后降低, GMn-8和HMn-8组活性达最大值,这表明饲料中补充一定量的锰可以提高石斑鱼幼鱼Mn-SOD活性,饲料缺锰则会降低Mn-SOD活性。目前已有报道:饲料中含锰低会导致大西洋鲑Salmosalar[13]、奥尼罗非鱼[12]、异育银鲫[5]、黄颡鱼[4]等肝脏Mn-SOD活性下降,但当大西洋鲑[13]饲料中锰补充到24 mg/kg时,会降低Mn-SOD活性,这与本研究结果相似,饲料中较高含量的锰对鱼类Mn-SOD活性的影响尚需深入研究。
SOD活力的高低间接反映出机体清除自由基的能力,而MDA含量的高低间接反映机体细胞受自由基攻击的严重程度[14]。本研究中,GMn-8组和HMn-8组肝脏的Mn-SOD活性最大时,肝脏MDA含量显著低于对照组,这表明饲料中添加锰使石斑鱼幼鱼肝脏Mn-SOD活性增强,使MDA含量显著降低。目前,国内外学者关于饲料中锰含量对水产动物机体MDA含量应用效果的报道相对较少。吕林等[15]发现,增加肉鸡饲料的锰含量可以提高其肌肉Mn-SOD mRNA水平,提高肌肉Mn-SOD活性,降低MDA含量。Lu等[16]报道,当肉鸡饲料中锰添加到100 mg/kg时,可以增加鸡腿部肌肉的Mn-SOD活性,减少MDA含量。
AKP直接参与磷酸基团的转移和代谢,在水生动物的骨骼矿化过程中起着重要作用[17]。本研究中,饲料中的锰含量显著影响肝脏AKP活性,随着饲料中锰含量的增加,AKP活性先升高后降低,这与饲料中锰含量对全鱼的锌含量的影响规律相似。这间接显示了饲料中的锰通过影响全鱼的锌含量来影响AKP的活性。
LPL水解极低密度脂蛋白和乳糜微粒中的甘油三酯,使之转变成小分子量的脂肪酸,供各种组织贮存和利用[18]。 HL主要在肝脏中合成,主要参与乳糜微粒残粒以及高密度脂蛋白的代谢[19]。本研究中,饲料中锰含量对LPL活性影响不显著,而对HL活性有显著影响,其中GMn-16组和HMn-32组的HL活性最高。Tan等[4]对黄颡鱼研究时也发现,饲料中锰含量对LPL活性影响不显著,而对HL活性有显著影响,当饲料中锰添加量为12 mg/kg时HL获得最大活性。锰对鱼类脂肪代谢影响的研究报道较少,但对肉鸡的研究发现,锰对腹脂中LPL的mRNA水平无显著影响,并认为锰对LPL基因表达的调节可能主要在转录水平上[20]。
3.3饲料中不同锰源和锰添加量对石斑鱼矿物元素沉积的影响
在饲料中添加锰可提高鱼体内锰的含量。本研究中,增加饲料中锰含量均显著提高了脊椎骨和全鱼的锰元素沉积,锰元素含量随饲料中锰含量的增加而升高。有研究报道:异育银鲫脊椎骨和残骸中的锰元素含量随饲料中锰添加量(7.21~12.62 mg/kg)的增加而增加[5];军曹鱼脊椎骨和全鱼中锰元素含量也随着饲料中锰添加量(5.98~22.38 mg/kg)的增加而增加[6]。在对虹鳟[8]、鲤[9]、大西洋鲑[14]、黄颡鱼[4]等的研究中均发现,增加饲料的锰含量可以提高全鱼的锰元素沉积。Ye等[7]对斜带石斑鱼的研究也发现了相似的结果,即随着饲料中锰添加量(0~50 mg/kg)的增加,全鱼和脊椎骨的锰含量相应增加。
本研究中,GMn组和HMn组鱼脊椎骨和全鱼的铁含量随锰添加量的增加而逐渐降低,这表明饲料中增加锰的含量减少了鱼体对铁的吸收贮存。这与Tan等[4]对黄颡鱼的研究结果相似,即脊椎骨的铁含量随饲料中锰含量的增加而减少。Ye等[7]对斜带石斑鱼的研究发现,当饲料中锰添加到1000 mg/kg时,全鱼的铁含量显著低于其他组。Andersen等[21]在研究大西洋鲑对铁需要量时发现,随着饲料中铁含量的增加全鱼的锰含量逐渐减少,并认为铁和锰竞争相同的结合位点。McDowell[22]认为,动物体内过多的锰会对机体代谢产生毒性作用,使铁代谢紊乱,形成拮抗作用。本研究中,饲料中锰含量对脊椎骨的铜、锌和全鱼的铜元素沉积无显著影响,对全鱼的锌元素沉积有显著影响。Ye等[7]指出,饲料中锰含量对斜带石斑鱼全鱼和脊椎骨的铜含量均无显著影响,对脊椎骨锌含量有显著影响,但对全鱼锌含量无显著影响。Tan等[4]在研究锰对黄颡鱼体内矿物元素沉积的影响时发现,饲料中锰含量对全鱼的锌和铜元素沉积均无显著影响。这表明鱼体内锰元素沉积与铜元素沉积无竞争干扰作用[23],饲料中锰含量对不同鱼类的不同组织中锌元素沉积的影响不同。微量元素锰对鱼类锌元素沉积的影响需要更进一步的研究。
参考文献:
[1]O’Dell B L,Sunde R A.Handbook of nutritionally essential mineral elements[M].State of Florida:CRC Press,1997.
[2]Leach Jr R M,Muenster A,Wien E M.Studies on the role of manganese in bone formation:II.effect upon chondroitin sulfate synthesis in chick epiphyseal cartilage[J].Archives of Biochemistry and Biophysics,1969,133(1):22-28.
[3]National Research Council.Nutrient requirements of fish and shrimp[M].Washington D C:National Academy Press,2011.
[4]Tan X Y,Xie P,Luo Z,et al.Dietary manganese requirement of juvenile yellow catfishPelteobagrusfulvidraco,and effects on whole body mineral composition and hepatic intermediary metabolism[J].Aquaculture,2012,326/329(1):68-73.
[5]Pan L,Zhu X,Xie S,et al.Effects of dietary manganese on growth and tissue manganese concentrations of juvenile gibel carp,Carassiusauratusgibelio[J].Aquaculture Nutrition,2008,14(5):459-463.
[6]Liu K,Ai Q H,Mai K S,et al.Dietary manganese requirement for juvenile cobia,RachycentroncanadumL.[J].Aquaculture Nutrition,2013,19(4):461-467.
[7]Ye C X,Tian L X,Yang H J,et al.Growth performance and tissue mineral content of juvenile grouper(Epinepheluscoioides) fed diets supplemented with various levels of manganese[J].Aquaculture Nutrition,2009,15(6):608-614.
[8]Ogino C,Yang G Y.Requirements of carp and rainbow trout for dietary manganese and copper[J].Bulletin of the Japanese Society of Scientific Fisheries,1980,46(4):455-458.
[9]Satoh S,Takeuchi T,Watanabe T.Availability to carp of manganese in white fish meal and of various manganese compounds[J].Nippon Suisan Gakkaishi,1987,53:825-832.
[10]Leach G A,Patton R S.Analysis techniques for chelated minerals evaluated[J].Feedstuffs,1997,69(21): 13215.
[11]Predieri G,Elviri L,Tegoni M,et al.Metal chelates of 2-hydroxy-4-methylthiobutanoic acid in animal feeding:part 2:further characterizations,in vitro and in vivo investigations[J].Journal of Inorganic Biochemistry,2005,99(2):627-636.
[12]Lin Y,Lin S,Shiau S.Dietary manganese requirements of juvenile tilapia,Oreochromisniloticus×O.aureus[J].Aquaculture,2008,284(1/4):207-210.
[13]Maage A,Lygren B,El-Mowafic A F A.Manganese requirement of Atlantic salmon(Salmosalar) fry[J].Fisheries Science,2000,66(1):1-8.
[14]Raharjo S,Sofos J N.Methodology for measuring malonaldehyde as a product of lipid peroxidation in muscle tissues:a review[J].Meat Science,1993,35(2):145-169.
[15]吕林,计成,罗绪刚,等.不同锰源对肉鸡胴体性能和肌肉品质的影响[J].中国农业科学,2007,40(7):1504-1514.
[16]Lu L,Ji C,Luo X G,et al.The effect of supplemental manganese in broiler diets on abdominal fat deposition and meat quality[J].Animal Feed Science and Technology,2006,129(1):49-59.
[17]Blasco J,Puppo J,Sarasquete M C.Acid and alkaline phosphatase activities in the clamRuditapesphilippinarum[J].Marine Biology,1993,115(1):113-118.
[18]Nilsson-Ehle P,Garfinkel A S,Schotz M C.Lipolytic enzymes and plasma lipoprotein metabolism[J].Annual Review of Biochemistry,1980,49(1):667-693.
[19]Santamarina-Fojo S,Haudenschild C,Amar M.The role of hepatic lipase in lipoprotein metabolism and atherosclerosis[J].Current Opinion in Lipidology,1998,9(3):211-219.
[20]王美玲,陈仲建,吕林,等.不同形态锰对肉仔鸡脂肪代谢关键酶活性及其基因表达的影响[J].中国农业科学,2011,44(18):3850-3858.
[21]Andersen F,Maage A,Julshamn K.An estimation of dietary iron requirement of Atlantic salmon,SalmosalarL.,parr[J].Aquaculture Nutrition,1996,2(1):41-47.
[22]McDowell L R.Minerals in animal and human nutrition[M].Amsterdam:Elsevier Science B V,2003.
[23]Luo Z,Tan X,Zheng J,et al.Quantitative dietary zinc requirement of juvenile yellow catfishPelteobagrusfulvidraco,and effects on hepatic intermediary metabolism and antioxidant responses[J].Aquaculture,2011,319(1/2):150-155.
Effects of manganese sources and dietary manganese level on growth
performance, antioxidative function and tissue mineral
accumulation in grouperEpinepheluscoioides
NIE Jia-quan, DONG Xiao-hui, TAN Bei-ping, CHI Shu-yan, YANG Qi-hui, LIU Hong-yu, ZHANG Shuang
(College of Fisheries, Laboratory of Aquatic Animal Nutrition and Feed, Guangdong Ocean University, Zhanjiang 524088, China)
Abstract:The effects of dietary organic manganese sources and level on growth performance, antioxidative function and tissue mineral accumulation were investigated in grouper Epinephelus coioides with initial body weight of 12.26 g. The grouper juveniles were fed eleven experimental diets supplemented with the graded levels of glycine manganese and manganese 2-Hydroxy-4-(methylthio) butyrate at a dose of 0, 2, 4, 8, 16 and 32 mg Mn/kg diet to satiation at water temperature of (28±2)℃ for 8 weeks. There was significantly lower weight gain rate (WGR) in the control group than in the Mn supplemented groups (P<0.05), in which the WGR was shown to be increased at first with the increase in manganese level, then to stable level. The requirement of juveniles for dietary manganese was estimated to be 9.04 mg/kg in glycine manganese and 12.87 mg/kg in manganese 2-Hydroxy-4-(methylthio) butyrate using the broken-line model with WGR as the dependent variables, the biological utilization of glycine manganesas being as high as 1.78 times as manganese 2-Hydroxy-4-(methylthio) butyrate in terms of WGR. The activities of Mn-SOD in the liver were found to be increased with elevated supplementation of dietary Mn, and the MDA contents in the liver decreased with the increasing dietary Mn level. The nonlinear model based on quadratic polynomial regression equations, with Mn-SOD as the dependent variables, revealed that the requirement of juveniles for dietary manganese was estimated to be 21.15 mg/kg in glycine manganese and 20.61 mg/kg in manganese 2-Hydroxy-4-(methylthio) butyrate. The manganese contents of vertebrae and whole fish were found to be increased significantly with increase in supplementation of dietary Mn (P<0.05). However, the Fe contents of vertebrae and whole fish were significant decreased with increase in supplementation of dietary Mn (P<0.05) when supplementation of dietary Mn . In conclusion, further addition of Mn did not lead to elevated growth in the grouper fed the diet containing enough Mn. But on the growth performance of grouper, the bioavailability of glycine manganese was found to be higher than the manganese 2-Hydroxy-4-(methylthio) butyrate, both showing the similar level of antioxidation ability.
Key words:Epinephelus coioides; manganese; growth performance; antioxidative function; mineral accumulation
通信作者:董晓慧(1970—), 女, 教授。E-mail:dongxiaohui2003@163.com15.0
作者简介:聂家全(1986—), 男, 硕士研究生。E-mail:daxuniejiaquan@163.com
基金项目:公益性行业(农业)科研专项(201003020);广东省珠江学者资助项目(2011)
收稿日期:2014-06-04
中图分类号:S965.334
文献标志码:A
文章编号:2095-1388(2015)02-0196-07
DOI:10.3969/J.ISSN.2095-1388.2015.02.016

