联用贝伐株单抗和标准疗法对新诊断为胶质母细胞瘤患者进行治疗的效果探究
张文燕 王翠英 赵宝帅
胶质母细胞瘤是起源于中枢神经系统的原发性恶性肿瘤。在临床上,对此病患者通常进行手术治疗,在术后对其进行放疗,并使用替莫唑胺对其进行同步化疗及放疗后的辅助治疗。近年来的研究发现,在进行上述治疗的基础上,为此病患者使用贝伐株单抗进行治疗的效果不错。为了进一步探讨此治疗方法的临床效果,笔者进行了本次研究。现将研究结果报告如下:
1 资料与方法
1.1 一般资料
本次研究的对象是2011年1月~2013年6月期间在我院进行治疗的38例GBM患者。按照随机数表法将这38例患者分为BEV组(20例)和TMZ组(18例)。在BEV组中,有男性患者15例,女性患者5例。他们的年龄在18~70岁之间,平均年龄为(48.5±6.4)岁。在这些患者中,肿瘤病灶位于左额叶的患者有8例,位于右颞叶的患者有10例,位于左顶叶的患者有2例。在TMZ组中,有男性患者12例,女性患者6例。他们的年龄在20~68岁之间,平均年龄为(49.6±5.6)岁。在这些患者中,肿瘤病灶位于右额叶的患者有6例,位于左颞叶的患者有8例,位于左顶叶的患者有4例。这些患者均签署了自愿参加本次研究的知情同意书。两组患者在性别、年龄、病灶部位等一般资料方面相比无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准
本次研究的纳入标准是:①经术后病理明确的新诊断胶质母细胞瘤(WHO IV级)患者。②肿瘤位于幕上,且经术后MRI检查证实有肿瘤组织残留,但残存肿瘤组织的体积小于术前肿瘤体积 25%的患者。③年龄 ≥18岁的患者。④KPS(Karnofsky功能状态评分标准)评分 ≥ 70分的患者。⑤术后生命体征平稳,已从术后感染或其他并发症中完全恢复的患者。本次研究的排除标准是:①在3年内有恶性肿瘤病史(排除非黑色素瘤的皮肤癌)、复发或多病灶的恶性胶质瘤、幕下或颅顶存在肿瘤转移病灶的患者。②接受过化疗或头颈部肿瘤增敏放疗的患者。③存在严重肝肾功能异常、心肺疾病的患者。
1.3 治疗方法
在手术结束后的3~5周,分别使用直线加速器对两组患者肿瘤病灶周围2~3cm的范围进行放疗,进行放疗的总剂量为60Gy,每次放疗的剂量为2Gy,每日对患者进行1次放疗,每周对其进行5次放疗,共治疗6周。从进行放疗的第1天开始,对两组患者均进行同期化疗。进行同期化疗的具体方法是:按照75mg/m2的剂量让患者口服TMZ,一直服用到进行放疗的最后一天,TMZ最长的使用时间为49天。自进行放疗的第4周起,为BEV组患者加用BEV进行治疗,治疗28天为1个周期。在每个治疗周期的第1天及第15天,分别按照10mg/kg的剂量为患者静脉滴注BEV。在治疗间歇期的第4周,进入辅助治疗阶段。在进行辅助治疗的第1~第5天,每日按照150mg/m2的剂量让两组患者口服TMZ,治疗28天为1个周期。在后续的治疗周期中,患者若没有出现与治疗相关的大于2级的不良反应,应将TMZ的每日给药剂量增至200 mg/m2(口服给药)。在此基础上,为BEV组患者加用BEV进行治疗,治疗28天为1个周期。在每个治疗周期的第1天和第15天,分别按照10 mg/kg的剂量为BEV组患者静脉滴注BEV。对两组患者均进行6个周期的辅助治疗。在此期间,患者的病情如果进一步发展或出现与治疗相关的不可耐受的毒副反应,应为其停药。
1.4 观察指标
在进行治疗期间,观察两组患者不良反应的发生情况。在放化疗结束的28d后,对两组患者均进行随访。在随访期间,每2个月对患者进行一次头颅MRI增强扫描检查,按照新RANO标准[1]评估其治疗的效果。观察记录两组患者的生存期。
1.5 评定标准
治疗效果的评定标准是:①完全缓解(CR):治疗结束后,对患者进行头颅MRI增强扫描的结果显示,其肿瘤病灶消失,且没有出现新的病灶。②部分缓解(PR):治疗结束后,对患者进行头颅MRI增强扫描的结果显示,其肿瘤病灶截面面积总和的减少幅度≥50%。③疾病进展(PD):治疗结束后,对患者进行头颅MRI增强扫描的结果显示,其肿瘤病灶最大径总和的增加幅度≥25%,或出现新的病灶。④疾病稳定(SD):治疗结束后,对患者进行头颅MRI增强扫描的结果显示,其肿瘤病灶截面面积总和的减少幅度<50%或病灶最大径总和的增加幅度>25%。客观缓解率(ORR)=完全缓解率+部分缓解率。患者的生存期=无进展生存期(PFS)+总体生存期(OS)。在进行治疗期间,使用CTCAE(常见不良反应事件评价标准)对这些患者发生的不良反应进行分级。
1.6 统计学方法
我们采用SPSS18.0统计学软件包对本研究中的数据进行分析处理,计量资料用均数±标准差()表示,采用t检验,计数资料用百分比(%)表示,采用χ²检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者治疗效果的比较
这38例患者均顺利完成6个周期的治疗。在治疗结束后的6个月、12个月及24个月,BEV组患者进行治疗的ORR均明显高于TMZ组患者,二者相比差异具有统计学意义(P<0.05)。详情见表1:
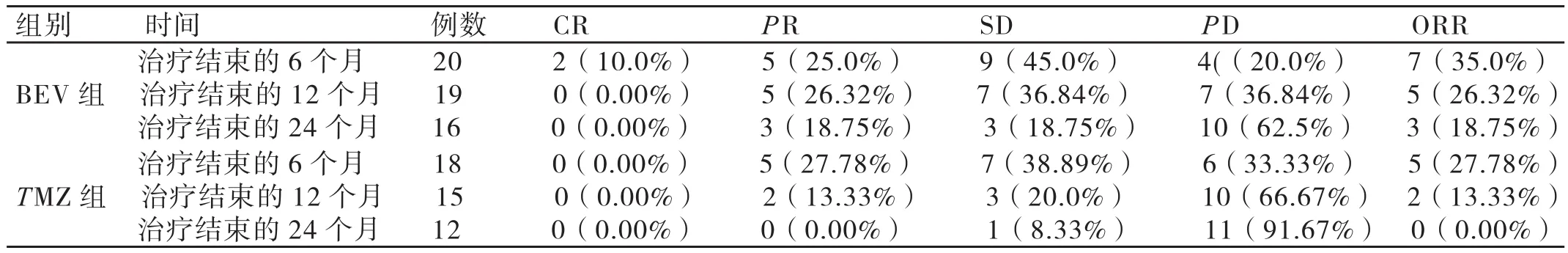
表1 两组患者治疗效果的比较(例,%)
2.2 两组患者生存期的比较
治疗结束后,BEV组患者的中位PFS为13.8个月[95%可信区间(CI):11.8~15.6个月],中位OS为15.9个月(95%CI:12.5~19.8个月)。TMZ组患者的中位PFS为8.2个月(95%CI:6.8~10.2个月),中位OS为16.2个月(95%CI:14.5~16.8个月)。BEV组患者的中位PFS明显长于TMZ组患者,二者相比差异具有统计学意义(P<0.05)。两组患者的中位OS相比差异不具有统计学意义(P>0.05)。
2.3 两组患者不良反应发生情况的比较
在进行治疗期间,在BEV组中,有5例(占25%)患者出现胃肠道的不良反应,其不良反应的分级为1级;有4例(占20.0%)患者出现白细胞下降的不良反应,其不良反应的分级为2级;有2例(占10.0%)患者出现手术切口愈合不良的不良反应,其不良反应的分级为2级;有1例(占5.0%)患者出现颅内出血的不良反应,其不良反应的分级为1级;有8例(占40.0%)患者出现血压升高的不良反应,其不良反应的分级为3级;有3例(占15.0%)患者出现下肢深静脉血栓的不良反应,其不良反应的分级为3级。对这些患者的不良反应进行对症处理后,其不良反应均有所缓解。在TMZ组中,有6例(占33.3%)患者出现胃肠道的不良反应,其不良反应的分级为1级;有5例(占27.8%)患者出现白细胞下降的不良反应,其不良反应的分级为2级。本组患者没有出现3级或4级的不良反应。TMZ组患者不良反应的发生情况明显好于BEV组患者,二者相比差异具有统计学意义(P<0.05)。
3 讨论
恶性胶质瘤是临床上最为常见的脑部恶性肿瘤。临床上对此病患者通常进行手术治疗。手术结束后,为患者进行同步放化疗。放疗结束后,对患者进行辅助化疗,但其预后仍不理想,其病情的复发率较高。据报道,GBM患者最长的中位生存期(median survival time,MST)仅为14.6个月,而病情复发的GBM患者其MST<6个月,其在治疗结束后5年内的总生存率不足10%。如何有效地延长此病患者的生存期一直是临床研究的热门课题[2-3]。研究[4-5]发现,恶性胶质瘤是一种高度血管化的肿瘤。VEGF(血管内皮细胞生长因子)在胶质瘤及肿瘤周围的组织中均有表达,其活性随着肿瘤恶性程度的增强而增强,但其在正常的脑组织中几乎不表达。
贝伐珠单抗是一种作用于VEGF的重组人源化单克隆抗体,可有效地阻断肿瘤血管芽生的过程,破坏依赖VEGF的肿瘤血管,使不依赖VEGF的血管正常化,进而使肿瘤血管退化,使肿瘤细胞缺氧、饥饿,最终导致肿瘤病灶的体积缩小[6]。在本次研究中,在BEV组中,出现不良反应患者的人数较多,但其不良反应大多可耐受,因此不会对其治疗的效果产生影响。
本次研究的结果证实,联用贝伐株单抗和标准疗法对新诊断胶质母细胞瘤的患者效果显著。此治疗方法值得在临床上推广应用。
[1] Wen PY,Macdonald DR,Reardon DA;et al.Updated Response Assessment Criteria for High-Grade Gliomas;Response Ass essment in Neuro-Oncology Working Group[J]. J Clin Onco l,2010,10:1963.
[2] Stupp R,ltegi ME,Mason WP,et a1.Effects of radioth erapy with concomitant and adjuvant temozolomide versu s radiotherapy alone on survival in glioblastoma in a ran domised phase m study:5-year analysis of the EORTC—NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
[3] Pichler l,Marosi c,Drug therapy of patients with recu rrent glioblastoma:is there any evidence?[J].Wien Med Wochensehr,2011,161(1_2):26-31.
[4] OnislIi M,Ichikawa T,Kurozumi K,et a1.Angiogenesis and invasion in glioma[J].Brain Tumor Pathol,201l,28(1):13-24.
[5] Maimi F,Del Basso De Caco M,Sieiliano A,et a1.Expr ession of growth factors in brain tumol8:correlation wi tII tumor grade,recurfence and survival[J].Clin Neump athol,2010,29(2):109—114.
[6] Vaziri SA,Kim J,Ganapathi MK,et al.Vascular endothelial growth factor polymorphisms:role in response and toxi city of tyrosine kinase inhibitors [J].Curr Oncol Rep,2010,12(2):102-108.

